 .
.| Газ | Т кип, К | Т К, К | L min, квт•ч/кг | L д, квт•ч/кг |
| Азот Аргон Водород Воздух Гелий Кислород Метан Неон Пропан Этилен | 77,4 87,3 20,4 78,8 4,2 90,2 111,7 27,1 231,1 169,4 | 126,2 150,7 33,0 132,5 5,3 154,2 191,1 44,5 370,0 282,6 | 0,220 0,134 3,31 0,205 1,93 0,177 0,307 0,37 0,04 0,119 | 1,2—1,5 0,8—0,95 15—40 1,25—1,5 15—25 1,2—1,4 0,75—1,2 3—4 ~ 0,08 ~ 0,3 |
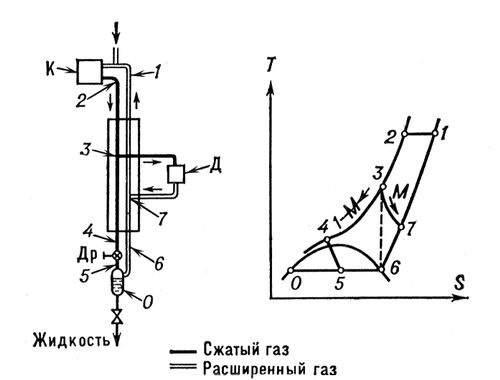
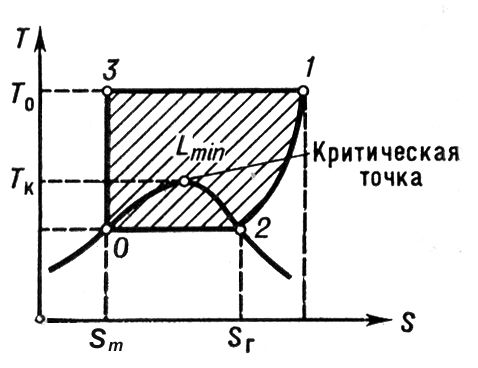
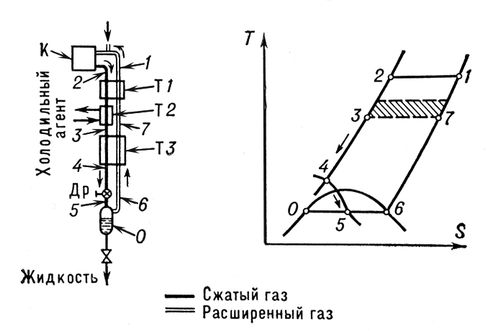
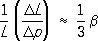 , где
L— линейный размер тела.
, где
L— линейный размер тела.