Страница:
К ферментам 2 типа относится, например, OGG1 (8-оксогуанин-ДНК-гликозилаза эукариот) удаляющая 8-oxoG, к тому же эта гликозилаза обладает и дезоксирибофосфатазной активностью.
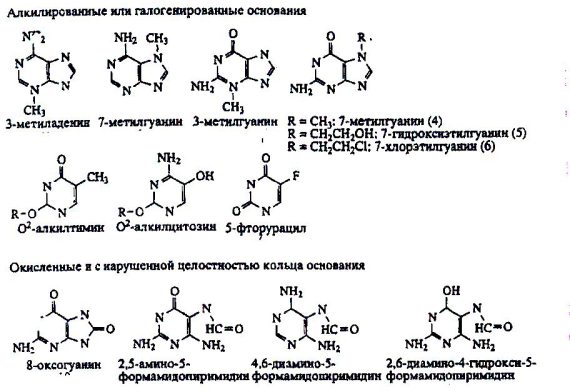
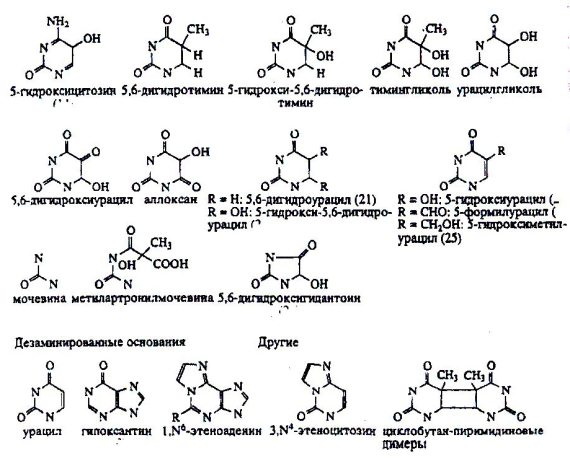
Рисунок 4. Типы повреждений оснований, репарируемые системой BER.
Здесь можно остановиться на систематике особых белков – нуклеаз. Они найдены у всех живых организмов – у бактерий, растений, животных, включая человека. Нуклеазами называют ферменты, способные расщеплять сахарофосфатную цепь. Они могут рвать эту цепь внутри полимерной молекулы ДНК или РНК, и тогда их называют эндонуклеазами, или же с концов полимеров, и тогда их называют экзонуклеазами. АР-эндонуклеазы принято делить на два класса: АР-лиазы (АР-эндонуклеазы первого типа) расщепляют связь между 3’-О-атомом дезоксирибозы и атомом фосфора. АР-эндонуклеазы второго типа осуществляют гидролиз связи между 5’-О-атомом дезоксирибозы и атомом фосфора, при этом образуется 5’-дезоксирибоза-5-фосфат и нуклеотид с 3’-гидроксильной группой. Эндонуклеазы второго типа ответственны за репарацию как спонтанно возникающих, так и АР-сайтов, образующихся в ходе гидролиза N-гликозидной связи простыми гликозилазами 1 типа без лиазной активности. Это специальные АР-эндонуклеазы APE1, APEX, Ref-1 или HAP1. АРЕ1 (AP endonuclease-1) активируется взаимодействием с белком XRCC1 и действует с ним в комплексе. О белках, называющихся XRCC (X-ray-induced damage repair cross comlementating) и их роли в различных репаративных реакциях мы поговорим позже. К настоящему времени in vitro проведена эффективная репарация неспаренных оснований U-G с возвращением к паре C: G. Реакция требовала присутствия урацил-ДНК-гликозилазы (UNG), АР-эндонуклеазы (АРЕ1), ДНК-полимеразы β (polβ) и лигазной активности, обеспечиваемой гетеродимером лигаза III/белок XRCC1. На первом этапе реакции белковая глобула UNG при связывании «покрывает» 10 пар оснований ДНК, причем каждая из этих пар взаимодействует со своим подцентром UNG, а распознаваемый урацил (то есть, собственно, связывающийся с активным центром гликозилазы) распложен на расстоянии одного-двух звеньев от 5’-конца декануклеотида, «покрытого» ферментом.
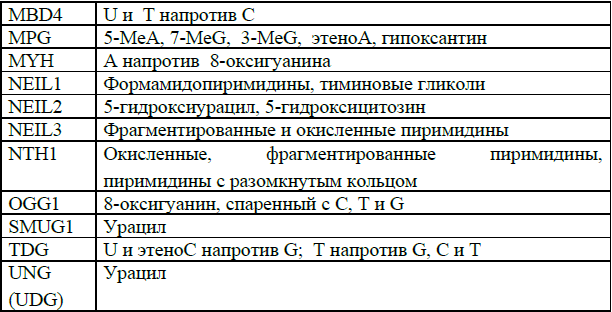
Таблица 2. Гликозилазы в клетках человека
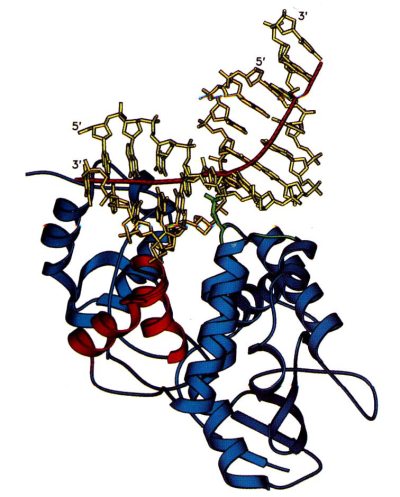
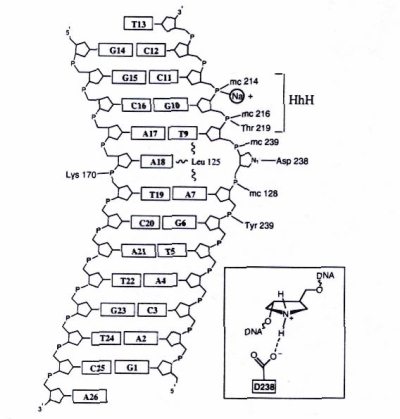
Сравнение данных структурного анализа и аминокислотных последовательностей выявляет общие черты для многих ДНК-гликозилаз. У большинства ферментов в активном центре обнаружен один и тот же повторяющийся мотив «спираль-шпилька-спираль» (Helix-hairpin-Helix, HhH). Помимо HhH-мотива в ДНК-связывающих центрах многих ферментов репарации обнаружен остаток консервативного Asp и Pro/Gly богатый район. Механизм узнавания ДНК для всех гликозилаз сходен, и активные центры этих ферментов могут связываться только с «вывернутыми» из спирали ДНК основаниями. Строение одной из гликозилаз (ALKA-1) и способ ее взаимодействия с поврежденным основанием показаны на рис. 5.
На рисунке 5а показано, как ДНК изгибается под углом 66 градусов под влиянием внедрения лейцина-125 и белковых петель αD-αE и αG-αH (показаны более сетлым). Белок заякоревается на ДНК с помощью мотива спираль-шпилька-спираль (HhH), показанного густо-серым. Локальная ось ДНК показана черным.
а
б
Рисунок 5. Схема действия ALKA-1.
а – ALKA-1-индуцированное расщепление ДНК, б – Схематическая диаграмма контакта ALKA-1 с ДНК.
На рисунке 5б видно, что АР-сайт характеризуется вывернутой позицией сахарного остатка, взаимодействующего с аспаргином 238. Лейцин-170 взаимодействует с другой нитью ДНК. HhH работает якорем ДНК на белке.
Несмотря на столь высокое функциональное сходство гликозилаз и их присутствие практически у всех организмов, поиск среди них генов-гомологов пока нельзя признать успешным. Четкая эволюционная линия гомологов найдена только для урацил-ДНК-гликозилазы – гены ung, UNG и hUDG в клетках Е. coli, S. cerevisiae и человека соответственно. Индуцибельная полифункциональная гликозилаза AlkA из Е. сoli (cхема строения которой приведена на рис. 5), репарирующая различные продукты метилирования оснований, оказалась гомологична N-гликозилазе MAG из S. cerevisiae и аналогична гликозилазе MPG из клеток человека. А в клетках S. сerevisiae недавно обнаружен гомолог формамидопиридин-ДНК-гликозилазы Fpg из Е. coli.
Схема процесса BER представлена на рис. 6. После распознавания повреждения гликозилазами и внесения разрыва в сахарофосфатный остов у E.coli в работу вступает еще один фермент – фосфодиэстераза, который отщепляет от ДНК ту сахарофосфатную группу, к которой теперь не присоединено основание. Появляется брешь в одной цепи ДНК размером в один нуклеотид. Напротив бреши в противоположной нити ДНК расположен неповрежденный нуклеотид, и следующий фермент – ДНК полимераза I вставляет в брешь комплементарный ему нуклеотид, присоединяя его к свободному З'ОН-концу. Чтобы соединить два свободных конца (З'ОН-конец вставленного нуклеотида и 5'-конец, ранее образовавшийся при разрыве нити ДНК АР-эндонукдеазой), вступает в действие еще один фермент – полинуклеотидлигаза. У человека это соответственно ДНК-полимераза β и лигирующий комплекс лигаза III/белок XRCC1. N-концевой участок этого белка взаимодействует с ДНК-полимеразой β, а С-концевой участок – с ДНК-лигазой III, выполняя структурную функцию. Это один из двух путей BER, при котором брешь в ДНК не превышает 1 нуклеотида. Этот путь носит названия репарации коротткими фрагментами (short path repair). Но есть и другой путь, при котором выщепляется 2-13 нуклеотидов и он носит название репарации длинными фрагментами (long path repair). В этом случае репаративеый синтез ДНК (начиная со второго нуклеотида) осуществляется полимеразами δ или ε, функционирование которых зависит от факторов пролиферации PCNA (proliferaiting сell nuclear antigene) и репликации RFC (replication factor C). Образовавшийся 3’-конец служит мишенью для привлечения RFC, который в свою очередь помогает PCNA связаться с ДНК.
Во время этого синтеза участок цепи ДНК, ранее спаренный с тем, который служит матрицей для синтеза, вытесняется, образуя свободно свешивающийся фрагмент ДНК – flap. Затем его удаляет специальная эндонуклеаза – ДНКаза IV у прокариот или FENI (flap endonuclease I) у эукариот. В настоящее время показано, что FENI, как и процессивные полимеразы, связана с PCNA, который ее активирует.
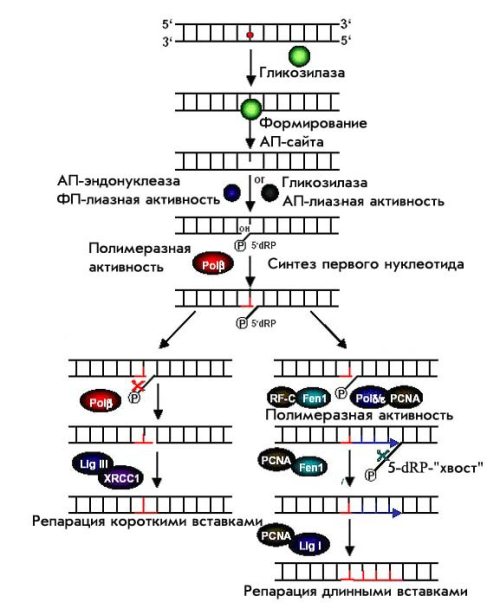
Рисунок 6. Схема процесса BER.
Лигирование, то есть восстановление фосфодиэфирной связи осуществляется ДНК-лигазами I и III, причем ДНК-лигаза I взаимодействует с PCNA и polδ и принимает участие преимущественно в репарации «длинными фрагментами». ДНК-лигаза III взаимодействует с XRCC1, polβ и PARP1 (polyadenosylribose polymerase I) и участвует в репарации «короткими фрагментами».
Теперь вся структура ДНК полностью восстановлена: неправильное основание удалено, сахарофосфат, к которому это основание было прикреплено, вырезан из нити ДНК, брешь заполнена правильным(и) нуклеотидом(ами), и все однонитевые разрывы залечены. Поскольку последовательность реакций запущена в действие путем расщепления гликозильной связи, этот вид репарации получил название еще одно название – "вырезание оснований с помощью гликозилаз".
До сих пор дискутируется вопрос о том, от чего зависит, по какому пути репарации – «короткими или длинными фрагментами» пойдет BER. Долгое время считалось, что «нормальные» АP-сайты репарируются по первому пути, а модифицированные (окисленные или восстановленные) – по второму. Современный взгляд несколько изменился. Было показано, что вставка первого нуклеотида не зависит от типа АP-сайта, причем в этой реакции главную роль играет ДНК-порлимераза-β. Во время репарации «короткими фрагментами» именно она вставляет один нуклеотид вместо вырезанного. Эта же полимераза вставляет первый нуклеотид в процессе репарации «длинными фрагментами».
Выбор между репарацией длинными или короткими фрагментами зависит от того, способна ли в данном конкретном случае ДНК-порлимераза-β проявить свою лиазную активность. А это как раз зависит от того, каким является АP-сайт. Если он окислен или расщеплен химически, то оказывается устойчивым к β-элиминации с помощью ДНК-полимеразы-β. В этом случае она после вставки первого нуклеотида диссоциирует от ДНК, и дальше сценарий идет по модели репарации «длинными фрагментами» с вовлечением PCNA-зависимых полимераз. Таким путем репарируется около 25 % повреждений. Но, к примеру, удаление 8-оксигуанина происходит преимущественно путем репарации «короткими фрагментами».
К настоящему времени у человека генетические заболевания, сопряженные с нарушением системы BER, не найдены. Но было обнаружена зависимость активности этой системы репарации от белка Р53. Этот антионкоген стимулирует BER путем прямого взаимодействия с АРЕ1 и ДНК-полимеразой-β, стабилизируя связывание последней с АР-сайтом. Данные об активации при этом транскрипции самого Р53 противоречивы, хотя показано, что после воздействия на мышей алкилирующим агентом нитропропаном наблюдалась активация транскрипциии Р53 и polβ, при одновременном повышении эффективности эксцизионной репарации оснований.
5.1.1. Многочисленные возможности репарации 8-оксигуанина
5.1.2. Роль PCNA в эксцизионной репарации оснований
5.1.3. BER, спаренная с репликацией
5.2. Эксцизионная репарация неспаренных оснований (mismatch repair, MMR)


Рисунок 4. Типы повреждений оснований, репарируемые системой BER.
Здесь можно остановиться на систематике особых белков – нуклеаз. Они найдены у всех живых организмов – у бактерий, растений, животных, включая человека. Нуклеазами называют ферменты, способные расщеплять сахарофосфатную цепь. Они могут рвать эту цепь внутри полимерной молекулы ДНК или РНК, и тогда их называют эндонуклеазами, или же с концов полимеров, и тогда их называют экзонуклеазами. АР-эндонуклеазы принято делить на два класса: АР-лиазы (АР-эндонуклеазы первого типа) расщепляют связь между 3’-О-атомом дезоксирибозы и атомом фосфора. АР-эндонуклеазы второго типа осуществляют гидролиз связи между 5’-О-атомом дезоксирибозы и атомом фосфора, при этом образуется 5’-дезоксирибоза-5-фосфат и нуклеотид с 3’-гидроксильной группой. Эндонуклеазы второго типа ответственны за репарацию как спонтанно возникающих, так и АР-сайтов, образующихся в ходе гидролиза N-гликозидной связи простыми гликозилазами 1 типа без лиазной активности. Это специальные АР-эндонуклеазы APE1, APEX, Ref-1 или HAP1. АРЕ1 (AP endonuclease-1) активируется взаимодействием с белком XRCC1 и действует с ним в комплексе. О белках, называющихся XRCC (X-ray-induced damage repair cross comlementating) и их роли в различных репаративных реакциях мы поговорим позже. К настоящему времени in vitro проведена эффективная репарация неспаренных оснований U-G с возвращением к паре C: G. Реакция требовала присутствия урацил-ДНК-гликозилазы (UNG), АР-эндонуклеазы (АРЕ1), ДНК-полимеразы β (polβ) и лигазной активности, обеспечиваемой гетеродимером лигаза III/белок XRCC1. На первом этапе реакции белковая глобула UNG при связывании «покрывает» 10 пар оснований ДНК, причем каждая из этих пар взаимодействует со своим подцентром UNG, а распознаваемый урацил (то есть, собственно, связывающийся с активным центром гликозилазы) распложен на расстоянии одного-двух звеньев от 5’-конца декануклеотида, «покрытого» ферментом.
Таблица 2. Гликозилазы в клетках человека

Сравнение данных структурного анализа и аминокислотных последовательностей выявляет общие черты для многих ДНК-гликозилаз. У большинства ферментов в активном центре обнаружен один и тот же повторяющийся мотив «спираль-шпилька-спираль» (Helix-hairpin-Helix, HhH). Помимо HhH-мотива в ДНК-связывающих центрах многих ферментов репарации обнаружен остаток консервативного Asp и Pro/Gly богатый район. Механизм узнавания ДНК для всех гликозилаз сходен, и активные центры этих ферментов могут связываться только с «вывернутыми» из спирали ДНК основаниями. Строение одной из гликозилаз (ALKA-1) и способ ее взаимодействия с поврежденным основанием показаны на рис. 5.
На рисунке 5а показано, как ДНК изгибается под углом 66 градусов под влиянием внедрения лейцина-125 и белковых петель αD-αE и αG-αH (показаны более сетлым). Белок заякоревается на ДНК с помощью мотива спираль-шпилька-спираль (HhH), показанного густо-серым. Локальная ось ДНК показана черным.

а

б
Рисунок 5. Схема действия ALKA-1.
а – ALKA-1-индуцированное расщепление ДНК, б – Схематическая диаграмма контакта ALKA-1 с ДНК.
На рисунке 5б видно, что АР-сайт характеризуется вывернутой позицией сахарного остатка, взаимодействующего с аспаргином 238. Лейцин-170 взаимодействует с другой нитью ДНК. HhH работает якорем ДНК на белке.
Несмотря на столь высокое функциональное сходство гликозилаз и их присутствие практически у всех организмов, поиск среди них генов-гомологов пока нельзя признать успешным. Четкая эволюционная линия гомологов найдена только для урацил-ДНК-гликозилазы – гены ung, UNG и hUDG в клетках Е. coli, S. cerevisiae и человека соответственно. Индуцибельная полифункциональная гликозилаза AlkA из Е. сoli (cхема строения которой приведена на рис. 5), репарирующая различные продукты метилирования оснований, оказалась гомологична N-гликозилазе MAG из S. cerevisiae и аналогична гликозилазе MPG из клеток человека. А в клетках S. сerevisiae недавно обнаружен гомолог формамидопиридин-ДНК-гликозилазы Fpg из Е. coli.
Схема процесса BER представлена на рис. 6. После распознавания повреждения гликозилазами и внесения разрыва в сахарофосфатный остов у E.coli в работу вступает еще один фермент – фосфодиэстераза, который отщепляет от ДНК ту сахарофосфатную группу, к которой теперь не присоединено основание. Появляется брешь в одной цепи ДНК размером в один нуклеотид. Напротив бреши в противоположной нити ДНК расположен неповрежденный нуклеотид, и следующий фермент – ДНК полимераза I вставляет в брешь комплементарный ему нуклеотид, присоединяя его к свободному З'ОН-концу. Чтобы соединить два свободных конца (З'ОН-конец вставленного нуклеотида и 5'-конец, ранее образовавшийся при разрыве нити ДНК АР-эндонукдеазой), вступает в действие еще один фермент – полинуклеотидлигаза. У человека это соответственно ДНК-полимераза β и лигирующий комплекс лигаза III/белок XRCC1. N-концевой участок этого белка взаимодействует с ДНК-полимеразой β, а С-концевой участок – с ДНК-лигазой III, выполняя структурную функцию. Это один из двух путей BER, при котором брешь в ДНК не превышает 1 нуклеотида. Этот путь носит названия репарации коротткими фрагментами (short path repair). Но есть и другой путь, при котором выщепляется 2-13 нуклеотидов и он носит название репарации длинными фрагментами (long path repair). В этом случае репаративеый синтез ДНК (начиная со второго нуклеотида) осуществляется полимеразами δ или ε, функционирование которых зависит от факторов пролиферации PCNA (proliferaiting сell nuclear antigene) и репликации RFC (replication factor C). Образовавшийся 3’-конец служит мишенью для привлечения RFC, который в свою очередь помогает PCNA связаться с ДНК.
Во время этого синтеза участок цепи ДНК, ранее спаренный с тем, который служит матрицей для синтеза, вытесняется, образуя свободно свешивающийся фрагмент ДНК – flap. Затем его удаляет специальная эндонуклеаза – ДНКаза IV у прокариот или FENI (flap endonuclease I) у эукариот. В настоящее время показано, что FENI, как и процессивные полимеразы, связана с PCNA, который ее активирует.

Рисунок 6. Схема процесса BER.
Лигирование, то есть восстановление фосфодиэфирной связи осуществляется ДНК-лигазами I и III, причем ДНК-лигаза I взаимодействует с PCNA и polδ и принимает участие преимущественно в репарации «длинными фрагментами». ДНК-лигаза III взаимодействует с XRCC1, polβ и PARP1 (polyadenosylribose polymerase I) и участвует в репарации «короткими фрагментами».
Теперь вся структура ДНК полностью восстановлена: неправильное основание удалено, сахарофосфат, к которому это основание было прикреплено, вырезан из нити ДНК, брешь заполнена правильным(и) нуклеотидом(ами), и все однонитевые разрывы залечены. Поскольку последовательность реакций запущена в действие путем расщепления гликозильной связи, этот вид репарации получил название еще одно название – "вырезание оснований с помощью гликозилаз".
До сих пор дискутируется вопрос о том, от чего зависит, по какому пути репарации – «короткими или длинными фрагментами» пойдет BER. Долгое время считалось, что «нормальные» АP-сайты репарируются по первому пути, а модифицированные (окисленные или восстановленные) – по второму. Современный взгляд несколько изменился. Было показано, что вставка первого нуклеотида не зависит от типа АP-сайта, причем в этой реакции главную роль играет ДНК-порлимераза-β. Во время репарации «короткими фрагментами» именно она вставляет один нуклеотид вместо вырезанного. Эта же полимераза вставляет первый нуклеотид в процессе репарации «длинными фрагментами».
Выбор между репарацией длинными или короткими фрагментами зависит от того, способна ли в данном конкретном случае ДНК-порлимераза-β проявить свою лиазную активность. А это как раз зависит от того, каким является АP-сайт. Если он окислен или расщеплен химически, то оказывается устойчивым к β-элиминации с помощью ДНК-полимеразы-β. В этом случае она после вставки первого нуклеотида диссоциирует от ДНК, и дальше сценарий идет по модели репарации «длинными фрагментами» с вовлечением PCNA-зависимых полимераз. Таким путем репарируется около 25 % повреждений. Но, к примеру, удаление 8-оксигуанина происходит преимущественно путем репарации «короткими фрагментами».
К настоящему времени у человека генетические заболевания, сопряженные с нарушением системы BER, не найдены. Но было обнаружена зависимость активности этой системы репарации от белка Р53. Этот антионкоген стимулирует BER путем прямого взаимодействия с АРЕ1 и ДНК-полимеразой-β, стабилизируя связывание последней с АР-сайтом. Данные об активации при этом транскрипции самого Р53 противоречивы, хотя показано, что после воздействия на мышей алкилирующим агентом нитропропаном наблюдалась активация транскрипциии Р53 и polβ, при одновременном повышении эффективности эксцизионной репарации оснований.
5.1.1. Многочисленные возможности репарации 8-оксигуанина
В целом, BER – чрезвычайно действенный барьер мутациям оснований. Ярким примером этого является тройная система защиты ДНК от окисления гуанинов, выявленная как у Е. сoli, так и у высших эукариот, включая человека.
Известно, что окислению может подвергаться не только уже встроенные в цепь ДНК нуклеотиды, но и их предшественники. Окисление dGTP приводит к образованию 8-окси-dСТР, но клетка содержит специализированную dGTPaзy – белок MutT, обладающий повышенным сродством к 8-окси-dGTP. Этот белок гидролизует 8-окси-dGTP до 8-окси-dGMP, удаляя его из пула нуклеотидов и предотвращая его встраивание во вновь синтезируемую ДНК. Таким образом MutT E.coli и МТН1 (Mut T homologue 1) человека являются крайне интересными белками, не вовлеченных напрямую в эксцизионную репарацию оснований, но существенно снижающими уровень оксипуринов в ДНК.
Если же модифицированный предшественник 8-оксиG все же внедряется в ДНК напротив С, то такая неправильная пара опознается гликозилазой MutM E.coli (Fpg, OGG1 соответственно у дрожжей и человека), которая может удалить 8-оксиG, встроившийся напротив С, из ДНК.
Если и этого до начала репликации ДНК не произошло, то в ходе нее 8-оксиG может попытаться спариться с А. Такая пара распознается гликозилазой MutY E.coli (гомолог эндонуклеазы III, выщепляющей из ДНК тиминовые гликоли, цитозиновые гидраты и другие повреждения). Эта гликозилаза обладает лиазной активностью, удаляет А из ДНК и вносит разрыв в сахарофосфатный остов. Также она распознает пары G-C и A-G. У человека эту функцию выполняет специализированная гликозилаза MYH (Mut Y homologue).
Говоря о взаимосвязи между собой в процессе защиты ДНК от встраивания 8-оксоG нескольких параллельных путей эксцизионной репарации оснований, необходимо добавить, что механизмы репарации, участвующие в удалении из поврежденной ДНК 8-оксо-G были исследованы in vitro, то есть на бесклеточных экстрактах очищенных белков. Было обнаружено, что из транскрибируемой части ДНК 8-окси-G удаляется быстрее, чем из нетранскрибируемой. Гликозилазой, необходимой для инцизии 8-окси-G и использованной в этих опытах, была Ogg1. Таким образом, по крайней мере для одной из гликозилаз, четко показано, что при BER наблюдается преимущественное выщепление поврежденного основания из транскрибиремой ДНК, то есть тот путь BER, который начинает специализированная гликозилаза Ogg1 может быть описан как зксцизионная репарация оснований, спаренная с транскрипцией.
Известно, что окислению может подвергаться не только уже встроенные в цепь ДНК нуклеотиды, но и их предшественники. Окисление dGTP приводит к образованию 8-окси-dСТР, но клетка содержит специализированную dGTPaзy – белок MutT, обладающий повышенным сродством к 8-окси-dGTP. Этот белок гидролизует 8-окси-dGTP до 8-окси-dGMP, удаляя его из пула нуклеотидов и предотвращая его встраивание во вновь синтезируемую ДНК. Таким образом MutT E.coli и МТН1 (Mut T homologue 1) человека являются крайне интересными белками, не вовлеченных напрямую в эксцизионную репарацию оснований, но существенно снижающими уровень оксипуринов в ДНК.
Если же модифицированный предшественник 8-оксиG все же внедряется в ДНК напротив С, то такая неправильная пара опознается гликозилазой MutM E.coli (Fpg, OGG1 соответственно у дрожжей и человека), которая может удалить 8-оксиG, встроившийся напротив С, из ДНК.
Если и этого до начала репликации ДНК не произошло, то в ходе нее 8-оксиG может попытаться спариться с А. Такая пара распознается гликозилазой MutY E.coli (гомолог эндонуклеазы III, выщепляющей из ДНК тиминовые гликоли, цитозиновые гидраты и другие повреждения). Эта гликозилаза обладает лиазной активностью, удаляет А из ДНК и вносит разрыв в сахарофосфатный остов. Также она распознает пары G-C и A-G. У человека эту функцию выполняет специализированная гликозилаза MYH (Mut Y homologue).
Говоря о взаимосвязи между собой в процессе защиты ДНК от встраивания 8-оксоG нескольких параллельных путей эксцизионной репарации оснований, необходимо добавить, что механизмы репарации, участвующие в удалении из поврежденной ДНК 8-оксо-G были исследованы in vitro, то есть на бесклеточных экстрактах очищенных белков. Было обнаружено, что из транскрибируемой части ДНК 8-окси-G удаляется быстрее, чем из нетранскрибируемой. Гликозилазой, необходимой для инцизии 8-окси-G и использованной в этих опытах, была Ogg1. Таким образом, по крайней мере для одной из гликозилаз, четко показано, что при BER наблюдается преимущественное выщепление поврежденного основания из транскрибиремой ДНК, то есть тот путь BER, который начинает специализированная гликозилаза Ogg1 может быть описан как зксцизионная репарация оснований, спаренная с транскрипцией.
5.1.2. Роль PCNA в эксцизионной репарации оснований
Хотелось бы отдельно остановиться она роли PCNA в процессах репарации.
Как уже говорилось, у высших эукариот эксцизионная репарация оснований протекает двумя альтернативными путями – с коротким и длинным ресинтезируемыми фрагментами. Их еще иногда называют ДНК-полимераза-β-зависимый и PCNA-зависимый пути.
PCNA-зависимый путь репарации АР-сайтов был совсем недавно реконструирован in vitro с участием АР-эндонуклеазы (АРЕ1), RFC, PCNA, FEN1, ДНК-полимеразы– δ и ДНК-лигазы I. При репарационной реакции в этой реконструированной системе преимущественно замещаются два нуклеотида. PCNA является обязательным участником этой системы и подавление его активности специфическими антителами приводит к ингибированию репарации АР-сайтов в клеточных экстрактах млекопитающих.
У дрожжей показано, что некоторые мутации в гене PCNA приводят к резкому снижению репарации после действия MMS (метил-метан-сульфоната, очень сильного мутагена), не затрагивая при этом их ростовой активности. К настоящему времени сложилось представление, что у дрожжей все пути BER PCNA-завимые.
Таким образом, polβ в процессе BER принимает участие и в PCNA-зависимом и в PCNA-независимом (polβ—завимом) путях. PCNA-зависимых путей тоже 2 – в первом из них вставляется 2 нуклеотида, а в другом – около 10–12 нуклеотидов. Может быть, это связано с тем, какая из полимераз – δ или ε будут использованы при этом, но прямых данных об этом нет, так как в системе in vitro замена одной на другую на уровень репарации не влияла.
Установлено, что PCNA может напрямую взаимодействовать с большой субъединицей RFC (состоящего из 5 субъединиц), экзонуклеазой FEN1, ДНК-полимеразой-δ (третья субъединица) и ДНК-лигазой I. Это взаимодействие происходит благодаря наличию во всех этих белках консервативного мотива QXX(I/L/M)XX(F/N)(F/Y), содержащего 8 аминокислотных остатков. Наличие этого мотива в различных белках представлено на рис. 7. PCNA служит молекулярным адаптером для привлечения всех этих белков в зону репаративной реакции. Данный мотив был обнаружен и у достаточно большого числа других белков – MSH2, MLH1 (белков, участвующих в эксцизионной репарации неспаренных оснований, MMR), р21, GADD45, циклина D, ДНК-цитозин-5-метил-трансферазы (MCMT), эндонуклеазы XPG. Для р21 опубликовано очень подробное описание его взаимодействия с PCNA, включающее вовлечение в этот процесс вторичной структуры белков.
На той же модели было показано, что эффективность репарации резко падает при использования в экспериментальной системе in vitro мутантных форм FEN1 и лигазы I, у которых не нарушена ферментативная активность, а только поврежден сайт их связывания с PCNA.

Рисунок 7. Белки, имеющие сайт QXX(I/L/M)XX(F/N)(F/Y) для связывания с PCNA
Остается неясным, как все эти молекулы с PCNA-связывающим мотивом умудряются связаться с PCNA одновременно – ведь PCNA является гомотримером и может быть одновременно связан по данному мотиву не более, чем с тремя белками, а таких белков описано уже как минимум 15. Можно предположить, что в системе BER PCNA преимущественно связан с ДНК-полимеразой-δ(ε), FEN1 и лигазой I. Связывание же со всеми остальными белками, вероятнее всего, зависит от места и времени протекания реакции, в которую вовлечен PCNА и данные белки.
Как уже говорилось, у высших эукариот эксцизионная репарация оснований протекает двумя альтернативными путями – с коротким и длинным ресинтезируемыми фрагментами. Их еще иногда называют ДНК-полимераза-β-зависимый и PCNA-зависимый пути.
PCNA-зависимый путь репарации АР-сайтов был совсем недавно реконструирован in vitro с участием АР-эндонуклеазы (АРЕ1), RFC, PCNA, FEN1, ДНК-полимеразы– δ и ДНК-лигазы I. При репарационной реакции в этой реконструированной системе преимущественно замещаются два нуклеотида. PCNA является обязательным участником этой системы и подавление его активности специфическими антителами приводит к ингибированию репарации АР-сайтов в клеточных экстрактах млекопитающих.
У дрожжей показано, что некоторые мутации в гене PCNA приводят к резкому снижению репарации после действия MMS (метил-метан-сульфоната, очень сильного мутагена), не затрагивая при этом их ростовой активности. К настоящему времени сложилось представление, что у дрожжей все пути BER PCNA-завимые.
Таким образом, polβ в процессе BER принимает участие и в PCNA-зависимом и в PCNA-независимом (polβ—завимом) путях. PCNA-зависимых путей тоже 2 – в первом из них вставляется 2 нуклеотида, а в другом – около 10–12 нуклеотидов. Может быть, это связано с тем, какая из полимераз – δ или ε будут использованы при этом, но прямых данных об этом нет, так как в системе in vitro замена одной на другую на уровень репарации не влияла.
Установлено, что PCNA может напрямую взаимодействовать с большой субъединицей RFC (состоящего из 5 субъединиц), экзонуклеазой FEN1, ДНК-полимеразой-δ (третья субъединица) и ДНК-лигазой I. Это взаимодействие происходит благодаря наличию во всех этих белках консервативного мотива QXX(I/L/M)XX(F/N)(F/Y), содержащего 8 аминокислотных остатков. Наличие этого мотива в различных белках представлено на рис. 7. PCNA служит молекулярным адаптером для привлечения всех этих белков в зону репаративной реакции. Данный мотив был обнаружен и у достаточно большого числа других белков – MSH2, MLH1 (белков, участвующих в эксцизионной репарации неспаренных оснований, MMR), р21, GADD45, циклина D, ДНК-цитозин-5-метил-трансферазы (MCMT), эндонуклеазы XPG. Для р21 опубликовано очень подробное описание его взаимодействия с PCNA, включающее вовлечение в этот процесс вторичной структуры белков.
На той же модели было показано, что эффективность репарации резко падает при использования в экспериментальной системе in vitro мутантных форм FEN1 и лигазы I, у которых не нарушена ферментативная активность, а только поврежден сайт их связывания с PCNA.

Рисунок 7. Белки, имеющие сайт QXX(I/L/M)XX(F/N)(F/Y) для связывания с PCNA
Остается неясным, как все эти молекулы с PCNA-связывающим мотивом умудряются связаться с PCNA одновременно – ведь PCNA является гомотримером и может быть одновременно связан по данному мотиву не более, чем с тремя белками, а таких белков описано уже как минимум 15. Можно предположить, что в системе BER PCNA преимущественно связан с ДНК-полимеразой-δ(ε), FEN1 и лигазой I. Связывание же со всеми остальными белками, вероятнее всего, зависит от места и времени протекания реакции, в которую вовлечен PCNА и данные белки.
5.1.3. BER, спаренная с репликацией
Тот же самый PCNA-связывающий мотив найден и в двух недавно описанных человеческих гликозилазах UNG2 и MYH1. Главными субстратами для этих гликозилаз служат некорректно встраивающиеся в процессе репликации урацил напротив аденина и аденин напротив 8-оксигуанина соответственно. UNG2 содержит PCNA-связывающий мотив в своей N-концевой части и является основной ДНК-урацил-гликозилазой человека. Напротив, N-конец UNG1, митохондриальной формы урацил-гликозилазы, содержит сигнал, указывающий на ее митохондриальную локализацию, но не PCNA-связывающий мотив. MYH является гомологом MutY E.coli, все ее формы несут PCNA-связывающий мотив в своем С-конце, вне зависимости от наличия у них сигнала митохондриальной локализации.
Предложено два объяснения возможного механизма, при котором эти две гликозилазы связываются с PCNA. Первое – обе эти гликозилазы могут преимущественно привлекать PCNА в район АР-сайта после выщепления неправильного основания, и таким образом направлять реакцию репарации по ее PCNA-зависимой ветви. Вторая возможность состоит в том, что UNG2 и MYH благодаря связыванию с PCNA могут ассоциироваться с «машиной репликации». Недавние исследования показали, что UNG2 может связываться с «машиной репликации» и через PCNA и через RPA (replication protein A, эукариотический гомолог белка SSB прокариот, состоящий из 3 субъединиц). Это больше подходит ко второму объяснению, но не отбрасывает и первого.
Урацил, являющийся субстратом UNG2, может попадать в ДНК двумя путями – при встраивании урацил-трифосфата во время репликации и дезаминировании уже встроенного цитозина. В первом случае, вновь встроенный урацил спаривается с аденином, и частота этого встраивания зависит от размера пула предшественника. Впрочем, надо помнить, что предшественник урацила совершенно «легально» постоянно присутствует в клетке и его уровень регулируется физиологическими механизмами. Во втором случае урацил оказывается спаренным с гуанином, причем 100–500 таких пар образуется в человеческой клетке ежедневно. UNG2 способна удалять урацил из обоих положений, две другие гликозилазы TDG и MED1 (MBD4) – только во втором случае (U/G). То есть урацил, встроившийся в процессе репликации может быть удален только UNG2, а урацил, появившийся в результате дезаминирования цитозина может быть убран тремя независимыми гликозилазами.
Похожая картина и с MYH1. Основной ее мишенью является аденин напротив 8-оксигуанина. Эта неправильная пара также образуется именно в процессе репликации ДНК. Здесь нужно отметить, что полимеразы ε и δ обычно вставляют именно аденин напротив 8-оксигуанина, а полимераза β – цитозин. Связывание MYH1 с PCNA может облегчать репарацию неправильного спаривания, возникшую в процессе репликации. Другая гликозилаза – OGG1 (FPG E.coli) способствует выщеплению 8-оксоG, который возникает при прямом окислении двунитевой ДНК, напротив цитозина, но не напротив аденина. OGG1 не несет PCNA-связывающего мотива и не нуждается в его помощи для выщепления 8-оксоG. Хотя пока нет точных экспериментальных подтверждений того, что MYH1 связывается с PCNA или с «машиной репликации», но аналогия с UNG2 напрашивается сама собой. Гликозилазы, несущие PCNA-связывающий мотив участвуют в репарации повреждений, возникающих именно в процессе репликации, в отличие от тех гликозилаз, которые подобные повреждения репарировать не способны.
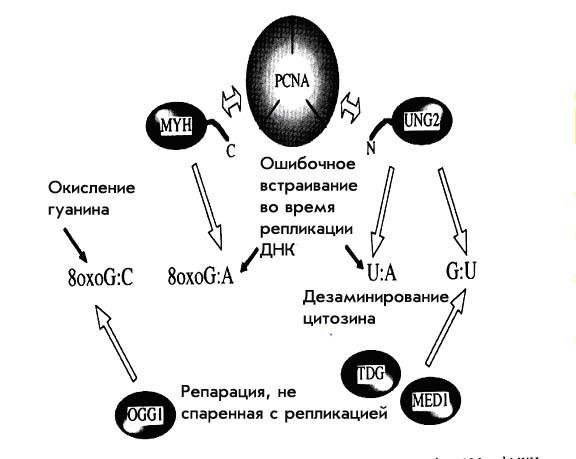
Рисунок 8. Схема репарации, спаренной с репликацией.
Таким образом две эти гликозилазы служат для специфической репарации, спаренной с репликацией, путем прямого связывания с репликационной машиной через PCNA. Схема этого процесса оитображена на рис. 8.
Остается нерешенным еще один вопрос – как эти две гликозилазы участвуют в репарации АР-сайтов. После действия UNG2 может включаться как PCNA-зависимый так и polβ зависимый процесс, так что тут все более-менее ясно. А вот MYH отличается тем, что не может использовать PCNA-зависимый путь, при котором синтез ведет polδ, так как polδ обязательно снова вставит аденин напротив 8-оксоG, и нарушение ДНК будет самовоспроизводиться в процессе репарации. Для репаративного синтеза может быть использован только polβ-зависимый путь, так как только polβ вставит напротив 8-оксоG цитозин
Предложено два объяснения возможного механизма, при котором эти две гликозилазы связываются с PCNA. Первое – обе эти гликозилазы могут преимущественно привлекать PCNА в район АР-сайта после выщепления неправильного основания, и таким образом направлять реакцию репарации по ее PCNA-зависимой ветви. Вторая возможность состоит в том, что UNG2 и MYH благодаря связыванию с PCNA могут ассоциироваться с «машиной репликации». Недавние исследования показали, что UNG2 может связываться с «машиной репликации» и через PCNA и через RPA (replication protein A, эукариотический гомолог белка SSB прокариот, состоящий из 3 субъединиц). Это больше подходит ко второму объяснению, но не отбрасывает и первого.
Урацил, являющийся субстратом UNG2, может попадать в ДНК двумя путями – при встраивании урацил-трифосфата во время репликации и дезаминировании уже встроенного цитозина. В первом случае, вновь встроенный урацил спаривается с аденином, и частота этого встраивания зависит от размера пула предшественника. Впрочем, надо помнить, что предшественник урацила совершенно «легально» постоянно присутствует в клетке и его уровень регулируется физиологическими механизмами. Во втором случае урацил оказывается спаренным с гуанином, причем 100–500 таких пар образуется в человеческой клетке ежедневно. UNG2 способна удалять урацил из обоих положений, две другие гликозилазы TDG и MED1 (MBD4) – только во втором случае (U/G). То есть урацил, встроившийся в процессе репликации может быть удален только UNG2, а урацил, появившийся в результате дезаминирования цитозина может быть убран тремя независимыми гликозилазами.
Похожая картина и с MYH1. Основной ее мишенью является аденин напротив 8-оксигуанина. Эта неправильная пара также образуется именно в процессе репликации ДНК. Здесь нужно отметить, что полимеразы ε и δ обычно вставляют именно аденин напротив 8-оксигуанина, а полимераза β – цитозин. Связывание MYH1 с PCNA может облегчать репарацию неправильного спаривания, возникшую в процессе репликации. Другая гликозилаза – OGG1 (FPG E.coli) способствует выщеплению 8-оксоG, который возникает при прямом окислении двунитевой ДНК, напротив цитозина, но не напротив аденина. OGG1 не несет PCNA-связывающего мотива и не нуждается в его помощи для выщепления 8-оксоG. Хотя пока нет точных экспериментальных подтверждений того, что MYH1 связывается с PCNA или с «машиной репликации», но аналогия с UNG2 напрашивается сама собой. Гликозилазы, несущие PCNA-связывающий мотив участвуют в репарации повреждений, возникающих именно в процессе репликации, в отличие от тех гликозилаз, которые подобные повреждения репарировать не способны.

Рисунок 8. Схема репарации, спаренной с репликацией.
Таким образом две эти гликозилазы служат для специфической репарации, спаренной с репликацией, путем прямого связывания с репликационной машиной через PCNA. Схема этого процесса оитображена на рис. 8.
Остается нерешенным еще один вопрос – как эти две гликозилазы участвуют в репарации АР-сайтов. После действия UNG2 может включаться как PCNA-зависимый так и polβ зависимый процесс, так что тут все более-менее ясно. А вот MYH отличается тем, что не может использовать PCNA-зависимый путь, при котором синтез ведет polδ, так как polδ обязательно снова вставит аденин напротив 8-оксоG, и нарушение ДНК будет самовоспроизводиться в процессе репарации. Для репаративного синтеза может быть использован только polβ-зависимый путь, так как только polβ вставит напротив 8-оксоG цитозин
5.2. Эксцизионная репарация неспаренных оснований (mismatch repair, MMR)
Продолжая изучать эксцизионную репарацию ДНК, остановимся на репарации неспаренных оснований (mismatch repair, MMR. На русский название этого типа репарации часто переводят как коррекция неспаренных оснований, сокращенно КНО. Основная роль MMR состоит в поддержании стабильности генома и снижении количества потенциально возникающих мутаций.
Довольно часто (у Е. coli один раз на 104 пар нуклеотидов, у эукариот еще чаще) во время репликации ДНК происходят ошибки спаривания, в результате которых вместо комплементарной пары нуклеотидов А + Т или G + C в дочернюю цепь ДНК оказываются включенными нуклеотиды, некомплементарные нуклеотидам в материнской нити и образующие с ними неправильные пары. Такие пары называют мисмэтчами – mismatch. Как уже говорилось ранее, исправление подобных ошибок самими полимеразами или автономными экзонуклеазами не может убрать их все, и в ДНК по окончании репликации остаются мисмэтчи. Но неспаренные основания в ДНК могут возникать и в результате других событий. Например, при модификации оснований ДНК или их предшественников продуктами клеточного метаболизма или экзогенными повреждающими агентами, если эти поврежденные основания не были отрепарированы системой BER. Особенности процесса рекомбинации мы будем обсуждать позже, но неспаренные основания могут возникать и при рекомбинационной интеграции однонитевого участка ДНК в неабсолютно идентичную ДНК партнера по рекомбинации. Все эти события приведут к образованию гетеродуплексной ДНК – субстрата для ферментов, исправляющих мисмэтчи.
Довольно часто (у Е. coli один раз на 104 пар нуклеотидов, у эукариот еще чаще) во время репликации ДНК происходят ошибки спаривания, в результате которых вместо комплементарной пары нуклеотидов А + Т или G + C в дочернюю цепь ДНК оказываются включенными нуклеотиды, некомплементарные нуклеотидам в материнской нити и образующие с ними неправильные пары. Такие пары называют мисмэтчами – mismatch. Как уже говорилось ранее, исправление подобных ошибок самими полимеразами или автономными экзонуклеазами не может убрать их все, и в ДНК по окончании репликации остаются мисмэтчи. Но неспаренные основания в ДНК могут возникать и в результате других событий. Например, при модификации оснований ДНК или их предшественников продуктами клеточного метаболизма или экзогенными повреждающими агентами, если эти поврежденные основания не были отрепарированы системой BER. Особенности процесса рекомбинации мы будем обсуждать позже, но неспаренные основания могут возникать и при рекомбинационной интеграции однонитевого участка ДНК в неабсолютно идентичную ДНК партнера по рекомбинации. Все эти события приведут к образованию гетеродуплексной ДНК – субстрата для ферментов, исправляющих мисмэтчи.
Конец бесплатного ознакомительного фрагмента
