Идеальный радиофармпрепарат должен характеризоваться не только преимущественным распространением в пределах обследуемого органа, но и иметь период полураспада, равный примерно 1/3 продолжительности радиоизотопного сканирования. Последний фактор позволяет ограничить лучевую нагрузку на пациента временными рамками проводимого исследования. К способам, уменьшающим лучевую нагрузку на пациента при применении сцинтиграфии, относятся: прием раствора Люголя с целью блокады щитовидной железы перед введением радиоизотопов йода при исследовании надпочечников, а также использование слабительных средств после окончания процедуры (в случае введения изотопов, выводящихся через желудочно-кишечный тракт).
Детектор, используемый в радионуклидных исследованиях, называется гамма-камерой, или сцинтилляционной камерой. Основным ее компонентом является сцинтилляционный кристалл, который наиболее часто выполняется из йодида калия и имеет диаметр около 60 см. Перед кристаллом (ближе к телу пациента) располагается свинцовое защитное устройство – коллиматор, в котором имеются отверстия, определяющие проекцию испускаемого излучения на кристалл.
Поглощение кристаллом гамма-фотонов сопровождается испусканием света, который передается к фотоумножителям и преобразовывается в электрические сигналы. Амплитуда этих сигналов пропорциональна количеству полученного света. Свет от каждого инсциллятора распространяется по всем фотоумножителям, но максимально интенсивен в том из них, который расположен непосредственно над сцинтиллятором. Одновременный анализ сигналов от всех фотоумножителей позволяет установить интенсивность и расположение каждой сцинтилляции и служит основой для реконструкции двухмерного изображения распространения радиофармпрепарата в тканях. Данное изображение может быть представлено на катодно-лучевой трубке или фотографической пленке. Современные гамма-камеры могут оцифровывать выходные электрические сигналы и создавать цифровые изображения. Создание цифровых изображений является необходимым для проведения динамических и томографических изображений.
Основными преимуществами радиоизотопного сканирования являются возможность изучения не только анатомических, но и функциональных особенностей исследуемого органа; одновременная оценка больших анатомических областей и тела человека в целом.
К недостаткам метода относятся низкое пространственное разрешение и лучевая нагрузка на пациента, а также трудности и ограничения, обусловленные особенностями работы с источниками радиоактивного излучения (необходимостью специальной лаборатории, вредным влиянием ионизирующего излучения на медицинский персонал и т. д.).
Наиболее широко в эндокринологии радионуклидная диагностика используется для выявления новообразований щитовидной и паращитовидных желез, надпочечников, островковоклеточных опухолей поджелудочной железы.
В последние годы появились методики, использующие компьютерные технологии радионуклидной визуализации:
1) однофотонная эмиссионная компьютерная томография (ОФЭКТ, SPECT);
2) позитронная эмиссионная томография (ПЭТ, PET).
ОФЭКТ основана на вращении вокруг тела обследуемого, которому предварительно вводится радиофармацевтический препарат, обычной гамма-камеры с фиксированием распределения радиоактивности при различных углах наклона, что после компьютерной обработки результатов позволяет реконструировать секционное изображение исследуемой области. Данный метод используется в основном у кардиологических и неврологических больных и пока не нашел применения в эндокринологии.
ПЭТ является более сложным томографическим методом, основанным на детекции испускаемых радионуклидами, введенными пациенту, позитронов. Позитроны и электроны имеют одинаковую массу, но различные заряды. По этой причине испускаемый радионуклидом позитрон сразу же реагирует на ближайший электрон. Происходящая при этом реакция (аннигиляция) сопровождается возникновением двух гамма-фотонов по 511 кэВ, которые распространяются в двух диаметрально противоположных направлениях. Учитывая большую энергию фотонов, для их регистрации используется не обычная гамма-камера, а специальные детекторы, расположенные коллинеарно.
ПЭТ позволяет провести количественную оценку концентрации радионуклидов, в связи с чем главным преимуществом данного метода является возможность изучения метаболических процессов в норме и при патологии. Основными позитрон-эмитирующими элементами, активно участвующими в метаболизме различных тканей, являются изотопы 11С, 13N, 15O. При необходимости позит-ронно-эмитирующими изотопами (ПЭИ) можно пометить другие важные метаболиты.
Основными недостатками ПЭТ являются высокая стоимость, обусловленная использованием для производства ПЭИ дорогих циклотронов, а также необходимость их размещения вблизи от лаборатории, что связано с быстрым распадом ПЭИ (периоды полураспада 15O и 18F составляют соответственно 2 и 110 мин). Эти факторы частично объясняют сравнительно редкое использование ПЭТ для клинических целей.
Значение метода ПЭТ для диагностики эндокринных заболеваний продолжает изучаться. В настоящее время показана диагностическая значимость ПЭТ лишь при локализации опухолей гипофиза и островковоклеточных новообразований поджелудочной железы.
ПЭТ выявляет не только локализацию опухолевого очага, но и метаболические процессы, происходящие в тканях. Метаболизм в опухоли (как и в метастатических очагах) отличается от метаболизма окружающих здоровых тканей, что и может быть выявлено с помощью ПЭТ. Для этого вводят некоторые вещества, более активно поглощаемые опухолевыми клетками (например, РТЮ), и по этому признаку судят о наличии метастаза в лимфоузле (или первичной опухоли).
Диагностическая чувствительность при опухолевом очаге более 1 см – 100 %.
Ядерно-магнитный резонанс. Используется редко из-за высокой стоимости исследования и недоступности для широкого применения.
При использовании ядерно-магнитного резонанса все доброкачественные образования дают интенсивность сигнала, равную или близкую к интенсивности, наблюдаемой от окружающих здоровых тканей. При злокачественных опухолях интенсивность сигнала низкая, их изображение плохо контурируется, неравномерно, с нечеткими краями. При опухолях менее 1 см диагностические возможности ядерно-магнитного резонанса пока значительно уступают магнитно-резонансной томографии.
МР-томография является одним из самых молодых и быстро развивающихся методов медицинской визуализации. С помощью этого метода можно создать изображение среза любой части тела человека в любой проекции.
Принцип метода теоретически сложен для понимания и в упрощенном виде может быть представлен следующим образом. Ядра атомов водорода (в дальнейшем – протоны) представляют собой по сути диполи маленьких размеров, которые при помещении внутрь сильного магнитного поля МР-томографа разворачиваются в направлении внешнего поля. Кроме того, магнитные моменты большей части протонов (параллельные протоны) начинают вращаться (прецессировать) вокруг оси внешнего магнитного поля. Частота этого вращения пропорциональна силе внешнего магнитного поля и называется резонансной частотой, или частотой Лар-мора. Магнитные моменты оставшихся протонов поворачиваются в другую сторону (антипараллельные протоны). В результате в тканях пациента создается суммарный магнитный момент, который ориентирован параллельно внешнему магнитному полю, величина которого определяется избытком параллельных протонов, а также количеством протонов в единице объема ткани, т. е. плотностью протонов. Магнитный момент огромного числа протонов достаточен для индукции электрического тока в принимающей катушке, расположенной вне пациента, однако необходимым условием такой индукции является изменение силы магнитного поля.
При воздействии на вращающиеся протоны радиоволнами с частотой, равной резонансной частоте прецессии протонов, изменяются оси вращения магнитных моментов протонов, что получило название резонансного эффекта, а само явление называется магнитным резонансом. Изменение вследствие этого суммарного магнитного момента индуцирует в катушке электрический ток, называемый МР-сигналом. Для реконструкции изображений МР-срезов необходимо несколько таких сигналов.
Контраст на МР-изображениях может определяться плотностью протонов и некоторыми другими факторами, из которых наиболее важными являются Т1 и Т2. После прекращения действия радиоимпульса протоны подвергаются двум различным процессам релаксации. Т2-релаксация – это процесс постепенного ослабления суммарного магнитного вектора в плоскости, вращаясь в которой он индуцировал электрический ток, а t2 – время, а t 1 – время, в течение которого магнитный вектор восстановится до 63 % от своего первоначального максимального значения. Величина Т2 сильно зависит от физических и химических свойств ткани. Жидкости и богатые жидкостями ткани имеют длительное время t2, а твердые ткани и вещества – короткое время t2. Значения t1 различных тканей сильно варьируют и зависят от размера и подвижности молекул. Значение t1, как правило, минимально для тканей с молекулами средних размеров и по– движности (жировой ткани), тогда как меньшие, подвижные молекулы (как в жидкости) и большие, но менее подвижные молекулы (как в твердых телах) имеют более высокое t1.
Оператор МР-системы, регулируя промежуток времени между подачей радиоимпульсов, самостоятельно выбирает, чем будет определяться контрастность МР-изображений, у которых контрастность определяется в большей степени различиями 11 (11 называют взвешенными изображениями). Аналогично существуют изображения, взвешенные по протонной плотности, и 12-взвешен-ные изображения.
Учитывая, что контрастность МР-изображения зависит как от свойств тканей, так и от выбранной оператором частоты подачи радиоимпульса, МР-томография имеет гораздо большие возможности для изменения контраста при визуализации, чем УЗИ и КТ.
Магнитный томограф состоит из сильного магнита, радиопередатчика, приемной радиочастотной катушки и компьютера. Внутренняя часть магнита выполнена в форме туннеля, достаточного для размещения в нем взрослого человека.
Первым шагом создания МР-изображения является выбор среза, для чего создается градиент магнитного поля через визуализируемую анатомическую область. Так как резонансная частота протонов пропорциональна силе магнитного поля, определяется частота радиоимпульсов, которыми следует воздействовать, чтобы получить магнитный резонанс из выбранного тонкого среза тканей. Следующим этапом исследования является: передача радиоимпульсов в установленном узком диапазоне частот и запись МР-сигналов от заданного слоя тканей. Получаемый МР-сигнал является комбинированным, поэтому компьютер кодирует по фазе и частоте МР-сигнала каждый отдельный элемент объема анатомического среза – воксел. Для получения окончательного изображения происходит сложная математическая обработка комбинированного сигнала с использованием двухмерного преобразования Фурье, что объясняет большую продолжительность исследования.
В большинстве случаев МРТ не требует контрастирования. Вместе с тем в течение последних 5–7 лет было предложено большое число контрастных веществ для МРТ, позволивших существенно увеличить информативность исследования при некоторых заболеваниях. Особенностью этих средств является то, что все они обладают магнитными свойствами и изменяют интенсивность изображения тканей, в которых находятся. Наиболее часто в контрастных препаратах этой группы используется парамагнитный ион металла гадолиния (Gd3+), связанный с молекулой-носителем.
В настоящее время не установлены вредные эффекты магнитных полей, используемых при МРТ. Проведение МРТ представляет опасность для пациентов, имеющих в теле различные ферромагнитные (металлические) объекты. Наличие у больного ферромагнитных клипсов на сосудах и внутриглазных инородных предметов, обладающих ферромагнитными свойствами, является абсолютным противопоказанием для проведения исследования из-за возможности тяжелого кровотечения, связанного с движением указанных объектов. Проведение МРТ также абсолютно противопоказано больным с установленными кардиостимуляторами, так как сильное магнитное поле может нарушить их работу, а также индуцировать электрические токи на электродах с возможным нагревом эндокарда.
Некоторые авторы считают абсолютным противопоказанием для проведения исследования первые три месяца беременности из-за риска нагрева плода, так как в этот временной период плод окружен относительно большим объемом амниотической жидкости в условиях ограниченной возможности отвода избытка тепла.
Таким образом, к преимуществам МР-томографии относится высокая разрешающая способность, а также тот факт, что на качество МР-изображения (в отличие от УЗИ) не оказывают влияния содержание воздуха в полых органах и костная ткань.
Метод безопасен для больного, если учитываются противопоказания к исследованию, так как МР-визуализация не связана с применением ионизирующего излучения. Последний фактор определяет предпочтительность применения метода (по сравнению с КТ) при диагностике заболеваний мужских и женских половых желез. К недостаткам метода относят его сравнительно высокую стоимость и техническую сложность, определяющую длительность исследования.
МРТ различных органов (печени, селезенки, корня брыжейки тонкой кишки, органов малого таза и т. д.) были проведены на томографах ВМТ-1100 (Bruker, Германия) с напряженностью магнитного поля 0,28 Т и MRT-50 A SUPER (Toshiba, Япония) с на– пряженностью магнитного поля 0,5 Т.
В связи с высокой информативностью МРТ нами изучены возможности данного метода исследования в определении распространенности рака не только по Т-категории, но и по N– и М-категориям.
МРТ при метастатических поражениях печени является высокочувствительным методом. По данным Р. Ф. Бахтиозина (1996 г.), чувствительность МРТ при метастазах печени достигает 89 %, а специфичность составляет 81 %. При МРТ с динамическим контрастированием метастазы в печени и других органах были выявлены у 68 больных раком желудка, что составило 43,8 % из группы больных, обследованных по данной методике.
Для метастазов печени были характерны следующие МР-то-мографические признаки: гипоинтенсивный сигнал (95 %), однородность сигнала (79 %), неоднородность сигнала (21 %), перифо-кальный отек (65 %).
Чувствительность МРТ с динамическим контрастированием при определении распространенности рака составила 75,7 %, специфичность – 66 %, точность – 70,3 %.
Рентгенодиагностика
Детектор, используемый в радионуклидных исследованиях, называется гамма-камерой, или сцинтилляционной камерой. Основным ее компонентом является сцинтилляционный кристалл, который наиболее часто выполняется из йодида калия и имеет диаметр около 60 см. Перед кристаллом (ближе к телу пациента) располагается свинцовое защитное устройство – коллиматор, в котором имеются отверстия, определяющие проекцию испускаемого излучения на кристалл.
Поглощение кристаллом гамма-фотонов сопровождается испусканием света, который передается к фотоумножителям и преобразовывается в электрические сигналы. Амплитуда этих сигналов пропорциональна количеству полученного света. Свет от каждого инсциллятора распространяется по всем фотоумножителям, но максимально интенсивен в том из них, который расположен непосредственно над сцинтиллятором. Одновременный анализ сигналов от всех фотоумножителей позволяет установить интенсивность и расположение каждой сцинтилляции и служит основой для реконструкции двухмерного изображения распространения радиофармпрепарата в тканях. Данное изображение может быть представлено на катодно-лучевой трубке или фотографической пленке. Современные гамма-камеры могут оцифровывать выходные электрические сигналы и создавать цифровые изображения. Создание цифровых изображений является необходимым для проведения динамических и томографических изображений.
Основными преимуществами радиоизотопного сканирования являются возможность изучения не только анатомических, но и функциональных особенностей исследуемого органа; одновременная оценка больших анатомических областей и тела человека в целом.
К недостаткам метода относятся низкое пространственное разрешение и лучевая нагрузка на пациента, а также трудности и ограничения, обусловленные особенностями работы с источниками радиоактивного излучения (необходимостью специальной лаборатории, вредным влиянием ионизирующего излучения на медицинский персонал и т. д.).
Наиболее широко в эндокринологии радионуклидная диагностика используется для выявления новообразований щитовидной и паращитовидных желез, надпочечников, островковоклеточных опухолей поджелудочной железы.
В последние годы появились методики, использующие компьютерные технологии радионуклидной визуализации:
1) однофотонная эмиссионная компьютерная томография (ОФЭКТ, SPECT);
2) позитронная эмиссионная томография (ПЭТ, PET).
ОФЭКТ основана на вращении вокруг тела обследуемого, которому предварительно вводится радиофармацевтический препарат, обычной гамма-камеры с фиксированием распределения радиоактивности при различных углах наклона, что после компьютерной обработки результатов позволяет реконструировать секционное изображение исследуемой области. Данный метод используется в основном у кардиологических и неврологических больных и пока не нашел применения в эндокринологии.
ПЭТ является более сложным томографическим методом, основанным на детекции испускаемых радионуклидами, введенными пациенту, позитронов. Позитроны и электроны имеют одинаковую массу, но различные заряды. По этой причине испускаемый радионуклидом позитрон сразу же реагирует на ближайший электрон. Происходящая при этом реакция (аннигиляция) сопровождается возникновением двух гамма-фотонов по 511 кэВ, которые распространяются в двух диаметрально противоположных направлениях. Учитывая большую энергию фотонов, для их регистрации используется не обычная гамма-камера, а специальные детекторы, расположенные коллинеарно.
ПЭТ позволяет провести количественную оценку концентрации радионуклидов, в связи с чем главным преимуществом данного метода является возможность изучения метаболических процессов в норме и при патологии. Основными позитрон-эмитирующими элементами, активно участвующими в метаболизме различных тканей, являются изотопы 11С, 13N, 15O. При необходимости позит-ронно-эмитирующими изотопами (ПЭИ) можно пометить другие важные метаболиты.
Основными недостатками ПЭТ являются высокая стоимость, обусловленная использованием для производства ПЭИ дорогих циклотронов, а также необходимость их размещения вблизи от лаборатории, что связано с быстрым распадом ПЭИ (периоды полураспада 15O и 18F составляют соответственно 2 и 110 мин). Эти факторы частично объясняют сравнительно редкое использование ПЭТ для клинических целей.
Значение метода ПЭТ для диагностики эндокринных заболеваний продолжает изучаться. В настоящее время показана диагностическая значимость ПЭТ лишь при локализации опухолей гипофиза и островковоклеточных новообразований поджелудочной железы.
ПЭТ выявляет не только локализацию опухолевого очага, но и метаболические процессы, происходящие в тканях. Метаболизм в опухоли (как и в метастатических очагах) отличается от метаболизма окружающих здоровых тканей, что и может быть выявлено с помощью ПЭТ. Для этого вводят некоторые вещества, более активно поглощаемые опухолевыми клетками (например, РТЮ), и по этому признаку судят о наличии метастаза в лимфоузле (или первичной опухоли).
Диагностическая чувствительность при опухолевом очаге более 1 см – 100 %.
Ядерно-магнитный резонанс. Используется редко из-за высокой стоимости исследования и недоступности для широкого применения.
При использовании ядерно-магнитного резонанса все доброкачественные образования дают интенсивность сигнала, равную или близкую к интенсивности, наблюдаемой от окружающих здоровых тканей. При злокачественных опухолях интенсивность сигнала низкая, их изображение плохо контурируется, неравномерно, с нечеткими краями. При опухолях менее 1 см диагностические возможности ядерно-магнитного резонанса пока значительно уступают магнитно-резонансной томографии.
МР-томография является одним из самых молодых и быстро развивающихся методов медицинской визуализации. С помощью этого метода можно создать изображение среза любой части тела человека в любой проекции.
Принцип метода теоретически сложен для понимания и в упрощенном виде может быть представлен следующим образом. Ядра атомов водорода (в дальнейшем – протоны) представляют собой по сути диполи маленьких размеров, которые при помещении внутрь сильного магнитного поля МР-томографа разворачиваются в направлении внешнего поля. Кроме того, магнитные моменты большей части протонов (параллельные протоны) начинают вращаться (прецессировать) вокруг оси внешнего магнитного поля. Частота этого вращения пропорциональна силе внешнего магнитного поля и называется резонансной частотой, или частотой Лар-мора. Магнитные моменты оставшихся протонов поворачиваются в другую сторону (антипараллельные протоны). В результате в тканях пациента создается суммарный магнитный момент, который ориентирован параллельно внешнему магнитному полю, величина которого определяется избытком параллельных протонов, а также количеством протонов в единице объема ткани, т. е. плотностью протонов. Магнитный момент огромного числа протонов достаточен для индукции электрического тока в принимающей катушке, расположенной вне пациента, однако необходимым условием такой индукции является изменение силы магнитного поля.
При воздействии на вращающиеся протоны радиоволнами с частотой, равной резонансной частоте прецессии протонов, изменяются оси вращения магнитных моментов протонов, что получило название резонансного эффекта, а само явление называется магнитным резонансом. Изменение вследствие этого суммарного магнитного момента индуцирует в катушке электрический ток, называемый МР-сигналом. Для реконструкции изображений МР-срезов необходимо несколько таких сигналов.
Контраст на МР-изображениях может определяться плотностью протонов и некоторыми другими факторами, из которых наиболее важными являются Т1 и Т2. После прекращения действия радиоимпульса протоны подвергаются двум различным процессам релаксации. Т2-релаксация – это процесс постепенного ослабления суммарного магнитного вектора в плоскости, вращаясь в которой он индуцировал электрический ток, а t2 – время, а t 1 – время, в течение которого магнитный вектор восстановится до 63 % от своего первоначального максимального значения. Величина Т2 сильно зависит от физических и химических свойств ткани. Жидкости и богатые жидкостями ткани имеют длительное время t2, а твердые ткани и вещества – короткое время t2. Значения t1 различных тканей сильно варьируют и зависят от размера и подвижности молекул. Значение t1, как правило, минимально для тканей с молекулами средних размеров и по– движности (жировой ткани), тогда как меньшие, подвижные молекулы (как в жидкости) и большие, но менее подвижные молекулы (как в твердых телах) имеют более высокое t1.
Оператор МР-системы, регулируя промежуток времени между подачей радиоимпульсов, самостоятельно выбирает, чем будет определяться контрастность МР-изображений, у которых контрастность определяется в большей степени различиями 11 (11 называют взвешенными изображениями). Аналогично существуют изображения, взвешенные по протонной плотности, и 12-взвешен-ные изображения.
Учитывая, что контрастность МР-изображения зависит как от свойств тканей, так и от выбранной оператором частоты подачи радиоимпульса, МР-томография имеет гораздо большие возможности для изменения контраста при визуализации, чем УЗИ и КТ.
Магнитный томограф состоит из сильного магнита, радиопередатчика, приемной радиочастотной катушки и компьютера. Внутренняя часть магнита выполнена в форме туннеля, достаточного для размещения в нем взрослого человека.
Первым шагом создания МР-изображения является выбор среза, для чего создается градиент магнитного поля через визуализируемую анатомическую область. Так как резонансная частота протонов пропорциональна силе магнитного поля, определяется частота радиоимпульсов, которыми следует воздействовать, чтобы получить магнитный резонанс из выбранного тонкого среза тканей. Следующим этапом исследования является: передача радиоимпульсов в установленном узком диапазоне частот и запись МР-сигналов от заданного слоя тканей. Получаемый МР-сигнал является комбинированным, поэтому компьютер кодирует по фазе и частоте МР-сигнала каждый отдельный элемент объема анатомического среза – воксел. Для получения окончательного изображения происходит сложная математическая обработка комбинированного сигнала с использованием двухмерного преобразования Фурье, что объясняет большую продолжительность исследования.
В большинстве случаев МРТ не требует контрастирования. Вместе с тем в течение последних 5–7 лет было предложено большое число контрастных веществ для МРТ, позволивших существенно увеличить информативность исследования при некоторых заболеваниях. Особенностью этих средств является то, что все они обладают магнитными свойствами и изменяют интенсивность изображения тканей, в которых находятся. Наиболее часто в контрастных препаратах этой группы используется парамагнитный ион металла гадолиния (Gd3+), связанный с молекулой-носителем.
В настоящее время не установлены вредные эффекты магнитных полей, используемых при МРТ. Проведение МРТ представляет опасность для пациентов, имеющих в теле различные ферромагнитные (металлические) объекты. Наличие у больного ферромагнитных клипсов на сосудах и внутриглазных инородных предметов, обладающих ферромагнитными свойствами, является абсолютным противопоказанием для проведения исследования из-за возможности тяжелого кровотечения, связанного с движением указанных объектов. Проведение МРТ также абсолютно противопоказано больным с установленными кардиостимуляторами, так как сильное магнитное поле может нарушить их работу, а также индуцировать электрические токи на электродах с возможным нагревом эндокарда.
Некоторые авторы считают абсолютным противопоказанием для проведения исследования первые три месяца беременности из-за риска нагрева плода, так как в этот временной период плод окружен относительно большим объемом амниотической жидкости в условиях ограниченной возможности отвода избытка тепла.
Таким образом, к преимуществам МР-томографии относится высокая разрешающая способность, а также тот факт, что на качество МР-изображения (в отличие от УЗИ) не оказывают влияния содержание воздуха в полых органах и костная ткань.
Метод безопасен для больного, если учитываются противопоказания к исследованию, так как МР-визуализация не связана с применением ионизирующего излучения. Последний фактор определяет предпочтительность применения метода (по сравнению с КТ) при диагностике заболеваний мужских и женских половых желез. К недостаткам метода относят его сравнительно высокую стоимость и техническую сложность, определяющую длительность исследования.
МРТ различных органов (печени, селезенки, корня брыжейки тонкой кишки, органов малого таза и т. д.) были проведены на томографах ВМТ-1100 (Bruker, Германия) с напряженностью магнитного поля 0,28 Т и MRT-50 A SUPER (Toshiba, Япония) с на– пряженностью магнитного поля 0,5 Т.
В связи с высокой информативностью МРТ нами изучены возможности данного метода исследования в определении распространенности рака не только по Т-категории, но и по N– и М-категориям.
МРТ при метастатических поражениях печени является высокочувствительным методом. По данным Р. Ф. Бахтиозина (1996 г.), чувствительность МРТ при метастазах печени достигает 89 %, а специфичность составляет 81 %. При МРТ с динамическим контрастированием метастазы в печени и других органах были выявлены у 68 больных раком желудка, что составило 43,8 % из группы больных, обследованных по данной методике.
Для метастазов печени были характерны следующие МР-то-мографические признаки: гипоинтенсивный сигнал (95 %), однородность сигнала (79 %), неоднородность сигнала (21 %), перифо-кальный отек (65 %).
Чувствительность МРТ с динамическим контрастированием при определении распространенности рака составила 75,7 %, специфичность – 66 %, точность – 70,3 %.
Рентгенодиагностика
Рентгеновское излучение было открыто в 1895 г. В. Рентгеном
– это вид электромагнитного излучения, имеющего длину волны 10-3-100 нм и энергетический диапазон от 100 эВ до 0,1 МэВ. Рентгеновское излучение имеет две разновидности: характеристическое и тормозное рентгеновское излучение. Характеристическое рентгеновское излучение – это электромагнитное излучение, которое возникает при переходе электронов с внешних электронных оболочек атома на внутренние, более близко расположенные к ядру K-, L-, M-, N-оболочки, образуя при этом характеристический линейчатый спектр рентгеновского излучения. Частоты линий характеристического спектра химических элементов подчиняются закону Мозли.
Закон Мозли – линейная зависимость квадратного корня из частоты характеристического рентгеновского излучения от атомного номера химического элемента. Установлен экспериментально Г. Мозли в 1913 г. Закон Мозли – основа рентгеновского спектрального анализа:
√v = A (Z – B)
Тормозное рентгеновское излучение – это электромагнитное излучение, которое возникает при уменьшении кинетической энергии (торможении, рассеянии) быстрых заряженных частиц (например, при торможении в кулоновском поле ускоренных электронов). Спектр тормозного излучения непрерывен, максимальная энергия равна начальной энергии частицы. Это коротковолновое электромагнитное (фотонное) излучение с диапазоном частот от 3 х 1016 до 3 х 1019 Гц, длиной волн 10-8-10-12 м. Именно этот вид рентгеновского излучения используется в медицине.
Источниками рентгеновского излучения могут быть рентгеновская трубка, ускорители (бетатрон) и накопители электронов (синхротронное излучение), лазеры, некоторые радиоактивные изотопы и др.
Бетатрон – это циклический ускоритель электронов, электроны в нем ускоряются вихревым электрическим полем, порожденным переменным магнитным полем. Обычно энергия электронов в бетатроне не выше 50 МэВ.
Линейный ускоритель – это ускоритель заряженных частиц, в котором траектории частиц приближаются к прямой линии. Максимальная энергия электронов в линейном ускорителе составляет 20 ГэВ, протонов – до 800 МэВ. В линейном ускорителе электронов электроны впрыскиваются в трубку ускорителя и разгоняются там с помощью электромагнитного поля высокой частоты. Линейный ускоритель может быть использован как источник рентгеновского излучения. Для этого пучок электронов направляется на мишень, изготовленную из тяжелого тугоплавкого металла. В результате бомбардировки электронами ядер атомов мишени образуются фотоны, а электроны отражаются с меньшей энергией. Пучок фотонов с энергией, соответствующей рентгеновскому излучению, проходит через выравнивающий фильтр, лучу придается нужная форма с помощью коллиматора до попадания на больного.
Коэффициент преломления практически любого вещества для рентгеновских лучей мало отличается от единицы. Следствием этого явления служит то, что не существует материала, использовав который можно было бы изготовить линзу для рентгеновских лучей. Кроме того, при перпендикулярном падении на поверхность вещества рентгеновские лучи почти не отражаются. Несмотря на это, в рентгеновской оптике были найдены способы построения оптических элементов для рентгеновских лучей.
Рентгеновские лучи способны проникать сквозь вещество, причем различные вещества по-разному их поглощают. Поглощение рентгеновских лучей является важнейшим их свойством в рентгеновской съемке. Интенсивность рентгеновских лучей экспоненциально убывает в зависимости от пройденного пути в поглощающем слое (I = 10е-kd, где d – толщина слоя, коэффициент k пропорционален Z3χ3,Z – атомный номер элемента, χ – длина волны).
Поглощение происходит в результате фотопоглощения и комп-тоновского рассеяния. Фотопоглощение – процесс выбивания фотоном электрона из оболочки атома, для чего требуется, чтобы энергия фотона была больше некоторого минимального значения. Если рассматривать вероятность акта поглощения в зависимости от энергии фотона, то при достижении определенной энергии она (вероятность) резко возрастает до своего максимального значения. Для более высоких значений энергии вероятность непрерывно уменьшается. По причине такой зависимости говорят, что существует граница поглощения. Место выбитого при акте поглощения электрона занимает другой электрон, при этом испускается излучение с меньшей энергией фотона, происходит так называемый процесс флюоресценции.
Рентгеновский фотон может взаимодействовать не только со связанными электронами, но и со свободными, а также слабосвязанными электронами. Происходит рассеяние фотонов на электронах (так называемое комптоновское рассеяние). В зависимости от угла рассеяния длина волны фотона увеличивается на определенную величину, и соответственно энергия уменьшается. Комп-тоновское рассеяние по сравнению с фотопоглощением становится преобладающим при более высоких энергиях фотона.
Процессы фотопоглощения и комптоновского рассеяния являются неупругими процессами, при которых фотон теряет энергию. Кроме того, существует так называемое упругое рассеяние (рэлеевское рассеяние), при котором рассеянный фотон сохраняет свою энергию.
В дополнение к названным процессам существует еще одна принципиальная возможность поглощения – за счет возникновения электрон-позитронных пар. Однако для этого необходимы энергии порядка 1 МэВ, которые лежат вне обозначенной выше границы рентгеновского излучения (<250 кэВ).
Рентгеновское излучение является ионизирующим. Оно воздействует на живые организмы и может быть причиной лучевой болезни и рака. По причине этого при работе с рентгеновским излучением необходимо соблюдать меры защиты. К возникновению рака ведет повреждение наследственной информации ДНК. Считается, что поражение прямо пропорционально поглощенной дозе излучения. Рентгеновское излучение является мутагенным фактором.
Рентгеновские лучи способны вызывать свечение некоторых веществ – флюоресценцию. Этот эффект используется в медицине при рентгеновской съемке. Медицинские фотопленки содержат флюоресцирующий слой, который светится при облучении рентгеновским излучением и засвечивает светочувствительную фотоэмульсию. Люминесцирующее вещество (сцинтиллятор) можно оптически соединить с электронным детектором светового излучения (фотоэлектронным умножителем, фотодиодом и т. п.), полученный прибор называется сцинтилляционным детектором. Он позволяет регистрировать отдельные фотоны и измерять их энергию, поскольку энергия сцинтилляционной вспышки пропорциональна энергии поглощенного фотона.
Рентгеновские лучи, так же как и обычный свет, способны напрямую засвечивать фотопленку. Однако без флюоресцирующего слоя для этого требуется примерно в 10–20 раз большая интенсивность. Преимуществом этого метода является большая резкость изображения.
В полупроводниковых детекторах рентгеновские лучи производят пары электрон-дырка в р-п переходе диода, включенного в запирающем направлении. При этом протекает небольшой ток, амплитуда которого пропорциональна энергии и интенсивности падающего рентгеновского излучения. В импульсном режиме возможны регистрация отдельных рентгеновских фотонов и измерение их энергии.
Отдельные фотоны рентгеновского излучения могут быть также зарегистрированы при помощи газонаполненных детекторов ионизирующего излучения (счетчика Гейгера, пропорциональной камеры и др.).
При помощи рентгеновских лучей можно просветить человеческое тело, в результате чего можно получить изображение костей, а в современных приборах – и внутренних органов. При этом используется тот факт, что у содержащегося преимущественно в костях элемента кальция (Z = 20) атомный номер гораздо больше, чем атомные номера элементов, из которых состоят мягкие ткани, а именно водорода (Z = 1), углерода (Z = 6), азота (Z = 7), кислорода (Z = 8).
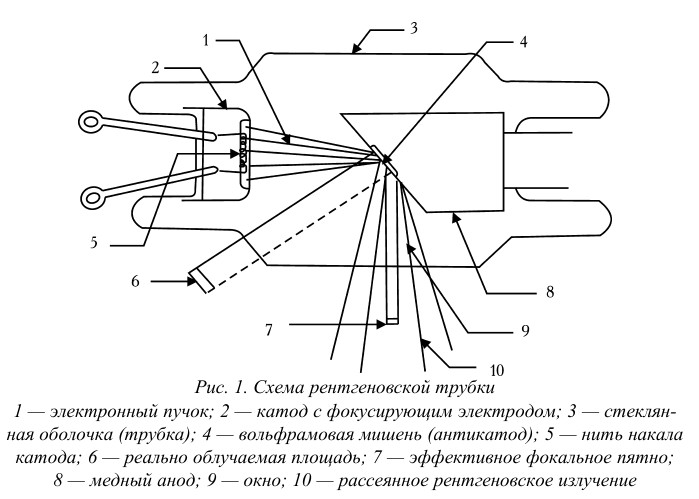
Простейшая рентгеновская трубка состоит из стеклянной колбы с впаянными в нее электродами – катодом и анодом (антикатодом). Электроны, испускаемые катодом, ускоряются сильным электрическим полем в вакууме между электродами и бомбардируют анод. При ударе электронов об анод часть их кинетической энергии преобразуется в энергию рентгеновского излучения. Важным компонентом рентгеновской трубки является электронная пушка – устройство для создания направленного пучка электронов; применяется в телевизионных трубках, рентгеновской аппаратуре, электронных микроскопах.
При бомбардировке электронами вольфрамовый антикатод испускает характеристическое рентгеновское излучение. Поперечное сечение рентгеновского пучка меньше реально облучаемой площади. Следовательно, чтобы получить рентгеновское излучение за счет взаимодействия электронов с веществом, нужно иметь источник электронов, устройство для их ускорения до больших скоростей и мишень, способную выдерживать электронную бомбардировку и давать рентгеновское излучение нужной интенсивности. Устройство, в котором все это есть, и называется рентгеновской трубкой (см. рис. 1).
 В газоразрядных трубках содержится небольшое количество газа, и когда на электроды трубки подается большая разность потенциалов, атомы газа превращаются в положительные и отрицательные ионы. Положительные движутся к отрицательному электроду (катоду) и, падая на него, выбивают из него электроны, а они в свою очередь движутся к положительному электроду (аноду) и, бомбардируя его, создают поток рентгеновских фотонов.
В газоразрядных трубках содержится небольшое количество газа, и когда на электроды трубки подается большая разность потенциалов, атомы газа превращаются в положительные и отрицательные ионы. Положительные движутся к отрицательному электроду (катоду) и, падая на него, выбивают из него электроны, а они в свою очередь движутся к положительному электроду (аноду) и, бомбардируя его, создают поток рентгеновских фотонов.
В рентгеновской трубке источником электронов является вольфрамовый катод, нагреваемый до высокой температуры. Электроны ускоряются до больших скоростей высокой разностью потенциалов между анодом (или антикатодом) и катодом. Поскольку электроны должны достичь анода без столкновений с атомами, необходим очень высокий вакуум, для чего нужно хорошо откачать трубку. Электроны фокусируются на аноде с помощью электрода особой формы, окружающего катод. Этот электрод называется фокусирующим и вместе с катодом образует «электронный прожектор» трубки. Подвергаемый электронной бомбардировке анод должен быть изготовлен из тугоплавкого материала, поскольку большая часть кинетической энергии бомбардирующих электронов превращается в тепло. Кроме того, желательно, чтобы анод был из материала с большим атомным номером, так как выход рентгеновского излучения растет с увеличением атомного номера. В качестве материала анода чаще всего выбирается вольфрам, атомный номер которого равен 74.
– это вид электромагнитного излучения, имеющего длину волны 10-3-100 нм и энергетический диапазон от 100 эВ до 0,1 МэВ. Рентгеновское излучение имеет две разновидности: характеристическое и тормозное рентгеновское излучение. Характеристическое рентгеновское излучение – это электромагнитное излучение, которое возникает при переходе электронов с внешних электронных оболочек атома на внутренние, более близко расположенные к ядру K-, L-, M-, N-оболочки, образуя при этом характеристический линейчатый спектр рентгеновского излучения. Частоты линий характеристического спектра химических элементов подчиняются закону Мозли.
Закон Мозли – линейная зависимость квадратного корня из частоты характеристического рентгеновского излучения от атомного номера химического элемента. Установлен экспериментально Г. Мозли в 1913 г. Закон Мозли – основа рентгеновского спектрального анализа:
√v = A (Z – B)
Тормозное рентгеновское излучение – это электромагнитное излучение, которое возникает при уменьшении кинетической энергии (торможении, рассеянии) быстрых заряженных частиц (например, при торможении в кулоновском поле ускоренных электронов). Спектр тормозного излучения непрерывен, максимальная энергия равна начальной энергии частицы. Это коротковолновое электромагнитное (фотонное) излучение с диапазоном частот от 3 х 1016 до 3 х 1019 Гц, длиной волн 10-8-10-12 м. Именно этот вид рентгеновского излучения используется в медицине.
Источниками рентгеновского излучения могут быть рентгеновская трубка, ускорители (бетатрон) и накопители электронов (синхротронное излучение), лазеры, некоторые радиоактивные изотопы и др.
Бетатрон – это циклический ускоритель электронов, электроны в нем ускоряются вихревым электрическим полем, порожденным переменным магнитным полем. Обычно энергия электронов в бетатроне не выше 50 МэВ.
Линейный ускоритель – это ускоритель заряженных частиц, в котором траектории частиц приближаются к прямой линии. Максимальная энергия электронов в линейном ускорителе составляет 20 ГэВ, протонов – до 800 МэВ. В линейном ускорителе электронов электроны впрыскиваются в трубку ускорителя и разгоняются там с помощью электромагнитного поля высокой частоты. Линейный ускоритель может быть использован как источник рентгеновского излучения. Для этого пучок электронов направляется на мишень, изготовленную из тяжелого тугоплавкого металла. В результате бомбардировки электронами ядер атомов мишени образуются фотоны, а электроны отражаются с меньшей энергией. Пучок фотонов с энергией, соответствующей рентгеновскому излучению, проходит через выравнивающий фильтр, лучу придается нужная форма с помощью коллиматора до попадания на больного.
Коэффициент преломления практически любого вещества для рентгеновских лучей мало отличается от единицы. Следствием этого явления служит то, что не существует материала, использовав который можно было бы изготовить линзу для рентгеновских лучей. Кроме того, при перпендикулярном падении на поверхность вещества рентгеновские лучи почти не отражаются. Несмотря на это, в рентгеновской оптике были найдены способы построения оптических элементов для рентгеновских лучей.
Рентгеновские лучи способны проникать сквозь вещество, причем различные вещества по-разному их поглощают. Поглощение рентгеновских лучей является важнейшим их свойством в рентгеновской съемке. Интенсивность рентгеновских лучей экспоненциально убывает в зависимости от пройденного пути в поглощающем слое (I = 10е-kd, где d – толщина слоя, коэффициент k пропорционален Z3χ3,Z – атомный номер элемента, χ – длина волны).
Поглощение происходит в результате фотопоглощения и комп-тоновского рассеяния. Фотопоглощение – процесс выбивания фотоном электрона из оболочки атома, для чего требуется, чтобы энергия фотона была больше некоторого минимального значения. Если рассматривать вероятность акта поглощения в зависимости от энергии фотона, то при достижении определенной энергии она (вероятность) резко возрастает до своего максимального значения. Для более высоких значений энергии вероятность непрерывно уменьшается. По причине такой зависимости говорят, что существует граница поглощения. Место выбитого при акте поглощения электрона занимает другой электрон, при этом испускается излучение с меньшей энергией фотона, происходит так называемый процесс флюоресценции.
Рентгеновский фотон может взаимодействовать не только со связанными электронами, но и со свободными, а также слабосвязанными электронами. Происходит рассеяние фотонов на электронах (так называемое комптоновское рассеяние). В зависимости от угла рассеяния длина волны фотона увеличивается на определенную величину, и соответственно энергия уменьшается. Комп-тоновское рассеяние по сравнению с фотопоглощением становится преобладающим при более высоких энергиях фотона.
Процессы фотопоглощения и комптоновского рассеяния являются неупругими процессами, при которых фотон теряет энергию. Кроме того, существует так называемое упругое рассеяние (рэлеевское рассеяние), при котором рассеянный фотон сохраняет свою энергию.
В дополнение к названным процессам существует еще одна принципиальная возможность поглощения – за счет возникновения электрон-позитронных пар. Однако для этого необходимы энергии порядка 1 МэВ, которые лежат вне обозначенной выше границы рентгеновского излучения (<250 кэВ).
Рентгеновское излучение является ионизирующим. Оно воздействует на живые организмы и может быть причиной лучевой болезни и рака. По причине этого при работе с рентгеновским излучением необходимо соблюдать меры защиты. К возникновению рака ведет повреждение наследственной информации ДНК. Считается, что поражение прямо пропорционально поглощенной дозе излучения. Рентгеновское излучение является мутагенным фактором.
Рентгеновские лучи способны вызывать свечение некоторых веществ – флюоресценцию. Этот эффект используется в медицине при рентгеновской съемке. Медицинские фотопленки содержат флюоресцирующий слой, который светится при облучении рентгеновским излучением и засвечивает светочувствительную фотоэмульсию. Люминесцирующее вещество (сцинтиллятор) можно оптически соединить с электронным детектором светового излучения (фотоэлектронным умножителем, фотодиодом и т. п.), полученный прибор называется сцинтилляционным детектором. Он позволяет регистрировать отдельные фотоны и измерять их энергию, поскольку энергия сцинтилляционной вспышки пропорциональна энергии поглощенного фотона.
Рентгеновские лучи, так же как и обычный свет, способны напрямую засвечивать фотопленку. Однако без флюоресцирующего слоя для этого требуется примерно в 10–20 раз большая интенсивность. Преимуществом этого метода является большая резкость изображения.
В полупроводниковых детекторах рентгеновские лучи производят пары электрон-дырка в р-п переходе диода, включенного в запирающем направлении. При этом протекает небольшой ток, амплитуда которого пропорциональна энергии и интенсивности падающего рентгеновского излучения. В импульсном режиме возможны регистрация отдельных рентгеновских фотонов и измерение их энергии.
Отдельные фотоны рентгеновского излучения могут быть также зарегистрированы при помощи газонаполненных детекторов ионизирующего излучения (счетчика Гейгера, пропорциональной камеры и др.).
При помощи рентгеновских лучей можно просветить человеческое тело, в результате чего можно получить изображение костей, а в современных приборах – и внутренних органов. При этом используется тот факт, что у содержащегося преимущественно в костях элемента кальция (Z = 20) атомный номер гораздо больше, чем атомные номера элементов, из которых состоят мягкие ткани, а именно водорода (Z = 1), углерода (Z = 6), азота (Z = 7), кислорода (Z = 8).
Простейшая рентгеновская трубка состоит из стеклянной колбы с впаянными в нее электродами – катодом и анодом (антикатодом). Электроны, испускаемые катодом, ускоряются сильным электрическим полем в вакууме между электродами и бомбардируют анод. При ударе электронов об анод часть их кинетической энергии преобразуется в энергию рентгеновского излучения. Важным компонентом рентгеновской трубки является электронная пушка – устройство для создания направленного пучка электронов; применяется в телевизионных трубках, рентгеновской аппаратуре, электронных микроскопах.
При бомбардировке электронами вольфрамовый антикатод испускает характеристическое рентгеновское излучение. Поперечное сечение рентгеновского пучка меньше реально облучаемой площади. Следовательно, чтобы получить рентгеновское излучение за счет взаимодействия электронов с веществом, нужно иметь источник электронов, устройство для их ускорения до больших скоростей и мишень, способную выдерживать электронную бомбардировку и давать рентгеновское излучение нужной интенсивности. Устройство, в котором все это есть, и называется рентгеновской трубкой (см. рис. 1).

В рентгеновской трубке источником электронов является вольфрамовый катод, нагреваемый до высокой температуры. Электроны ускоряются до больших скоростей высокой разностью потенциалов между анодом (или антикатодом) и катодом. Поскольку электроны должны достичь анода без столкновений с атомами, необходим очень высокий вакуум, для чего нужно хорошо откачать трубку. Электроны фокусируются на аноде с помощью электрода особой формы, окружающего катод. Этот электрод называется фокусирующим и вместе с катодом образует «электронный прожектор» трубки. Подвергаемый электронной бомбардировке анод должен быть изготовлен из тугоплавкого материала, поскольку большая часть кинетической энергии бомбардирующих электронов превращается в тепло. Кроме того, желательно, чтобы анод был из материала с большим атомным номером, так как выход рентгеновского излучения растет с увеличением атомного номера. В качестве материала анода чаще всего выбирается вольфрам, атомный номер которого равен 74.
