Страница:
 ,
с= 4,679
,
с= 4,679
 ), а выше этой температуры — b-форма с кубической объёмно-центрированной решёткой
а =3,269
), а выше этой температуры — b-форма с кубической объёмно-центрированной решёткой
а =3,269
 . Примеси и легирующие добавки могут существенно изменять температуру a/b превращения.
. Примеси и легирующие добавки могут существенно изменять температуру a/b превращения. , ионные радиусы Ti
+0,94
, ионные радиусы Ti
+0,94
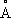 , Ti
2+0,78
, Ti
2+0,78
 , Ti
3+0,69
, Ti
3+0,69
 , Ti
4+0,64
, Ti
4+0,64
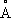 , t
пл1668±5°С,
t
кип3227 °С; теплопроводность в интервале 20—25 °С 22,065
вт/(
мЧ К) [0,0527
кал/(
смЧ
секЧ °С)]; температурный коэффициент линейного расширения при 20 °С 8,5Ч10
-6, в интервале 20—700 °С 9,7Ч10
-6; теплоёмкость 0,523
кдж/(
кгЧ К) [0,1248
кал/(
гЧ°С)]; удельное электросопротивление 42,1Ч10
-6
омЧ
смпри 20 °С; температурный коэффициент электросопротивления 0,0035 при 20 °С; обладает сверхпроводимостью ниже 0,38±0,01 К. Т. парамагнитен, удельная магнитная восприимчивость (3,2±0,4)Ч10
-6при 20°С. Предел прочности 256
Мн/м
2(25,6
кгс/мм
2)
,относительное удлинение 72%, твёрдость по Бринеллю менее 1000
Мн/м
2(100
кгс/мм
2)
.Модуль нормальной упругости 108000
Мн/м
2(10800
кгс/мм
2)
.Металл высокой степени чистоты ковок при обычной температуре.
, t
пл1668±5°С,
t
кип3227 °С; теплопроводность в интервале 20—25 °С 22,065
вт/(
мЧ К) [0,0527
кал/(
смЧ
секЧ °С)]; температурный коэффициент линейного расширения при 20 °С 8,5Ч10
-6, в интервале 20—700 °С 9,7Ч10
-6; теплоёмкость 0,523
кдж/(
кгЧ К) [0,1248
кал/(
гЧ°С)]; удельное электросопротивление 42,1Ч10
-6
омЧ
смпри 20 °С; температурный коэффициент электросопротивления 0,0035 при 20 °С; обладает сверхпроводимостью ниже 0,38±0,01 К. Т. парамагнитен, удельная магнитная восприимчивость (3,2±0,4)Ч10
-6при 20°С. Предел прочности 256
Мн/м
2(25,6
кгс/мм
2)
,относительное удлинение 72%, твёрдость по Бринеллю менее 1000
Мн/м
2(100
кгс/мм
2)
.Модуль нормальной упругости 108000
Мн/м
2(10800
кгс/мм
2)
.Металл высокой степени чистоты ковок при обычной температуре.