Страница:
9. Процесс превращения альдегидной формы в циклическую обратим. В растворе существует подвижное равновесие между ними. Данное явление называется мутаротацией.
Молекул, которые содержат альдегидную группу, недостаточно, чтобы ярко проявилась реакция глюкозы с фуксинсернистой кислотой.
60. Химические свойства глюкозы и ее применение
61. Моносахариды
62. Дисахариды
63. Полисахариды
64. Рибоза и дезоксирибоза
65. Сахароза, ее физические и химические свойства
66. Крахмал и его строение
67. Крахмал как питательное вещество. Применение и получение крахмала
68. Целлюлоза, ее физические свойства
69. Химические свойства целлюлозы и ее применение
70. Получение ацетатного волокна
Молекул, которые содержат альдегидную группу, недостаточно, чтобы ярко проявилась реакция глюкозы с фуксинсернистой кислотой.
60. Химические свойства глюкозы и ее применение
Химические свойства альдегидной формы глюкозы:
а) глюкоза – это вещество с двойственной химической природой;
б) как многоатомный спирт глюкоза образует сложные эфиры;
в) как альдегид она окисляется. Окислительное действие аммиачного раствора оксида серебра (I) на глюкозу можно записать следующим образом:
 г) окислителем альдегидной группы глюкозы может служить и гидроксид меди (II). Если к небольшому количеству свежеосажденного гидроксида меди (II) прилить раствор глюкозы и смесь нагреть, то образуется красный оксид меди (I). Уравнение реакции окисления глюкозы гидроксидом меди (II) аналогично уравнению для альдегидов;
г) окислителем альдегидной группы глюкозы может служить и гидроксид меди (II). Если к небольшому количеству свежеосажденного гидроксида меди (II) прилить раствор глюкозы и смесь нагреть, то образуется красный оксид меди (I). Уравнение реакции окисления глюкозы гидроксидом меди (II) аналогично уравнению для альдегидов;
д) альдегидная группа глюкозы может быть восстановлена.
Тогда образуется шестиатомный спирт (сорбит): СН2ОН-СНОН-СНОН-СНОН-СНОН-СН2ОН.
Виды брожения.
1. Спиртовое брожение идет под действием фермента дрожжей: С6Н12O6 ? 2С2Н5ОН + 2СO2.
2. Под действием фермента молочнокислых бактерий происходит молочнокислое брожение глюкозы: C6H12O6 ? 2СН3-СН(ОН) – СOОН – молочная кислота.
Особенности молочной кислоты:
1) это соединение с двойственной химической функцией, в ней сочетаются свойства спирта и карбоновой кислоты;
2) процесс образования молочной кислоты происходит при скисании молока;
3) появление кислоты в молоке можно установить при помощи лакмуса;
4) молочнокислое брожение имеет большое значение в переработке сельскохозяйственных продуктов;
5) с ним связано получение молочных продуктов: простокваши, творога, сметаны, сыра;
6) молочная кислота образуется в процессе квашения капусты, силосования кормов и выполняет при этом консервирующую роль.
Способы применения глюкозы.
1. Глюкоза– ценное питательное вещество.
2. Крахмал пищи в пищеварительном тракте превращается в глюкозу, которая кровью разносится по всем тканям и клеткам организма.
3. Как вещество, легко усваиваемое организмом и дающее ему энергию, глюкоза находит и непосредственное применение в качестве укрепляющего лечебного средства.
4. Сладкий вкус обусловил применение ее в кондитерском деле (в составе патоки) при изготовлении мармелада, карамели, пряников и т. д.
а) глюкоза – это вещество с двойственной химической природой;
б) как многоатомный спирт глюкоза образует сложные эфиры;
в) как альдегид она окисляется. Окислительное действие аммиачного раствора оксида серебра (I) на глюкозу можно записать следующим образом:

д) альдегидная группа глюкозы может быть восстановлена.
Тогда образуется шестиатомный спирт (сорбит): СН2ОН-СНОН-СНОН-СНОН-СНОН-СН2ОН.
Виды брожения.
1. Спиртовое брожение идет под действием фермента дрожжей: С6Н12O6 ? 2С2Н5ОН + 2СO2.
2. Под действием фермента молочнокислых бактерий происходит молочнокислое брожение глюкозы: C6H12O6 ? 2СН3-СН(ОН) – СOОН – молочная кислота.
Особенности молочной кислоты:
1) это соединение с двойственной химической функцией, в ней сочетаются свойства спирта и карбоновой кислоты;
2) процесс образования молочной кислоты происходит при скисании молока;
3) появление кислоты в молоке можно установить при помощи лакмуса;
4) молочнокислое брожение имеет большое значение в переработке сельскохозяйственных продуктов;
5) с ним связано получение молочных продуктов: простокваши, творога, сметаны, сыра;
6) молочная кислота образуется в процессе квашения капусты, силосования кормов и выполняет при этом консервирующую роль.
Способы применения глюкозы.
1. Глюкоза– ценное питательное вещество.
2. Крахмал пищи в пищеварительном тракте превращается в глюкозу, которая кровью разносится по всем тканям и клеткам организма.
3. Как вещество, легко усваиваемое организмом и дающее ему энергию, глюкоза находит и непосредственное применение в качестве укрепляющего лечебного средства.
4. Сладкий вкус обусловил применение ее в кондитерском деле (в составе патоки) при изготовлении мармелада, карамели, пряников и т. д.
61. Моносахариды
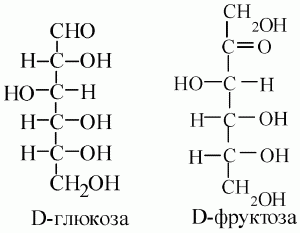
Моносахариды– это простейшие углеводы. Они не подвергаются гидролизу – не расщепляются водой на более простые углеводы. Общая формула – Сn(H2O)n. Моносахариды представляют собой бесцветные кристаллические вещества, растворимые в воде и сладкие на вкус (фруктоза – самый сладкий сахар). Все они являются оптически активными веществами. Моносахариды являются полиоксикарбонильными соединениями, следовательно, классифицируются по числу углеродных атомов в молекуле и присутствию альдегидной или кетонной группы. Например: альдогексоза, кетопентоза и т. д.
Важнейшими моносахаридами являются альдопентозы: рибоза и дезоксирибоза, которые входят в состав нуклеиновых кислот; ксилоза (древесный сахар), который является составной частью ксиланов, содержащихся в древесине, лузге подсолнуха, соломе. Из альдогексоз самыми распространенными являются глюкоза и фруктоза.
 В природе моносахариды образуются в зеленых растениях в результате фотосинтеза, который представляет собой процесс химического связывания или «фиксации» углекислого газа и воды за счет использования энергии солнечных лучей растениями.
В природе моносахариды образуются в зеленых растениях в результате фотосинтеза, который представляет собой процесс химического связывания или «фиксации» углекислого газа и воды за счет использования энергии солнечных лучей растениями.
Главным источником получения моносахаридов, имеющих практическое значение, являются полисахариды. Так, глюкозу получают в большом количестве гидролизом крахмала:
(С6H10O5)n + nН2О ? nС6Н12O6.
Химические свойства.Для моносахаридов характерны реакции, свойственные спиртам, альдегидам и кетонам, так как в молекулах простых сахаров содержатся гидроксильные и в скрытом виде карбонильные группы. При взаимодействии моносахаридов с различными веществами реакции могут протекать: по карбонильной группе, гидроксильным группам либо с изменением углеродного скелета молекулы.
1. Альдегидная группа моносахаридов окисляется до карбоксильной группы с образованием альдоновых кислот.
2. При нагревании моносахаридов с концентрированными кислотами происходит дегидратация молекулы. Из пентоз образуется фурфурол, из гексоз – оксиметилфурфурол:
 3. Моносахариды D-ряда (глюкоза, фруктоза, манноза) расщепляются при каталитическом действии ферментов дрожжей.
3. Моносахариды D-ряда (глюкоза, фруктоза, манноза) расщепляются при каталитическом действии ферментов дрожжей.
Важнейшими моносахаридами являются альдопентозы: рибоза и дезоксирибоза, которые входят в состав нуклеиновых кислот; ксилоза (древесный сахар), который является составной частью ксиланов, содержащихся в древесине, лузге подсолнуха, соломе. Из альдогексоз самыми распространенными являются глюкоза и фруктоза.

Главным источником получения моносахаридов, имеющих практическое значение, являются полисахариды. Так, глюкозу получают в большом количестве гидролизом крахмала:
(С6H10O5)n + nН2О ? nС6Н12O6.
Химические свойства.Для моносахаридов характерны реакции, свойственные спиртам, альдегидам и кетонам, так как в молекулах простых сахаров содержатся гидроксильные и в скрытом виде карбонильные группы. При взаимодействии моносахаридов с различными веществами реакции могут протекать: по карбонильной группе, гидроксильным группам либо с изменением углеродного скелета молекулы.
1. Альдегидная группа моносахаридов окисляется до карбоксильной группы с образованием альдоновых кислот.
2. При нагревании моносахаридов с концентрированными кислотами происходит дегидратация молекулы. Из пентоз образуется фурфурол, из гексоз – оксиметилфурфурол:

62. Дисахариды
Дисахариды– это углеводы, которые при нагревании с водой в присутствии минеральных кислот или под влиянием ферментов подвергаются гидролизу, расщепляясь на две молекулы моносахаридов.
Наиболее широко распространенным дисахаридом является сахароза (тростниковый или свекловичный сахар). Получают его из сахарного тростника или из сахарной свеклы. В молоке содержится 5 % лактозы – молочного сахара. Мальтоза содержится в прорастающем зерне и образуется при гидролизе зернового крахмала. Целлобиоза является промежуточным продуктом при ферментативном гидролизе целлюлозы.
Строение.Молекула дисахарида состоит из двух молекул моносахаридов, соединенных гликозидной связью. В зависимости от того, какие атомы углерода участвуют в образовании гликозидной связи, молекула дисахарида может или не может содержать свободную карбонильную группу.
Дисахариды можно разделить на две группы: невосстанавливающие и восстанавливающие. Невосстанавливающие сахара не имеют ОН-группы ни при одном аномерном центре, восстанавливающие – имеют свободную ОН-группу при аномерном центре.
Невосстанавливающие сахара называют гликозил-гликозидами; восстанавливающие – гликозил-гликозами.
Мальтоза– восстанавливающий дисахарид, образующийся при ферментативном гидролизе крахмала. Мальтоза состоит из двух остатков D-глюкозы, соединенных гликозидной связью по положениям 1,4.
 Целлобиоза, или 4-(?-глюкозидо) – глюкоза построена также, как и мальтоза, но представляет собой ?-гликозид.
Целлобиоза, или 4-(?-глюкозидо) – глюкоза построена также, как и мальтоза, но представляет собой ?-гликозид.
Сахароза состоит из остатков глюкозы и фруктозы, соединенных 1,2-гликозидной связью. У сахарозы полуацетальные гидроксильные группы обеих молекул моносахаридов участвуют в образовании гликозидной связи, вследствие чего сахароза является невосстанавливающим сахаром.
Химические свойства дисахаридов:
1) способность гидролизоваться: под действием кислоты или соответствующего фермента разрывается гликозидная связь и образуются два моносахарида;
2) окисляются ионами меди, серебра, ртути, образуют озазоны и вступают во все реакции, характерные для соединений, содержащих свободные карбонильные группы;
3) дисахариды могут быть окислены до диоксида углерода и воды. Под действием ферментов дрожжей сахароза и мальтоза дают этанол, а лактоза не изменяется.
Наиболее широко распространенным дисахаридом является сахароза (тростниковый или свекловичный сахар). Получают его из сахарного тростника или из сахарной свеклы. В молоке содержится 5 % лактозы – молочного сахара. Мальтоза содержится в прорастающем зерне и образуется при гидролизе зернового крахмала. Целлобиоза является промежуточным продуктом при ферментативном гидролизе целлюлозы.
Строение.Молекула дисахарида состоит из двух молекул моносахаридов, соединенных гликозидной связью. В зависимости от того, какие атомы углерода участвуют в образовании гликозидной связи, молекула дисахарида может или не может содержать свободную карбонильную группу.
Дисахариды можно разделить на две группы: невосстанавливающие и восстанавливающие. Невосстанавливающие сахара не имеют ОН-группы ни при одном аномерном центре, восстанавливающие – имеют свободную ОН-группу при аномерном центре.
Невосстанавливающие сахара называют гликозил-гликозидами; восстанавливающие – гликозил-гликозами.
Мальтоза– восстанавливающий дисахарид, образующийся при ферментативном гидролизе крахмала. Мальтоза состоит из двух остатков D-глюкозы, соединенных гликозидной связью по положениям 1,4.

Сахароза состоит из остатков глюкозы и фруктозы, соединенных 1,2-гликозидной связью. У сахарозы полуацетальные гидроксильные группы обеих молекул моносахаридов участвуют в образовании гликозидной связи, вследствие чего сахароза является невосстанавливающим сахаром.
Химические свойства дисахаридов:
1) способность гидролизоваться: под действием кислоты или соответствующего фермента разрывается гликозидная связь и образуются два моносахарида;
2) окисляются ионами меди, серебра, ртути, образуют озазоны и вступают во все реакции, характерные для соединений, содержащих свободные карбонильные группы;
3) дисахариды могут быть окислены до диоксида углерода и воды. Под действием ферментов дрожжей сахароза и мальтоза дают этанол, а лактоза не изменяется.
63. Полисахариды
Характерные особенности крахмала:
1) относится к полисахаридам;
2) молекулярная масса этого вещества точно не установлена, но она очень велика (порядка 100 000) и для разных образцов может быть различна;
3) формулу крахмала, как и других полисахаридов, можно записать в виде (С6H10O5)n;
4) для каждого полисахарида n имеет различные значения;
5) представляет собой безвкусный белый порошок, не растворимый в холодной воде.
Способы получения крахмала:
1) крахмал широко распространен в природе;
2) он является для различных растений запасным питательным материалом и содержится в них в виде крахмальных зерен;
3) наиболее богаты крахмалом зерно злаков: риса (до 86 %), пшеницы (до 75 %), кукурузы (до 72 %), а также клубни картофеля (до 24 %);
4) крахмал является одним из продуктов фотосинтеза;
5) из растений извлекается крахмал путем разрушения его клеток и отмывания его водой;
6) в промышленном масштабе крахмал получается из клубней картофеля (в виде картофельной муки).
При действии фермента или при нагревании с кислотами (ионы водорода служат катализатором) крахмал, как и все сложные углеводы, подвергается гидролизу.
Особенности гидролиза:
1) при гидролизе сначала образуется растворимый крахмал, далее сложные вещества – декстрины, мальтоза;
2) конечным продуктом гидролиза является глюкоза;
3) суммарное уравнение можно записать следующим образом:
(С6H10O5)n + nН2О ? nС6Н12O6;
4) гидролиз крахмала – это его важное химическое свойство;
5) крахмал не дает реакции «серебряного зеркала», но ее дают продукты его гидролиза.
Особенности процесса образования крахмала:
а) соединение молекул глюкозы происходит с участием наиболее реакционноспособных гидроксильных групп, а исчезновение последних исключает возможность образования альдегидных групп, и они в молекуле крахмала отсутствуют;
б) раствор йода окрашивает крахмал в синий цвет;
в) при нагревании окраска синего цвета исчезает, при охлаждении вновь появляется;
г) раствор йода используется для обнаружения крахмала, а раствор крахмала (клейстер) – для обнаружения йода.
Применение крахмала:
1) крахмал является основным углеводом пищи человека – хлеба, круп, картофеля;
2) в значительных количествах крахмал перерабатывается на декстрины, патоку и глюкозу, которые используются в кондитерском производстве;
3) из крахмала, который содержится в картофеле и зерне злаков, получается этиловый спирт.
1) относится к полисахаридам;
2) молекулярная масса этого вещества точно не установлена, но она очень велика (порядка 100 000) и для разных образцов может быть различна;
3) формулу крахмала, как и других полисахаридов, можно записать в виде (С6H10O5)n;
4) для каждого полисахарида n имеет различные значения;
5) представляет собой безвкусный белый порошок, не растворимый в холодной воде.
Способы получения крахмала:
1) крахмал широко распространен в природе;
2) он является для различных растений запасным питательным материалом и содержится в них в виде крахмальных зерен;
3) наиболее богаты крахмалом зерно злаков: риса (до 86 %), пшеницы (до 75 %), кукурузы (до 72 %), а также клубни картофеля (до 24 %);
4) крахмал является одним из продуктов фотосинтеза;
5) из растений извлекается крахмал путем разрушения его клеток и отмывания его водой;
6) в промышленном масштабе крахмал получается из клубней картофеля (в виде картофельной муки).
При действии фермента или при нагревании с кислотами (ионы водорода служат катализатором) крахмал, как и все сложные углеводы, подвергается гидролизу.
Особенности гидролиза:
1) при гидролизе сначала образуется растворимый крахмал, далее сложные вещества – декстрины, мальтоза;
2) конечным продуктом гидролиза является глюкоза;
3) суммарное уравнение можно записать следующим образом:
(С6H10O5)n + nН2О ? nС6Н12O6;
4) гидролиз крахмала – это его важное химическое свойство;
5) крахмал не дает реакции «серебряного зеркала», но ее дают продукты его гидролиза.
Особенности процесса образования крахмала:
а) соединение молекул глюкозы происходит с участием наиболее реакционноспособных гидроксильных групп, а исчезновение последних исключает возможность образования альдегидных групп, и они в молекуле крахмала отсутствуют;
б) раствор йода окрашивает крахмал в синий цвет;
в) при нагревании окраска синего цвета исчезает, при охлаждении вновь появляется;
г) раствор йода используется для обнаружения крахмала, а раствор крахмала (клейстер) – для обнаружения йода.
Применение крахмала:
1) крахмал является основным углеводом пищи человека – хлеба, круп, картофеля;
2) в значительных количествах крахмал перерабатывается на декстрины, патоку и глюкозу, которые используются в кондитерском производстве;
3) из крахмала, который содержится в картофеле и зерне злаков, получается этиловый спирт.
64. Рибоза и дезоксирибоза
Известны углеводы с пятью углеродными атомами в молекуле – это пентозы.
Особенности рибозы и дезоксирибозы.
1. Рибоза С5H10O5 и дезоксирибоза С5H10O4 – кристаллические вещества сладкого вкуса, растворимые в воде.
2. Состав дезоксирибозы не отвечает формуле Сn(Н2О)m, считавшейся общей формулой всех углеводов.
3. Дезоксирибоза отличается от рибозы отсутствием в молекуле одной гидроксильной группы (оксигруппы), которая заменена атомом водорода. Отсюда и произошло название вещества (дезоксирибоза).
Структурные формулы:
 СН2-СН-СН-СН-С-Н=О (рибоза).
СН2-СН-СН-СН-С-Н=О (рибоза).
4. Они точно указывают, при каком именно атоме углерода дезоксирибозы нет гидроксильной группы.
5. Подобно глюкозе молекулы пентоз существуют не только в альдегидной, но и в циклической форме.
Замыкание кольца в них можно представить аналогичным образом.
Отличие будет лишь в том, что карбонильная группа взаимодействует с гидроксилом не пятого, а четвертого атома углерода, и в результате перегруппировки атомов образуется не шестичленный, а пятичленный цикл.
Как и в случае глюкозы, пентозы известны в двух циклических формах (? и ?); в водном растворе они находятся в подвижном равновесии с альдегидной формой.
Фруктоза как изомер глюкозы.
Известен ряд углеводов, состав которых отвечает формуле С6Н12O6.
Все они являются изомерами и как вещества, содержащие шесть атомов углерода в молекуле, называются гексозами.
Распространенный их представитель – фруктоза. По стоению фруктоза является кетоспиртом.
Свекловичный или тростниковый сахар: получается из сахарной свеклы или сахарного тростника; содержится также в соке березы, клена и некоторых фруктах, меде.
Химические свойства рибозы и дезоксирибозы.
1. При окислении по альдегидной группе они образуют соответствующие кислоты.
2. При восстановлении пентозы превращаются в многоатомные спирты.
3. Рибоза и дезоксирибоза имеют большое биологическое значение.
4. Они входят в состав нуклеиновых кислот, которые осуществляют в клетках организмов синтез белков и передачу наследственных признаков.
Особенности рибозы и дезоксирибозы.
1. Рибоза С5H10O5 и дезоксирибоза С5H10O4 – кристаллические вещества сладкого вкуса, растворимые в воде.
2. Состав дезоксирибозы не отвечает формуле Сn(Н2О)m, считавшейся общей формулой всех углеводов.
3. Дезоксирибоза отличается от рибозы отсутствием в молекуле одной гидроксильной группы (оксигруппы), которая заменена атомом водорода. Отсюда и произошло название вещества (дезоксирибоза).
Структурные формулы:

4. Они точно указывают, при каком именно атоме углерода дезоксирибозы нет гидроксильной группы.
5. Подобно глюкозе молекулы пентоз существуют не только в альдегидной, но и в циклической форме.
Замыкание кольца в них можно представить аналогичным образом.
Отличие будет лишь в том, что карбонильная группа взаимодействует с гидроксилом не пятого, а четвертого атома углерода, и в результате перегруппировки атомов образуется не шестичленный, а пятичленный цикл.
Как и в случае глюкозы, пентозы известны в двух циклических формах (? и ?); в водном растворе они находятся в подвижном равновесии с альдегидной формой.
Фруктоза как изомер глюкозы.
Известен ряд углеводов, состав которых отвечает формуле С6Н12O6.
Все они являются изомерами и как вещества, содержащие шесть атомов углерода в молекуле, называются гексозами.
Распространенный их представитель – фруктоза. По стоению фруктоза является кетоспиртом.
Свекловичный или тростниковый сахар: получается из сахарной свеклы или сахарного тростника; содержится также в соке березы, клена и некоторых фруктах, меде.
Химические свойства рибозы и дезоксирибозы.
1. При окислении по альдегидной группе они образуют соответствующие кислоты.
2. При восстановлении пентозы превращаются в многоатомные спирты.
3. Рибоза и дезоксирибоза имеют большое биологическое значение.
4. Они входят в состав нуклеиновых кислот, которые осуществляют в клетках организмов синтез белков и передачу наследственных признаков.
65. Сахароза, ее физические и химические свойства
Физические свойства и нахождение в природе.
1. Она представляет собой бесцветные кристаллы сладкого вкуса, хорошо растворима в воде.
2. Температура плавления сахарозы 160 °C.
3. При застывании расплавленной сахарозы образуется аморфная прозрачная масса – карамель.
4. Содержится во многих растениях: в соке березы, клена, в моркови, дыне, а также в сахарной свекле и сахарном тростнике.
Строение и химические свойства.
1. Молекулярная формула сахарозы – С12Н22О11.
2. Сахароза имеет более сложное строение, чем глюкоза.
3. Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов.
Если раствор сахарозы прилить к гидроксиду меди (II), образуется ярко-синий раствор сахарата меди.
4. Альдегидной группы в сахарозе нет: при нагревании с аммиачным раствором оксида серебра (I) она не дает «серебряного зеркала», при нагревании с гидроксидом меди (II) не образует красного оксида меди (I).
5. Сахароза, в отличие от глюкозы, не является альдегидом.
6. Сахароза является важнейшим из дисахаридов.
7. Она получается из сахарной свеклы (в ней содержится до 28 % сахарозы от сухого вещества) или из сахарного тростника.
Реакция сахарозы с водой.
Если прокипятить раствор сахарозы с несколькими каплями соляной или серной кислоты и нейтрализовать кислоту щелочью, а после этого нагреть раствор с гидроксидом меди (II), выпадает красный осадок.
При кипячении раствора сахарозы появляются молекулы с альдегидными группами, которые и восстанавливают гидроксид меди (II) до оксида меди (I). Эта реакция показывает, что сахароза при каталитическом действии кислоты подвергается гидролизу, в результате чего образуются глюкоза и фруктоза:
С12Н22О11 + Н2О ? С6Н12O6 + С6Н12O6.
6. Молекула сахарозы состоит из соединенных друг с другом остатков глюкозы и фруктозы.
Из числа изомеров сахарозы, имеющих молекулярную формулу С12Н22О11, можно выделить мальтозу и лактозу.
Особенности мальтозы:
1) мальтоза получается из крахмала под действием солода;
2) она называется еще солодовым сахаром;
3) при гидролизе она образует глюкозу:
С12Н22О11 (мальтоза) + Н2О ? 2С6Н12O6 (глюкоза).
Особенности лактозы: 1) лактоза (молочный сахар) содержится в молоке; 2) она обладает высокой питательностью; 3) при гидролизе лактоза разлагается на глюкозу и галактозу – изомер глюкозы и фруктозы, что является важной особенностью.
1. Она представляет собой бесцветные кристаллы сладкого вкуса, хорошо растворима в воде.
2. Температура плавления сахарозы 160 °C.
3. При застывании расплавленной сахарозы образуется аморфная прозрачная масса – карамель.
4. Содержится во многих растениях: в соке березы, клена, в моркови, дыне, а также в сахарной свекле и сахарном тростнике.
Строение и химические свойства.
1. Молекулярная формула сахарозы – С12Н22О11.
2. Сахароза имеет более сложное строение, чем глюкоза.
3. Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов.
Если раствор сахарозы прилить к гидроксиду меди (II), образуется ярко-синий раствор сахарата меди.
4. Альдегидной группы в сахарозе нет: при нагревании с аммиачным раствором оксида серебра (I) она не дает «серебряного зеркала», при нагревании с гидроксидом меди (II) не образует красного оксида меди (I).
5. Сахароза, в отличие от глюкозы, не является альдегидом.
6. Сахароза является важнейшим из дисахаридов.
7. Она получается из сахарной свеклы (в ней содержится до 28 % сахарозы от сухого вещества) или из сахарного тростника.
Реакция сахарозы с водой.
Если прокипятить раствор сахарозы с несколькими каплями соляной или серной кислоты и нейтрализовать кислоту щелочью, а после этого нагреть раствор с гидроксидом меди (II), выпадает красный осадок.
При кипячении раствора сахарозы появляются молекулы с альдегидными группами, которые и восстанавливают гидроксид меди (II) до оксида меди (I). Эта реакция показывает, что сахароза при каталитическом действии кислоты подвергается гидролизу, в результате чего образуются глюкоза и фруктоза:
С12Н22О11 + Н2О ? С6Н12O6 + С6Н12O6.
6. Молекула сахарозы состоит из соединенных друг с другом остатков глюкозы и фруктозы.
Из числа изомеров сахарозы, имеющих молекулярную формулу С12Н22О11, можно выделить мальтозу и лактозу.
Особенности мальтозы:
1) мальтоза получается из крахмала под действием солода;
2) она называется еще солодовым сахаром;
3) при гидролизе она образует глюкозу:
С12Н22О11 (мальтоза) + Н2О ? 2С6Н12O6 (глюкоза).
Особенности лактозы: 1) лактоза (молочный сахар) содержится в молоке; 2) она обладает высокой питательностью; 3) при гидролизе лактоза разлагается на глюкозу и галактозу – изомер глюкозы и фруктозы, что является важной особенностью.
66. Крахмал и его строение
Физические свойства и нахождение в природе.
1. Крахмал представляет собой белый порошок, не растворимый в воде.
2. В горячей воде он набухает и образует коллоидный раствор – клейстер.
3. Являясь продуктом усвоения оксида углерода (IV) зелеными (содержащими хлорофилл) клетками растений, крахмал распространен в растительном мире.
4. Клубни картофеля содержат около 20 % крахмала, зерна пшеницы и кукурузы – около 70 %, риса – около 80 %.
5. Крахмал – одно из важнейших питательных веществ для человека.
Строение крахмала.
1. Крахмал (С6H10O5)n – природный полимер.
2. Образуется он в результате фотосинтетической деятельности растений при поглощении энергии солнечного излучения.
3. Сначала из углекислого газа и воды в результате ряда процессов синтезируется глюкоза, что в общем виде может быть выражено уравнением: 6СO2 + 6Н2О = С6Н12O6 + 6O2.
4. Глюкоза далее превращается в крахмал: nС6Н12O6 = (С6H10O5)n + nН2О.
5. Макромолекулы крахмала неодинаковы по размерам: а) в них входит разное число звеньев С6H10O5 – от нескольких сотен до нескольких тысяч, при этом неодинакова и их молекулярная масса; б) различаются они и по строению: наряду с линейными молекулами с молекулярной массой в несколько сотен тысяч имеются молекулы разветвленного строения, молекулярная масса которых достигает нескольких миллионов.
Химические свойства крахмала.
1. Одно из свойств крахмала – это способность давать синюю окраску при взаимодействии с йодом. Эту окраску легко наблюдать, если поместить каплю раствора йода на срез картофеля или ломтик белого хлеба и нагреть крахмальный клейстер с гидроксидом меди (II), будет видно образование оксида меди (I).
2. Если прокипятить крахмальный клейстер с небольшим количеством серной кислоты, нейтрализовать раствор и провести реакцию с гидроксидом меди (II), образуется характерный осадок оксида меди (I). То есть при нагревании с водой в присутствии кислоты крахмал подвергается гидролизу, при этом образуется вещество, восстанавливающее гидроксид меди (II) в оксид меди (I).
3. Процесс расщепления макромолекул крахмала водой идет постепенно. Сначала образуются промежуточные продукты с меньшей молекулярной массой, чем у крахмала, – декстрины, затем изомер сахарозы – мальтоза, конечным продуктом гидролиза является глюкоза.
4. Реакцию превращения крахмала в глюкозу при каталитическом действии серной кислоты открыл в 1811 г. русский ученый К. Кирхгоф.Разработанный им способ получения глюкозы используется и в настоящее время.
5. Макромолекулы крахмала состоят из остатков молекул циклической L-глюкозы.
1. Крахмал представляет собой белый порошок, не растворимый в воде.
2. В горячей воде он набухает и образует коллоидный раствор – клейстер.
3. Являясь продуктом усвоения оксида углерода (IV) зелеными (содержащими хлорофилл) клетками растений, крахмал распространен в растительном мире.
4. Клубни картофеля содержат около 20 % крахмала, зерна пшеницы и кукурузы – около 70 %, риса – около 80 %.
5. Крахмал – одно из важнейших питательных веществ для человека.
Строение крахмала.
1. Крахмал (С6H10O5)n – природный полимер.
2. Образуется он в результате фотосинтетической деятельности растений при поглощении энергии солнечного излучения.
3. Сначала из углекислого газа и воды в результате ряда процессов синтезируется глюкоза, что в общем виде может быть выражено уравнением: 6СO2 + 6Н2О = С6Н12O6 + 6O2.
4. Глюкоза далее превращается в крахмал: nС6Н12O6 = (С6H10O5)n + nН2О.
5. Макромолекулы крахмала неодинаковы по размерам: а) в них входит разное число звеньев С6H10O5 – от нескольких сотен до нескольких тысяч, при этом неодинакова и их молекулярная масса; б) различаются они и по строению: наряду с линейными молекулами с молекулярной массой в несколько сотен тысяч имеются молекулы разветвленного строения, молекулярная масса которых достигает нескольких миллионов.
Химические свойства крахмала.
1. Одно из свойств крахмала – это способность давать синюю окраску при взаимодействии с йодом. Эту окраску легко наблюдать, если поместить каплю раствора йода на срез картофеля или ломтик белого хлеба и нагреть крахмальный клейстер с гидроксидом меди (II), будет видно образование оксида меди (I).
2. Если прокипятить крахмальный клейстер с небольшим количеством серной кислоты, нейтрализовать раствор и провести реакцию с гидроксидом меди (II), образуется характерный осадок оксида меди (I). То есть при нагревании с водой в присутствии кислоты крахмал подвергается гидролизу, при этом образуется вещество, восстанавливающее гидроксид меди (II) в оксид меди (I).
3. Процесс расщепления макромолекул крахмала водой идет постепенно. Сначала образуются промежуточные продукты с меньшей молекулярной массой, чем у крахмала, – декстрины, затем изомер сахарозы – мальтоза, конечным продуктом гидролиза является глюкоза.
4. Реакцию превращения крахмала в глюкозу при каталитическом действии серной кислоты открыл в 1811 г. русский ученый К. Кирхгоф.Разработанный им способ получения глюкозы используется и в настоящее время.
5. Макромолекулы крахмала состоят из остатков молекул циклической L-глюкозы.
67. Крахмал как питательное вещество. Применение и получение крахмала
Крахмал как питательное вещество.
1. Крахмалявляется основным углеводом нашей пищи, но он не может самостоятельно усваиваться организмом.
2. Подобно жирам, крахмал сначала подвергается гидролизу.
3. Этот процесс начинается уже при пережевывании пищи во рту под действием фермента, содержащегося в слюне.
4. Далее гидролиз крахмала продолжается в кишечнике.
5. Образующаяся глюкоза всасывается через стенки кишечника в кровь и поступает в печень, а оттуда – во все ткани организма.
6. Избыток глюкозы отлагается в печени в виде высокомолекулярного углевода – гликогена.
Особенности гликогена:а) по строению гликоген отличается от крахмала большей разветвленностью своих молекул; б) этот запасный гликоген между приемами пищи снова превращается в глюкозу по мере расходования ее в клетках организма.
7. Промежуточные продукты гидролиза крахмала (декстрины) легче усваиваются организмом, чем сам крахмал, так как состоят из меньших по размерам молекул и лучше растворяются в воде.
8. Приготовление пищи часто связано именно с превращением крахмала в декстрины.
Применение крахмала и получение его из крахмалсодержащих продуктов.
1. Крахмал используется не только как продукт питания.
2. В пищевой промышленности из него готовят глюкозу и патоку.
3. Для получения глюкозы крахмал нагревают с разбавленной серной кислотой в течение нескольких часов.
4. Когда процесс гидролиза закончится, кислоту нейтрализуют мелом, образующийся осадок сульфата кальция отфильтровывается и раствор упаривается.
5. Если процесс гидролиза не доводить до конца, то в результате получается густая сладкая масса – смесь декстринов и глюкозы – патока.
Особенности патоки:а) она применяется в кондитерском деле для приготовления некоторых сортов конфет, мармелада, пряников и т. п.; б) с патокой кондитерские изделия не кажутся приторно-сладкими, как приготовленные на чистом сахаре, и долго остаются мягкими.
6. Декстрины, получаемые из крахмала, используются в качестве клея. Крахмал применяется для крахмаления белья: под действием нагревания горячим утюгом он превращается в декстрины, которые склеивают волокна ткани и образуют плотную пленку, предохраняющую ткань от быстрого загрязнения.
7. Крахмал получается чаще всего из картофеля. Картофель моется, затем измельчается на механических терках, измельченная масса промывается на ситах водой.
8. Освободившиеся из клеток клубня мелкие зерна крахмала проходят с водой через сито и оседают на дне чана. Крахмал тщательно промывается, отделяется от воды и сушится.
1. Крахмалявляется основным углеводом нашей пищи, но он не может самостоятельно усваиваться организмом.
2. Подобно жирам, крахмал сначала подвергается гидролизу.
3. Этот процесс начинается уже при пережевывании пищи во рту под действием фермента, содержащегося в слюне.
4. Далее гидролиз крахмала продолжается в кишечнике.
5. Образующаяся глюкоза всасывается через стенки кишечника в кровь и поступает в печень, а оттуда – во все ткани организма.
6. Избыток глюкозы отлагается в печени в виде высокомолекулярного углевода – гликогена.
Особенности гликогена:а) по строению гликоген отличается от крахмала большей разветвленностью своих молекул; б) этот запасный гликоген между приемами пищи снова превращается в глюкозу по мере расходования ее в клетках организма.
7. Промежуточные продукты гидролиза крахмала (декстрины) легче усваиваются организмом, чем сам крахмал, так как состоят из меньших по размерам молекул и лучше растворяются в воде.
8. Приготовление пищи часто связано именно с превращением крахмала в декстрины.
Применение крахмала и получение его из крахмалсодержащих продуктов.
1. Крахмал используется не только как продукт питания.
2. В пищевой промышленности из него готовят глюкозу и патоку.
3. Для получения глюкозы крахмал нагревают с разбавленной серной кислотой в течение нескольких часов.
4. Когда процесс гидролиза закончится, кислоту нейтрализуют мелом, образующийся осадок сульфата кальция отфильтровывается и раствор упаривается.
5. Если процесс гидролиза не доводить до конца, то в результате получается густая сладкая масса – смесь декстринов и глюкозы – патока.
Особенности патоки:а) она применяется в кондитерском деле для приготовления некоторых сортов конфет, мармелада, пряников и т. п.; б) с патокой кондитерские изделия не кажутся приторно-сладкими, как приготовленные на чистом сахаре, и долго остаются мягкими.
6. Декстрины, получаемые из крахмала, используются в качестве клея. Крахмал применяется для крахмаления белья: под действием нагревания горячим утюгом он превращается в декстрины, которые склеивают волокна ткани и образуют плотную пленку, предохраняющую ткань от быстрого загрязнения.
7. Крахмал получается чаще всего из картофеля. Картофель моется, затем измельчается на механических терках, измельченная масса промывается на ситах водой.
8. Освободившиеся из клеток клубня мелкие зерна крахмала проходят с водой через сито и оседают на дне чана. Крахмал тщательно промывается, отделяется от воды и сушится.
68. Целлюлоза, ее физические свойства
Нахождение в природе. Физические свойства.
1. Целлюлоза, или клетчатка, входит в состав растений, образуя в них оболочки клеток.
2. Отсюда происходит и ее название (от лат. «целлула» – клетка).
3. Целлюлоза придает растениям необходимую прочность и эластичность и является как бы их скелетом.
4. Волокна хлопка содержат до 98 % целлюлозы.
5. Волокна льна и конопли также в основном состоят из целлюлозы; в древесине она составляет около 50 %.
6. Бумага, хлопчатобумажные ткани – это изделия из целлюлозы.
7. Особенно чистыми образцами целлюлозы являются вата, полученная из очищенного хлопка, и фильтровальная (непроклеенная) бумага.
8. Выделенная из природных материалов целлюлоза представляет собой твердое волокнистое вещество, не растворяющееся ни в воде, ни в обычных органических растворителях.
Строение целлюлозы:
1) целлюлоза, как и крахмал, является природным полимером;
2) эти вещества имеют даже одинаковые по составу структурные звенья – остатки молекул глюкозы, одну и ту же молекулярную формулу (С6H10O5)n;
3) значение n у целлюлозы обычно выше, чем у крахмала: средняя молекулярная масса ее достигает нескольких миллионов;
4) основное различие между крахмалом и целлюлозой – в структуре их молекул.
Нахождение целлюлозы в природе.
1. В природных волоконцах макромолекулы целлюлозы располагаются в одном направлении: они ориентированы вдоль оси волокна.
2. Возникающие при этом многочисленные водородные связи между гидроксильными группами макромолекул обусловливают высокую прочность этих волокон.
3. В процессе прядения хлопка, льна и т. д. эти элементарные волокна сплетаются в более длинные нити.
4. Это объясняется тем, что макромолекулы в ней хотя и имеют линейную структуру, но расположены более беспорядочно, не ориентированы в одном направлении.
Построение макромолекул крахмала и целлюлозы из разных циклических форм глюкозы существенно сказывается на их свойствах:
1) крахмал является важным продуктом питания человека, целлюлоза для этой цели использоваться не может;
2) причина состоит в том, что ферменты, способствующие гидролизу крахмала, не действуют на связи между остатками целлюлозы.
1. Целлюлоза, или клетчатка, входит в состав растений, образуя в них оболочки клеток.
2. Отсюда происходит и ее название (от лат. «целлула» – клетка).
3. Целлюлоза придает растениям необходимую прочность и эластичность и является как бы их скелетом.
4. Волокна хлопка содержат до 98 % целлюлозы.
5. Волокна льна и конопли также в основном состоят из целлюлозы; в древесине она составляет около 50 %.
6. Бумага, хлопчатобумажные ткани – это изделия из целлюлозы.
7. Особенно чистыми образцами целлюлозы являются вата, полученная из очищенного хлопка, и фильтровальная (непроклеенная) бумага.
8. Выделенная из природных материалов целлюлоза представляет собой твердое волокнистое вещество, не растворяющееся ни в воде, ни в обычных органических растворителях.
Строение целлюлозы:
1) целлюлоза, как и крахмал, является природным полимером;
2) эти вещества имеют даже одинаковые по составу структурные звенья – остатки молекул глюкозы, одну и ту же молекулярную формулу (С6H10O5)n;
3) значение n у целлюлозы обычно выше, чем у крахмала: средняя молекулярная масса ее достигает нескольких миллионов;
4) основное различие между крахмалом и целлюлозой – в структуре их молекул.
Нахождение целлюлозы в природе.
1. В природных волоконцах макромолекулы целлюлозы располагаются в одном направлении: они ориентированы вдоль оси волокна.
2. Возникающие при этом многочисленные водородные связи между гидроксильными группами макромолекул обусловливают высокую прочность этих волокон.
3. В процессе прядения хлопка, льна и т. д. эти элементарные волокна сплетаются в более длинные нити.
4. Это объясняется тем, что макромолекулы в ней хотя и имеют линейную структуру, но расположены более беспорядочно, не ориентированы в одном направлении.
Построение макромолекул крахмала и целлюлозы из разных циклических форм глюкозы существенно сказывается на их свойствах:
1) крахмал является важным продуктом питания человека, целлюлоза для этой цели использоваться не может;
2) причина состоит в том, что ферменты, способствующие гидролизу крахмала, не действуют на связи между остатками целлюлозы.
69. Химические свойства целлюлозы и ее применение
Химические свойства целлюлозы.
1. Из повседневной жизни известно, что целлюлоза хорошо горит.
2. При нагревании древесины без доступа воздуха происходит термическое разложение целлюлозы. При этом образуются летучие органические вещества, вода и древесный уголь.
3. В числе органических продуктов разложения древесины – метиловый спирт, уксусная кислота, ацетон.
4. Макромолекулы целлюлозы состоят из звеньев, аналогичных тем, которые образуют крахмал, она подвергается гидролизу, и продуктом ее гидролиза, как и у крахмала, будет глюкоза.
5. Если растереть в фарфоровой ступке кусочки фильтровальной бумаги (целлюлозы), смоченной концентрированной серной кислотой, и разбавить полученную кашицу водой, а также нейтрализовать кислоту щелочью и, как в случае с крахмалом, испытать раствор на реакцию с гидроксидом меди (II), то будет видно появление оксида меди (I). То есть в опыте произошел гидролиз целлюлозы. Процесс гидролиза, как и у крахмала, идет ступенчато, пока не образуется глюкоза.
6. Суммарно гидролиз целлюлозы может быть выражен тем же уравнением, что и гидролиз крахмала: (С6H10O5)n + nН2О = nС6H12O6.
7. Структурные звенья целлюлозы (С6H10O5)n содержат гидроксильные группы.
8. За счет этих групп целлюлоза может давать простые и сложные эфиры.
9. Большое значение имеют азотно-кислые эфиры целлюлозы.
Особенности азотно-кислых эфиров целлюлозы.
1. Они получаются при действии на целлюлозу азотной кислотой в присутствии серной кислоты.
2. В зависимости от концентрации азотной кислоты и от других условий в реакцию этерификации вступают одна, две или все три гидроксильные группы каждого звена молекулы целлюлозы, например: [C6H7O2(OH)3]n + 3nHNO3 ? [C6H7O2(ONO2)3]n + 3n H2O.
Общее свойство нитратов целлюлозы – их чрезвычайная горючесть.
Тринитрат целлюлозы, называемый пироксилином, – сильновзрывчатое вещество. Он применяется для производства бездымного пороха.
Очень важными являются также уксусно-кислые эфиры целлюлозы – диацетат и триацетат целлюлозы. Диацетат и триацетат целлюлозы по внешнему виду сходны с целлюлозой.
Применение целлюлозы.
1. Благодаря своей механической прочности в составе древесины используется в строительстве.
2. Из нее изготавливают разного рода столярные изделия.
3. В виде волокнистых материалов (хлопка, льна) используется для изготовления нитей, тканей, канатов.
4. Выделенная из древесины (освобожденная от сопутствующих веществ) целлюлоза идет на изготовление бумаги.
1. Из повседневной жизни известно, что целлюлоза хорошо горит.
2. При нагревании древесины без доступа воздуха происходит термическое разложение целлюлозы. При этом образуются летучие органические вещества, вода и древесный уголь.
3. В числе органических продуктов разложения древесины – метиловый спирт, уксусная кислота, ацетон.
4. Макромолекулы целлюлозы состоят из звеньев, аналогичных тем, которые образуют крахмал, она подвергается гидролизу, и продуктом ее гидролиза, как и у крахмала, будет глюкоза.
5. Если растереть в фарфоровой ступке кусочки фильтровальной бумаги (целлюлозы), смоченной концентрированной серной кислотой, и разбавить полученную кашицу водой, а также нейтрализовать кислоту щелочью и, как в случае с крахмалом, испытать раствор на реакцию с гидроксидом меди (II), то будет видно появление оксида меди (I). То есть в опыте произошел гидролиз целлюлозы. Процесс гидролиза, как и у крахмала, идет ступенчато, пока не образуется глюкоза.
6. Суммарно гидролиз целлюлозы может быть выражен тем же уравнением, что и гидролиз крахмала: (С6H10O5)n + nН2О = nС6H12O6.
7. Структурные звенья целлюлозы (С6H10O5)n содержат гидроксильные группы.
8. За счет этих групп целлюлоза может давать простые и сложные эфиры.
9. Большое значение имеют азотно-кислые эфиры целлюлозы.
Особенности азотно-кислых эфиров целлюлозы.
1. Они получаются при действии на целлюлозу азотной кислотой в присутствии серной кислоты.
2. В зависимости от концентрации азотной кислоты и от других условий в реакцию этерификации вступают одна, две или все три гидроксильные группы каждого звена молекулы целлюлозы, например: [C6H7O2(OH)3]n + 3nHNO3 ? [C6H7O2(ONO2)3]n + 3n H2O.
Общее свойство нитратов целлюлозы – их чрезвычайная горючесть.
Тринитрат целлюлозы, называемый пироксилином, – сильновзрывчатое вещество. Он применяется для производства бездымного пороха.
Очень важными являются также уксусно-кислые эфиры целлюлозы – диацетат и триацетат целлюлозы. Диацетат и триацетат целлюлозы по внешнему виду сходны с целлюлозой.
Применение целлюлозы.
1. Благодаря своей механической прочности в составе древесины используется в строительстве.
2. Из нее изготавливают разного рода столярные изделия.
3. В виде волокнистых материалов (хлопка, льна) используется для изготовления нитей, тканей, канатов.
4. Выделенная из древесины (освобожденная от сопутствующих веществ) целлюлоза идет на изготовление бумаги.
70. Получение ацетатного волокна
Характерные особенности ацетатного волокна.
1. С давних времен человек широко использует природные волокнистые материалы для изготовления одежды и различных изделий домашнего обихода.
1. С давних времен человек широко использует природные волокнистые материалы для изготовления одежды и различных изделий домашнего обихода.
