Е. В. Савинкина Г. П. Логинова
Сборник основныхформул по химии
Карманный справочник школьника
Общая химия
Важнейшие химические понятия и законы
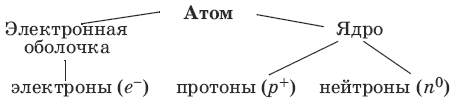
Химический элемент– это определенный вид атомов с одинаковым зарядом ядра.
Относительная атомная масса (Аr) показывает, во сколько раз масса атома данного химического элемента больше – массы атома углерода-12 (12С).
Химическое вещество – совокупность любых химических частиц.
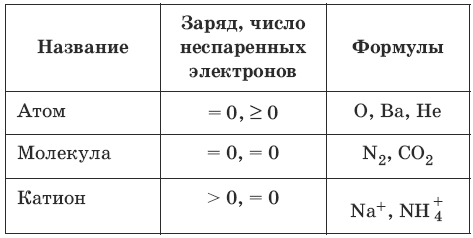
 Формульная единица – условная частица, состав которой соответствует приведенной химической формуле, например:
Формульная единица – условная частица, состав которой соответствует приведенной химической формуле, например:
Аr – вещество аргон (состоит из атомов Ar),
Н2O – вещество вода (состоит из молекул Н2O),
KNO3 – вещество нитрат калия (состоит из катионов К+ и анионов NO3¯).
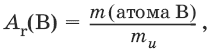 где *т (атома В) – масса атома элемента В;
где *т (атома В) – масса атома элемента В;
*ти – атомная единица массы;
*ти = 1/12 т (атома 12С) = 1,661024 г.
Количество вещества B, n(B), моль:
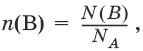 где N (B) – число частиц В;
где N (B) – число частиц В;
NA– постоянная Авогадро (NA = 6,021023 моль-1).
Молярная масса вещества В, М(В), г/моль:
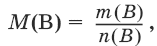 где т(В) – масса В.
где т(В) – масса В.
Молярный объем газа В, VM, л/моль:
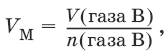 где VM = 22,4 л/моль (следствие из закона Авогадро), при нормальных условиях (н.у. – атмосферное давлениер = 101 325 Па (1 атм); термодинамическая температура Т = 273,15 К или температура Цельсия t = 0 °C).
где VM = 22,4 л/моль (следствие из закона Авогадро), при нормальных условиях (н.у. – атмосферное давлениер = 101 325 Па (1 атм); термодинамическая температура Т = 273,15 К или температура Цельсия t = 0 °C).
*Плотность газообразного вещества B по водороду, D (газа B по H2):
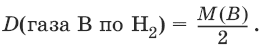 *Плотность газообразного вещества В по воздуху, D (газ В по воздуху):
*Плотность газообразного вещества В по воздуху, D (газ В по воздуху):
 Массовая доля элемента Э в веществе В, w(Э):
Массовая доля элемента Э в веществе В, w(Э):
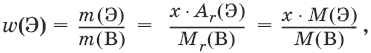 где х – число атомов Э в формуле вещества В
где х – число атомов Э в формуле вещества В
Относительная атомная масса (Аr) показывает, во сколько раз масса атома данного химического элемента больше – массы атома углерода-12 (12С).
Химическое вещество – совокупность любых химических частиц.
Химические частицы


Аr – вещество аргон (состоит из атомов Ar),
Н2O – вещество вода (состоит из молекул Н2O),
KNO3 – вещество нитрат калия (состоит из катионов К+ и анионов NO3¯).
Соотношения между физическими величинами
Атомная масса (относительная) элемента B, Ar(B):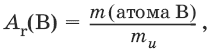
*ти – атомная единица массы;
*ти = 1/12 т (атома 12С) = 1,661024 г.
Количество вещества B, n(B), моль:
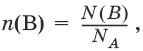
NA– постоянная Авогадро (NA = 6,021023 моль-1).
Молярная масса вещества В, М(В), г/моль:
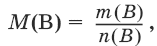
Молярный объем газа В, VM, л/моль:
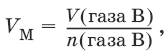
*Плотность газообразного вещества B по водороду, D (газа B по H2):
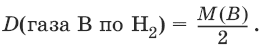

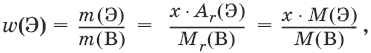
Строение атома и Периодический закон Д.И. Менделеева
A = N(p0) + N(p+).
Заряд ядра атома (Z) равен числу протонов в ядре и числу электронов в атоме:Z = N(p+) = N(e¯).
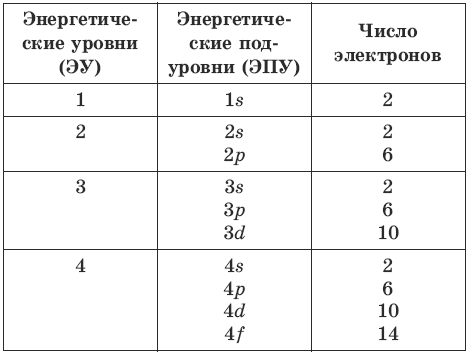
Изотопы – атомы одного элемента, различающиеся числом нейтронов в ядре, например: калий-39: 39К (19р+, 20п0, 19е¯); калий-40: 40К (19р+, 21п0, 19е¯).*Энергетические уровни и подуровни
*Формы s– и р-орбиталей

Периодический закон и Периодическая система Д.И. Менделеева
Свойства элементов и их соединений периодически повторяются с возрастанием порядкового номера, который равен заряду ядра атома элемента.Номер периода соответствует числу энергетических уровней, заполненных электронами, и обозначает последний по заполнению энергетический уровень (ЭУ).
Номер группы А показывает число валентных электронов ns и пр.
Номер группы Б показывает число валентных электронов ns и (п – 1)d.
Секция s-элементов – заполняется электронами энергетический подуровень (ЭПУ) ns-ЭПУ – IA– и IIА-группы, Н и Не.
Секция р-элементов – заполняется электронами np-ЭПУ – IIIA-VIIIA-группы.
Секция d-элементов – заполняется электронами (п-1)d-ЭПУ – IБ-VIIIБ2-группы.
Секция f-элементов – заполняется электронами (п-2)f-ЭПУ – лантаноиды и актиноиды.
Изменение состава и свойств водородных соединений элементов 3-го периода Периодической системы
Нелетучие, разлагаются водой: NaH, MgH2, AlH3.Летучие: SiH4, PH3, H2S, HCl.
Изменение состава и свойств высших оксидов и гидроксидов элементов 3-го периода Периодической системы
Оснóвные: Na2O – NaOH, MgO – Mg(OH)2.Амфотерные: Al2O3 – Al(OH)3.
Кислотные: SiO2 – H4SiO4, P2O5 – H3PO4, SO3 – H2SO4, Cl2O7 – HClO4.
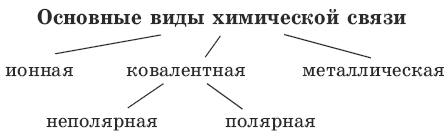
Химическая связь
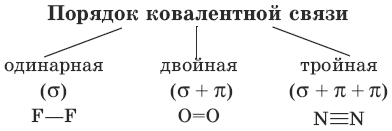
Механизмы образования ковалентной связи
Обменный механизм – перекрывание двух орбиталей соседних атомов, на каждой из которых имелось по одному электрону.Донорно-акцепторный механизм – перекрывание свободной орбитали одного атома с орбиталью другого атома, на которой имеется пара электронов.
Перекрывание орбиталей при образовании связи

*Тип гибридизации – геометрическая форма частицы – угол между связями
Гибридизация орбиталей центрального атома – выравнивание их энергии и формы.sp – линейная – 180°
sp2 – треугольная – 120°
sp3 – тетраэдрическая – 109,5°
sp3d – тригонально-бипирамидальная – 90°; 120°
sp3d2 – октаэдрическая – 90°
Смеси и растворы
Раствор – однородная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах.
Раствор: растворитель (например, вода) + растворенное вещество.
Истинные растворы содержат частицы размером менее 1 нанометра.
Коллоидные растворы содержат частицы размером 1-100 нанометра.
Механические смеси (взвеси) содержат частицы размером более 100 нанометра.
Суспензия => твердое + жидкое
Эмульсия => жидкое + жидкое
Пена, туман => газ + жидкое
Неоднородные смеси разделяют отстаиванием и фильтрованием.
Однородные смеси разделяют выпариванием, дистилляцией, хроматографией.
Насыщенный раствор находится или может находиться в равновесии с растворяемым веществом (если растворяемое вещество – твердое, то его избыток – в осадке).
Растворимость – содержание растворенного вещества в насыщенном растворе при данной температуре.
Ненасыщенный раствор содержит растворенного вещества меньше, чем его растворимость при данной температуре.
Пересыщенный раствор содержит растворенного вещества больше, чем его растворимость при данной температуре.
 где т(В) – масса В,
где т(В) – масса В,
т(р) – масса раствора.
Масса раствора, m(p), г:
ρ(p) – плотность раствора.
Объем раствора, V(p), л:
 Молярная концентрация, с(В), моль/л:
Молярная концентрация, с(В), моль/л:
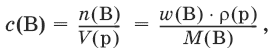 где n(В) – количество вещества В;
где n(В) – количество вещества В;
М(В) – молярная масса вещества В.

> масса растворенного вещества не изменяется: т'(В) = т(В);
> масса раствора увеличивается на массу добавленной воды: m'(p) = m(p) + m(H2O).
Выпаривание воды из раствора:
> масса растворенного вещества не изменяется: т'(В) = т(В).
> масса раствора уменьшается на массу выпаренной воды: m'(p) = m(p) – m(H2O).
Сливание двух растворов: массы растворов, а также массы растворенного вещества складываются:
т"(В) = т(В) + т'(В);
т"(р) = т(р) + т'(р).
Выпадение кристаллов: масса растворенного вещества и масса раствора уменьшается на массу выпавших кристаллов:
m'(В) = m(В) – m(осадка); m'(р) = m(р) – m(осадка).
Масса воды не изменяется.
Раствор: растворитель (например, вода) + растворенное вещество.
Истинные растворы содержат частицы размером менее 1 нанометра.
Коллоидные растворы содержат частицы размером 1-100 нанометра.
Механические смеси (взвеси) содержат частицы размером более 100 нанометра.
Суспензия => твердое + жидкое
Эмульсия => жидкое + жидкое
Пена, туман => газ + жидкое
Неоднородные смеси разделяют отстаиванием и фильтрованием.
Однородные смеси разделяют выпариванием, дистилляцией, хроматографией.
Насыщенный раствор находится или может находиться в равновесии с растворяемым веществом (если растворяемое вещество – твердое, то его избыток – в осадке).
Растворимость – содержание растворенного вещества в насыщенном растворе при данной температуре.
Ненасыщенный раствор содержит растворенного вещества меньше, чем его растворимость при данной температуре.
Пересыщенный раствор содержит растворенного вещества больше, чем его растворимость при данной температуре.
Соотношения между физико-химическими величинами в растворе
Массовая доля растворенного вещества В, w(B); доля единицы или %:
т(р) – масса раствора.
Масса раствора, m(p), г:
m(p) = m(B) + m(H2O) = V(p) • ρ(p),
где F(p) – объем раствора;ρ(p) – плотность раствора.
Объем раствора, V(p), л:

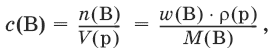
М(В) – молярная масса вещества В.

Изменение состава раствора
Разбавление раствора водой:> масса растворенного вещества не изменяется: т'(В) = т(В);
> масса раствора увеличивается на массу добавленной воды: m'(p) = m(p) + m(H2O).
Выпаривание воды из раствора:
> масса растворенного вещества не изменяется: т'(В) = т(В).
> масса раствора уменьшается на массу выпаренной воды: m'(p) = m(p) – m(H2O).
Сливание двух растворов: массы растворов, а также массы растворенного вещества складываются:
т"(В) = т(В) + т'(В);
т"(р) = т(р) + т'(р).
Выпадение кристаллов: масса растворенного вещества и масса раствора уменьшается на массу выпавших кристаллов:
m'(В) = m(В) – m(осадка); m'(р) = m(р) – m(осадка).
Масса воды не изменяется.
Тепловой эффект химической реакции

*Тепловой эффект химический реакции (закон Гесса)
Q = ΣQ(продуктов) – ΣQ(реагентов).
ΔН° = ΣΔН°(продуктов) – ΣΔН°(реагентов).
Для реакции аА + bВ +… = dD + еЕ +…ΔН° = {dΔH°(D) + еΔH°(Е) +…} – {аΔH°(А) + ЬΔH°(В) +…},
где а, b, d, e – стехиометрические количества веществ, соответствующие коэффициентам в уравнении реакции.
Скорость химической реакции
Если за время τ в объеме V количество реагента или продукта изменилось на Δn, скорость реакции:
 Для мономолекулярной реакции А → …:
Для мономолекулярной реакции А → …:
1) химически активные реагенты;
2) повышение концентрации реагентов;
3) увеличение поверхности твердых и жидких реагентов;
4) повышение температуры;
5) катализаторы. Скорость реакции уменьшают:
1) химически неактивные реагенты;
2) понижение концентрации реагентов;
3) уменьшение поверхности твердых и жидких реагентов;
4) понижение температуры;
5) ингибиторы.
*Температурный коэффициент скорости (γ) равен числу, которое показывает, во сколько раз увеличивается скорость реакции при повышении температуры на десять градусов:


v = k • с(А).
Для бимолекулярной реакции А + В → …:v = k • с(А) • с(В).
Для тримолекулярной реакции А + В + С → …:v = k • с(А) • с(В) • с(С).
Изменение скорости химической реакции
Скорость реакции увеличивают:1) химически активные реагенты;
2) повышение концентрации реагентов;
3) увеличение поверхности твердых и жидких реагентов;
4) повышение температуры;
5) катализаторы. Скорость реакции уменьшают:
1) химически неактивные реагенты;
2) понижение концентрации реагентов;
3) уменьшение поверхности твердых и жидких реагентов;
4) понижение температуры;
5) ингибиторы.
*Температурный коэффициент скорости (γ) равен числу, которое показывает, во сколько раз увеличивается скорость реакции при повышении температуры на десять градусов:

Химическое равновесие
*Закон действующих масс для химического равновесия: в состоянии равновесия отношение произведения молярных концентраций продуктов в степенях, равных
их стехиометрическим коэффициентам, к произведению молярных концентраций реагентов в степенях, равных их стехиометрическим коэффициентам, при постоянной температуре есть величина постоянная (концентрационная константа равновесия).
В состоянии химического равновесия для обратимой реакции:
2) уменьшение концентрации продуктов;
3) увеличение температуры (для эндотермической реакции);
4) уменьшение температуры (для экзотермической реакции);
5) увеличение давления (для реакции, идущей с уменьшением объема);
6) уменьшение давления (для реакции, идущей с увеличением объема).
их стехиометрическим коэффициентам, к произведению молярных концентраций реагентов в степенях, равных их стехиометрическим коэффициентам, при постоянной температуре есть величина постоянная (концентрационная константа равновесия).
В состоянии химического равновесия для обратимой реакции:
аА + bВ + … ↔ dD + fF + …
Кc = [D] d • [F]f …/ [А]а • [В]b …
*Смещение химического равновесия в сторону образования продуктов
1) Увеличение концентрации реагентов;2) уменьшение концентрации продуктов;
3) увеличение температуры (для эндотермической реакции);
4) уменьшение температуры (для экзотермической реакции);
5) увеличение давления (для реакции, идущей с уменьшением объема);
6) уменьшение давления (для реакции, идущей с увеличением объема).
Обменные реакции в растворе
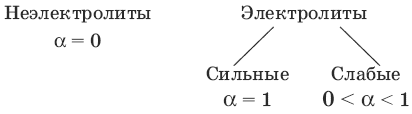
Электролитическая диссоциация – процесс образования ионов (катионов и анионов) при растворении в воде некоторых веществ.
При электролитической диссоциации кислот образуются катионы водорода и анионы кислоты, например:
Степень диссоциации α – отношение количества продиссоциировавших частиц к количеству исходных частиц.
При постоянном объеме:
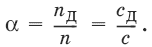
«Полное» ионное уравнение: Сu2+ + 2Сl¯ + 2Na+ + 2OH¯ = Cu(OH)2↓ + 2Na+ + 2Сl¯
«Краткое» ионное уравнение: Сu2+ + 2OН¯ = Cu(OH)2↓
2. Молекулярное уравнение: FeS(T) + 2HCl = FeCl2 + H2S↑
«Полное» ионное уравнение: FeS + 2Н+ + 2Сl¯ = Fe2+ + 2Сl¯ + H2S↑
«Краткое» ионное уравнение: FeS (T) + 2H+ = Fe2+ + H2S↑
3. Молекулярное уравнение: 3HNO3 + K3PO4 = Н3РO4 + 3KNO3
«Полное» ионное уравнение: 3Н+ + 3NO3¯ + ЗК+ + PO43- = Н3РO4 + 3K+ + 3NO3¯
«Краткое» ионное уравнение: 3Н+ + PO43- = Н3РO4
1. Щелочь + сильная кислота: Ва(OН)2 + 2НСl = ВаСl2 + 2Н2O
Ва2+ + 2OН¯ + 2Н+ + 2Сl¯ = Ва2+ + 2Сl¯ + 2Н2O
Н+ + ОН¯ = Н2O
2. Малорастворимое основание + сильная кислота: Сu(ОН)2(т) + 2НСl = СuСl2 + 2Н2O
Сu(ОН)2 + 2Н+ + 2Сl¯ = Сu2+ + 2Сl¯ + 2Н2O
Сu(ОН)2 + 2Н+ = Сu2+ + 2Н2O
*Гидролиз – обменная реакция между веществом и водой без изменения степеней окисления атомов.
1. Необратимый гидролиз бинарных соединений:
Mg3N2 + 6Н2O = 3Mg(OH)2 + 2NH3
2. Обратимый гидролиз солей:
а) Соль образована катионом сильного основания и анионом сильной кислоты:
NaCl = Na+ + Сl¯
Na+ + Н2O ≠;
Сl¯ + Н2O ≠
гидролиз отсутствует; среда нейтральная, рН = 7.
б) Соль образована катионом сильного основания и анионом слабой кислоты:
Na2S = 2Na+ + S2-
Na+ + H2O ≠
S2- + Н2O ↔ HS¯ + ОН¯
гидролиз по аниону; среда щелочная, рН >7.
в) Соль образована катионом слабого или малорастворимого основания и анионом сильной кислоты:
При электролитической диссоциации кислот образуются катионы водорода и анионы кислоты, например:
HNO3 = Н+ + NO3¯
При электролитической диссоциации оснований образуются катионы металла и гидроксид-ионы, например:NaOH = Na+ + ОН¯
При электролитической диссоциации солей (средних, двойных, смешанных) образуются катионы металла и анионы кислоты, например:NaNO3 = Na+ + NO3¯
KAl(SO4)2 = К+ + Al3+ + 2SO42-
При электролитической диссоциации кислых солей образуются катионы металла и гидроанионы кислоты, например:NaHCO3 = Na+ + HCO3‾
Некоторые сильные кислоты
HBr, HCl, НСlO4, H2Cr2O7, HI, HMnO4, H2SO4, H2SeO4, HNO3, Н2СrO4Некоторые сильные основания
RbOH, CsOH, КОН, NaOH, LiOH, Ba(OH)2, Sr(OH)2, Ca(OH)2Степень диссоциации α – отношение количества продиссоциировавших частиц к количеству исходных частиц.
При постоянном объеме:
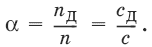
Классификация веществ по степени диссоциации

Правило Бертолле
Обменные реакции в растворе протекают необратимо, если в результате образуется осадок, газ, слабый электролит.Примеры молекулярных и ионных уравнений реакций
1. Молекулярное уравнение: CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl«Полное» ионное уравнение: Сu2+ + 2Сl¯ + 2Na+ + 2OH¯ = Cu(OH)2↓ + 2Na+ + 2Сl¯
«Краткое» ионное уравнение: Сu2+ + 2OН¯ = Cu(OH)2↓
2. Молекулярное уравнение: FeS(T) + 2HCl = FeCl2 + H2S↑
«Полное» ионное уравнение: FeS + 2Н+ + 2Сl¯ = Fe2+ + 2Сl¯ + H2S↑
«Краткое» ионное уравнение: FeS (T) + 2H+ = Fe2+ + H2S↑
3. Молекулярное уравнение: 3HNO3 + K3PO4 = Н3РO4 + 3KNO3
«Полное» ионное уравнение: 3Н+ + 3NO3¯ + ЗК+ + PO43- = Н3РO4 + 3K+ + 3NO3¯
«Краткое» ионное уравнение: 3Н+ + PO43- = Н3РO4
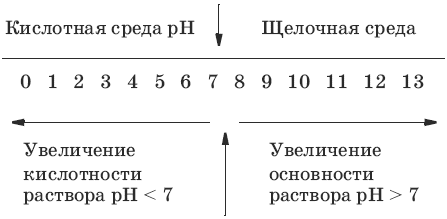
*Водородный показатель
(рН) рН = – lg[H3O+] = 14 + lg[OH¯]*Интервал рН для разбавленных водных растворов
рН 7 (нейтральная среда)
Примеры обменных реакций
Реакция нейтрализации – обменная реакция, протекающая при взаимодействии кислоты и основания.1. Щелочь + сильная кислота: Ва(OН)2 + 2НСl = ВаСl2 + 2Н2O
Ва2+ + 2OН¯ + 2Н+ + 2Сl¯ = Ва2+ + 2Сl¯ + 2Н2O
Н+ + ОН¯ = Н2O
2. Малорастворимое основание + сильная кислота: Сu(ОН)2(т) + 2НСl = СuСl2 + 2Н2O
Сu(ОН)2 + 2Н+ + 2Сl¯ = Сu2+ + 2Сl¯ + 2Н2O
Сu(ОН)2 + 2Н+ = Сu2+ + 2Н2O
*Гидролиз – обменная реакция между веществом и водой без изменения степеней окисления атомов.
1. Необратимый гидролиз бинарных соединений:
Mg3N2 + 6Н2O = 3Mg(OH)2 + 2NH3
2. Обратимый гидролиз солей:
а) Соль образована катионом сильного основания и анионом сильной кислоты:
NaCl = Na+ + Сl¯
Na+ + Н2O ≠;
Сl¯ + Н2O ≠
гидролиз отсутствует; среда нейтральная, рН = 7.
б) Соль образована катионом сильного основания и анионом слабой кислоты:
Na2S = 2Na+ + S2-
Na+ + H2O ≠
S2- + Н2O ↔ HS¯ + ОН¯
гидролиз по аниону; среда щелочная, рН >7.
в) Соль образована катионом слабого или малорастворимого основания и анионом сильной кислоты:
Конец бесплатного ознакомительного фрагмента
