Цирк. Водяная пантомима в цирке Ченизелли. Петербург. 19 в.
Цирк. Внутренний вид Московского цирка на Ленинских горах.
Цирк. Выступления советских артистов. «Летающие акробаты» Арнаутовы.
Цирк. Дрессировщица У. Бётнер с белыми медведями. ГДР.
Цирк. Жонглер на проволоке А. Бошилов. Болгария.
Цирк. Акробатическая группа цирка Астлея. Лондон. 1770.
Цирк. Внешний вид цирка Саразани. Берлин. 1930.
Цирк. Выступления советских артистов. Дагестанские канатоходцы «Цовкра».
Цирк. Выступления советских артистов. Дрессировщик А. И. Попов в номере «Приём у доктора Айболита».
Цирк. Акробаты Варади. Венгрия.
Цирк. Выступления советских артистов. Джигиты Кантемировы. («Али-Бек»).
Цирк. Д. Гибор с дрессированным дельфином. США.
Цирк. Выступления советских артистов. Конные дрессировщики Л. Т. Котова и Ю. М. Ермолаев.
Цирк. Выступления советских артистов. Иллюзионный номер Э. Т. Кио «Загадочный домик».
Цирк. Здание школы верховой езды цирка Астлея. Лондон. 1770.
Цирк. Цирк на Елисейских полях. Париж. 1843.
Цирк. Выступления советских артистов. Жонглёр А. Н. Кисс.
Цирк. Внутренний вид цирка Билла Рикетса. Филадельфия. 1785.
кар.
Шапито.
Ю. А. Дмитриев.
Архитекторы Ю. Л. Шварцбрейм, В. Я. Эдемская, инженеры Н. В. Топилин, П. У. Карпов. Цирк в Сочи. 1971.
Цирк. 1967. Архитектор Г. М, Пичуев, инженер О. И. Берим и др.
суточные ритмы,наблюдающиеся у организмов в естественных условиях. д В изолированном же помещении, где поддерживаются постоянные освещение или темнота, температура и т.д., у растений, животных и человека период ритма, как правило, отклоняется от суточного. Если условия не изменяются, период Ц. р. стабилен. Чаще всего у животных, активных преимущественно в конце дня, вечером и ночью, период Ц. р. наиболее короток в темноте и тем продолжительнее, чем выше уровень постоянной освещённости. У животных, более активных в начале и середине 1 дня, наблюдается обратное соотношение. Наиболее признана теория, согласно: которой Ц. р. (независимо от его периода); рассматривают как собственную спонтанную (эндогенную) и генетически закрепленную цикличность биологических процессов в организме (см.
«Биологические часы»
)
;этот ритм превращается в суточный под влиянием цикличности внешних условий. Согласно др. теории, Ц. р. возникают как артефакт из наследуемых суточных под влиянием принудительных постоянных условий, неестественных для организма. Например, если постоянные условия благоприятны для жизнедеятельности, животное становится активным раньше обычного времени; если же условия неблагоприятны, время активности ежедневно запаздывает; соответственно период исходного 24-часового ритма ежесуточно укорачивается или удлиняется. Ц. р. могут влиять как на поведение целого организма (например, откладка яиц насекомыми, изменение положения листьев у растений), так и на отдельные физиологические процессы. В постоянных условиях периоды Ц. р. этих функций часто различны (например, при постоянной освещённости у человека изменяются периоды ритма температуры тела, сна и бодрствования). Такое их рассогласование во времени приводит к патологическому состоянию организма, что имеет большое значение для медицины, в частности в связи с космическими полётами человека и животных. По-видимому, аналогичным образом годичные эндогенные ритмы в постоянных условиях теряют стабильность своего периода и превращаются в окологодичные (цирканные) ритмы.
Лит.:Циркадные ритмы человека и животных, Фр., 1975; см. также лит. при статьях
Биологические ритмы
,
Физиологические ритмы
и
Хронобиология
.
В. Б. Чернышев.
Метамиктные минералы
) дипирамидальные Ц., содержащие Th, U, H
2O (Th > U), называются малаконами призматические (Th < U) — циртолитами. Прозрачный Ц. медово-жёлтого красно-бурого, розового цвета называется гиацинтом; метаколлоидный, колломорфный — аршиновитом. Кристаллизуется в тетрагональной системе, образуя столбчатые или короткопризматические, реже дипирамидальные кристаллы. Часты закономерные срастания с ксенотимом YPO
4. Цвет коричневато-желтый до коричневого, сероватый, красный, розовый; иногда бесцветен. Прозрачный до просвечивающего. Спайность обычно отсутствует. Твердость по минералогической шкале 7—8; плотность 4680—4710
кг/м
3(у метамиктных разностей твердость и плотность ниже).
Ц. — характерный акцессорный минерал гранитов, нефелиновых сиенитов и их эффузивных аналогов, а также различных метаморфических и терригенно-осадочных пород, крупные его выделения встречаются в гранитных и щелочных пегматитах. В промышленных количествах концентрируется иногда совместно с пирохлором в зонах альбитизации щелочных пород При выветривании пород переходит в россыпи. Большие запасы Ц. заключены в прибрежно-морских россыпях Тихоокеанского побережья США (Флорида) на о. Шри-Ланка, в Восточной Австралии Ц. — основной источник получения Zr и Hf двуокиси циркония. Чисто цирконовые пески применяются в формовочном литье, а также в качестве сырья для получения огнеупоров, специальной керамики. Гиацинт и прозрачные жёлтые и зелёные Ц. используются в ювелирном деле (драгоценные камни II класса).
Л. И. Гинзбург
циркония.До начала 50-х гг. 20 в. Ц. с. изучались мало и практически не применялись, а полученная в то время информация об их свойствах во многих случаях была недостоверной, вследствие использования для исследований недостаточно чистого циркония и несовершенных методов приготовления сплавов. Положение резко изменилось, когда в начале 50-х гг. удалось получить цирконий, очищенный от примеси гафния, и было обнаружено, что такой металл имеет малое поперечное сечение поглощения тепловых.
Механическое свойства циркониевых сплавов
| Сплав |
Полуфабрикат (состояние) |
При 20 °С |
При 300 °С |
| предел прочности s
В
|
Относи- тельное удлине- ние d % |
предел прочности s
В
|
Относи- тельное удлине- ние d % |
|
Мн/м
2
|
кгс/мм
2'
|
Мн/м
2
|
кгс/мм
2'
|
| Циркалой-2 |
Листы (отожжённые) |
480 |
48 |
22 |
200 |
20 |
35 |
| Zr2,5Nb |
То же |
450 |
45 |
25 |
300 |
30 |
23 |
| Циркалой-2 |
Трубы (холоднокатаные) |
690 |
69 |
22 |
400 |
40 |
19 |
| Zr2,5Nb |
То же |
790 |
79 |
27 |
560 |
56 |
23 |
нейтронов. Это позволило рассматривать цирконий (при наличии других благоприятных свойств) как весьма перспективный материал для конструкций энергетических ядерных реакторов на тепловых нейтронах. Однако, как показали первые исследования, использовать для этой цели нелегированный цирконий не представлялось возможным в первую очередь из-за нестабильной коррозионной стойкости его в нагретой воде. Это обстоятельство стимулировало начало интенсивных исследований Ц. с., в результате чего были разработаны промышленные сплавы, нашедшие широкое применение в ядерной энергетике. Ц. с. используются для элементов конструкции активной зоны ядерных реакторов на тепловых нейтронах — оболочки тепловыделяющих элементов (твэлов), каналы, кассеты, дистанционные решётки и др. Наибольшее применение Ц. с. получили в реакторах с пароводяным теплоносителем. Ц. с. наряду с малым поперечным сечением поглощения тепловых нейтронов обладают высокой и стабильной коррозионной стойкостью в воде и паре высоких параметров и в других агрессивных средах, хорошей пластичностью и удовлетворительными прочностными характеристиками. К легирующим элементам Ц. с. предъявляется комплекс требований: одни из них должны значительно ослаблять (подавлять) вредное влияние азота на коррозионную стойкость циркония (при допустимом содержании азота в сплавах менее 0,01%), другие — ощутимо не увеличивать поперечное сечение поглощения тепловых нейтронов, не снижать радиационную стойкость, повышать прочностные характеристики и при этом существенно не уменьшать пластичность (сплавы должны быть пригодны для изготовления из них особо тонкостенных труб и листов, обладать хорошей свариваемостью). Поэтому выбор легирующих добавок ограничен сравнительно небольшим числом элементов при невысоком содержании их в сплавах. Для легирования используются Nb, Sn, Fe, Cr, Ni, Cu и Mo, которые вводятся в количествах от долей процента до 2—3% (в сумме).
Из большого числа исследованных Ц. с. практическое применение нашли лишь немногие. За рубежом наибольшее распространение получил американский сплав циркалой-2 (1,5% Sn, 0,1% Fe, 0,1% Cr, 0,05% Ni и не более 0,01% N). Используется также сплав циркалой-4 (отличается от циркалоя-2 пониженным содержанием никеля — 0,007%). Сплав циркалой-2 специально разрабатывался и был сначала использован для оболочек твэлов реактора первой американской атомной подводной лодки «Наутилус», затем нашёл применение во многих энергетических реакторах атомных станций для твэлов и каналов, работающих в воде и пароводяных смесях с температурой 250—300 °C. В СССР разработаны и применяются оригинальные сплавы, не содержащие олова, — Zr1Nb и Zr2, 5Nb (соответственно с 1 и 2,5% Nb). Сплав Zr1Nb впервые был применен для твэлов реактора атомного ледокола «Ленин», а сплав Zr2, 5Nb — для кассет реактора Ново-Воронежской АЭС. В середине 70-х гг. сплавы Zr1Nb и Zr2, 5Nb используются для оболочек твэлов, кассет и каналов реакторов большинства атомных электростанций СССР и социалистических стран. Кроме того, сплав Zr2, 5Nb применен в ряде реакторов в Канаде. По коррозионной стойкости сплав Zr2, 5Nb сопоставим со сплавами типа циркалой, однако он имеет меньшую склонность к наводороживанию, не подвержен снижению сопротивления коррозии под облучением и обладает большей прочностью, в частности более высоким сопротивлением ползучести. Несмотря на высокую температуру плавления циркония (1852 °C), его известные сплавы не отличаются высокой жаропрочностью и практически пригодны для работы в пароводяных средах при температурах не выше 400 °C. При более высоких температурах наряду со снижением прочности Ц. с. происходит сильное окисление их с растворением кислорода, приводящее к потере пластичности и наводороживанию, которое вызывает охрупчивание в результате образования гидридов. Механические свойства Ц. с. типа циркалой и цирконий-ниобиевых сплавов по уровню прочности и пластичности (при кратковременных испытаниях) одного порядка (см. табл.) и зависят, как и для других металлических материалов, от структурного состояния, обусловленного термической и деформационной обработкой.
Ц. с. выплавляют в дуговых вакуумных печах с расходуемым электродом и электроннолучевых печах. Используется цирконий т. н. ядерной чистоты (значительно очищенный от гафния и др. примесей с большим поперечным сечением поглощения тепловых нейтронов). Полуфабрикаты из Ц. с. изготовляются на обычном оборудовании, применяемом для многих цветных металлов. Отжиг проводится в вакуумных печах. Если в ядерной энергетике Ц. с. получили широкое распространение, то в др. областях техники они практически не нашли применения; в частности, как конструкционный и коррозионностойкий материал они уступают более прочным, лёгким и дешёвым титановым сплавам.
Лит.:Металлургия циркония, пер. с англ., М., 1959; Труды второй Международной конференции по мирному использованию атомной энергии, Женева, 1958. Доклады советских ученых, т. 3, М., 1959, с. 486; Ривкин Е. Ю., Родченков Б. С., Филатов В. И., Прочность сплавов циркония, М., 1974; Дуглас Д., Металловедение циркония, пер. с англ., М., 1975 (лит.).
А. А. Киселев.


















 Архитекторы Ю. Л. Шварцбрейм, В. Я. Эдемская, инженеры Н. В. Топилин, П. У. Карпов. Цирк в Сочи. 1971.
Архитекторы Ю. Л. Шварцбрейм, В. Я. Эдемская, инженеры Н. В. Топилин, П. У. Карпов. Цирк в Сочи. 1971. Цирк. 1967. Архитектор Г. М, Пичуев, инженер О. И. Берим и др.
Цирк. 1967. Архитектор Г. М, Пичуев, инженер О. И. Берим и др.


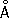 ;
с= 5,120
;
с= 5,120
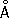 ) и b-формы с кубической объёмноцентрированной решёткой (
а= 3,61
) и b-формы с кубической объёмноцентрированной решёткой (
а= 3,61
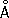 ). Переход a ® b происходит при 862 °C. Плотность a-Ц. (20 °C) 6,45
г/см
3;
t
пл1825 ± 10 °C;
t
кип3580—3700 °C; удельная теплоёмкость (25—100 °С) 0,291
кдж/(
кгЧ
К) [0,0693
кал/(
гЧ
°С)]
,коэффициент теплопроводности (50 °С) 20,96
вт/(
мЧ
К) [0,050
кал/(
смЧ
секЧ°С)]; температурный коэффициент линейного расширения (20—400 °С) 6,9Ч10
-6; удельное электрическое сопротивление Ц. высокой степени чистоты (20°С) 44,1
мкомЧ
см.температура перехода в состояние сверхпроводимости 0,7 К. Ц. парамагнитен; удельная магнитная восприимчивость увеличивается при нагревании и при —73 °С равна 1,28Ч10
-6, а при 327 °С — 1,41Ч10
-6. Сечение захвата тепловых нейтронов (0,18 ± 0,004)Ч10
-28
м
2, примесь гафния увеличивает это значение. Чистый Ц. пластичен, легко поддаётся холодной и горячей обработке (прокатке, ковке, штамповке). Наличие растворённых в металле малых количеств кислорода, азота, водорода и углерода (или соединений этих элементов с Ц.) вызывает хрупкость Ц. Модуль упругости (20 °С) 97
Гн/м
2(9700
кгс /мм
2)
;предел прочности при растяжении 253
Мн/м
2(25,3
кгс/мм
2)
;твёрдость по Бринеллю 640—670
Мн/м
2(64—67
кгс/мм
2)
;на твёрдость очень сильное влияние оказывает содержание кислорода: при концентрации более 0,2% Ц. не поддаётся холодной обработке давлением.
). Переход a ® b происходит при 862 °C. Плотность a-Ц. (20 °C) 6,45
г/см
3;
t
пл1825 ± 10 °C;
t
кип3580—3700 °C; удельная теплоёмкость (25—100 °С) 0,291
кдж/(
кгЧ
К) [0,0693
кал/(
гЧ
°С)]
,коэффициент теплопроводности (50 °С) 20,96
вт/(
мЧ
К) [0,050
кал/(
смЧ
секЧ°С)]; температурный коэффициент линейного расширения (20—400 °С) 6,9Ч10
-6; удельное электрическое сопротивление Ц. высокой степени чистоты (20°С) 44,1
мкомЧ
см.температура перехода в состояние сверхпроводимости 0,7 К. Ц. парамагнитен; удельная магнитная восприимчивость увеличивается при нагревании и при —73 °С равна 1,28Ч10
-6, а при 327 °С — 1,41Ч10
-6. Сечение захвата тепловых нейтронов (0,18 ± 0,004)Ч10
-28
м
2, примесь гафния увеличивает это значение. Чистый Ц. пластичен, легко поддаётся холодной и горячей обработке (прокатке, ковке, штамповке). Наличие растворённых в металле малых количеств кислорода, азота, водорода и углерода (или соединений этих элементов с Ц.) вызывает хрупкость Ц. Модуль упругости (20 °С) 97
Гн/м
2(9700
кгс /мм
2)
;предел прочности при растяжении 253
Мн/м
2(25,3
кгс/мм
2)
;твёрдость по Бринеллю 640—670
Мн/м
2(64—67
кгс/мм
2)
;на твёрдость очень сильное влияние оказывает содержание кислорода: при концентрации более 0,2% Ц. не поддаётся холодной обработке давлением.