Страница:
витаминах
позволило установить причину заболевания — недостаточное поступление в организм витамина С, что сопровождается резким уменьшением содержания аскорбиновой кислоты в крови и моче, повышением проницаемости сосудистой стенки. Основные источники витамина С в пище — свежие овощи, зелень, ягоды и плоды. При длительном их хранении и продолжительной тепловой обработке витамин С разрушается. Поэтому Ц. чаще болели весной и в начале лета. Раннее проявление Ц. — общие, преимущественно нервные, нарушения: потеря мышечной силы, вялость, быстрая утомляемость, сонливость, головокружения; затем появляются синюха ушей, носа, губ, пальцев и ногтей, набухание и кровоточивость дёсен, расшатывание и выпадение зубов. Характерный признак Ц. — точечные кровоизлияния в волосяные фолликулы кожи, образующие сыпь сначала ярко-красного, а затем сине-чёрного цвета, преимущественно на голенях, бедрах и ягодицах, подкожные и внутримышечные кровоизлияния на местах механического воздействия одежды, после ушибов и пр. Возникают также кровоизлияния в органы и полости (чаще — плевральные) тела, расстройство деятельности желудочно-кишечного тракта (понижение содержания соляной кислоты в желудочном соке, запоры, сменяющиеся поносами с кровянистыми испражнениями), гипохромная анемия и др. Сопротивляемость организма простудным и инфекционным заболеваниям резко снижена, заживление ран и переломов замедлено.
Лечение: приём внутрь аскорбиновой кислоты по 100 мг3—5 раз в день в течение 15—20 дней или внутримышечное, подкожное введение 200—500 мгаскорбиновой кислоты в день в течение 10—15 дней. Массовая профилактика: сбалансированное по содержанию животных белков и витамина С питание; при его нарушении — дополнительное применение аскорбиновой кислоты по 70—100 мгв день.
Лит.:Ефремов В. В., Авитаминоз и гиповитаминоз С (цынга), М., 1942; Витамины в питании и профилактика витаминной недостаточности, М., 1969; Витамины, М., 1974.
В. В. Ефремов.
Цингера способ
)
.
Лечение: приём внутрь аскорбиновой кислоты по 100 мг3—5 раз в день в течение 15—20 дней или внутримышечное, подкожное введение 200—500 мгаскорбиновой кислоты в день в течение 10—15 дней. Массовая профилактика: сбалансированное по содержанию животных белков и витамина С питание; при его нарушении — дополнительное применение аскорбиновой кислоты по 70—100 мгв день.
Лит.:Ефремов В. В., Авитаминоз и гиповитаминоз С (цынга), М., 1942; Витамины в питании и профилактика витаминной недостаточности, М., 1969; Витамины, М., 1974.
В. В. Ефремов.

 ,
,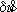 — поправка, учитывающая изменение наклона трубы во время наблюдений пары звёзд, и da — поправка, учитывающая влияние суточной аберрации на прямые восхождения.
— поправка, учитывающая изменение наклона трубы во время наблюдений пары звёзд, и da — поправка, учитывающая влияние суточной аберрации на прямые восхождения. ,
с= 4,9370
,
с= 4,9370
 . Атомный радиус 1,37
. Атомный радиус 1,37
 ; ионный Zn
2+— 0,83
; ионный Zn
2+— 0,83
 . Плотность твёрдого Ц. 7,133
г/см
3(20 °С), жидкого 6,66
г/см
3(419,5 °С);
t
пл419,5 °С;
t
кип906 °С. Температурный коэффициент линейного расширения 39,7Ч10
-6(20—250 °С), коэффициент теплопроводности 110,950
вт/(
мЧ
К) 0,265
кал/смЧ
секЧ°С (20 °С), удельное электросопротивление 5,9Ч10
-6
омЧ
см(20 °С), удельная теплоёмкость Ц. 25,433
кдж/(
кгЧК) [6,07
кал/гЧ
оС)
].Предел прочности при растяжении 200—250
Мн/м
2(2000—2500
кгс/см
2)
,относительное удлинение 40—50%, твёрдость по Бринеллю 400—500
Мн/м
2(4000—5000
кгс/см
2). Ц. диамагнитен, его удельная магнитная восприимчивость — 0,175Ч10
-6.
. Плотность твёрдого Ц. 7,133
г/см
3(20 °С), жидкого 6,66
г/см
3(419,5 °С);
t
пл419,5 °С;
t
кип906 °С. Температурный коэффициент линейного расширения 39,7Ч10
-6(20—250 °С), коэффициент теплопроводности 110,950
вт/(
мЧ
К) 0,265
кал/смЧ
секЧ°С (20 °С), удельное электросопротивление 5,9Ч10
-6
омЧ
см(20 °С), удельная теплоёмкость Ц. 25,433
кдж/(
кгЧК) [6,07
кал/гЧ
оС)
].Предел прочности при растяжении 200—250
Мн/м
2(2000—2500
кгс/см
2)
,относительное удлинение 40—50%, твёрдость по Бринеллю 400—500
Мн/м
2(4000—5000
кгс/см
2). Ц. диамагнитен, его удельная магнитная восприимчивость — 0,175Ч10
-6.