Страница:
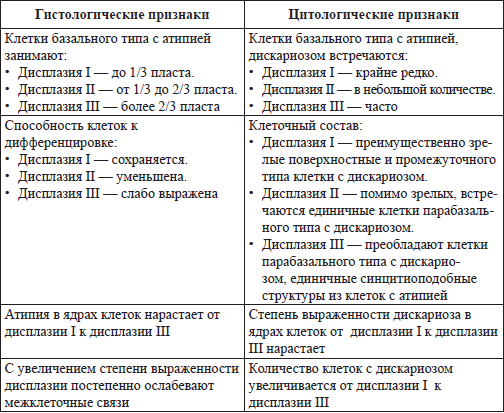
Инвазивный рак характеризуется выраженным полиморфизмом клеток, нарушается целость базальной мембраны, отмечается инвазия атипичных клеток в строму.
4. Цитологическая классификация состояний шейки матки
Со времен разработки Д. Папаниколау классификации результатов цитологического исследования до настоящего времени делаются попытки упростить систему наименований данных обследования, сделать ее доступной и понятной не только врачу, но и пациентке.
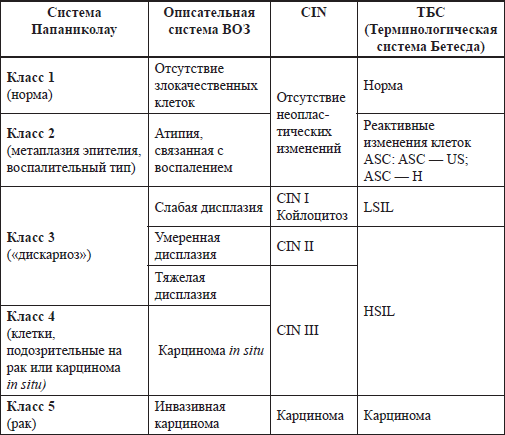
Цитологическая классификация Д. Папаниколау включала в себя пять классов мазков в зависимости от наличия и тяжести цитологических аномалий (табл. 4).
Со временем, класс 3 потребовал более подробного рассмотрения, и появилась концепция дисплазии, или пролиферации атипичных клеток, предложенная Reagan и соавт. в 1953 г. Предложенная терминология была утверждена ВОЗ и могла быть использована в качестве как цитологической, так и гистологической классификации. Она дифференцировала четыре интраэпителиальные стадии: три варианта дисплазии (слабую, среднюю и тяжелую), без уточнения их онкогенного потенциала, и Carcinoma in situ как истинный неопластический процесс.
В конце 1960-х годов результаты длительных клинических и лабораторных исследований привели к заключению, что дисплазия и Carcinoma in situ представляют собой гистологическую непрерывность и имеют единую потенцию к прогрессии. Был предложен термин «цервикальная интраэпителиальная неоплазия» (CIN), который первоначально использовался для гистологических исследований (1967 г., Richart), а позже эта классификация была адаптирована ВОЗ для цитологических исследований (1973). CIN были разделены на три стадии (см. табл. 4): CIN I – соответствует дисплазии слабой степени, CIN II – дисплазии средней степени, CIN III – дисплазии тяжелой степени и Са in situ (CIS). Описанная CIN-терминология подчеркивала, что все эти процессы, включая и CIN I, являются по сути своей предраковыми, а термин «CIN III» объединяет два состояния, так как не всегда возможно установить различия между дисплазией тяжелой степени и интраэпителиальным раком.
До 1988 г. большинство цитологических лабораторий мира использовало одну из вышеперечисленных классификаций: Папаниколау, дисплазия – карцинома in situ или CIN-терминология.
С признанием в 1980-х годах прошлого столетия ведущей роли вируса папилломы человека в патогенезе цервикального рака стало ясно, что спектр CIN – это не стадии единого заболевания, а два биологических процесса, отражающие продуктивную папилломавирусную инфекцию и истинные предраковые состояния [3, 10, 12].
Таблица 3
Терминологическая система Бетесда, 2001 (The Bethesda System, TBS)
 В 1988 г. с целью стандартизации результатов цитологического исследования в г. Бетесда (США) группой специалистов при содействии Государственного института онкологии была разработана новая классификация – терминологическая система Бетесда (The Bethesda System) [36]. Данная классификация была пересмотрена после ее внедрения (1991 и 2001 гг.) на основании лабораторного и клинического опыта (см. табл. 3 – принятые сокращения). В настоящее время на терминологической системе Бетесда построены все алгоритмы ведения пациенток с патологическими состояниями шейки матки.
В 1988 г. с целью стандартизации результатов цитологического исследования в г. Бетесда (США) группой специалистов при содействии Государственного института онкологии была разработана новая классификация – терминологическая система Бетесда (The Bethesda System) [36]. Данная классификация была пересмотрена после ее внедрения (1991 и 2001 гг.) на основании лабораторного и клинического опыта (см. табл. 3 – принятые сокращения). В настоящее время на терминологической системе Бетесда построены все алгоритмы ведения пациенток с патологическими состояниями шейки матки.
Таблица 4
Терминологическая система Бетесда, 2001 (The Bethesda System, TBS)
(формат и рекомендуемая терминология)
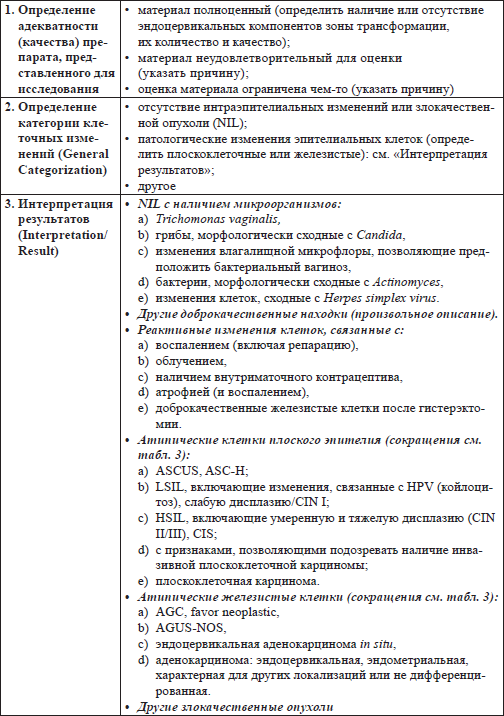
Основными составляющими системы Бетесда являются (см. табл. 4):
1. оценка адекватности цитологического мазка (описание наличия или отсутствия компонентов эндоцервикальной зоны трансформации или другие индикаторы качества),
2. определение категории клеточных изменений (сортировка препаратов),
3. интерпретация результатов (описательный диагноз).
Оценка адекватности цитологического образца, от качества которого зависит чувствительность метода, является важным компонентом системы Бетесда. Как «удовлетворительные» квалифицируются мазки, содержащие не менее 8 000-12 000 хорошо визуализируемых (не перекрытых воспалительными клетками или эритроцитами) плоских клеток в традиционном мазке и не менее 5 000 плоских клеток при жидкостном варианте, а также не менее 10 хорошо сохраненных клеток эндоцервикса или метапластических клеток [36]. Отсутствие клеток цилиндрического эпителия может быть отмечено цитологом, но не позволяет расценивать образец как неудовлетворительный. Необходимость повторного взятия мазка определяется только клиницистом.
Таким образом, TBS объединяет три градации CIN в две группы неинвазивных плоскоклеточных заболеваний шейки матки: плоскоклеточные интраэпителиальные поражения низкой и высокой степени. При этом низкая степень плоскоклеточных интраэпителиальных поражений (LSIL) включает в себя койлоцитоз (цитологические признаки ВПЧ-обусловленных изменений клеток) и CIN I, что соответствует транзиторной форме папилломавирусной инфекции. Высокая степень плоскоклеточных интраэпителиальных поражений (HSIL), чаще связанная с персистирующей вирусной инфекцией и высоким риском прогрессии, включает в себя CIN II и CIN III.
Терминологическая система Бетесда допускает использование терминов «CIN» или «дисплазия» в качестве дополнительного описания, что может быть полезным в отдельных случаях для корреляции цитологических и гистологических заключений (табл. 5).
Таблица 5
Сопоставление морфологических классификаций заболеваний шейки матки [10,17]
Цитологическая классификация Д. Папаниколау включала в себя пять классов мазков в зависимости от наличия и тяжести цитологических аномалий (табл. 4).
Со временем, класс 3 потребовал более подробного рассмотрения, и появилась концепция дисплазии, или пролиферации атипичных клеток, предложенная Reagan и соавт. в 1953 г. Предложенная терминология была утверждена ВОЗ и могла быть использована в качестве как цитологической, так и гистологической классификации. Она дифференцировала четыре интраэпителиальные стадии: три варианта дисплазии (слабую, среднюю и тяжелую), без уточнения их онкогенного потенциала, и Carcinoma in situ как истинный неопластический процесс.
В конце 1960-х годов результаты длительных клинических и лабораторных исследований привели к заключению, что дисплазия и Carcinoma in situ представляют собой гистологическую непрерывность и имеют единую потенцию к прогрессии. Был предложен термин «цервикальная интраэпителиальная неоплазия» (CIN), который первоначально использовался для гистологических исследований (1967 г., Richart), а позже эта классификация была адаптирована ВОЗ для цитологических исследований (1973). CIN были разделены на три стадии (см. табл. 4): CIN I – соответствует дисплазии слабой степени, CIN II – дисплазии средней степени, CIN III – дисплазии тяжелой степени и Са in situ (CIS). Описанная CIN-терминология подчеркивала, что все эти процессы, включая и CIN I, являются по сути своей предраковыми, а термин «CIN III» объединяет два состояния, так как не всегда возможно установить различия между дисплазией тяжелой степени и интраэпителиальным раком.
До 1988 г. большинство цитологических лабораторий мира использовало одну из вышеперечисленных классификаций: Папаниколау, дисплазия – карцинома in situ или CIN-терминология.
С признанием в 1980-х годах прошлого столетия ведущей роли вируса папилломы человека в патогенезе цервикального рака стало ясно, что спектр CIN – это не стадии единого заболевания, а два биологических процесса, отражающие продуктивную папилломавирусную инфекцию и истинные предраковые состояния [3, 10, 12].
Таблица 3
Терминологическая система Бетесда, 2001 (The Bethesda System, TBS)

Таблица 4
Терминологическая система Бетесда, 2001 (The Bethesda System, TBS)
(формат и рекомендуемая терминология)

Основными составляющими системы Бетесда являются (см. табл. 4):
1. оценка адекватности цитологического мазка (описание наличия или отсутствия компонентов эндоцервикальной зоны трансформации или другие индикаторы качества),
2. определение категории клеточных изменений (сортировка препаратов),
3. интерпретация результатов (описательный диагноз).
Оценка адекватности цитологического образца, от качества которого зависит чувствительность метода, является важным компонентом системы Бетесда. Как «удовлетворительные» квалифицируются мазки, содержащие не менее 8 000-12 000 хорошо визуализируемых (не перекрытых воспалительными клетками или эритроцитами) плоских клеток в традиционном мазке и не менее 5 000 плоских клеток при жидкостном варианте, а также не менее 10 хорошо сохраненных клеток эндоцервикса или метапластических клеток [36]. Отсутствие клеток цилиндрического эпителия может быть отмечено цитологом, но не позволяет расценивать образец как неудовлетворительный. Необходимость повторного взятия мазка определяется только клиницистом.
Таким образом, TBS объединяет три градации CIN в две группы неинвазивных плоскоклеточных заболеваний шейки матки: плоскоклеточные интраэпителиальные поражения низкой и высокой степени. При этом низкая степень плоскоклеточных интраэпителиальных поражений (LSIL) включает в себя койлоцитоз (цитологические признаки ВПЧ-обусловленных изменений клеток) и CIN I, что соответствует транзиторной форме папилломавирусной инфекции. Высокая степень плоскоклеточных интраэпителиальных поражений (HSIL), чаще связанная с персистирующей вирусной инфекцией и высоким риском прогрессии, включает в себя CIN II и CIN III.
Терминологическая система Бетесда допускает использование терминов «CIN» или «дисплазия» в качестве дополнительного описания, что может быть полезным в отдельных случаях для корреляции цитологических и гистологических заключений (табл. 5).
Таблица 5
Сопоставление морфологических классификаций заболеваний шейки матки [10,17]

5. Возможности скрининга рака шейки матки
Система профилактики и снижения заболеваемости раком шейки матки состоит из двух этапов: первый – предупреждение факторов риска и вакцинопрофилактика, второй – разработка и внедрение полноценных скрининговых программ. Основными требованиями к скрининговым программам являются доступность, невысокая стоимость, достаточная чувствительность и специфичность, неинвазивность и безопасность. Следовательно, выбор скрининговых программ зависит от объема финансирования, уровня подготовки вовлеченного медицинского персонала, численности включенных в эти программы женщин, возможности применения новых технологий [25, 26]. Примером организованного цитологического скрининга могут служить некоторые европейские страны (Великобритания, Финляндия и др.), где имеется популяционная база данных всех женщин, обращавшихся по различным причинам к врачам общей практики. Из офиса семейного врача зарегистрированная в базе данных женщина получает уведомление с приглашением принять участие в очередном этапе скрининга [16]. Взятие материала для цитологического скрининга осуществляется специально обученным средним персоналом. Цитологическое исследование в рамках скрининговых программ выполняют высококвалифицированные специалисты, имеющие большой опыт работы в данной области. В результате исследования выдается цитологическое заключение, а в случаях выявления отклонений от нормы проводится подбор рекомендаций по дальнейшей тактике ведения, что позволяет избежать потери времени и увеличить эффективность лечения.
В нашей стране скрининг носит, в основном, добровольный характер (проводится при обращении). До последнего времени не были уточнены требования к организации скрининга: стартовый возраст для начала скрининга колебался между 18 и 35 годами, а временные промежутки повторного обследования – от 1 года до 5 лет. Специальной рабочей группой ведущих специалистов в области цервикальной патологии в 2007 году разработаны следующие рекомендации для проведения скрининговых программ в России [10, 13]:
• стартовый возраст для начала скрининга – 25 лет;
• проведение скрининга в возрасте старше 65 лет считать нецелесообразным (при условии адекватного скрининга с отрицательными результатами до этого возраста);
• интервалы при проведении скрининга – каждые 3 года в возрасте моложе 50 лет и каждые 5 лет в возрасте 50–65 лет.
Нужно еще раз отметить, что данные рекомендации не могут применяться в группе женщин, имеющих факторы риска развития рака шейки матки или положительные результаты предыдущего этапа скрининга.
В настоящее время известно, что ведущим фактором риска развития рака шейки матки является инфицирование вирусом папилломы человека (ВПЧ). В 99,7 % биоптатов, взятых у больных раком шейки матки по всему миру, как при плоскоклеточных карциномах, так и при аденокарциномах, были обнаружены высокоонкогенные типы ВПЧ.
Кофакторами, повышающими как риск инфицирования ВПЧ, так и вероятность развития персистирующей формы ПВИ, считаются:
• курение;
• наследственная предрасположенность (полиморфизм кодона 72р53 – гена, подавляющего рост опухоли);
• ранний сексуальный дебют;
• длительный (более 5 лет) прием комбинированных оральных контрацептивов;
• инфекции, передаваемые половым путем (а именно хламидиоз, гонорея, генитальный герпес);
• многократные роды (три и более);
• состояния иммунодефицита (СПИД, прием цитостатиков, кортикостероидов).
Эпидемиологические исследования показали, что рак шейки матки может вызываться 18 типами вирусов, из которых наиболее часто (в 94–98 % случае рака шейки матки) встречаются следующие генотипы: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68. Таким образом, традиционное ранее обследование на папилломавирусы только 16 и 18 типов обладает невысокой диагностической чувствительностью (не более 72–75 %).
Накопленные данные позволили рассматривать обследование на папилломавирусную инфекцию (ПВИ) как важнейшую составляющую скрининга и профилактики рака шейки матки [25]. Результаты многочисленных исследований показали, что чувствительность ВПЧ-теста (88-100 %) превышает чувствительность цитологического исследования (68–86 %), но специфичность его (68–97 %)) несколько меньше специфичности цитологического исследования (86-100 %) [35]. При этом чувствительность и прогностическая значимость отрицательного результата ВПЧ-теста в сочетании с отрицательными результатами цитологического исследования приближается к 100 %.
В то же время, в регионах, где с успехом применяется цитологический скрининг, тест на ВПЧ не включают в эту программу из-за его низкой прогностической значимости, особенно у молодых женщин (моложе 30 лет), что обусловлено высокой частотой инфицирования и транзиторным характером инфекции в этой возрастной группе. Существуют ограничения по возрасту первого скринингового исследования с использованием ВПЧ-теста: проведение тестирования не ранее 25–30 лет либо через 7-10 лет после начала половой жизни [12]. Одним из аргументов сторонников включения ВПЧ-теста в программы скрининга является возможность увеличения интервала скрининга у пациенток с отрицательными результатами ВПЧ-теста и цитологического исследования. Пациенткам с отрицательным результатом цитологического исследования и положительным ВПЧ-тестом рекомендуется повторить оба теста через 6-12 мес. Если при повторном обследовании результат какого-либо теста окажется положительным, показано проведение кольпоскопии.
В нашей стране скрининг носит, в основном, добровольный характер (проводится при обращении). До последнего времени не были уточнены требования к организации скрининга: стартовый возраст для начала скрининга колебался между 18 и 35 годами, а временные промежутки повторного обследования – от 1 года до 5 лет. Специальной рабочей группой ведущих специалистов в области цервикальной патологии в 2007 году разработаны следующие рекомендации для проведения скрининговых программ в России [10, 13]:
• стартовый возраст для начала скрининга – 25 лет;
• проведение скрининга в возрасте старше 65 лет считать нецелесообразным (при условии адекватного скрининга с отрицательными результатами до этого возраста);
• интервалы при проведении скрининга – каждые 3 года в возрасте моложе 50 лет и каждые 5 лет в возрасте 50–65 лет.
Нужно еще раз отметить, что данные рекомендации не могут применяться в группе женщин, имеющих факторы риска развития рака шейки матки или положительные результаты предыдущего этапа скрининга.
В настоящее время известно, что ведущим фактором риска развития рака шейки матки является инфицирование вирусом папилломы человека (ВПЧ). В 99,7 % биоптатов, взятых у больных раком шейки матки по всему миру, как при плоскоклеточных карциномах, так и при аденокарциномах, были обнаружены высокоонкогенные типы ВПЧ.
Кофакторами, повышающими как риск инфицирования ВПЧ, так и вероятность развития персистирующей формы ПВИ, считаются:
• курение;
• наследственная предрасположенность (полиморфизм кодона 72р53 – гена, подавляющего рост опухоли);
• ранний сексуальный дебют;
• длительный (более 5 лет) прием комбинированных оральных контрацептивов;
• инфекции, передаваемые половым путем (а именно хламидиоз, гонорея, генитальный герпес);
• многократные роды (три и более);
• состояния иммунодефицита (СПИД, прием цитостатиков, кортикостероидов).
Эпидемиологические исследования показали, что рак шейки матки может вызываться 18 типами вирусов, из которых наиболее часто (в 94–98 % случае рака шейки матки) встречаются следующие генотипы: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68. Таким образом, традиционное ранее обследование на папилломавирусы только 16 и 18 типов обладает невысокой диагностической чувствительностью (не более 72–75 %).
Накопленные данные позволили рассматривать обследование на папилломавирусную инфекцию (ПВИ) как важнейшую составляющую скрининга и профилактики рака шейки матки [25]. Результаты многочисленных исследований показали, что чувствительность ВПЧ-теста (88-100 %) превышает чувствительность цитологического исследования (68–86 %), но специфичность его (68–97 %)) несколько меньше специфичности цитологического исследования (86-100 %) [35]. При этом чувствительность и прогностическая значимость отрицательного результата ВПЧ-теста в сочетании с отрицательными результатами цитологического исследования приближается к 100 %.
В то же время, в регионах, где с успехом применяется цитологический скрининг, тест на ВПЧ не включают в эту программу из-за его низкой прогностической значимости, особенно у молодых женщин (моложе 30 лет), что обусловлено высокой частотой инфицирования и транзиторным характером инфекции в этой возрастной группе. Существуют ограничения по возрасту первого скринингового исследования с использованием ВПЧ-теста: проведение тестирования не ранее 25–30 лет либо через 7-10 лет после начала половой жизни [12]. Одним из аргументов сторонников включения ВПЧ-теста в программы скрининга является возможность увеличения интервала скрининга у пациенток с отрицательными результатами ВПЧ-теста и цитологического исследования. Пациенткам с отрицательным результатом цитологического исследования и положительным ВПЧ-тестом рекомендуется повторить оба теста через 6-12 мес. Если при повторном обследовании результат какого-либо теста окажется положительным, показано проведение кольпоскопии.
Конец бесплатного ознакомительного фрагмента
