Страница:
В 2010–2011 годы появились сообщения (Oza V. et al., 2010; Hogeling М. et al., 2011) об обширных некрозах подкожно-жировой клетчатки (спины, головы, рук) у детей с гипоксически-ишемической энцефалопатией, лечившихся методом терапевтической гипотермии.
Christensen R. D. et al. (2011) описали нарушения функций тромбоцитов у 60 % детей, пролеченных с помощью «активной» гипотермии, проявившиеся геморрагическим синдромом различной локализации. Геморрагический синдром возник в первые 24 часа жизни младенцев. Функции тромбоцитов восстановились после согревания ребенка. Израильские коллеги (Landau Y. et al., 2011) кровоточивости не описывают, но, применив гипотермию у 6 детей с постгипоксической энцефалопатией в первые часы жизни (средний возраст 4,2 часа от рождения), они отметили гиперкальцемию у одного ребенка, некрозы подкожно-жировой клетчатки – у одного новорожденного, пневмоторакс – у одного, синдром аспирации – у двух младенцев. В заключение работы, правда, они пишут, что в среднем возрасте 7,2 месяца жизни дети показывают удовлетворительное неврологическое развитие и отсутствие судорожного синдрома. Но, заметим, что вряд ли можно оценивать катамнез через такой короткий срок.
Наконец, в 2011 году, подводя некоторые итоги применения церебральной гипотермии в течение десятилетия, специалисты одной из ведущих неонатальных клиник в США Bonifacio S. L. et al. в большой обзорной работе указывают: «Терапия, направленная на снижение неврологических осложнений у детей, перенесших асфиксию, сделала гипотермию стандартным лечением. Однако эта терапия не обеспечивает полной защиты при возникновении неврологических осложнений и диктует необходимость разработки вспомогательной терапии для улучшения неврологического результата». Им вторят Johnston М. V. et al. (2011) из Балтимора, Leone Т. A., Finer N. N. (2011) из Сан-Диего и т. д.
Добавим от себя, что необходимы клинические, лабораторные или функциональные методы исследования, позволяющие оценить эффективность гипотермии и прогноз тяжести постгипоксической энцефалопатии. Какие же показатели и методы предлагаются для оценки тяжести состояния и эффективности гипотермии? Единодушного мнения на этот счет нет. Предлагаются ЭЭГ (Wusthoff С. J. et al., 2011), индекс резистентности сосудов головного мозга (Elstad М. et al., 2011), чередование циклов сон-бодрствование (Takenouchi Т. et al., 2011), видео-мониторинг ЭЭГ (Nash К. В. et al., 2011), концентрация глюкозы крови (Nadeem М. et al., 2011), эхокардиография (Kluckow М., 2011), уровень нейрон-специфической энолазы (Yamada К. et al., 2011) и т. д. Пока, к сожалению, эффективность этих методов оценки эффективности церебральной гипотермии у детей не является общепризнанной, поскольку, зачастую не позволяет строить долгосрочный прогноз. Например, показатели ЭЭГ коррелируют со смертельным исходом, но не всегда ассоциированы с неблагоприятным исходом постгипоксической энцефалопатии (Hamelin S. et al., 2011) и т. д.
Отсутствие эффективности данного метода у части детей также пытаются объяснить по-разному. Заметим от себя, что, по нашему убеждению, ни один из терапевтических методов, применяемых в медицине, в том числе и неонатологии, не может обладать 100 %-й эффективностью. Но где тот предел эффективности, который позволяет рекомендовать применение того или иного метода в клиническую практику? Хорошо бы ответить на этот вопрос. Вероятно, для разных методов этот предел неодинаковый. Тем не менее, изучение церебральной гипотермии значительно расширяет наши представления о многих патологических процессах у новорожденных детей. Так, в некоторых работах неэффективность церебральной гипотермии пытаются объяснить внутриутробным поражением плода, в частности инфекционного генеза, который можно диагностировать по поражению плаценты (Wintermark P. et al., 2011).
На наш взгляд, данные результаты перекликаются с достаточно давно проведенными исследованиями в нашей стране и за рубежом. И отражают общие закономерности, в том числе встречающиеся и в неонатальной медицине. Например, выяснение механизмов поражения ЦНС при неонатальных гипербилирубинемиях выявило ряд закономерностей. Напомним читателю факт хорошо известный из клинической практики. Хоть возникновение «ядерной желтухи» у новорожденных и зависит от уровня непрямого билирубина (НБ) в плазме крови, но не всегда у детей с одинаковой массой тела, сроком гестации и даже одинаково высоким уровнем билирубина возникает поражение мозга. Большое значение в развитии билирубиновой энцефалопатии имеют факторы риска. Например, факторы, увеличивающие проницаемость гематоэнцефалического барьера, такие как гиперосмолярность, метаболический ацидоз, артериальная гипертензия и т. д. По нашему мнению, должны быть выделены такие же «факторы риска» или «факторы неэффективности» различных методов, применяемых для лечения новорожденных детей. Это может быть одной из приоритетных научных задач неонатологии.
Исследования по применению гипотермии у новорожденных имеют большое значение и для неонатальной фармакологии. Имеются попытки использования различных лекарственных препаратов, усиливающих действие терапевтической гипотермии. Filippi L. et al. (2011) обследовали 19 новорожденных, перенесших тяжелую асфиксию, имевших в структуре постгипоксической энцефалопатии судорожный синдром. Применялась церебральная гипотермия. Им также был назначен фенобарбитал в возрастных дозировках для купирования судорожного синдрома. Оценка фармакодинамики фенобарбитала при охлаждении позволила авторам работы сделать вывод, что пиковые концентрации препарата в крови значительно более высокие, чем у детей с судорожным синдромом, не получавших терапевтическую гипотермию. У охлажденных детей также увеличивался период полураспада препарата, составляя 173,9 ±62,5 часа. На наш взгляд, это необходимо учитывать при проведении терапии охлаждением. Вполне возможно и другие препараты меняют фармакодинамику при охлаждении, что, по нашему мнению, требует дальнейших и более широких исследований.
Конечно, не только фенобарбитал применяется для лечения постгипоксической энцефалопатии. Имеются попытки применения с целью нейропротекции блокаторов ионных каналов (ксенон), антиоксидантов (аллопуринол, индометацин), антивоспалительных цитокинов (эритропоэтин, мелатонин), блокаторов апоптоза (ядерный фактор каппа) и т. д. (Fan X., van Bel F., 2010).
В некоторых клиниках используют пассивную гипотермию (Сурков Д. Н., 2011; Hagmann С. F. et al., 2011), несомненно более щадящий метод, с достаточно выраженным эффектом, в том числе не только при постгипоксической энцефалопатии, но и при ЯНЭК у новорожденных (Hall N. J., et al., 2010). Терапевтическую гипотермию также пытаются применять при других формах неонатальной патологии, например, энцефалитах (Yamada К. et al., 2011). Правда, эффект не очень хороший: у 30 % больных возник отек мозга.
Заманчивость использования температурного фактора как физического лечебного метода поддерживается также положительным опытом смежных отраслей медицины в течение нескольких столетий (общеизвестно увеличение шансов выживания с сохранением функций ЦНС при утоплении в холодной воде, использование гипотермии в кардиохирургии, использование гипертермии при лечении иммунодефицитов и т. п.). Но, как и при применении любого лекарства или метода терапии, важны дозировки, длительность использования, когда и кому его применяют и т. д., так и при использовании церебральной гипотермии должны учитываться способ вхождения и выхода из данного состояния, особенности применения в различные возрастные периоды, сопутствующая патология, факторы риска и т. д.
Хотелось бы, чтобы это в некоторой степени явилось предостережением для врачей нашей страны: может, не будем торопиться с внедрением церебральной гипотермии в наши стационары, тем более что данная методика, как мы уже отмечали выше, у нас в стране уже применялась.
К сожалению, вряд ли в этом вопросе наша страна «останется позади планеты всей». Есть же заинтересованность конкретных фирм, а соответственно, и «заинтересованных» людей… И вот уже в повестку дня многих конгрессов и конференций, проводимых в России, включаются секции типа: «Современные методы оценки церебральных функций и использования гипотермии для защиты мозга новорожденных детей». Как говорил небезызвестный персонаж нашей истории, «процесс пошел». И как говорят представители нынешней «элиты», тяготеющей к англосаксам: «No comments». Комментарии мы дали выше… Конечно, мы не против всестороннего, вдумчивого, кропотливого обследования и последующего обсуждения данных методов. Но, как раз в данном случае, было бы хорошо, чтобы проводимые исследования были рандомизированными и мультицентровыми. Кстати, заметим: выше мы написали «в кардиохирургии»… С другой стороны, имеются рандомизированные исследования (Stocker С. F. et al., 2011) демонстрирующие, что выраженная гипотермия (24 °C) не имеет никаких преимуществ, по сравнению со средней (34 °C), на исходы после корригирующих операции по поводу ВПС. Указанные исследователи оценивали показатели системного воспалительного и иммунного ответов, параметры гемодинамики и коагуляции, органные повреждения. Авторы даже отмечают, что рутинное использование гипотермии не оправдано в педиатрической практике. Так что вопрос о применении гипотермии очень не прост.
Обратим внимание еще на один аспект данной проблемы. По заключению экспертов (Jacobs S. et al., 2007; Shah P. S. et al., 2007), данный метод требует нахождения ребенка в ОРИТ, поскольку дети нуждаются в инотропной поддержке, у них возможно развитие брадикардии, тром-боцитопении, олигурии и т. д. Например, более 60 % детей нуждаются в проведении ИВЛ (Cavallaro G. et al., 2011). Некоторым детям в силу тяжести состояния приходится проводить ЭКМО (Massaro A. et al., 2011). В первой отечественной публикации по пассивной гипотермии у новорожденных с тяжелой постгипоксической энцефалопатией (Сурков Д. Н., 2011) указывается, что все дети нуждаются в проведении ИВЛ. С другой стороны, необходимо также учитывать, что аппаратура для применения активной терапевтической гипотермии достаточно дорога, требует квалифицированного персонала и т. д., поэтому применение данных методик в стационарах первого уровня в нашей стране представляется достаточно проблематичным.
Если же принято решение о проведении терапевтической гипотермия, то нужно помнить, что она должна быть начата не позже шести часов после рождения ребенка. С другой стороны известно, что ребенок, перенесший тяжелую асфиксию, как правило, имеет множественные органные дисфункции, требующие лечения в условиях ОРИТ. Далеко не всегда новорожденные с указанной патологией рождаются в условиях перинатального центра (учреждениях III уровня оказания помощи). Достаточно часто роды происходят в учреждениях первого и/ или второго уровня, и ребенок в последующем нуждается в межгоспитальной транспортировке. В настоящее время общепринятой точкой зрения является та, что новорожденный ребенок, перенесший критическое состояние при рождении, как можно быстрее должен быть переведен в стационар, где ему может быть оказана адекватная и всесторонняя помощь (подробно этот вопрос освящен в нашей монографии «Интенсивная терапия и транспортировка новорожденных детей, 2009»). Как же быть в этой ситуации с терапевтической гипотермией? В конце прошлого десятилетия в США были проведены пилотные исследования, посвященные проведению терапевтической гипотермии новорожденным детям при межгоспитальной транспортировке. На результатах этих исследований мы более подробно остановимся.
В разных странах мира при проведении межгоспитальной транспортировки проводится как «пассивная» гипотермия (отключение источника лучистого тепла), так и «активная» (церебральная). Указывают (Hallberg В. et al., 2009), что применение пассивной гипотермии часто (более чем у 50 %) приводит к переохлаждению новорожденных. Учитывая это обстоятельство, американские коллеги (Fairchild К. et al., 2010) провели активную гипотермию во время межгоспитальной транспортировки (из госпиталя I или II уровня в стационар III уровня оказания помощи новорожденным). У них имеется опыт применения гипотермии у 40 младенцев, перенесших тяжелую постгипоксическую энцефалопатию. У пяти детей гипотермия применялась только в отправляющем госпитале, у двух новорожденных во время трансфера проводилась «пассивная» гипотермия, у 33 младенцев – активная. Значения ректальной температуры у этих детей представлены на рисунке 4.
Таблица 3
Клиническая характеристика и лабораторные показатели у детей, получавших гипотермию во время межгоспитальной транспортировки (Fairchild К. et al., 2010)
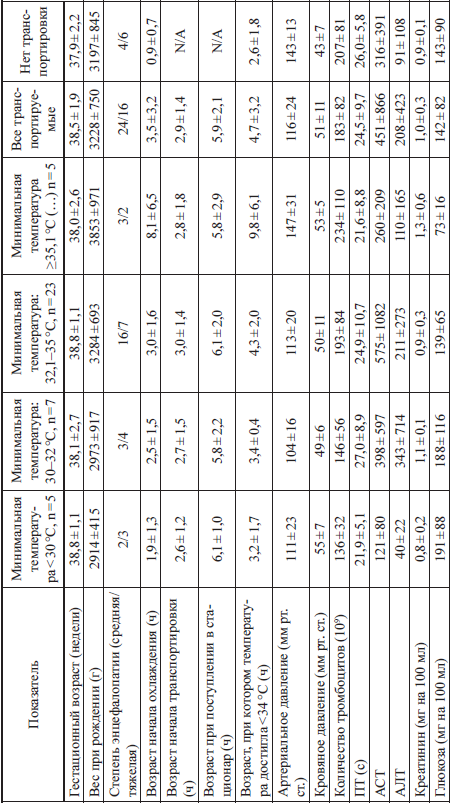
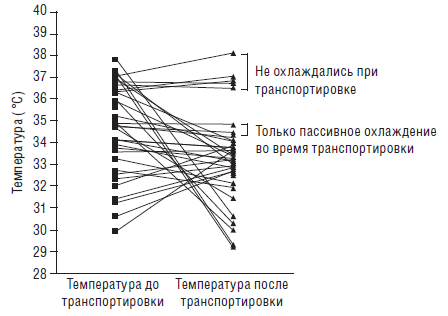
Рис. 4. Сравнение ректальной температуры у 40 новорожденных до и после межгоспитальной транспортировки (Fairchild К. et al., 2010)
Клиническая характеристика детей, получавших гипотермию во время транспортировки, представлена в таблице 3. Дети были разделены на группы по степени возникшей гипотермии. Авторы отмечают, что только у одного ребенка была отмечена синусовая брадикардия. У детей с максимальной степенью охлаждения выявлена корреляция с весом при рождении, склонностью к тромбоцитопении и гипергликемии. Таким образом, и в данном исследовании отмечена достаточно высокая частота осложнений у новорожденных детей, подвергшихся охлаждению.
Некоторые исследователи (Сурков Д. Н., 2011) считают, что гипотермия может быть рекомендована в первые 72 часа жизни после перенесенной тяжелой асфиксии, поскольку именно в этот промежуток времени начинается некроз и усиливается апоптоз нейронов. По этим данным, даже при более позднем начале пассивной гипотермии (до 72 часов жизни) неврологические результаты у детей были лучше, чем без проведения гипотермии. Но чем позднее начата гипотермия, тем ниже ее эффективность.
Вот такое большое отступление получилось в связи с достаточно широким применением церебральной гипотермии у новорожденных детей в настоящее время. Хотя, наверное, и не отступление, поскольку сегодняшний день неразрывно связан с прошлым. Как говорил У. Черчилль: «Если мы поссорим прошлое с настоящим, то потеряем будущее».
Возвращаясь к историческим аспектам применения гипотермии, можно отметить, что в большинстве стран применение гипотермии у новорожденных продолжалось относительно недолго. Роли теплового режима и влажности в инкубаторе были тщательно изучены в 1957 г. Сильверманом В.
У детей, помещенных в инкубатор с высокой влажностью, отмечалась более низкая смертность. В последующих исследованиях было показано, что при повышении температуры в инкубаторе всего лишь на 1,5 °C (с 28 до 29,5 °C) выживаемость увеличилась на 22 % (с 61 до 83 %), особенно эта разница в выживании проявилась у маловесных детей.
После этих, ставших уже классическими работ, проведены многочисленные исследования, подтвердившие огромную роль поддержания теплового баланса у новорожденных детей. На наш взгляд, в России в настоящее время вопросам теплового баланса у новорожденных, особенно при длительной межгоспитальной транспортировке, уделяется мало внимания. К сожалению, у нас в стране иногда начинают внедрять дорогостоящее методы лечения, которые, безусловно, показаны очень небольшому количеству больных, например ЭКМО (Tobin М. J., 2003), из-за большого количества осложнений, или же ВчИВЛ (Johnson А. Н. et al., 2002), тратя на это десятки, а то и сотни тысяч долларов США. Вместо того чтобы купить хороший транспортный кувез и средства доставки из роддома в отделения больницы всего потока больных детей.
Конечно, может иногда и нужно вентилировать новорожденного ребенка с помощью ВчИВЛ или применять ЭКМО, но лучше не доводить его до такого состояния, в частности, переохлаждением, когда ему такая вентиляция понадобится.
Глава 2 Теплорегуляция у новорожденных
2.1. Общие вопросы теплорегуляции
Christensen R. D. et al. (2011) описали нарушения функций тромбоцитов у 60 % детей, пролеченных с помощью «активной» гипотермии, проявившиеся геморрагическим синдромом различной локализации. Геморрагический синдром возник в первые 24 часа жизни младенцев. Функции тромбоцитов восстановились после согревания ребенка. Израильские коллеги (Landau Y. et al., 2011) кровоточивости не описывают, но, применив гипотермию у 6 детей с постгипоксической энцефалопатией в первые часы жизни (средний возраст 4,2 часа от рождения), они отметили гиперкальцемию у одного ребенка, некрозы подкожно-жировой клетчатки – у одного новорожденного, пневмоторакс – у одного, синдром аспирации – у двух младенцев. В заключение работы, правда, они пишут, что в среднем возрасте 7,2 месяца жизни дети показывают удовлетворительное неврологическое развитие и отсутствие судорожного синдрома. Но, заметим, что вряд ли можно оценивать катамнез через такой короткий срок.
Наконец, в 2011 году, подводя некоторые итоги применения церебральной гипотермии в течение десятилетия, специалисты одной из ведущих неонатальных клиник в США Bonifacio S. L. et al. в большой обзорной работе указывают: «Терапия, направленная на снижение неврологических осложнений у детей, перенесших асфиксию, сделала гипотермию стандартным лечением. Однако эта терапия не обеспечивает полной защиты при возникновении неврологических осложнений и диктует необходимость разработки вспомогательной терапии для улучшения неврологического результата». Им вторят Johnston М. V. et al. (2011) из Балтимора, Leone Т. A., Finer N. N. (2011) из Сан-Диего и т. д.
Добавим от себя, что необходимы клинические, лабораторные или функциональные методы исследования, позволяющие оценить эффективность гипотермии и прогноз тяжести постгипоксической энцефалопатии. Какие же показатели и методы предлагаются для оценки тяжести состояния и эффективности гипотермии? Единодушного мнения на этот счет нет. Предлагаются ЭЭГ (Wusthoff С. J. et al., 2011), индекс резистентности сосудов головного мозга (Elstad М. et al., 2011), чередование циклов сон-бодрствование (Takenouchi Т. et al., 2011), видео-мониторинг ЭЭГ (Nash К. В. et al., 2011), концентрация глюкозы крови (Nadeem М. et al., 2011), эхокардиография (Kluckow М., 2011), уровень нейрон-специфической энолазы (Yamada К. et al., 2011) и т. д. Пока, к сожалению, эффективность этих методов оценки эффективности церебральной гипотермии у детей не является общепризнанной, поскольку, зачастую не позволяет строить долгосрочный прогноз. Например, показатели ЭЭГ коррелируют со смертельным исходом, но не всегда ассоциированы с неблагоприятным исходом постгипоксической энцефалопатии (Hamelin S. et al., 2011) и т. д.
Отсутствие эффективности данного метода у части детей также пытаются объяснить по-разному. Заметим от себя, что, по нашему убеждению, ни один из терапевтических методов, применяемых в медицине, в том числе и неонатологии, не может обладать 100 %-й эффективностью. Но где тот предел эффективности, который позволяет рекомендовать применение того или иного метода в клиническую практику? Хорошо бы ответить на этот вопрос. Вероятно, для разных методов этот предел неодинаковый. Тем не менее, изучение церебральной гипотермии значительно расширяет наши представления о многих патологических процессах у новорожденных детей. Так, в некоторых работах неэффективность церебральной гипотермии пытаются объяснить внутриутробным поражением плода, в частности инфекционного генеза, который можно диагностировать по поражению плаценты (Wintermark P. et al., 2011).
На наш взгляд, данные результаты перекликаются с достаточно давно проведенными исследованиями в нашей стране и за рубежом. И отражают общие закономерности, в том числе встречающиеся и в неонатальной медицине. Например, выяснение механизмов поражения ЦНС при неонатальных гипербилирубинемиях выявило ряд закономерностей. Напомним читателю факт хорошо известный из клинической практики. Хоть возникновение «ядерной желтухи» у новорожденных и зависит от уровня непрямого билирубина (НБ) в плазме крови, но не всегда у детей с одинаковой массой тела, сроком гестации и даже одинаково высоким уровнем билирубина возникает поражение мозга. Большое значение в развитии билирубиновой энцефалопатии имеют факторы риска. Например, факторы, увеличивающие проницаемость гематоэнцефалического барьера, такие как гиперосмолярность, метаболический ацидоз, артериальная гипертензия и т. д. По нашему мнению, должны быть выделены такие же «факторы риска» или «факторы неэффективности» различных методов, применяемых для лечения новорожденных детей. Это может быть одной из приоритетных научных задач неонатологии.
Исследования по применению гипотермии у новорожденных имеют большое значение и для неонатальной фармакологии. Имеются попытки использования различных лекарственных препаратов, усиливающих действие терапевтической гипотермии. Filippi L. et al. (2011) обследовали 19 новорожденных, перенесших тяжелую асфиксию, имевших в структуре постгипоксической энцефалопатии судорожный синдром. Применялась церебральная гипотермия. Им также был назначен фенобарбитал в возрастных дозировках для купирования судорожного синдрома. Оценка фармакодинамики фенобарбитала при охлаждении позволила авторам работы сделать вывод, что пиковые концентрации препарата в крови значительно более высокие, чем у детей с судорожным синдромом, не получавших терапевтическую гипотермию. У охлажденных детей также увеличивался период полураспада препарата, составляя 173,9 ±62,5 часа. На наш взгляд, это необходимо учитывать при проведении терапии охлаждением. Вполне возможно и другие препараты меняют фармакодинамику при охлаждении, что, по нашему мнению, требует дальнейших и более широких исследований.
Конечно, не только фенобарбитал применяется для лечения постгипоксической энцефалопатии. Имеются попытки применения с целью нейропротекции блокаторов ионных каналов (ксенон), антиоксидантов (аллопуринол, индометацин), антивоспалительных цитокинов (эритропоэтин, мелатонин), блокаторов апоптоза (ядерный фактор каппа) и т. д. (Fan X., van Bel F., 2010).
В некоторых клиниках используют пассивную гипотермию (Сурков Д. Н., 2011; Hagmann С. F. et al., 2011), несомненно более щадящий метод, с достаточно выраженным эффектом, в том числе не только при постгипоксической энцефалопатии, но и при ЯНЭК у новорожденных (Hall N. J., et al., 2010). Терапевтическую гипотермию также пытаются применять при других формах неонатальной патологии, например, энцефалитах (Yamada К. et al., 2011). Правда, эффект не очень хороший: у 30 % больных возник отек мозга.
Заманчивость использования температурного фактора как физического лечебного метода поддерживается также положительным опытом смежных отраслей медицины в течение нескольких столетий (общеизвестно увеличение шансов выживания с сохранением функций ЦНС при утоплении в холодной воде, использование гипотермии в кардиохирургии, использование гипертермии при лечении иммунодефицитов и т. п.). Но, как и при применении любого лекарства или метода терапии, важны дозировки, длительность использования, когда и кому его применяют и т. д., так и при использовании церебральной гипотермии должны учитываться способ вхождения и выхода из данного состояния, особенности применения в различные возрастные периоды, сопутствующая патология, факторы риска и т. д.
Хотелось бы, чтобы это в некоторой степени явилось предостережением для врачей нашей страны: может, не будем торопиться с внедрением церебральной гипотермии в наши стационары, тем более что данная методика, как мы уже отмечали выше, у нас в стране уже применялась.
К сожалению, вряд ли в этом вопросе наша страна «останется позади планеты всей». Есть же заинтересованность конкретных фирм, а соответственно, и «заинтересованных» людей… И вот уже в повестку дня многих конгрессов и конференций, проводимых в России, включаются секции типа: «Современные методы оценки церебральных функций и использования гипотермии для защиты мозга новорожденных детей». Как говорил небезызвестный персонаж нашей истории, «процесс пошел». И как говорят представители нынешней «элиты», тяготеющей к англосаксам: «No comments». Комментарии мы дали выше… Конечно, мы не против всестороннего, вдумчивого, кропотливого обследования и последующего обсуждения данных методов. Но, как раз в данном случае, было бы хорошо, чтобы проводимые исследования были рандомизированными и мультицентровыми. Кстати, заметим: выше мы написали «в кардиохирургии»… С другой стороны, имеются рандомизированные исследования (Stocker С. F. et al., 2011) демонстрирующие, что выраженная гипотермия (24 °C) не имеет никаких преимуществ, по сравнению со средней (34 °C), на исходы после корригирующих операции по поводу ВПС. Указанные исследователи оценивали показатели системного воспалительного и иммунного ответов, параметры гемодинамики и коагуляции, органные повреждения. Авторы даже отмечают, что рутинное использование гипотермии не оправдано в педиатрической практике. Так что вопрос о применении гипотермии очень не прост.
Обратим внимание еще на один аспект данной проблемы. По заключению экспертов (Jacobs S. et al., 2007; Shah P. S. et al., 2007), данный метод требует нахождения ребенка в ОРИТ, поскольку дети нуждаются в инотропной поддержке, у них возможно развитие брадикардии, тром-боцитопении, олигурии и т. д. Например, более 60 % детей нуждаются в проведении ИВЛ (Cavallaro G. et al., 2011). Некоторым детям в силу тяжести состояния приходится проводить ЭКМО (Massaro A. et al., 2011). В первой отечественной публикации по пассивной гипотермии у новорожденных с тяжелой постгипоксической энцефалопатией (Сурков Д. Н., 2011) указывается, что все дети нуждаются в проведении ИВЛ. С другой стороны, необходимо также учитывать, что аппаратура для применения активной терапевтической гипотермии достаточно дорога, требует квалифицированного персонала и т. д., поэтому применение данных методик в стационарах первого уровня в нашей стране представляется достаточно проблематичным.
Если же принято решение о проведении терапевтической гипотермия, то нужно помнить, что она должна быть начата не позже шести часов после рождения ребенка. С другой стороны известно, что ребенок, перенесший тяжелую асфиксию, как правило, имеет множественные органные дисфункции, требующие лечения в условиях ОРИТ. Далеко не всегда новорожденные с указанной патологией рождаются в условиях перинатального центра (учреждениях III уровня оказания помощи). Достаточно часто роды происходят в учреждениях первого и/ или второго уровня, и ребенок в последующем нуждается в межгоспитальной транспортировке. В настоящее время общепринятой точкой зрения является та, что новорожденный ребенок, перенесший критическое состояние при рождении, как можно быстрее должен быть переведен в стационар, где ему может быть оказана адекватная и всесторонняя помощь (подробно этот вопрос освящен в нашей монографии «Интенсивная терапия и транспортировка новорожденных детей, 2009»). Как же быть в этой ситуации с терапевтической гипотермией? В конце прошлого десятилетия в США были проведены пилотные исследования, посвященные проведению терапевтической гипотермии новорожденным детям при межгоспитальной транспортировке. На результатах этих исследований мы более подробно остановимся.
В разных странах мира при проведении межгоспитальной транспортировки проводится как «пассивная» гипотермия (отключение источника лучистого тепла), так и «активная» (церебральная). Указывают (Hallberg В. et al., 2009), что применение пассивной гипотермии часто (более чем у 50 %) приводит к переохлаждению новорожденных. Учитывая это обстоятельство, американские коллеги (Fairchild К. et al., 2010) провели активную гипотермию во время межгоспитальной транспортировки (из госпиталя I или II уровня в стационар III уровня оказания помощи новорожденным). У них имеется опыт применения гипотермии у 40 младенцев, перенесших тяжелую постгипоксическую энцефалопатию. У пяти детей гипотермия применялась только в отправляющем госпитале, у двух новорожденных во время трансфера проводилась «пассивная» гипотермия, у 33 младенцев – активная. Значения ректальной температуры у этих детей представлены на рисунке 4.
Таблица 3
Клиническая характеристика и лабораторные показатели у детей, получавших гипотермию во время межгоспитальной транспортировки (Fairchild К. et al., 2010)


Рис. 4. Сравнение ректальной температуры у 40 новорожденных до и после межгоспитальной транспортировки (Fairchild К. et al., 2010)
Клиническая характеристика детей, получавших гипотермию во время транспортировки, представлена в таблице 3. Дети были разделены на группы по степени возникшей гипотермии. Авторы отмечают, что только у одного ребенка была отмечена синусовая брадикардия. У детей с максимальной степенью охлаждения выявлена корреляция с весом при рождении, склонностью к тромбоцитопении и гипергликемии. Таким образом, и в данном исследовании отмечена достаточно высокая частота осложнений у новорожденных детей, подвергшихся охлаждению.
Некоторые исследователи (Сурков Д. Н., 2011) считают, что гипотермия может быть рекомендована в первые 72 часа жизни после перенесенной тяжелой асфиксии, поскольку именно в этот промежуток времени начинается некроз и усиливается апоптоз нейронов. По этим данным, даже при более позднем начале пассивной гипотермии (до 72 часов жизни) неврологические результаты у детей были лучше, чем без проведения гипотермии. Но чем позднее начата гипотермия, тем ниже ее эффективность.
Вот такое большое отступление получилось в связи с достаточно широким применением церебральной гипотермии у новорожденных детей в настоящее время. Хотя, наверное, и не отступление, поскольку сегодняшний день неразрывно связан с прошлым. Как говорил У. Черчилль: «Если мы поссорим прошлое с настоящим, то потеряем будущее».
Возвращаясь к историческим аспектам применения гипотермии, можно отметить, что в большинстве стран применение гипотермии у новорожденных продолжалось относительно недолго. Роли теплового режима и влажности в инкубаторе были тщательно изучены в 1957 г. Сильверманом В.
У детей, помещенных в инкубатор с высокой влажностью, отмечалась более низкая смертность. В последующих исследованиях было показано, что при повышении температуры в инкубаторе всего лишь на 1,5 °C (с 28 до 29,5 °C) выживаемость увеличилась на 22 % (с 61 до 83 %), особенно эта разница в выживании проявилась у маловесных детей.
После этих, ставших уже классическими работ, проведены многочисленные исследования, подтвердившие огромную роль поддержания теплового баланса у новорожденных детей. На наш взгляд, в России в настоящее время вопросам теплового баланса у новорожденных, особенно при длительной межгоспитальной транспортировке, уделяется мало внимания. К сожалению, у нас в стране иногда начинают внедрять дорогостоящее методы лечения, которые, безусловно, показаны очень небольшому количеству больных, например ЭКМО (Tobin М. J., 2003), из-за большого количества осложнений, или же ВчИВЛ (Johnson А. Н. et al., 2002), тратя на это десятки, а то и сотни тысяч долларов США. Вместо того чтобы купить хороший транспортный кувез и средства доставки из роддома в отделения больницы всего потока больных детей.
Конечно, может иногда и нужно вентилировать новорожденного ребенка с помощью ВчИВЛ или применять ЭКМО, но лучше не доводить его до такого состояния, в частности, переохлаждением, когда ему такая вентиляция понадобится.
Глава 2 Теплорегуляция у новорожденных
2.1. Общие вопросы теплорегуляции
Теплорегуляция – это поддержание баланса между потерями тепла и теплопродукцией. К концу XIX столетия стало ясно (Landois L., Rosemann R., 1900), что высвобождающаяся при биологическом окислении (сгорании) энергия питательных веществ (или при голодании материал, отдаваемый самим организмом) превращается в тепло. В настоящее время понятно, что тепло – «побочный продукт» метаболических процессов, и хотя скорость биологического окисления возрастает при увеличении температуры и, следовательно, увеличивается теплообразование, но в норме температура тела остается стабильной. Это вызвано тем, что прирост температуры тела приводит к увеличению отдачи тепла организмом. То есть, как и при рассмотрении любого физиологического процесса, мы видим удивительное сохранение баланса, в данном случае баланса между теплопродукцией и теплоотдачей, позволяющего организму сохранять относительно постоянную температуру тела.
Суммарная теплопродукция в организме происходит тремя способами. Сразу же оговоримся, существует еще и четвертый – основной обмен, но в данной монографии вопросов, связанных с ним, мы практически касаться не будем. Единственное, отметим: основной обмен – величина постоянная и не может быть изменена. Итак, три способа теплопродукции:
1. «Сократительный (дрожательный) термогенез» (холодовая мышечная дрожь) – с помощью усиления непроизвольной мышечной активности (сокращения с частотой 10–20 раз в секунду скелетных мышц). У новорожденных этот механизм развит плохо, хотя у взрослых именно он является наиболее значимым для дополнительного теплообразования. Сокращение мышц способно за несколько минут повысить величину теплопродукции в 4–5 раз, поскольку никакой полезной работы при «мышечной дрожи» не совершается, то вся энергия, получаемая в результате «данной работы» остается в организме в виде тепла. Эта реакция используется организмом только тогда, когда нужно очень быстро повысить температуру тела. Хотя «сократительный» термогенез уже очень давно признан важным механизмом повышения температуры тела, и его значимость доказана в большом количестве экспериментальных и клинических исследований, конкретные центральные механизмы генерации «дрожания» практически неизвестны (Palmes Е. D., Park С. R., 1962; Saper С. В., Breder С. D., 1994; Morrison S. F., Nakamura K., 2011). Новорожденные дети включают механизм дрожательного термогенеза только при предельных температурах охлаждения. Связывают (Аршавский И. А., 1969) это с тем, что у них имеется существенно более высокий уровень постоянной тонической мышечной активности (гипертонус), выполняющий терморегуляционную функцию, повышая порог дрожательного рефлекса.
2. «Несократительный термогенез» – теплообразование, не связанное с мышечной активностью, то есть продуцирование тепла в результате увеличения скорости обмена веществ и, следовательно, увеличение потребления кислорода организмом. Основным источником образования такого тепла у новорожденных детей является бурый жир. Это очень интересная ткань, изучение которой в настоящее время интенсивно продолжается. Но об этом ниже.

Рис. 5. Конрад Гесснер (1516–1565)
Бурая жировая ткань открыта в 1551 году великим швейцарским ученым Конрадом Гесснером (рис. 5). Несколько слов о К. Гесснере. Он был ученым-энциклопедистом, одним из первых попытавшимся систематизировать накопленные к тому времени сведения о животных и растениях. Научные интересы К. Геснера были чрезвычайно широки и касались филологии, фармакологии, медицины, минералогии, зоологии, ботаники, библиографии. Ему принадлежит одна из первых попыток классификации растений (Enchiridion historiae plantarum, 1541). Он разделил растительное царство, основываясь на признаках цветка и семени; отделил класс, порядок, род и вид, наметив тем самым принципы бинарной номенклатуры. Кроме того, К. Гесснер является одним из основоположников ботанической иллюстрации, сделав сотни рисунков растений и животных. Ученый впервые описал все 130 языков, существовавших в Европе его времени, а своей книгой «Всеобщая библиотека» (1545–1555) заложил основы библиографии (Cannon В., Nedergaard J., 2008).
К. Гесснер описал бурую жировую ткань в межлопаточной области, как «ни жир, ни плоть (мышцы)». Интересно, что через 460 лет, анализируя работу К. Гесснера, В. Cannon и J. Nedergaard (2008) отмечают, что он был абсолютно прав и по своим функциям «бурые и белые адипоциты действительно различны. Клетки бурого жира на самом деле более “телесны”, чем это предполагалось ранее». Необходимо отметить, что происхождение белых жировых клеток и бурых разное. Если первые происходят из боковой мезодермы, то вторые – миобластного происхождения – из параксиальной мезодермы (Atit R. et al., 2006). Некоторые исследователи (Barbatelli G. et al., 2010) в экспериментальных работах показали, что белый адипоцит может трансформироваться в бурый. Они могут появляться в белой жировой ткани в ответ на холод или стимуляцию катехоламинами (Young P. et al., 1984; Cousin В. et al., 1992).
До начала XIX века бурую жировую ткань расценивали как часть тимуса. Позже, к концу XIX века, ее стали считать измененной формой жировой ткани с эндокринными свойствами. И только в середине XX века стало понятно, что это «центральная» ткань, обеспечивающая «несократительный термогенез».
У зародыша человека бурая жировая ткань появляется на пятом месяце гестации (Merklin R. J., 1974). Бурый жир составляет от 2 до 6 % массы тела новорожденных, расположен подкожно, между лопатками, в виде небольших отложений вокруг мышц и кровеносных сосудов шеи, щеках (комочки Биша), а также в большом количестве в подмышечных впадинах. Более глубокие отложения – в переднем средостении, вдоль позвоночника, вокруг почек, надпочечников, аорты. По сравнению с белой жировой тканью, васкуляризация бурой в 4–6 раз больше. Она очень хорошо иннервирована. На бурых адипоцитах находится большое количество норадреналиновых рецепторов, а также симпатические норадренергические нервные окончания. Несколько адипоцитов со смежными капиллярами и нервом составляют долю, окруженную толстыми соединительнотканными структурами.
Молекула, ответственная за термогенез, называется несцепленным белком 1 (UCP-1), расположенным во внутренней мембране митохондрий. Ранее его называли «термогенин». Его количество составляет примерно 5 % от общего количества белка, находящегося в митохондриях бурого адипоцита (Stuart J. A. et al., 2001). Точный механизм активации UCP-1 жирными кислотами не известен. Считают (Cannon В., Nedergaard J., 2004), что жирные кислоты могут функционировать как кофакторы или аллостерические регуляторы. Термогенез бурой жировой ткани увеличивается через индукцию UCP-1 катехоламинами или гормонами щитовидной железы (Cannon В., Nedergaard J., 2010). Зная это, становится понятным еще один механизм, делающий недоношенных, особенно детей с ЭНМТ, склонными к развитию гипотермии. Ниже мы еще раз вернемся к рассмотрению этого механизма развития гипотермии у глубоконедоношенных детей. Апоптоз бурых адипоцитов увеличивает ФНОа (Hotamisligil G. S., 1999). Забегая чуть-чуть вперед, эти сведения нам пригодятся чуть позже, отметим, что при ожирении содержание ФНОа в жировой ткани повышено (Hotamisligil G. S., 1999).
Окисление жирных кислот в бурой жировой ткани осуществляется без значимого синтеза макроэргов и, таким образом, с максимально возможным образованием теплоты (рис. 6). Посредством механизмов несократительного термогенеза, уровень теплопродукции у человека может быть увеличен примерно в 3 раза по сравнению с уровнем основного обмена (50 г бурого жира могут обеспечить 20 % обмена) (Cypess А. М. et al., 2009). Но у детей, особенно недоношенных, запасы бурого жира невелики, поэтому увеличить теплопродукцию несократительным термогенезом с участием бурой жировой ткани они не могут (Nedergaard J. et al., 2007; Cypess A. M. et al., 2009).
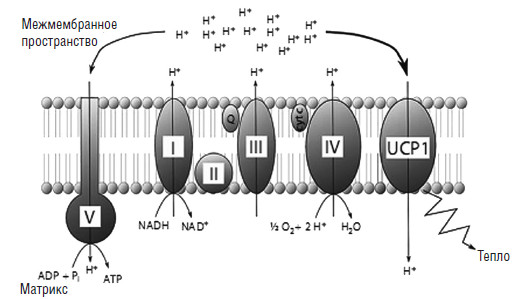
Рис. 6. Схематическое изображение дыхательной цепи митохондрий (Tews D., Wabitsch М., 2011)
В митохондриях активированных бурых адипоцитов, протонный градиент установлен дыхательной цепью несцепленного белка 1 (UCP-1). Это приводит к продукции тепловой энергии вместо производства АТФ. I – NADH дегидрогеназа, II – циксинат дегидрогеназа, III – комплекс цитохрома bc1, IV – цитохром с оксидаза, V – АТФ-синтаза, Q – убихинон, cyt с – цитохром С
Интересно, что в некоторых экспериментальных исследованиях установлено (Madden С. J., Morrison S. F., 2005), что артериальная гипоксемия блокирует окисление жирных кислот в адипоцитах бурой жировой ткани. Кроме того, у животных отмечалось снижение АД, урежение ЧСС (рис. 7). Возможно, это объясняет склонность новорожденных детей, перенесших гипоксию к гипотермии. С другой стороны, эндотоксин увеличивает окисление, приводя к возникновению гипертермии (Sarkar S. et al., 2007).
До 80-х годов прошлого века считали, что бурая жировая ткань регрессирует с возрастом и у взрослых людей не существует. Затем было установлено, что бурая жировая ткань и белок UCP-1 присутствует у взрослых (Lean М. Е. et al., 1986; Bouillaud F. et al., 1988). Она была обнаружена у больных с катехоламин-секретирующими опухолями, такими как феохромоцитомы и параганглиомы, в которых развиваются клетки бурой жировой ткани (Ricquier D. et al., 1982; Fukuchi К. et al., 2004). Далее (Virtanen К. A. et al., 2009; Van Marken Lichtenbelt W. D. et al., 2009) было продемонстрировано, что бурая жировая ткань присутствует у человека во все периоды жизни. Находится она на шее, паравертебрально, окружает надпочечники. У женщин ее в два раза больше, чем у мужчин. Ее количество увеличивается во время осени и зимы (Au-Yong I. Т. Н. et al., 2009).
Суммарная теплопродукция в организме происходит тремя способами. Сразу же оговоримся, существует еще и четвертый – основной обмен, но в данной монографии вопросов, связанных с ним, мы практически касаться не будем. Единственное, отметим: основной обмен – величина постоянная и не может быть изменена. Итак, три способа теплопродукции:
1. «Сократительный (дрожательный) термогенез» (холодовая мышечная дрожь) – с помощью усиления непроизвольной мышечной активности (сокращения с частотой 10–20 раз в секунду скелетных мышц). У новорожденных этот механизм развит плохо, хотя у взрослых именно он является наиболее значимым для дополнительного теплообразования. Сокращение мышц способно за несколько минут повысить величину теплопродукции в 4–5 раз, поскольку никакой полезной работы при «мышечной дрожи» не совершается, то вся энергия, получаемая в результате «данной работы» остается в организме в виде тепла. Эта реакция используется организмом только тогда, когда нужно очень быстро повысить температуру тела. Хотя «сократительный» термогенез уже очень давно признан важным механизмом повышения температуры тела, и его значимость доказана в большом количестве экспериментальных и клинических исследований, конкретные центральные механизмы генерации «дрожания» практически неизвестны (Palmes Е. D., Park С. R., 1962; Saper С. В., Breder С. D., 1994; Morrison S. F., Nakamura K., 2011). Новорожденные дети включают механизм дрожательного термогенеза только при предельных температурах охлаждения. Связывают (Аршавский И. А., 1969) это с тем, что у них имеется существенно более высокий уровень постоянной тонической мышечной активности (гипертонус), выполняющий терморегуляционную функцию, повышая порог дрожательного рефлекса.
2. «Несократительный термогенез» – теплообразование, не связанное с мышечной активностью, то есть продуцирование тепла в результате увеличения скорости обмена веществ и, следовательно, увеличение потребления кислорода организмом. Основным источником образования такого тепла у новорожденных детей является бурый жир. Это очень интересная ткань, изучение которой в настоящее время интенсивно продолжается. Но об этом ниже.

Рис. 5. Конрад Гесснер (1516–1565)
Бурая жировая ткань открыта в 1551 году великим швейцарским ученым Конрадом Гесснером (рис. 5). Несколько слов о К. Гесснере. Он был ученым-энциклопедистом, одним из первых попытавшимся систематизировать накопленные к тому времени сведения о животных и растениях. Научные интересы К. Геснера были чрезвычайно широки и касались филологии, фармакологии, медицины, минералогии, зоологии, ботаники, библиографии. Ему принадлежит одна из первых попыток классификации растений (Enchiridion historiae plantarum, 1541). Он разделил растительное царство, основываясь на признаках цветка и семени; отделил класс, порядок, род и вид, наметив тем самым принципы бинарной номенклатуры. Кроме того, К. Гесснер является одним из основоположников ботанической иллюстрации, сделав сотни рисунков растений и животных. Ученый впервые описал все 130 языков, существовавших в Европе его времени, а своей книгой «Всеобщая библиотека» (1545–1555) заложил основы библиографии (Cannon В., Nedergaard J., 2008).
К. Гесснер описал бурую жировую ткань в межлопаточной области, как «ни жир, ни плоть (мышцы)». Интересно, что через 460 лет, анализируя работу К. Гесснера, В. Cannon и J. Nedergaard (2008) отмечают, что он был абсолютно прав и по своим функциям «бурые и белые адипоциты действительно различны. Клетки бурого жира на самом деле более “телесны”, чем это предполагалось ранее». Необходимо отметить, что происхождение белых жировых клеток и бурых разное. Если первые происходят из боковой мезодермы, то вторые – миобластного происхождения – из параксиальной мезодермы (Atit R. et al., 2006). Некоторые исследователи (Barbatelli G. et al., 2010) в экспериментальных работах показали, что белый адипоцит может трансформироваться в бурый. Они могут появляться в белой жировой ткани в ответ на холод или стимуляцию катехоламинами (Young P. et al., 1984; Cousin В. et al., 1992).
До начала XIX века бурую жировую ткань расценивали как часть тимуса. Позже, к концу XIX века, ее стали считать измененной формой жировой ткани с эндокринными свойствами. И только в середине XX века стало понятно, что это «центральная» ткань, обеспечивающая «несократительный термогенез».
У зародыша человека бурая жировая ткань появляется на пятом месяце гестации (Merklin R. J., 1974). Бурый жир составляет от 2 до 6 % массы тела новорожденных, расположен подкожно, между лопатками, в виде небольших отложений вокруг мышц и кровеносных сосудов шеи, щеках (комочки Биша), а также в большом количестве в подмышечных впадинах. Более глубокие отложения – в переднем средостении, вдоль позвоночника, вокруг почек, надпочечников, аорты. По сравнению с белой жировой тканью, васкуляризация бурой в 4–6 раз больше. Она очень хорошо иннервирована. На бурых адипоцитах находится большое количество норадреналиновых рецепторов, а также симпатические норадренергические нервные окончания. Несколько адипоцитов со смежными капиллярами и нервом составляют долю, окруженную толстыми соединительнотканными структурами.
Молекула, ответственная за термогенез, называется несцепленным белком 1 (UCP-1), расположенным во внутренней мембране митохондрий. Ранее его называли «термогенин». Его количество составляет примерно 5 % от общего количества белка, находящегося в митохондриях бурого адипоцита (Stuart J. A. et al., 2001). Точный механизм активации UCP-1 жирными кислотами не известен. Считают (Cannon В., Nedergaard J., 2004), что жирные кислоты могут функционировать как кофакторы или аллостерические регуляторы. Термогенез бурой жировой ткани увеличивается через индукцию UCP-1 катехоламинами или гормонами щитовидной железы (Cannon В., Nedergaard J., 2010). Зная это, становится понятным еще один механизм, делающий недоношенных, особенно детей с ЭНМТ, склонными к развитию гипотермии. Ниже мы еще раз вернемся к рассмотрению этого механизма развития гипотермии у глубоконедоношенных детей. Апоптоз бурых адипоцитов увеличивает ФНОа (Hotamisligil G. S., 1999). Забегая чуть-чуть вперед, эти сведения нам пригодятся чуть позже, отметим, что при ожирении содержание ФНОа в жировой ткани повышено (Hotamisligil G. S., 1999).
Окисление жирных кислот в бурой жировой ткани осуществляется без значимого синтеза макроэргов и, таким образом, с максимально возможным образованием теплоты (рис. 6). Посредством механизмов несократительного термогенеза, уровень теплопродукции у человека может быть увеличен примерно в 3 раза по сравнению с уровнем основного обмена (50 г бурого жира могут обеспечить 20 % обмена) (Cypess А. М. et al., 2009). Но у детей, особенно недоношенных, запасы бурого жира невелики, поэтому увеличить теплопродукцию несократительным термогенезом с участием бурой жировой ткани они не могут (Nedergaard J. et al., 2007; Cypess A. M. et al., 2009).

Рис. 6. Схематическое изображение дыхательной цепи митохондрий (Tews D., Wabitsch М., 2011)
В митохондриях активированных бурых адипоцитов, протонный градиент установлен дыхательной цепью несцепленного белка 1 (UCP-1). Это приводит к продукции тепловой энергии вместо производства АТФ. I – NADH дегидрогеназа, II – циксинат дегидрогеназа, III – комплекс цитохрома bc1, IV – цитохром с оксидаза, V – АТФ-синтаза, Q – убихинон, cyt с – цитохром С
Интересно, что в некоторых экспериментальных исследованиях установлено (Madden С. J., Morrison S. F., 2005), что артериальная гипоксемия блокирует окисление жирных кислот в адипоцитах бурой жировой ткани. Кроме того, у животных отмечалось снижение АД, урежение ЧСС (рис. 7). Возможно, это объясняет склонность новорожденных детей, перенесших гипоксию к гипотермии. С другой стороны, эндотоксин увеличивает окисление, приводя к возникновению гипертермии (Sarkar S. et al., 2007).
До 80-х годов прошлого века считали, что бурая жировая ткань регрессирует с возрастом и у взрослых людей не существует. Затем было установлено, что бурая жировая ткань и белок UCP-1 присутствует у взрослых (Lean М. Е. et al., 1986; Bouillaud F. et al., 1988). Она была обнаружена у больных с катехоламин-секретирующими опухолями, такими как феохромоцитомы и параганглиомы, в которых развиваются клетки бурой жировой ткани (Ricquier D. et al., 1982; Fukuchi К. et al., 2004). Далее (Virtanen К. A. et al., 2009; Van Marken Lichtenbelt W. D. et al., 2009) было продемонстрировано, что бурая жировая ткань присутствует у человека во все периоды жизни. Находится она на шее, паравертебрально, окружает надпочечники. У женщин ее в два раза больше, чем у мужчин. Ее количество увеличивается во время осени и зимы (Au-Yong I. Т. Н. et al., 2009).
