Страница:
Смешанные вазодилататоры рекомендуется использовать при тяжелой недостаточности кровообращения, перегрузке малого круга и низком сердечном индексе (например, при дилатационных кардиомиопатиях, постинфарктном кардиосклерозе, поздних стадиях недостаточности аортального или митрального клапана).
Периферические вазодилататоры всех групп противопоказаны больным с резко выраженным митральным и (или) аортальным стенозом, так как в этих случаях снижение притока крови к сердцу и снижение общего периферического сопротивления ухудшает условия работы левого желудочка и состояние больных.
Для улучшения сократительной функции сердца применяют сердечные гликозиды; обычно их назначают больным при ХСН ПА стадии.
Выбор оптимального сердечного гликозида для лечения конкретного больного представляет собой важную задачу и основывается на ряде принципов:
а) внутривенное назначение гликозидов (строфантин, дигоксин, коргликон) должно ограничиваться лишь случаями обострения ХСН, когда эффект необходимо получить немедленно; в остальных случаях лечение лучше начинать с перорального приема дигоксина, дигитоксина или изоланида;
б) при далеко зашедшей ХСН и выраженных изменениях пищеварительного тракта, целесообразно вводить гликозиды внутривенно, так как принятый внутрь препарат плохо всасывается из пищеварительного тракта и усиливает диспепсические явления. Так как в дальнейшем предстоит перевод больного на прием препарата внутрь, то рекомендуется начинать лечение с внутривенного введения дигоксина;
в) при сочетании ХСН с мерцательной аритмией, трепетанием предсердий следует назначать дигоксин, изоланид – средства, замедляющие атриовентрикулярную проводимость;
г) после назначения гликозида и получения терапевтического эффекта следует перевести больного на поддерживающие дозы того же препарата.
Сердечные гликозиды далеко не во всех случаях позволяют добиться желаемого терапевтического эффекта, особенно у больных с тяжелыми поражениями миокарда (пороки сердца, кардиомиопатии, постинфарктный кардиосклероз). Нередко гликозиды вызывают интоксикацию (тошнота, рвота, потеря аппетита, эктопические аритмии); они неприменимы при брадикардии, нарушениях проводимости (особенно атриовентрикулярной).
Следует отметить, что сердечные гликозиды наиболее эффективны у больных ХСН, имеющих тахиаритмическую форму мерцания.
Нормализация водно-солевого обмена достигается назначением мочегонных препаратов. Существуют разные группы препаратов, применение которых зависит от выраженности ХСН и индивидуальной реакции на них больного.
В I стадии диуретики не назначают. При ХСН IIA стадии применяют тиазидные (дихлотиазид, или гипотиазид) или нетиазидные (клопамид, или бринальдикс) препараты. Частое применение этих средств может нарушить электролитный обмен (гипокалиемия и гипонатриемия), в связи с чем целесообразно комбинировать эти препараты с триамтереном (птерофен) – средством, оказывающим мочегонный эффект за счет обмена ионов натрия на ионы калия и водорода в дистальной части канальца нефрона, что обусловливает сохранение в организме запасов калия.
Комплексный препарат триампур (12,5 мг гипотиазида и 25 мг триамтерена) по силе своего действия вполне подходит для больных с ХСН НА стадии. Он не вызывает форсированного диуреза и не приводит к значительным сдвигам в электролитном обмене.
Если такая мочегонная терапия недостаточно эффективна, то следует назначать фуросемид или этакриновую кислоту (урегит). Дозы диуретиков не должны быть слишком большими, чтобы не вызвать форсированного диуреза и появления вторичного гиперальдостеронизма. Рекомендуется начинать с небольших доз: фуросемид 20 мг/сут, урегит – 25 мг/сут.
При ХСН II Б стадии, сопровождающейся выраженным отечным синдромом и трудно поддающейся терапии, следует использовать фуросемид или урегит в сочетании с калийсберегающими препаратами (триамтерен, верошпирон). Если такая комбинация мочегонных окажется недостаточно эффективной, то следует сочетать фуросемид с урегитом и с теми же калийсберегающими препаратами.
При рефрактерном отечном синдроме решающим фактором может оказаться включение в терапию осмотических диуретиков (маннит, или маннитол), блокирующих реабсорбцию натрия и воды в проксимальной части канальцев нефрона, снижающих сопротивление почечных сосудов, улучшающих почечный кровоток. Увеличивая «загрузку» натрием нижележащих отделов нефрона, они повышают эффективность других диуретиков (прежде всего фуросемида и урегита).
После достижения эффекта от мочегонных препаратов следует назначить препараты калия и перейти к поддерживающей диуретической терапии, смысл которой заключается в том, чтобы количество принятой жидкости было равно количеству выделенной (масса тела должна оставаться стабильной).
В последние годы при лечении ХСН стали использовать B-адреноблокаторы, которые блокируют САС и опосредованно – РААС, что делает патогенетически оправданным их применение. Кроме того, B-адреноблокаторы уменьшают ЧСС и потребление кислорода миокардом, снижают токсическое влияние катехоламинов на миокард, оказывают антиаритмическое действие. Для преодоления побочных реакций (снижение сократительной функции миокарда и развитие гипотонии) следует применять эти препараты в малых дозах – метопролол 12,5—25 мг/сут, атенолол 25–50 мг/сут. Особенно эффективны B-адреноблокаторы при лечении больных с синусовой тахикардией и мерцательной аритмией, не поддающейся адекватному контролю сердечными гликозидами.
Прогрессирование ХСН сопровождается усугублением различных видов метаболических нарушений в организме. В связи с этим целесообразно назначать средства, корригирующие нарушение обмена веществ, оксигенотерапию. Используют анаболические стероиды: метандростенолол (неробол) по 10–30 мг внутрь ежедневно в течение 1 месяца, ретаболил – 50 мг внутримышечно 1 раз в 7—10 дней (всего 6–8 инъекций).
Кроме анаболических стероидов, можно назначить комплексные препараты (драже ундевит, таблетки декамевит, драже гендевит, центрум, витрум, витамакс, биовиталь, гериатрик фарматон), содержащие основные витамины. Их назначают месячными курсами.
ИНФАРКТ МИОКАРДА
Периферические вазодилататоры всех групп противопоказаны больным с резко выраженным митральным и (или) аортальным стенозом, так как в этих случаях снижение притока крови к сердцу и снижение общего периферического сопротивления ухудшает условия работы левого желудочка и состояние больных.
Для улучшения сократительной функции сердца применяют сердечные гликозиды; обычно их назначают больным при ХСН ПА стадии.
Выбор оптимального сердечного гликозида для лечения конкретного больного представляет собой важную задачу и основывается на ряде принципов:
а) внутривенное назначение гликозидов (строфантин, дигоксин, коргликон) должно ограничиваться лишь случаями обострения ХСН, когда эффект необходимо получить немедленно; в остальных случаях лечение лучше начинать с перорального приема дигоксина, дигитоксина или изоланида;
б) при далеко зашедшей ХСН и выраженных изменениях пищеварительного тракта, целесообразно вводить гликозиды внутривенно, так как принятый внутрь препарат плохо всасывается из пищеварительного тракта и усиливает диспепсические явления. Так как в дальнейшем предстоит перевод больного на прием препарата внутрь, то рекомендуется начинать лечение с внутривенного введения дигоксина;
в) при сочетании ХСН с мерцательной аритмией, трепетанием предсердий следует назначать дигоксин, изоланид – средства, замедляющие атриовентрикулярную проводимость;
г) после назначения гликозида и получения терапевтического эффекта следует перевести больного на поддерживающие дозы того же препарата.
Сердечные гликозиды далеко не во всех случаях позволяют добиться желаемого терапевтического эффекта, особенно у больных с тяжелыми поражениями миокарда (пороки сердца, кардиомиопатии, постинфарктный кардиосклероз). Нередко гликозиды вызывают интоксикацию (тошнота, рвота, потеря аппетита, эктопические аритмии); они неприменимы при брадикардии, нарушениях проводимости (особенно атриовентрикулярной).
Следует отметить, что сердечные гликозиды наиболее эффективны у больных ХСН, имеющих тахиаритмическую форму мерцания.
Нормализация водно-солевого обмена достигается назначением мочегонных препаратов. Существуют разные группы препаратов, применение которых зависит от выраженности ХСН и индивидуальной реакции на них больного.
В I стадии диуретики не назначают. При ХСН IIA стадии применяют тиазидные (дихлотиазид, или гипотиазид) или нетиазидные (клопамид, или бринальдикс) препараты. Частое применение этих средств может нарушить электролитный обмен (гипокалиемия и гипонатриемия), в связи с чем целесообразно комбинировать эти препараты с триамтереном (птерофен) – средством, оказывающим мочегонный эффект за счет обмена ионов натрия на ионы калия и водорода в дистальной части канальца нефрона, что обусловливает сохранение в организме запасов калия.
Комплексный препарат триампур (12,5 мг гипотиазида и 25 мг триамтерена) по силе своего действия вполне подходит для больных с ХСН НА стадии. Он не вызывает форсированного диуреза и не приводит к значительным сдвигам в электролитном обмене.
Если такая мочегонная терапия недостаточно эффективна, то следует назначать фуросемид или этакриновую кислоту (урегит). Дозы диуретиков не должны быть слишком большими, чтобы не вызвать форсированного диуреза и появления вторичного гиперальдостеронизма. Рекомендуется начинать с небольших доз: фуросемид 20 мг/сут, урегит – 25 мг/сут.
При ХСН II Б стадии, сопровождающейся выраженным отечным синдромом и трудно поддающейся терапии, следует использовать фуросемид или урегит в сочетании с калийсберегающими препаратами (триамтерен, верошпирон). Если такая комбинация мочегонных окажется недостаточно эффективной, то следует сочетать фуросемид с урегитом и с теми же калийсберегающими препаратами.
При рефрактерном отечном синдроме решающим фактором может оказаться включение в терапию осмотических диуретиков (маннит, или маннитол), блокирующих реабсорбцию натрия и воды в проксимальной части канальцев нефрона, снижающих сопротивление почечных сосудов, улучшающих почечный кровоток. Увеличивая «загрузку» натрием нижележащих отделов нефрона, они повышают эффективность других диуретиков (прежде всего фуросемида и урегита).
После достижения эффекта от мочегонных препаратов следует назначить препараты калия и перейти к поддерживающей диуретической терапии, смысл которой заключается в том, чтобы количество принятой жидкости было равно количеству выделенной (масса тела должна оставаться стабильной).
В последние годы при лечении ХСН стали использовать B-адреноблокаторы, которые блокируют САС и опосредованно – РААС, что делает патогенетически оправданным их применение. Кроме того, B-адреноблокаторы уменьшают ЧСС и потребление кислорода миокардом, снижают токсическое влияние катехоламинов на миокард, оказывают антиаритмическое действие. Для преодоления побочных реакций (снижение сократительной функции миокарда и развитие гипотонии) следует применять эти препараты в малых дозах – метопролол 12,5—25 мг/сут, атенолол 25–50 мг/сут. Особенно эффективны B-адреноблокаторы при лечении больных с синусовой тахикардией и мерцательной аритмией, не поддающейся адекватному контролю сердечными гликозидами.
Прогрессирование ХСН сопровождается усугублением различных видов метаболических нарушений в организме. В связи с этим целесообразно назначать средства, корригирующие нарушение обмена веществ, оксигенотерапию. Используют анаболические стероиды: метандростенолол (неробол) по 10–30 мг внутрь ежедневно в течение 1 месяца, ретаболил – 50 мг внутримышечно 1 раз в 7—10 дней (всего 6–8 инъекций).
Кроме анаболических стероидов, можно назначить комплексные препараты (драже ундевит, таблетки декамевит, драже гендевит, центрум, витрум, витамакс, биовиталь, гериатрик фарматон), содержащие основные витамины. Их назначают месячными курсами.
Прогноз
Возможность излечения основного заболевания (например, эффективное хирургическое лечение порока сердца) значительно улучшает прогноз. Больные с ХСН I стадии трудоспособны, но тяжелый физический труд им противопоказан. При II A стадии трудоспособность ограничена или утрачена, II Б стадии – утрачена. Больные с ХСН III стадии нуждаются в постоянном уходе.Профилактика
Предупреждение развития сердечной недостаточности достигается систематическим лечением заболеваний сердца (в том числе хирургическим), а также созданием адекватного состоянию больного режима труда и быта, правильным питанием, категорическим отказом от приема алкоголя и курения.
ИНФАРКТ МИОКАРДА
Инфаркт миокарда – это острый некроз участка сердечной мышцы, возникающий вследствие абсолютной или относительной недостаточности его кровоснабжения.
В подавляющем большинстве случаев (97 %) непосредственной причиной инфаркта миокарда является тромботическая окклюзия коронарных артерий.
Исключение составляет инфаркт миокарда, вызванный длительным спазмом коронарных артерий, резким и продолжительным повышение потребности миокарда в кислороде. Известны случаи развития инфаркта миокарда при травме, артериите, аномалии, расслоении, эмболии коронарных артерий, заболеваниях крови, пороках сердца, особенно аортальных, расслаивающей аневризме аорты, тиреотоксикозе, тяжелой гипоксии, анемии и других заболеваниях и состояниях.
Подавляющее большинство летальных исходов при инфаркте миокарда развиваются в первые часы заболевания на догоспитальном этапе. Из общего числа заболевших каждый четвертый погибает в течение первых шести часов от начала сердечного приступа.
Выделяют несколько вариантов начала инфаркта миокарда: ангинозный, аритмический, цереброваскулярный, астматический, абдоминальный, малосимптомный (безболевой).
Ангинозный – самый частый вариант дебюта инфаркта миокарда. Характер ангинозной боли при инфаркте миокарда аналогичен таковому при стенокардии. Больные описывают возникающие ощущения как сильное сжатие, сдавление, тяжесть («стянуло обручем, сжало тисками»). При большой интенсивности боль воспринимается как «кинжальная», раздирающая, разрывающая, жгучая, палящая, как «кол в грудной клетке». Болевые ощущения протекают волнообразно, периодически уменьшаясь, но не прекращаясь полностью. С каждой новой волной приступы усиливаются, быстро достигают максимума, а затем ослабевают, и промежутки между ними удлиняются. Локализация ангинозной боли – обычно за грудиной в глубине грудной клетки, реже – в левой половине грудной клетки или в надчревной области. Иногда эпицентр боли смещается в правую половину грудной клетки, шею, нижнюю челюсть. Иррадиирует ангинозная боль, как правило, в левую лопатку, плечо, предплечье, кисть. Чаще, чем при стенокардии, боль широко отражается в обе лопатки, оба плеча и предплечья, надчревную область, шею, нижнюю челюсть, причем иррадиацию в шею и обе лопатки считают более специфичной.
Начало ангинозной боли при инфаркте миокарда – внезапное, часто в утренние часы, длительность – несколько часов.
Окончание боли. Повторный сублингвальный прием нитроглицерина не устраняет боль полностью, но может ее несколько ослабить.
Особенности ангинозного болевого синдрома при инфаркте миокарда зависят от локализации и течения заболевания, фона, на котором оно развивается, и возраста больного. У 90 % молодых больных ангинозный статус проявляется ярко. Боли часто носят сжимающий, сверлящий, режущий, жгучий характер, трудно поддаются терапии, рецидивируют. Напротив, у 30 % больных пожилого и старческого возраста типичная загрудинная боль вообще не наблюдается.
К аритмическому варианту заболевания относят случаи, когда инфаркт миокарда начинается с острых нарушений ритма или проводимости сердца при отсутствии боли. Чаще аритмический вариант проявляется фибрилляцией желудочков, реже – аритмическим шоком, обусловленным пароксизмом тахикардии (тахиаритмии) или острой брадикардией. Нередко аритмический вариант клинически дает знать о себе обмороком.
Цереброваскулярный вариант наблюдается у больных с отягощенным неврологическим анамнезом и развивается на фоне значительного снижения или повышения артериального давления. Неврологическая симптоматика зависит от тяжести нарушений системного и регионарного (мозгового) кровообращения и может быть представлена головной болью, головокружением, тошнотой, рвотой, расстройством зрения, помрачением сознания (от легкой заторможенности до комы) и очаговыми неврологическими симптомами. У больных старческого возраста нарушение мозгового кровотока вследствие ухудшения кровообращения и снижения артериального давления может проявляться психозом.
К цереброваскулярному варианту иногда относят синкопальные состояния в дебюте заболевания, однако они чаще обусловлены кратковременными эпизодами аритмий или развиваются на высоте боли.
Астматический вариант инфаркта миокарда обычно встречается при повторном инфаркте миокарда или у больных с исходной недостаточностью кровообращения. Сердечная астма или отек легких в дебюте инфаркта миокарда могут быть обусловлены вовлечением в патологический процесс сосочковых мышц, а внезапная одышка без выраженного застоя в легких – поражением правого желудочка. Об астматическом варианте инфаркта миокарда следует думать тогда, когда ведущим симптомом заболевания является внезапный, часто немотивированный приступ удушья или отек легких.
Абдоминальный вариант обычно наблюдается при локализации некроза на нижней стенке левого желудочка. Кроме смещения эпицентра болевых ощущений в надчревную область, реже – в область правого подреберья, при нем могут наблюдаться тошнота, рвота, метеоризм, расстройство стула, явления пареза кишечника, повышение температуры тела. Нередко отмечаются цианоз, одышка, аритмии, в то время как живот остается мягким, а симптомы раздражения брюшины отсутствуют.
Малосимптомная (безболевая) форма инфаркта миокарда проявляется неспецифической симптоматикой (слабость, ухудшение сна или настроения, ощущение дискомфорта в грудной клетке). Малосимптомная форма инфаркта миокарда чаще встречается у больных пожилого возраста, особенно страдающих сахарным диабетом, и вовсе не является свидетельством благоприятного течения заболевания.
ЭКГ при инфаркте миокарда относительно специфична, но отличается низкой чувствительностью. Признаки острого нарушения коронарного кровообращения часто искажаются другими патологическими изменениями ЭКГ и всегда запаздывают по отношению к началу ангинозного приступа. Эти обстоятельства снижают ценность однократно снятой ЭКГ, позволяющей, по данным различных авторов, диагностировать инфаркт миокарда лишь в 48–51 % случаев.
В то же время неотложное электрокардиографическое исследование может иметь решающее значение для постановки правильного диагноза. Ценность этого метода диагностики проявляется не только при особо тяжелых или трудно дифференцируемых состояниях. Изменения ЭКГ могут оказаться единственным убедительным симптомом инфаркта миокарда при относительно кратковременной и легко устраненной ангинозной боли или при других нетипичных клинических проявлениях заболевания. Напротив, отсутствие электрокардиографических признаков нарушения коронарного кровообращения на фоне тяжелого многочасового болевого приступа может свидетельствовать о наличии другого заболевания (например, расслаивающей аневризмы аорты). Бесспорно, что диагностировать инфаркт миокарда нужно в первую очередь по клиническим признакам, но во всех случаях, когда он может быть заподозрен, необходима экстренная оценка ЭКГ.
Подтверждение диагноза и определение ЭКГ-разновидности инфаркта миокарда имеет определяющее значение для выбора лечения, в первую очередь – содержания и объема неотложной антитромботической терапии.
По электрокардиографическим признакам важно различать трансмуральный и субэндокардиальный инфаркт миокарда.
При трансмуральном (крупноочаговом) некрозе поражается более 50–70 % толщи стенки левого желудочка. Так как большая часть миокарда под электродом теряет способность к возбуждению, то форму ЭКГ в прямых отведениях определяет вектор деполяризации противоположной стенки, формируя комплекс QRS или патологический зубец Q. Зубец Q считают патологическим при продолжительности 0,04 с или больше, при амплитуде больше 1/4 зубца R, а также если он появляется в грудных отведениях правее переходной зоны. Вектор сохранившейся части миокарда приводит к образованию зубца r с меньшей, чем исходная, амплитудой.
При субэндокардиальном инфаркте миокарда патологический зубец Q не образуется, хотя может отмечаться зазубренность начальной части комплекса QRS. На ЭКГ проявляются признаки субэндокардиального повреждения, т. е. депрессия сегмента ST (максимально выраженная в отведениях V3—V5, реже – в отведениях III и aVP). Эти признаки свидетельствуют об инфаркте миокарда, если сохраняются не менее 48 ч, в дальнейшем закономерно изменяются и сопровождаются усилением активности кардиоспецифичных ферментов или повышением содержания миокардиальных белков в крови. Субэндокардиальные инфаркты всегда обширные, и хотя изменения реполяризации неточно очерчивают зону поражения, их нельзя относить к мелкоочаговым.
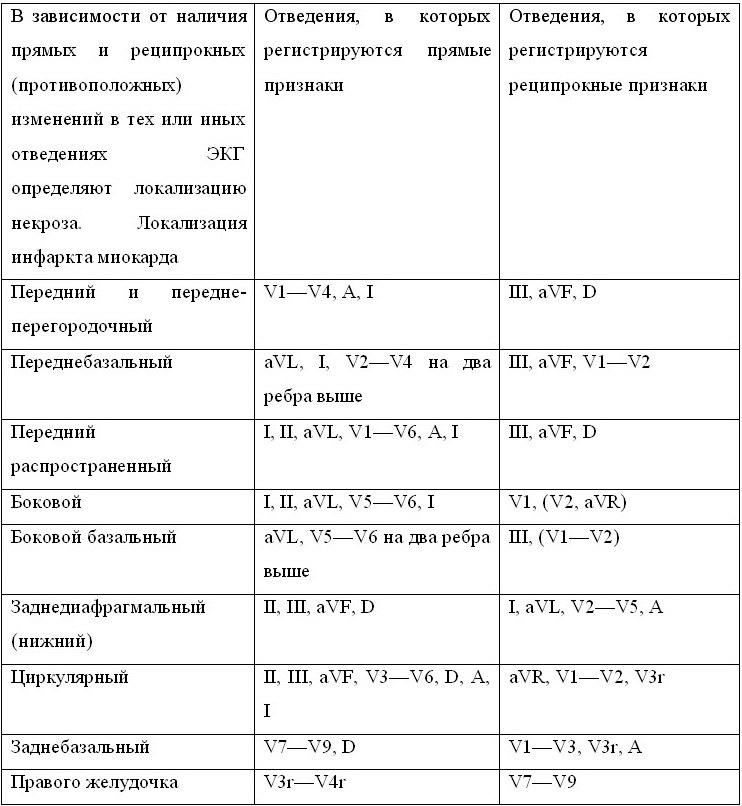 С течением времени ЭКГ при инфаркте миокарда претерпевает ряд динамических изменений. Выделяют три электрокардиографических стадии трансмурального инфаркта миокарда: острую, подострую, рубцовую.
С течением времени ЭКГ при инфаркте миокарда претерпевает ряд динамических изменений. Выделяют три электрокардиографических стадии трансмурального инфаркта миокарда: острую, подострую, рубцовую.
Острая стадия трансмурального инфаркта проявляется признаками некроза (появлением комплексов QS или патологических зубцов Q) и повреждения (подъемом сегмента ST выше изоэлектрической линии) миокарда.
В самом начале острая стадия (иногда этот период называют острейшей стадией) проявляется признаками трансмурального повреждения миокарда (быстро нарастающими изменениями реполяризации: подъемом сегмента ST в виде монофазной кривой, преходящими нарушениями ритма и проводимости, снижением амплитуды зубца R, началом формирования патологического зубца Q). Выделение этого начального периода острой стадии имеет важное значение, так как позволяет определить содержание экстренной помощи (тромболитическая терапия или антикоагулянты), не дожидаясь появления прямых признаков некроза (комплексов QRS или патологических зубцов Q). Если при наличии клинических данных признаки повреждения миокарда (смещения сегмента ST) отсутствуют, то ЭКГ необходимо регистрировать повторно каждые 20–30 мин, чтобы не упустить время для начала тромболитической терапии.
На протяжении острой стадии окончательно формируется зона некроза (формируются комплексы QS или патологические зубцы Q), за счет уменьшения возбуждающейся части миокарда снижается амплитуда зубца R. По мере уменьшения степени повреждения миокарда, окружающего некротический участок, сегмент ST приближается к изоэлектрической линии. Трансформация повреждения в ишемию приводит к появлению и нарастанию инверсии зубца Т. В конце острой стадии вся зона повреждения трансформируется в ишемическую, поэтому сегмент ST находится на изоэлектрической линии, а зубец Т – глубокий, отрицательный.
Подострая стадия представлена зоной некроза (комплексы QS или патологические зубцы Q) и зоной ишемии (отрицательные зубцы Т). Динамика ЭКГ в этом периоде заболевания сводится к постепенному уменьшению ишемии (степени инверсии зубца Т).
Рубцовая стадия. Для рубцовой стадии трансмурального инфаркта миокарда характерны наличие патологического зубца Q, сниженная амплитуда зубца R, расположение сегмента ST на изоэлектрической линии, стабильная форма зубца Т. Признаки рубцовых изменений на ЭКГ могут сохраняться пожизненно, но могут со временем исчезать.
Распознавание инфаркта миокарда по ЭКГ может быть затруднено.
К наиболее значимым факторам, затрудняющим диагностику, относятся:
1) отсутствие типичных изменений ЭКГ в начале инфаркта миокарда;
2) поздняя регистрация ЭКГ;
3) инфаркт миокарда без патологического зубца Q или с нечеткими изменениями зубца Q;
4) локализация некроза, при которой нет прямых изменений в обычных отведениях ЭКГ;
5) повторный инфаркт миокарда;
6) переднезадний инфаркт миокарда;
7) блокада ножек пучка Гиса и их разветвлений;
8) инфарктоподобные изменения ЭКГ при других заболеваниях и состояниях (ТЭЛА, синдром WPW и др.).
Особенно актуальна проблема, связанная с запаздыванием появления изменений на ЭКГ относительно начала болевого синдрома.
Отсутствие типичных изменений ЭКГ в начале инфаркта миокарда может наблюдаться в течение минут, а иногда и часов.
Н. А. Мазур (1985) выделяет 5 вариантов изменений ЭКГ в течение первого часа развития инфаркта миокарда:
1) подъем сегмента SТ с патологическим зубцом Q или без него;
2) депрессия сегмента ST;
3) появление реципрокных изменений ЭКГ раньше, чем прямых;
4) образование патологического зубца Q раньше типичных изменений реполяризации (псевдорубцовая стадия);
5) отсутствие изменений ЭКГ.
В случаях, когда в начале клинических проявлений инфаркта миокарда отсутствуют его электрокардиографические признаки, регистрацию ЭКГ следует повторять с интервалом 20–30 мин.
На ранних стадиях заболевания заподозрить инфаркт миокарда по ЭКГ помогают:
1) появление отрицательной и, не в меньшей степени, положительной (псевдонормализация) динамики по сравнению с предыдущими ЭКГ;
2) появление высоких заостренных зубцов Т;
3) появление реципрокных изменений;
4) нарушения внутрижелудочковой проводимости (обычно при передне-перегородочных инфарктах);
5) нарушения АВ-проводимости (при заднедиафрагмальных инфарктах);
6) желудочковые экстрасистолы типа (QS, qR или QRS (но не QS) в прекардиальных отведениях;
7) регистрация дополнительных (V7—8, высоких и правых прекардиальных) отведений ЭКГ;
8) особая настороженность при анализе изменений в отведениях aVL, V5—6, III;
9) при низкоамплитудных зубцах регистрация ЭКГ с усилением 2:1.
Изменения ЭКГ в первые часы инфаркта миокарда имеют определенное прогностическое значение. Прогностически неблагоприятными являются следующие электрокардиографические признаки:
1) высокая ЧСС;
2) значительный суммарный подъем сегмента ST;
3) выраженная депрессия сегмента ST в реципрокных отведениях;
4) увеличение продолжительности комплекса QRS до 0,11 с и более;
5) наличие признаков ранее перенесенного инфаркта миокарда (комплексов QS или патологических зубцов Q в удаленных от зоны острого инфаркта миокарда отведениях).
Поставить окончательный диагноз ИМ можно на основании сочетания признаков резорбционно-некротического синдрома и данных ЭКГ.
Резорбционно-некротический синдром выявляется по результатам общеклинического и биохимического исследований крови:
1) лейкоцитоз со сдвигом лейкоцитарной формулы влево и анэозинофилия (не всегда) с первых часов заболевания;
2) увеличение СОЭ с 3—5-го дня;
3) повышение в крови активности ферментов – креатинфосфокиназы (КФК) и ее МВ-фракции (с первых часов, сохраняющееся 2–3 дня), аминотрансфераз (особенно аспарагиновой и в меньшей степени аланиновой с конца первых суток, нормализующееся к 3—5-му дню), ЛДГ-лактатдегидрогеназы (общей) и ее первого и второго изоферментов, которое может держаться 10–14 дней.
В настоящее время при острой коронарной патологии наряду с прочно вошедшими в клиническую практику лабораторными методами, такими как исследование уровня КФК, ЛДГ-1, КФК – МВ, широко используют новые маркеры – тропонин Т, тропонин И и миоглобин.
Для экстренной диагностики инфаркта миокарда наиболее подходит качественный иммунологический тест для определения содержания в крови специфического миокардиального белка тропонина-Т. При инфаркте миокарда наблюдаются два пика повышения его концентрации в крови. Первый начинается через 2–3 ч, достигает максимума через 8—10 ч, второй начинается через трое суток. Нормализация концентрации тропонина-Т в крови происходит через 10–14 суток.
Чувствительность теста через 3 ч – примерно 60 %, через 10 ч приближается к 100 %, специфичность – почти 100 %.
С помощью этого метода удается диагностировать не только крупно-, но и мелкоочаговые повреждения миокарда, что имеет принципиальное значение у больных с нестабильной стенокардией.
Для проведения анализа на тест-полоску наносят 150 мкл крови. Результат считывают через 20 мин. При инфаркте миокарда концентрация тропонина-Т превышает 0,2 нг/мл и на полоске появляются две линии. При наличии одной (контрольной) линии тест считают отрицательным (в ранние сроки для исключения инфаркта миокарда тест рекомендуют повторить через несколько часов). Отсутствие контрольной линии свидетельствует о том, что провести тест не удалось.
Таким образом, метод прост и доступен, отличается высокой чувствительностью и специфичностью, позволяет диагностировать инфаркт миокарда как в ранние, так и в поздние сроки заболевания (в промежутке от 3 ч до 10 суток). Тропонин является белковым комплексом, регулирующим мышечное сокращение, и состоит из трех субъединиц – тропонин Т (ТнТ), тропонин Ц (ТнЦ) и тропонин И (ТнИ). В начале 90-х годов были разработаны иммунологические методы, позволяющие с помощью моноклональных антител различать тропонины Т и И кардиомиоцитов и других поперечнополосатых мышечных волокон. Считается, что ТнИ и ТнТ являются наиболее чувствительными и специфичными маркерами некроза сердечной мышцы. Их уровень повышается в крови уже через 2–3 ч после инфаркта миокарда, увеличивается в 300–400 раз по сравнению с нормой и сохраняется повышенным в течение 10–14 дней.
В последнее время появились данные о том, что уровень ТнТ может повышаться при ХПН и некоторых других патологических состояниях, в связи с чем большее предпочтение отдается ТнИ.
Миоглобин – хромопротеид, сходный по строению с гемоглобином, – пигментный белок мышечной ткани, обеспечивающий депонирование в ней кислорода, что особенно важно для сердечной мышцы. У здоровых людей уровень миоглобина в крови, определяемый радиоиммунным методом, не превышает 80 мкг/л, а с мочой за сутки выделяется 0,4–4 мкг. При травмировании и ишемии мышц миоглобин, обладая малой молекулярной массой, быстро выделяется в кровь, а затем поступает в мочу.
В подавляющем большинстве случаев (97 %) непосредственной причиной инфаркта миокарда является тромботическая окклюзия коронарных артерий.
Исключение составляет инфаркт миокарда, вызванный длительным спазмом коронарных артерий, резким и продолжительным повышение потребности миокарда в кислороде. Известны случаи развития инфаркта миокарда при травме, артериите, аномалии, расслоении, эмболии коронарных артерий, заболеваниях крови, пороках сердца, особенно аортальных, расслаивающей аневризме аорты, тиреотоксикозе, тяжелой гипоксии, анемии и других заболеваниях и состояниях.
Подавляющее большинство летальных исходов при инфаркте миокарда развиваются в первые часы заболевания на догоспитальном этапе. Из общего числа заболевших каждый четвертый погибает в течение первых шести часов от начала сердечного приступа.
Диагностика
Основой диагностики инфаркта миокарда, особенно в первые часы заболевания, являются тщательный анализ болевого синдрома с учетом анамнеза, указывающего на наличие ИБС или соответствующих факторов риска, а в дальнейшем – появление изменений ЭКГ и повышение активности кардиоспецифических ферментов или содержания миокардиальных белков в крови.Выделяют несколько вариантов начала инфаркта миокарда: ангинозный, аритмический, цереброваскулярный, астматический, абдоминальный, малосимптомный (безболевой).
Ангинозный – самый частый вариант дебюта инфаркта миокарда. Характер ангинозной боли при инфаркте миокарда аналогичен таковому при стенокардии. Больные описывают возникающие ощущения как сильное сжатие, сдавление, тяжесть («стянуло обручем, сжало тисками»). При большой интенсивности боль воспринимается как «кинжальная», раздирающая, разрывающая, жгучая, палящая, как «кол в грудной клетке». Болевые ощущения протекают волнообразно, периодически уменьшаясь, но не прекращаясь полностью. С каждой новой волной приступы усиливаются, быстро достигают максимума, а затем ослабевают, и промежутки между ними удлиняются. Локализация ангинозной боли – обычно за грудиной в глубине грудной клетки, реже – в левой половине грудной клетки или в надчревной области. Иногда эпицентр боли смещается в правую половину грудной клетки, шею, нижнюю челюсть. Иррадиирует ангинозная боль, как правило, в левую лопатку, плечо, предплечье, кисть. Чаще, чем при стенокардии, боль широко отражается в обе лопатки, оба плеча и предплечья, надчревную область, шею, нижнюю челюсть, причем иррадиацию в шею и обе лопатки считают более специфичной.
Начало ангинозной боли при инфаркте миокарда – внезапное, часто в утренние часы, длительность – несколько часов.
Окончание боли. Повторный сублингвальный прием нитроглицерина не устраняет боль полностью, но может ее несколько ослабить.
Особенности ангинозного болевого синдрома при инфаркте миокарда зависят от локализации и течения заболевания, фона, на котором оно развивается, и возраста больного. У 90 % молодых больных ангинозный статус проявляется ярко. Боли часто носят сжимающий, сверлящий, режущий, жгучий характер, трудно поддаются терапии, рецидивируют. Напротив, у 30 % больных пожилого и старческого возраста типичная загрудинная боль вообще не наблюдается.
К аритмическому варианту заболевания относят случаи, когда инфаркт миокарда начинается с острых нарушений ритма или проводимости сердца при отсутствии боли. Чаще аритмический вариант проявляется фибрилляцией желудочков, реже – аритмическим шоком, обусловленным пароксизмом тахикардии (тахиаритмии) или острой брадикардией. Нередко аритмический вариант клинически дает знать о себе обмороком.
Цереброваскулярный вариант наблюдается у больных с отягощенным неврологическим анамнезом и развивается на фоне значительного снижения или повышения артериального давления. Неврологическая симптоматика зависит от тяжести нарушений системного и регионарного (мозгового) кровообращения и может быть представлена головной болью, головокружением, тошнотой, рвотой, расстройством зрения, помрачением сознания (от легкой заторможенности до комы) и очаговыми неврологическими симптомами. У больных старческого возраста нарушение мозгового кровотока вследствие ухудшения кровообращения и снижения артериального давления может проявляться психозом.
К цереброваскулярному варианту иногда относят синкопальные состояния в дебюте заболевания, однако они чаще обусловлены кратковременными эпизодами аритмий или развиваются на высоте боли.
Астматический вариант инфаркта миокарда обычно встречается при повторном инфаркте миокарда или у больных с исходной недостаточностью кровообращения. Сердечная астма или отек легких в дебюте инфаркта миокарда могут быть обусловлены вовлечением в патологический процесс сосочковых мышц, а внезапная одышка без выраженного застоя в легких – поражением правого желудочка. Об астматическом варианте инфаркта миокарда следует думать тогда, когда ведущим симптомом заболевания является внезапный, часто немотивированный приступ удушья или отек легких.
Абдоминальный вариант обычно наблюдается при локализации некроза на нижней стенке левого желудочка. Кроме смещения эпицентра болевых ощущений в надчревную область, реже – в область правого подреберья, при нем могут наблюдаться тошнота, рвота, метеоризм, расстройство стула, явления пареза кишечника, повышение температуры тела. Нередко отмечаются цианоз, одышка, аритмии, в то время как живот остается мягким, а симптомы раздражения брюшины отсутствуют.
Малосимптомная (безболевая) форма инфаркта миокарда проявляется неспецифической симптоматикой (слабость, ухудшение сна или настроения, ощущение дискомфорта в грудной клетке). Малосимптомная форма инфаркта миокарда чаще встречается у больных пожилого возраста, особенно страдающих сахарным диабетом, и вовсе не является свидетельством благоприятного течения заболевания.
ЭКГ при инфаркте миокарда относительно специфична, но отличается низкой чувствительностью. Признаки острого нарушения коронарного кровообращения часто искажаются другими патологическими изменениями ЭКГ и всегда запаздывают по отношению к началу ангинозного приступа. Эти обстоятельства снижают ценность однократно снятой ЭКГ, позволяющей, по данным различных авторов, диагностировать инфаркт миокарда лишь в 48–51 % случаев.
В то же время неотложное электрокардиографическое исследование может иметь решающее значение для постановки правильного диагноза. Ценность этого метода диагностики проявляется не только при особо тяжелых или трудно дифференцируемых состояниях. Изменения ЭКГ могут оказаться единственным убедительным симптомом инфаркта миокарда при относительно кратковременной и легко устраненной ангинозной боли или при других нетипичных клинических проявлениях заболевания. Напротив, отсутствие электрокардиографических признаков нарушения коронарного кровообращения на фоне тяжелого многочасового болевого приступа может свидетельствовать о наличии другого заболевания (например, расслаивающей аневризмы аорты). Бесспорно, что диагностировать инфаркт миокарда нужно в первую очередь по клиническим признакам, но во всех случаях, когда он может быть заподозрен, необходима экстренная оценка ЭКГ.
Подтверждение диагноза и определение ЭКГ-разновидности инфаркта миокарда имеет определяющее значение для выбора лечения, в первую очередь – содержания и объема неотложной антитромботической терапии.
По электрокардиографическим признакам важно различать трансмуральный и субэндокардиальный инфаркт миокарда.
При трансмуральном (крупноочаговом) некрозе поражается более 50–70 % толщи стенки левого желудочка. Так как большая часть миокарда под электродом теряет способность к возбуждению, то форму ЭКГ в прямых отведениях определяет вектор деполяризации противоположной стенки, формируя комплекс QRS или патологический зубец Q. Зубец Q считают патологическим при продолжительности 0,04 с или больше, при амплитуде больше 1/4 зубца R, а также если он появляется в грудных отведениях правее переходной зоны. Вектор сохранившейся части миокарда приводит к образованию зубца r с меньшей, чем исходная, амплитудой.
При субэндокардиальном инфаркте миокарда патологический зубец Q не образуется, хотя может отмечаться зазубренность начальной части комплекса QRS. На ЭКГ проявляются признаки субэндокардиального повреждения, т. е. депрессия сегмента ST (максимально выраженная в отведениях V3—V5, реже – в отведениях III и aVP). Эти признаки свидетельствуют об инфаркте миокарда, если сохраняются не менее 48 ч, в дальнейшем закономерно изменяются и сопровождаются усилением активности кардиоспецифичных ферментов или повышением содержания миокардиальных белков в крови. Субэндокардиальные инфаркты всегда обширные, и хотя изменения реполяризации неточно очерчивают зону поражения, их нельзя относить к мелкоочаговым.

Острая стадия трансмурального инфаркта проявляется признаками некроза (появлением комплексов QS или патологических зубцов Q) и повреждения (подъемом сегмента ST выше изоэлектрической линии) миокарда.
В самом начале острая стадия (иногда этот период называют острейшей стадией) проявляется признаками трансмурального повреждения миокарда (быстро нарастающими изменениями реполяризации: подъемом сегмента ST в виде монофазной кривой, преходящими нарушениями ритма и проводимости, снижением амплитуды зубца R, началом формирования патологического зубца Q). Выделение этого начального периода острой стадии имеет важное значение, так как позволяет определить содержание экстренной помощи (тромболитическая терапия или антикоагулянты), не дожидаясь появления прямых признаков некроза (комплексов QRS или патологических зубцов Q). Если при наличии клинических данных признаки повреждения миокарда (смещения сегмента ST) отсутствуют, то ЭКГ необходимо регистрировать повторно каждые 20–30 мин, чтобы не упустить время для начала тромболитической терапии.
На протяжении острой стадии окончательно формируется зона некроза (формируются комплексы QS или патологические зубцы Q), за счет уменьшения возбуждающейся части миокарда снижается амплитуда зубца R. По мере уменьшения степени повреждения миокарда, окружающего некротический участок, сегмент ST приближается к изоэлектрической линии. Трансформация повреждения в ишемию приводит к появлению и нарастанию инверсии зубца Т. В конце острой стадии вся зона повреждения трансформируется в ишемическую, поэтому сегмент ST находится на изоэлектрической линии, а зубец Т – глубокий, отрицательный.
Подострая стадия представлена зоной некроза (комплексы QS или патологические зубцы Q) и зоной ишемии (отрицательные зубцы Т). Динамика ЭКГ в этом периоде заболевания сводится к постепенному уменьшению ишемии (степени инверсии зубца Т).
Рубцовая стадия. Для рубцовой стадии трансмурального инфаркта миокарда характерны наличие патологического зубца Q, сниженная амплитуда зубца R, расположение сегмента ST на изоэлектрической линии, стабильная форма зубца Т. Признаки рубцовых изменений на ЭКГ могут сохраняться пожизненно, но могут со временем исчезать.
Распознавание инфаркта миокарда по ЭКГ может быть затруднено.
К наиболее значимым факторам, затрудняющим диагностику, относятся:
1) отсутствие типичных изменений ЭКГ в начале инфаркта миокарда;
2) поздняя регистрация ЭКГ;
3) инфаркт миокарда без патологического зубца Q или с нечеткими изменениями зубца Q;
4) локализация некроза, при которой нет прямых изменений в обычных отведениях ЭКГ;
5) повторный инфаркт миокарда;
6) переднезадний инфаркт миокарда;
7) блокада ножек пучка Гиса и их разветвлений;
8) инфарктоподобные изменения ЭКГ при других заболеваниях и состояниях (ТЭЛА, синдром WPW и др.).
Особенно актуальна проблема, связанная с запаздыванием появления изменений на ЭКГ относительно начала болевого синдрома.
Отсутствие типичных изменений ЭКГ в начале инфаркта миокарда может наблюдаться в течение минут, а иногда и часов.
Н. А. Мазур (1985) выделяет 5 вариантов изменений ЭКГ в течение первого часа развития инфаркта миокарда:
1) подъем сегмента SТ с патологическим зубцом Q или без него;
2) депрессия сегмента ST;
3) появление реципрокных изменений ЭКГ раньше, чем прямых;
4) образование патологического зубца Q раньше типичных изменений реполяризации (псевдорубцовая стадия);
5) отсутствие изменений ЭКГ.
В случаях, когда в начале клинических проявлений инфаркта миокарда отсутствуют его электрокардиографические признаки, регистрацию ЭКГ следует повторять с интервалом 20–30 мин.
На ранних стадиях заболевания заподозрить инфаркт миокарда по ЭКГ помогают:
1) появление отрицательной и, не в меньшей степени, положительной (псевдонормализация) динамики по сравнению с предыдущими ЭКГ;
2) появление высоких заостренных зубцов Т;
3) появление реципрокных изменений;
4) нарушения внутрижелудочковой проводимости (обычно при передне-перегородочных инфарктах);
5) нарушения АВ-проводимости (при заднедиафрагмальных инфарктах);
6) желудочковые экстрасистолы типа (QS, qR или QRS (но не QS) в прекардиальных отведениях;
7) регистрация дополнительных (V7—8, высоких и правых прекардиальных) отведений ЭКГ;
8) особая настороженность при анализе изменений в отведениях aVL, V5—6, III;
9) при низкоамплитудных зубцах регистрация ЭКГ с усилением 2:1.
Изменения ЭКГ в первые часы инфаркта миокарда имеют определенное прогностическое значение. Прогностически неблагоприятными являются следующие электрокардиографические признаки:
1) высокая ЧСС;
2) значительный суммарный подъем сегмента ST;
3) выраженная депрессия сегмента ST в реципрокных отведениях;
4) увеличение продолжительности комплекса QRS до 0,11 с и более;
5) наличие признаков ранее перенесенного инфаркта миокарда (комплексов QS или патологических зубцов Q в удаленных от зоны острого инфаркта миокарда отведениях).
Поставить окончательный диагноз ИМ можно на основании сочетания признаков резорбционно-некротического синдрома и данных ЭКГ.
Резорбционно-некротический синдром выявляется по результатам общеклинического и биохимического исследований крови:
1) лейкоцитоз со сдвигом лейкоцитарной формулы влево и анэозинофилия (не всегда) с первых часов заболевания;
2) увеличение СОЭ с 3—5-го дня;
3) повышение в крови активности ферментов – креатинфосфокиназы (КФК) и ее МВ-фракции (с первых часов, сохраняющееся 2–3 дня), аминотрансфераз (особенно аспарагиновой и в меньшей степени аланиновой с конца первых суток, нормализующееся к 3—5-му дню), ЛДГ-лактатдегидрогеназы (общей) и ее первого и второго изоферментов, которое может держаться 10–14 дней.
В настоящее время при острой коронарной патологии наряду с прочно вошедшими в клиническую практику лабораторными методами, такими как исследование уровня КФК, ЛДГ-1, КФК – МВ, широко используют новые маркеры – тропонин Т, тропонин И и миоглобин.
Для экстренной диагностики инфаркта миокарда наиболее подходит качественный иммунологический тест для определения содержания в крови специфического миокардиального белка тропонина-Т. При инфаркте миокарда наблюдаются два пика повышения его концентрации в крови. Первый начинается через 2–3 ч, достигает максимума через 8—10 ч, второй начинается через трое суток. Нормализация концентрации тропонина-Т в крови происходит через 10–14 суток.
Чувствительность теста через 3 ч – примерно 60 %, через 10 ч приближается к 100 %, специфичность – почти 100 %.
С помощью этого метода удается диагностировать не только крупно-, но и мелкоочаговые повреждения миокарда, что имеет принципиальное значение у больных с нестабильной стенокардией.
Для проведения анализа на тест-полоску наносят 150 мкл крови. Результат считывают через 20 мин. При инфаркте миокарда концентрация тропонина-Т превышает 0,2 нг/мл и на полоске появляются две линии. При наличии одной (контрольной) линии тест считают отрицательным (в ранние сроки для исключения инфаркта миокарда тест рекомендуют повторить через несколько часов). Отсутствие контрольной линии свидетельствует о том, что провести тест не удалось.
Таким образом, метод прост и доступен, отличается высокой чувствительностью и специфичностью, позволяет диагностировать инфаркт миокарда как в ранние, так и в поздние сроки заболевания (в промежутке от 3 ч до 10 суток). Тропонин является белковым комплексом, регулирующим мышечное сокращение, и состоит из трех субъединиц – тропонин Т (ТнТ), тропонин Ц (ТнЦ) и тропонин И (ТнИ). В начале 90-х годов были разработаны иммунологические методы, позволяющие с помощью моноклональных антител различать тропонины Т и И кардиомиоцитов и других поперечнополосатых мышечных волокон. Считается, что ТнИ и ТнТ являются наиболее чувствительными и специфичными маркерами некроза сердечной мышцы. Их уровень повышается в крови уже через 2–3 ч после инфаркта миокарда, увеличивается в 300–400 раз по сравнению с нормой и сохраняется повышенным в течение 10–14 дней.
В последнее время появились данные о том, что уровень ТнТ может повышаться при ХПН и некоторых других патологических состояниях, в связи с чем большее предпочтение отдается ТнИ.
Миоглобин – хромопротеид, сходный по строению с гемоглобином, – пигментный белок мышечной ткани, обеспечивающий депонирование в ней кислорода, что особенно важно для сердечной мышцы. У здоровых людей уровень миоглобина в крови, определяемый радиоиммунным методом, не превышает 80 мкг/л, а с мочой за сутки выделяется 0,4–4 мкг. При травмировании и ишемии мышц миоглобин, обладая малой молекулярной массой, быстро выделяется в кровь, а затем поступает в мочу.
