Страница:
Разумеется, обе научные группы пока лишь в самом начале пути. Пройдет еще немало времени, прежде чем новые методы станут привычным инструментом биологов. Но эти разработки способны навести долгожданный мост между молекулярной и клеточной биологией, и возможно, что открытия вскоре посыплются как из рога изобилия.
 Разработчики новейших методик стараются сблизить два полюса биомикроскопии, разделенные по разрешающей способности пропастью шириной более чем в два порядка: оптическую микроскопию, позволяющую исследовать не только мертвые, но и живые клетки, и электронную микроскопию, изучающую клетки заведомо убитые, но зато с завидной точностью. Граница применимости «прижизненной» микроскопии понятна: с длины волны ниже 400 нм начинается губительный для клеток ультрафиолет.
Разработчики новейших методик стараются сблизить два полюса биомикроскопии, разделенные по разрешающей способности пропастью шириной более чем в два порядка: оптическую микроскопию, позволяющую исследовать не только мертвые, но и живые клетки, и электронную микроскопию, изучающую клетки заведомо убитые, но зато с завидной точностью. Граница применимости «прижизненной» микроскопии понятна: с длины волны ниже 400 нм начинается губительный для клеток ультрафиолет.
Что же до электронной микроскопии, то именно благодаря достигаемому ею разрешению в несколько ангстрем удалось составить подробные карты «внутриклеточного ландшафта» и воочию, без домыслов, увидеть строение клеточного ядра, а также митохондрий, рибосом и других клеточных органелл. Но понятно, что на острие электронного пучка, разогнанного в вакууме полем напряженностью в десятки киловольт, живьем ничего не разглядишь. Электронная микроскопия знает лишь один экзотический пример, когда твердейший хитиновый покров членистоногих сканируют без всякой предварительной подготовки. А так — нежную и трепетную живую ткань приходится фиксировать альдегидами и четырехокисью осмия, обезвоживать, заливать полимеризующимися материалами, пропитывать специальными «электронными» красителями и готовить тончайшие срезы «на просвет».
А биология сегодняшнего дня предъявляет все больший спрос на исследование клеток и тканей непосредственно в процессе их жизнедеятельности. Чтобы сохранить «щадящий» характер световой микроскопии и при этом повысить разрешающую способность, исследователи идут на компромисс — скажем, в обмен на вожделенную точность смиряются с необходимостью многократных повторных измерений. Компромисс, однако, всегда штука непростая. Обратим внимание: схема, при которой процесс получения одной-единственной сверхточной картинки растягивается на минуты и даже часы, может безотказно работать только на неподвижном объекте, отдельные части которого не расползутся в разные стороны прямо по ходу «сложносочиненного» замера. Собственно, все сенсационные результаты новейших методик высокого разрешения и были получены на специально фиксированных объектах. Но ведь поставленная сверхзадача — исследование функционирующей клетки со всеми ее внутриклеточными транспортными потоками, сократительными белками и т. п. И мы не можем, подобно пляжному фотографу, скомандовать ей «замрите, снимаю».
Судя по оптимистичному тону профессора Сяовэя Чжуана (Xiaowei Zhuang), уверенного в возможности ускорения процедуры STORM-микроскопии вплоть до исследования живых клеток с молекулярным разрешением в реальном масштабе времени, разработчики надеются преодолеть это концептуальное противоречие. Но, может быть, ближе к истине профессор Дженнифер Липпинкотт-Шварц (Jennifer Lippincott-Schwartz), видящая будущее новых методик в их сочетании с электронной микроскопией: «Соотнося результаты PALM-микроскопии с электронномикроскопической картиной, можно понять, как отдельные активные молекулы распределены по тонким субклеточным структурам».
imagemagick.org — официальный сайт проекта: релизы для скачивания, исчерпывающая документация, полезные ссылки.

Что же до электронной микроскопии, то именно благодаря достигаемому ею разрешению в несколько ангстрем удалось составить подробные карты «внутриклеточного ландшафта» и воочию, без домыслов, увидеть строение клеточного ядра, а также митохондрий, рибосом и других клеточных органелл. Но понятно, что на острие электронного пучка, разогнанного в вакууме полем напряженностью в десятки киловольт, живьем ничего не разглядишь. Электронная микроскопия знает лишь один экзотический пример, когда твердейший хитиновый покров членистоногих сканируют без всякой предварительной подготовки. А так — нежную и трепетную живую ткань приходится фиксировать альдегидами и четырехокисью осмия, обезвоживать, заливать полимеризующимися материалами, пропитывать специальными «электронными» красителями и готовить тончайшие срезы «на просвет».
А биология сегодняшнего дня предъявляет все больший спрос на исследование клеток и тканей непосредственно в процессе их жизнедеятельности. Чтобы сохранить «щадящий» характер световой микроскопии и при этом повысить разрешающую способность, исследователи идут на компромисс — скажем, в обмен на вожделенную точность смиряются с необходимостью многократных повторных измерений. Компромисс, однако, всегда штука непростая. Обратим внимание: схема, при которой процесс получения одной-единственной сверхточной картинки растягивается на минуты и даже часы, может безотказно работать только на неподвижном объекте, отдельные части которого не расползутся в разные стороны прямо по ходу «сложносочиненного» замера. Собственно, все сенсационные результаты новейших методик высокого разрешения и были получены на специально фиксированных объектах. Но ведь поставленная сверхзадача — исследование функционирующей клетки со всеми ее внутриклеточными транспортными потоками, сократительными белками и т. п. И мы не можем, подобно пляжному фотографу, скомандовать ей «замрите, снимаю».
Судя по оптимистичному тону профессора Сяовэя Чжуана (Xiaowei Zhuang), уверенного в возможности ускорения процедуры STORM-микроскопии вплоть до исследования живых клеток с молекулярным разрешением в реальном масштабе времени, разработчики надеются преодолеть это концептуальное противоречие. Но, может быть, ближе к истине профессор Дженнифер Липпинкотт-Шварц (Jennifer Lippincott-Schwartz), видящая будущее новых методик в их сочетании с электронной микроскопией: «Соотнося результаты PALM-микроскопии с электронномикроскопической картиной, можно понять, как отдельные активные молекулы распределены по тонким субклеточным структурам».
imagemagick.org — официальный сайт проекта: релизы для скачивания, исчерпывающая документация, полезные ссылки.
• www.cit.gu.edu.au/~anthony/graphics/imagick6 — обширная галерея примеров использования ImageMagick.
Команды пакета ImageMagick
• animate — отображение анимации (слайд-шоу) из набора файлов через X-сервер;
• compare — визуальное сравнение файлов и количественная оценка степени их схожести;
• composite — наложение изображений;
• conjure — выполнение скриптов на собственном языке Magick Scripting Language;
• convert — конвертирование изображений из одного формата в другой, а также применение к ним самых разнообразных операций (изменение размера, наложение фильтров и т. д.);
• display — отображение изображений и слайд-шоу через X-сервер;
• identify — получение информации о формате и параметрах одного или нескольких графических файлов;
• import — сохранение скриншотов произвольных областей экрана;
• mogrify — изменение размера изображения или применение к нему различных операций. Отличается от convert тем, что меняет исходный файл, а не создает новый;
• montage — объединение нескольких изображений в одно;
• stream — средство сохранения информации о цветовых каналах в различные форматы.
www.agnitum.ru
• Версия: 3.51
• Размер: 5,5 Мбайт
• Интерфейс: русский, украинский
• Цена: 699 руб.
Outpost Firewall Pro является одним из лучших по функциональности персональных брандмауэров. Приложение позволяет в автоматическом режиме блокировать проникновение из Интернета вредоносных программ самого разного профиля. Наличие «скрытого» режима делает компьютер полностью невидимым для злоумышленников. Одновременно программа контролирует передачу данных в Сеть, предотвращая потерю конфиденциальной информации, а также позволяет ограничить доступ к внешним ресурсам нежелательного содержания. Новая версия Outpost Firewall Pro обладает встроенным модулем Outpost AntiSpyware.
***
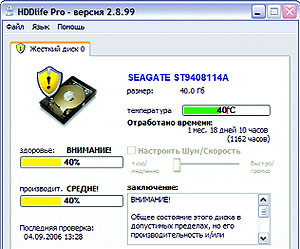
• ОС: Windows
• Адрес: www.hddlife.com/rus
• Версия: 2.8.99
• Размер: 4,3 Мбайт
• Интерфейс: многоязычный (русский поддерживается)
• Цена: бесплатно, 500 руб. (версия Pro), 700 руб. (версия for Notebooks)
• Ознакомительный период: 14 дней
Иногда внезапная кончина жесткого диска может нанести катастрофический урон накопленным данным и рабочим материалам. Исключить подобный форс-мажор призвана программа HDDlife Pro. С заданной пользователем периодичностью она отслеживает состояние накопителей с помощью встроенной в них системы самодиагностики S.M.A.R.T. и своевременно предупреждает о возможных проблемах. Кроме того, HDDlife осуществляет мониторинг температурного режима HDD, предотвращая его перегрев, и сигнализирует о заполняемости накопителей. В случае отсутствия пользователя программа способна автоматически переводить компьютер в спящий режим с сохранением текущих документов.

