Одновременно вирусы гриппа удалось выделить и из организма таких благородных рыб, как лососи, его обнаружили у млекопитающих, например у косули, белки, северного оленя, и, наконец, выделили даже из печени и легких… кого бы вы думали? Китов! Да-да, китов, которые бороздили воды Тихого океана у берегов Антарктиды зимой 1975–1976 годов…Очень непросто, а порой и вовсе невозможно определить пути попадания того или иного вируса в организм, но я не могу обойти молчанием романтически увлекательное объяснение последней из названных мною находок, которое дал ее автор – директор НИИ вирусологии им. Д. И. Ивановского академик Д. К. Львов. Не чисто умозрительно, а на основании разностороннего изучения тонких характеристик выделенного от китов вируса ученый высказал предположение о том, что данный вирус относится к той разновидности вирусов гриппа, которая циркулировала во временной промежуток 1934–1940 годы, а затем исчезла из человеческой популяции. Но смотрите: вирус от китов выделяют через 36 лет (!) после его исчезновения из человеческой популяции. Спрашивается: куда же он девался? Где все это время находился? Ученый предположил, что человеческий вирус заразил вначале свиней, от них попал к водоплавающим домашним и диким птицам, которые, в свою очередь, передали его птицам, гнездящимся на птичьих базарах островов, расположенных среди бескрайних океанских просторов. Здесь вирус с птичьими фекалиями попадает в воду, а с ней – и в зоопланктон, излюбленную пищу китов.
Итак, накопившиеся факты заставляют признать, что разнообразные вирусы могут длительное время скрыто размножаться в организме человека, различных животных и насекомых, растений и даже бактерий. Такое продолжительное размножение вирусов в одном организме-хозяине уже давно получило специальное название – персистенция (запомните его, пожалуйста!).Этот термин происходит от латинского слова persistentia, что означает «сохранение предыдущего состояния», «упорство», «постоянство», т. е. при персистенции проявляется способность вируса упорно сохраняться в организме продолжительное время. Естественно, возникает вопрос: какое время пребывания вируса в организме можно считать продолжительным, а какое – непродолжительным?
Давайте разберемся. Всякое вирусное заболевание начинается потому, что в организм попадает вирус. Но признаки заболевания развиваются не сразу, а спустя несколько дней или недель, необходимые вирусу для размножения в зараженном организме и достижения определенной концентрации.
Время скрытого пребывания возбудителя в организме, до развития первых симптомов заболевания, называется инкубационным периодом. Только после него у нас с вами поднимается температура выше нормы, болит голова, появляются кашель, насморк, боли в мышцах или другие симптомы, характерные для той или иной болезни.Организм больного не безучастен к вирусу. С первых же часов он активно включается в борьбу с возбудителем и мобилизует для этого все свои защитные силы – различные механизмы иммунитета. А их, надо сказать, немало.
Против проникшего вируса прежде всего «выступают» некоторые виды лейкоцитов, которые поглощают (фагоцитируют) вирусные частицы. Такие лейкоциты, называемые фагоцитами (пожирающими клетками), вначале не в состоянии уничтожить захваченные вирусные частицы и даже нередко распадаются сами (незавершенный фагоцитоз). Однако со временем фагоциты оказывают все более активное сопротивление (им в этом помогают различные вещества, вырабатываемые в зараженном организме) и вскоре становятся способными не только захватывать вирус, поглощать его, но и переваривать внутри себя вирусные частицы (завершенный фагоцитоз). При этом часть такого переваренного вируса, не разрушаясь окончательно, передается Т– и В-лимфоцитам — особым группам лейкоцитов, которые затем, объединив усилия, обеспечивают выработку антител против проникшего вируса. Такие антитела, соединяясь с вирусными частицами, склеивают их между собой, нейтрализуют их активность и в конце концов способствуют растворению вирусных частиц либо их более активному фагоцитированию. Некоторые из Т-лимфоцитов приобретают способность соединяться с вируссодержащими клетками органов и тканей и убивать эти клетки, тем самым препятствуя дальнейшему размножению вируса в клетках, а в конечном итоге – и собственно распространению вируса по организму. Такие лимфоциты так и называются Т-киллеры.
Мало того, практически в каждой зараженной клетке начинается выработка особого вещества белковой природы – интерферона, который препятствует размножению вируса и тормозит его дальнейшее распространение по органам и тканям, действуя особенно активно в самом начале заболевания.
Вот почему препараты интерферона или вещества, способствующего его выработке в организме, которые сегодня можно купить в любой аптеке, рекомендуют применять, например при гриппе, уже с первых моментов ощущения недомогания, а лучше всего – профилактически, в небольших дозах, как указано в инструкции.Проходит несколько дней, и болезнь оказывается побежденной. Вирус уничтожен, мучительные симптомы исчезают, организм выздоравливает, приобретая некоторую устойчивость к повторному заражению (в наличии интерферон и в изобилии противовирусные антитела).
Повышение температуры тела – тоже защитная реакция организма, направленная на уничтожение вируса. Наконец, значительные количества накапливающегося в зараженном организме вируса постоянно выводятся из него с мочой (не зря врачи советуют нам во время болезни обильное питье).
Инкубационный период и неосложненный период самой болезни составляют время непродолжительного пребывания вируса в организме. Однако известно, что длительность как инкубационного периода, так и самой болезни при заражении различными вирусами у разных людей неодинакова. Время пребывания в организме каждого конкретного вируса обусловлено особенностями и самого вируса, скоростью его размножения и характером поражения органов и тканей, и, конечно, особенностями ответной (иммунной) реакции зараженного организма.
Так, например, инкубационный период при гриппе соответствует 1–3 дням, течение неосложненного гриппа, как правило, не превышает недели. Следовательно, если нам удается обнаружить вирус гриппа у выздоровевшего человека, скажем, спустя месяц после заражения, то мы имеем все основания говорить о персистенции данного вируса в организме. Другой пример – корь. Инкубационный период при этой болезни в среднем равен 14 дням, далее развивается 4-5-дневный период предвестников, а затем – собственно картина заболевания, длящаяся 10–14 дней. Таким образом, инкубационный период и период заболевания занимают от 28 до 33 дней. Поэтому обнаружение вируса кори в организме ребенка через месяц после заражения еще никак нельзя рассматривать как показатель персистенции этого вируса.
Теперь еще об одной особенности персистенции вирусов. Мы уже говорили о том, что всякое вирусное заболевание начинается с попадания вируса в организм. Но ведь недавно мы рассмотрели многочисленные примеры присутствия (и порой длительного присутствия) вирусов в организме людей и животных, когда это не приводило к развитию заболевания и такие организмы выглядели практически совершенно здоровыми. Тем не менее в подобных случаях говорят о скрытой инфекции.
Итак, инфекция и болезнь. В целях достижения полного взаимопонимания договоримся о терминах. Часто приходится слышать: «В ранку попала инфекция». Здесь под словом «инфекция» подразумевают инфекционный агент (например, вирус). В других случаях употребляют выражение «произошло инфицирование», имея в виду сам процесс заражения. Наконец, во многих учебниках можно встретить, например, «Курс детских инфекций». В этом случае под термином «инфекция» понимают «заболевание». Иными словами, мы сталкиваемся с типичным примером полисемии – многозначности слова.
Поэтому, чтобы избежать недоразумений, термином «инфекция» будем обозначать процесс взаимодействия вируса (ведь мы пока ведем речь только о вирусных инфекциях) с организмом хозяина.Формы этого процесса могут быть различными, и зависят они как от свойств самого вируса, так и от особенностей организма хозяина. Какие же это формы?
Наиболее знакомой всем является острая форма инфекции (помните грозные встречи?), когда после заражения развивается картина заболевания. Но ведь после заражения начинается размножение вируса в организме, а организм вступает с ним в борьбу. Следовательно, еще до проявления первых симптомов болезни начинается то самое взаимодействие вируса с хозяином, которое мы только что определили как суть инфекции. Следовательно, всякая болезнь подразумевает инфекцию. А инфекция? Обязательно ли она приводит к развитию болезни?
Теперь мы и это знаем – нет, не всегда. Далеко не всегда. Сегодня уже никто не сомневается в том, что скрытые вирусные инфекции (помните тайные встречи?) наиболее широко распространены в природе, их могут вызывать самые разнообразные (практически все!) вирусы, и такие инфекции являются правилом во взаимодействии вирусов с организмом, в то время как болезнь служит исключением из этого правила.
Но и скрытые инфекции могут иметь различную продолжительность. Скрытая инфекция, при которой вирус присутствует в организме сравнительно недолго (а мы уже знаем, что под этим подразумевать), называется инаппарантной (от французского слова inapparent — «неявный», «невидимый»). Если же речь идет о скрытой персистенции вируса, то такую форму инфекции называют латентной (от латинского слова latens — «скрытый»). На первый взгляд может показаться, что эти два термина достаточно близки по значению и нет большой необходимости в подобном разделении скрытых вирусных инфекций. Однако смысл есть, и немалый. Как мы увидим несколько позднее, именно латентные вирусные инфекции оказывают самое большое влияние, например, на рассеивание вирусов в окружающей среде, и в этом их коварство. Вспомните хотя бы вирус герпеса, который заразившийся человек сохраняет в своем организме в течение всей жизни.
Но почему же вирус, сформировавший в организме латентную инфекцию, не вызывает развития заболевания? Каков механизм вирусной персистенции?
Отчего и почему?
Большое количество вирусов населяет нашу планету. У разнообразных хозяев формируют они латентную инфекцию, и механизмы, поддерживающие вирусную персистенцию, тоже могут быть различными. В 1950 году американский вирусолог Р. Магнус изучал размножение вируса гриппа в курином эмбрионе. Ученый обратил внимание на то, что при заражении эмбрионов очень большой дозой вируса в них накапливается значительное количество вирусных частиц, при этом их инфекционность резко падает. Магнус объяснил обнаруженное несоответствие накоплением в эмбрионе «неполного» вируса, т. е. вирусных частиц, внутри которых отсутствует нуклеиновая кислота. Однако оказалось, что это не совсем так. Позднее выяснилось, что при условии массированного заражения куриных эмбрионов вирусом гриппа накапливается «урожай» потомства, среди которого преобладают вирусные частицы с нехваткой (дефектом) генетического материала. Иными словами, в разных частицах недостает того или иного кусочка (гена) рибонуклеиновой кислоты, которая служит генетическим материалом частиц вируса гриппа.
Такие вирусные частицы, не способные к размножению, получили название дефектных. Их поведение напоминает таковое «собаки на сене»: они не размножаются сами и, находясь внутри клетки, препятствуют размножению стандартных вирусных частиц. Однако при одновременном заражении клетки как дефектной, так и стандартной частицами картина меняется: дефектные частицы начинают размножаться, используя недостающие «инструменты» стандартных частиц. Поэтому роль дефектных вирусных частиц в механизме формирования персистенции можно представить следующим образом (рис. 5).
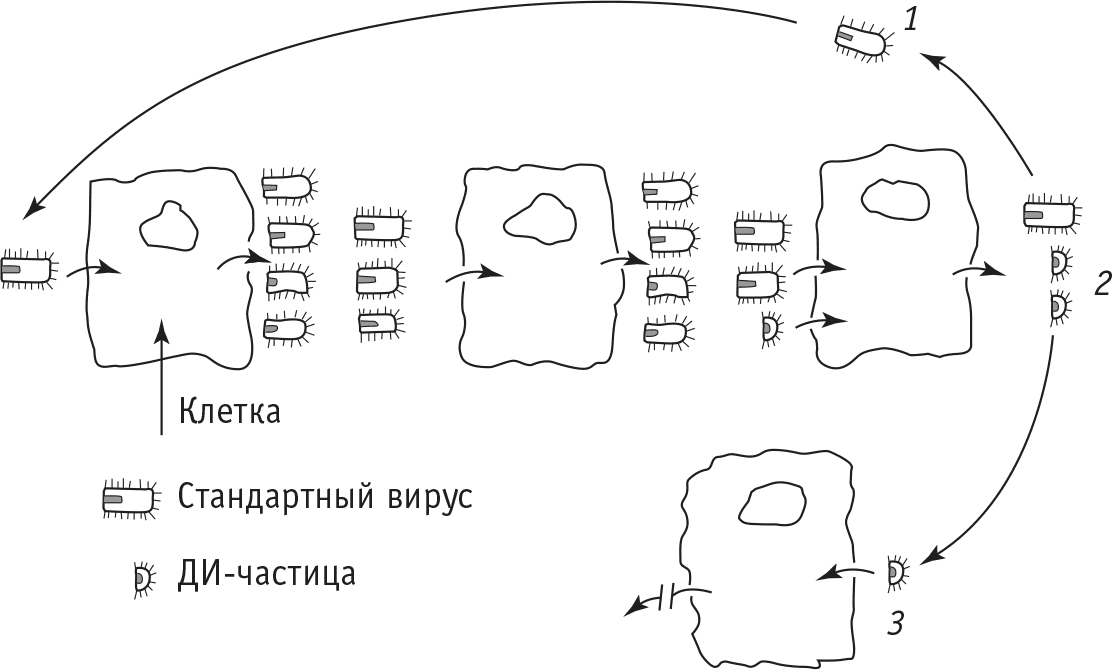 Рис. 5. Схема образования в клетках дефектных интерферирующих (ДИ) вирусных частиц: 1 – стандартная частица заражает клетку, которая после этого дает новый «урожай» стандартных частиц; 2 – дефектная частица заражает клетку совместно со стандартными частицами, в результате чего в клетке образуется «урожай» новых вирусных частиц, среди которых дефектные будут преобладающими; 3 – клетка, зараженная только дефектными частицами, не будет давать «урожая» вирусного потомства, и в таких клетках не будет происходить размножение стандартных частиц
Рис. 5. Схема образования в клетках дефектных интерферирующих (ДИ) вирусных частиц: 1 – стандартная частица заражает клетку, которая после этого дает новый «урожай» стандартных частиц; 2 – дефектная частица заражает клетку совместно со стандартными частицами, в результате чего в клетке образуется «урожай» новых вирусных частиц, среди которых дефектные будут преобладающими; 3 – клетка, зараженная только дефектными частицами, не будет давать «урожая» вирусного потомства, и в таких клетках не будет происходить размножение стандартных частиц
Процесс последовательных заражений клеток (и в клеточной культуре, и в организме) обладает одной особенностью. Очень редко случается так, чтобы в клетке, зараженной стандартной частицей, среди накапливающегося потомства вируса появлялась хотя бы одна дефектная частица. Но если это все же происходит, то дефектные частицы, используя недостающие «инструменты» стандартных частиц, имеющиеся тут же, в клетке («под рукой»), начинают активно размножаться и делают это значительно быстрее, чем стандартные частицы, так как у дефектных генетического материала меньше, а стало быть, и собрать его можно быстрее. Выйдя из клетки вместе со стандартными частицами, дефектные теперь уже заражают новые клетки, в которых стандартные частицы уже размножаться не смогут, так как места в клетке уже «заняты». Такое явление называют интерференцией или исключением активности. Вместе с тем при одномоментном заражении новых клеток и дефектными, и стандартными частицами начинается одновременное размножение как тех, так и других, и опять дефектные будут опережать в этом стандартные вирусные частицы. Понятно, что очень скоро среди всего потомства вируса дефектные частицы станут преобладающими и будут защищать от стандартного вируса те клетки, в которых они (дефектные) находятся.
В 1977 году в Москве в Институте эпидемиологии и микробиологии им. Η. Ф. Гамалеи Л. А. Денисов привел прямые доказательства ведущей роли дефектных частиц вируса гриппа в формировании и поддержании латентной формы инфекции. Ученый разработал метод обогащения вирусного препарата (по выбору исследователя) дефектными или стандартными вирусными частицами. Используя свой метод, он заражал как теми, так и другими препаратами вируса клеточные культуры, которые до этого считались нечувствительными к вирусу гриппа. И вот что было обнаружено.
При заражении клеток большой дозой вируса, обогащенного стандартными частицами, в так называемых нечувствительных клетках развивалась острая инфекция – клетки дегенерировали и погибали, а в питательную среду выходило большое количество частиц вновь синтезированного вируса гриппа. Если же такие клетки заражались тем же самым препаратом вируса, но в маленькой дозе, то формировалась скрытая инфекция, при которой клетки продолжали хорошо размножаться, не обнаруживали ни малейших признаков заболевания, но вместе с тем из таких клеток в питательную среду постоянно выделялся инфекционный вирус гриппа.
Но вот исследователь заразил клетки препаратом вируса, обогащенным дефектными частицами – в клетках не было обнаружено ни признаков заболевания, ни признаков присутствия вируса. Тогда Л. А. Денисов заражает клетки таким же препаратом, но в очень большой дозе. И вновь та же картина. Но что интересно: после заражения клетки стали размножаться быстрее и оказались устойчивыми даже к заражению стандартными частицами вируса. Прошло немало дней напряженного поиска, прежде чем Л. А. Денисову в содружестве со специалистом по электронной микроскопии из Института вирусологии им. Д. И. Ивановского А. А. Маныкиным удалось обнаружить в клетках такой культуры рибонуклеопротеидные (рибонуклеиновая кислота, связанная с белком) структуры вируса гриппа, которые, однако, были значительно короче, чем подобные структуры внутри стандартных вирусных частиц. Таким образом, латентная гриппозная инфекция этих клеток была доказана!
Пытаясь ответить на эти вопросы, мы должны будем коснуться столь важной проблемы, как саморегуляция у вирусов. Представьте ситуацию, при которой дефектных частиц нарабатывается все больше и больше. К чему это приведет? Совершенно ясно – к постепенному уменьшению количества стандартного вируса, так как мы помним, что в клетку, занятую дефектной частицей, стандартная частица попасть не может. Но подобный ход развития событий тоже не может остаться без последствий: стандартного вируса будет нарабатываться все меньше и меньше, все большее число клеток будет заниматься дефектными вирусными частицами, но сами-то они не способны к размножению… Им требуется помощник в лице стандартной вирусной частицы, а помощников стало очень мало. Поэтому интенсивность размножения дефектных частиц будет быстро снижаться. А следовательно, меньше клеток будет заражаться дефектными частицами, и в свободные от них клетки с успехом проникнут стандартные вирусные частицы. В связи с этим продукция стандартных вирусных частиц вновь увеличится. И до каких пор это будет происходить? До тех пор, пока среди стандартных частиц не появятся дефектные, а они появляются тем чаще, чем более массивной дозой заражается клетка. Появившиеся дефектные частицы начинают успешно размножаться, так как в этот момент у них много помощников (т. е. стандартных частиц), число дефектных частиц вновь возрастает, и все повторяется сначала. Таким образом, в самой популяции вируса заложен механизм, регулирующий и численность популяции, и ее качество.
Однако объяснить механизм формирования и длительного поддержания персистенции вирусов в организме хозяина присутствием и своеобразным эффектом дефектных вирусных частиц можно не всегда.
Уже шла речь о том, что много лет назад была открыта латентная вирусная инфекция у бактерий – лизогения, при которой дезоксирибонуклеиновая кислота (генетический материал) бактериофага объединяется (интегрирует) с хромосомой бактериальной клетки и в дальнейшем расщепляется как составная часть хромосомы в процессе клеточного деления. Наличие строгих доказательств интеграции генетического материала бактериофага с генетическим материалом бактериальной клетки и широкая распространенность лизогенных бактерий в природе наводили на мысль о возможности существования подобных взаимоотношений между вирусами животных и клетками животного организма.
 Лев Александрович Зильбер
Лев Александрович Зильбер
В 1946 году отечественный вирусолог Л. А. Зильбер (см. фото) выдвинул вирусную теорию происхождения опухолей, согласно которой вирус играет роль пускового механизма злокачественного процесса. Позднее в результате больших успехов в изучении лизогении Л. А. Зильбер значительно расширил и уточнил положения теории, названной им вирусо-генетической теорией происхождения опухолей. Ее главным постулатом как раз и стал факт объединения генетического материала опухолевого вируса с генетическим материалом клетки человека или животных.
Прошло много лет. В 1968 году в лаборатории американского вирусолога Р. Дюльбекко было доказано, что два известных опухолевых вируса – вирус полиомы и обезьяний 0В40 – поддерживают скрытую форму инфекции в клетках благодаря интеграции их ДНК с ДНК животной клетки. Публикации этих работ положили конец многолетним спорам о возможности существования для вирусов животных такого же типа взаимодействия с клеткой, как хорошо и давно известный в области бактериофагии. А спустя несколько лет интеграционный механизм был выявлен также и при латентной инфекции клеточных культур вирусами герпеса и аденовирусами.
Казалось бы, наступила пора торжества положений вирусо-генетической теории происхождения опухолей. Однако все эти открытия были связаны с вирусами, генетический материал (геном) которых представлен ДНК. Так как геном клетки высших организмов также представляет собой молекулу ДНК, то возможность интеграции двух геномов одинаковой химической природы не вызывала сомнений. И вот тут-то мы подходим, казалось бы, к наиболее уязвимому месту вирусо-генетической теории происхождения опухолей. Ведь большинство скрытых опухолевых вирусов животных являются РНК-содержащими! Это было давно известно и, откровенно говоря, очень затрудняло теоретическое объяснение возможной интеграции геномов таких вирусов с клеточным геномом.
Работы по разрешению этого кажущегося противоречия были начаты американским биохимиком X. Теминым, который еще в 1964 году обнаружил в клетках, зараженных РНК-содержащим вирусом саркомы Рауса, процесс синтеза ДНК, никогда не встречавшейся в незараженных этим вирусом клетках. Позднее X. М. Темин со своим сотрудником С. Мизутани и одновременно и независимо от них в другой лаборатории США Д. Балтимор открыли в составе частиц некоторых вирусов новый фермент – РНК-зависимую ДНК-полимеразу, уже само название которого говорит о его функции: с его помощью осуществляется построение молекул ДНК на матрице (основе) РНК. И именно такая вновь синтезированная ДНК интегрирует с ДНК клетки.
Эти открытия объясняли возможность интеграции геномов РНК-содержащих вирусов с геномом клетки и, таким образом, окончательно доказывали справедливость положений вирусо-генетической теории происхождения опухолей, тем более что фермент РНК-зависимая ДНК-полимераза (получивший название обратная транскриптаза или, еще короче, ревертаза) вскоре был обнаружен в составе частиц всех (!) РНК-содержащих опухолевых вирусов.
Однако возможностью интеграции геномов не исчерпываются механизмы вирусной персистенции. Так, несколько лет назад в одной из лабораторий изучали длительную персистенцию вируса ящура в организме теленка. При этом выяснился очень интересный факт: на протяжении года от этого теленка постоянно удавалось выделять вирус, который не размножался в культуре чувствительных клеток, если их после заражения культивировали при температуре 41 °С, т. е. соответствующей температуре тела теленка. Вместе с тем если такие же зараженные вирусом клетки инкубировали при температуре 37 °С, то вирус в них начинал активно размножаться и в конечном счете даже вызывал разрушение клеток.
Чем же вызвано подобное различие в поведении вируса в одних и тех же клетках? Оказалось, все дело в так называемых температурочувствительных мутантах. В результате мутационных изменений в геноме вируса иногда может быть затронут участок, который определяет синтез специального фермента – полимеразы, осуществляющего конструирование вирусных нуклеиновых кислот (геномов) при размножении вируса внутри клетки. При этом изменения в ферменте могут иметь весьма своеобразные последствия: фермент перестает работать или работает плохо при той температуре, при которой обычно вирус хорошо размножается. Но при этом, как оказалось, фермент успешно функционирует при более низкой температуре. Потому-то такие вирусные мутанты и назвали температурочувствительными.
Теперь представим себе, что группа клеток заражена температурочувствительным вирусом, но помещена в обычные для стандартного вируса температурные условия. Понятно, что такой мутантный вирус размножаться будет плохо, что приведет к накоплению в клетках вирусных «полупродуктов», образования же зрелого, полноценного вируса, имеющего в своем составе все необходимое, происходить не будет. Именно вирусные «полупродукты» будут персистировать в клетках. Нередко наличие в клетках таких «полупродуктов» может привести к совершенно неожиданным последствиям.
Вот один из примеров. Реовирус вызываету человека заболевание верхних дыхательных путей, диарею и жирный понос. Введение обычного штамма реовируса в мозг новорожденным крысятам вызывает у них скорое развитие острого энцефалита с высокой смертностью. Если же таких животных заражают температурочувствительным мутантом реовируса, то крысята в течение нескольких месяцев выглядят совершенно здоровыми, но затем у них медленно развивается гидроцефалия, которая постепенно прогрессирует и в конце концов заканчивается гибелью животных.
Такие вирусные частицы, не способные к размножению, получили название дефектных. Их поведение напоминает таковое «собаки на сене»: они не размножаются сами и, находясь внутри клетки, препятствуют размножению стандартных вирусных частиц. Однако при одновременном заражении клетки как дефектной, так и стандартной частицами картина меняется: дефектные частицы начинают размножаться, используя недостающие «инструменты» стандартных частиц. Поэтому роль дефектных вирусных частиц в механизме формирования персистенции можно представить следующим образом (рис. 5).

Процесс последовательных заражений клеток (и в клеточной культуре, и в организме) обладает одной особенностью. Очень редко случается так, чтобы в клетке, зараженной стандартной частицей, среди накапливающегося потомства вируса появлялась хотя бы одна дефектная частица. Но если это все же происходит, то дефектные частицы, используя недостающие «инструменты» стандартных частиц, имеющиеся тут же, в клетке («под рукой»), начинают активно размножаться и делают это значительно быстрее, чем стандартные частицы, так как у дефектных генетического материала меньше, а стало быть, и собрать его можно быстрее. Выйдя из клетки вместе со стандартными частицами, дефектные теперь уже заражают новые клетки, в которых стандартные частицы уже размножаться не смогут, так как места в клетке уже «заняты». Такое явление называют интерференцией или исключением активности. Вместе с тем при одномоментном заражении новых клеток и дефектными, и стандартными частицами начинается одновременное размножение как тех, так и других, и опять дефектные будут опережать в этом стандартные вирусные частицы. Понятно, что очень скоро среди всего потомства вируса дефектные частицы станут преобладающими и будут защищать от стандартного вируса те клетки, в которых они (дефектные) находятся.
При определенном соотношении скорости процессов активного синтеза дефектных вирусных частиц и синтеза весьма небольшого количества стандартных частиц инфекционный процесс начинает протекать в латентной форме.Подтверждением того, что описанное выше совершается именно так, а не иначе, служат следующие факты. Во-первых, дефектные интерферирующие вирусные частицы обнаружены в популяциях очень многих вирусов – гриппа человека, полиомиелита, бешенства, везикулярного стоматита, лимфоцитарного хориоменингита, клещевого энцефалита, японского энцефалита, лихорадки долины Рифт, гриппа птиц, парагриппа, обезьяньих вирусов, аденовирусов и многих других. Во-вторых, при ряде скрытых вирусных инфекций удалось выделить дефектные интерферирующие частицы из организма зараженных животных и человека, а также из зараженных клеточных культур.
В 1977 году в Москве в Институте эпидемиологии и микробиологии им. Η. Ф. Гамалеи Л. А. Денисов привел прямые доказательства ведущей роли дефектных частиц вируса гриппа в формировании и поддержании латентной формы инфекции. Ученый разработал метод обогащения вирусного препарата (по выбору исследователя) дефектными или стандартными вирусными частицами. Используя свой метод, он заражал как теми, так и другими препаратами вируса клеточные культуры, которые до этого считались нечувствительными к вирусу гриппа. И вот что было обнаружено.
При заражении клеток большой дозой вируса, обогащенного стандартными частицами, в так называемых нечувствительных клетках развивалась острая инфекция – клетки дегенерировали и погибали, а в питательную среду выходило большое количество частиц вновь синтезированного вируса гриппа. Если же такие клетки заражались тем же самым препаратом вируса, но в маленькой дозе, то формировалась скрытая инфекция, при которой клетки продолжали хорошо размножаться, не обнаруживали ни малейших признаков заболевания, но вместе с тем из таких клеток в питательную среду постоянно выделялся инфекционный вирус гриппа.
Но вот исследователь заразил клетки препаратом вируса, обогащенным дефектными частицами – в клетках не было обнаружено ни признаков заболевания, ни признаков присутствия вируса. Тогда Л. А. Денисов заражает клетки таким же препаратом, но в очень большой дозе. И вновь та же картина. Но что интересно: после заражения клетки стали размножаться быстрее и оказались устойчивыми даже к заражению стандартными частицами вируса. Прошло немало дней напряженного поиска, прежде чем Л. А. Денисову в содружестве со специалистом по электронной микроскопии из Института вирусологии им. Д. И. Ивановского А. А. Маныкиным удалось обнаружить в клетках такой культуры рибонуклеопротеидные (рибонуклеиновая кислота, связанная с белком) структуры вируса гриппа, которые, однако, были значительно короче, чем подобные структуры внутри стандартных вирусных частиц. Таким образом, латентная гриппозная инфекция этих клеток была доказана!
Проведенные эксперименты показали: изменяя в одном и том же препарате соотношение дефектных и стандартных вирусных частиц, можно получать различные формы инфекционного процесса, а присутствие в таком препарате большого количества дефектных частиц вызывает формирование латентной инфекции.У вдумчивого читателя вполне естественно возникнут следующие вопросы: для чего дефектные интерферирующие вирусные частицы созданы природой? Почему в одной и той же вирусной «семье» существуют «два брата», из которых один (инфекционные частицы) «помогает» другому, а этот другой (дефектные частицы) только и делает, что «платит за помощь» постоянным стремлением помешать?
Пытаясь ответить на эти вопросы, мы должны будем коснуться столь важной проблемы, как саморегуляция у вирусов. Представьте ситуацию, при которой дефектных частиц нарабатывается все больше и больше. К чему это приведет? Совершенно ясно – к постепенному уменьшению количества стандартного вируса, так как мы помним, что в клетку, занятую дефектной частицей, стандартная частица попасть не может. Но подобный ход развития событий тоже не может остаться без последствий: стандартного вируса будет нарабатываться все меньше и меньше, все большее число клеток будет заниматься дефектными вирусными частицами, но сами-то они не способны к размножению… Им требуется помощник в лице стандартной вирусной частицы, а помощников стало очень мало. Поэтому интенсивность размножения дефектных частиц будет быстро снижаться. А следовательно, меньше клеток будет заражаться дефектными частицами, и в свободные от них клетки с успехом проникнут стандартные вирусные частицы. В связи с этим продукция стандартных вирусных частиц вновь увеличится. И до каких пор это будет происходить? До тех пор, пока среди стандартных частиц не появятся дефектные, а они появляются тем чаще, чем более массивной дозой заражается клетка. Появившиеся дефектные частицы начинают успешно размножаться, так как в этот момент у них много помощников (т. е. стандартных частиц), число дефектных частиц вновь возрастает, и все повторяется сначала. Таким образом, в самой популяции вируса заложен механизм, регулирующий и численность популяции, и ее качество.
Однако объяснить механизм формирования и длительного поддержания персистенции вирусов в организме хозяина присутствием и своеобразным эффектом дефектных вирусных частиц можно не всегда.
Уже шла речь о том, что много лет назад была открыта латентная вирусная инфекция у бактерий – лизогения, при которой дезоксирибонуклеиновая кислота (генетический материал) бактериофага объединяется (интегрирует) с хромосомой бактериальной клетки и в дальнейшем расщепляется как составная часть хромосомы в процессе клеточного деления. Наличие строгих доказательств интеграции генетического материала бактериофага с генетическим материалом бактериальной клетки и широкая распространенность лизогенных бактерий в природе наводили на мысль о возможности существования подобных взаимоотношений между вирусами животных и клетками животного организма.

В 1946 году отечественный вирусолог Л. А. Зильбер (см. фото) выдвинул вирусную теорию происхождения опухолей, согласно которой вирус играет роль пускового механизма злокачественного процесса. Позднее в результате больших успехов в изучении лизогении Л. А. Зильбер значительно расширил и уточнил положения теории, названной им вирусо-генетической теорией происхождения опухолей. Ее главным постулатом как раз и стал факт объединения генетического материала опухолевого вируса с генетическим материалом клетки человека или животных.
Прошло много лет. В 1968 году в лаборатории американского вирусолога Р. Дюльбекко было доказано, что два известных опухолевых вируса – вирус полиомы и обезьяний 0В40 – поддерживают скрытую форму инфекции в клетках благодаря интеграции их ДНК с ДНК животной клетки. Публикации этих работ положили конец многолетним спорам о возможности существования для вирусов животных такого же типа взаимодействия с клеткой, как хорошо и давно известный в области бактериофагии. А спустя несколько лет интеграционный механизм был выявлен также и при латентной инфекции клеточных культур вирусами герпеса и аденовирусами.
Казалось бы, наступила пора торжества положений вирусо-генетической теории происхождения опухолей. Однако все эти открытия были связаны с вирусами, генетический материал (геном) которых представлен ДНК. Так как геном клетки высших организмов также представляет собой молекулу ДНК, то возможность интеграции двух геномов одинаковой химической природы не вызывала сомнений. И вот тут-то мы подходим, казалось бы, к наиболее уязвимому месту вирусо-генетической теории происхождения опухолей. Ведь большинство скрытых опухолевых вирусов животных являются РНК-содержащими! Это было давно известно и, откровенно говоря, очень затрудняло теоретическое объяснение возможной интеграции геномов таких вирусов с клеточным геномом.
Работы по разрешению этого кажущегося противоречия были начаты американским биохимиком X. Теминым, который еще в 1964 году обнаружил в клетках, зараженных РНК-содержащим вирусом саркомы Рауса, процесс синтеза ДНК, никогда не встречавшейся в незараженных этим вирусом клетках. Позднее X. М. Темин со своим сотрудником С. Мизутани и одновременно и независимо от них в другой лаборатории США Д. Балтимор открыли в составе частиц некоторых вирусов новый фермент – РНК-зависимую ДНК-полимеразу, уже само название которого говорит о его функции: с его помощью осуществляется построение молекул ДНК на матрице (основе) РНК. И именно такая вновь синтезированная ДНК интегрирует с ДНК клетки.
Эти открытия объясняли возможность интеграции геномов РНК-содержащих вирусов с геномом клетки и, таким образом, окончательно доказывали справедливость положений вирусо-генетической теории происхождения опухолей, тем более что фермент РНК-зависимая ДНК-полимераза (получивший название обратная транскриптаза или, еще короче, ревертаза) вскоре был обнаружен в составе частиц всех (!) РНК-содержащих опухолевых вирусов.
Итак, в основе превращения нормальной клетки в опухолевую лежит интеграция вирусных ДНК-копий, либо собственно вирусных, либо построенных на основе вирусной РНК, с клеточной ДНК. Поэтому, желая установить вирусную природу той или иной опухоли, в составе ДНК клеток ищут молекулы вирусных ДНК, для чего на сегодняшний день имеется несколько довольно чувствительных и точных методов. Следовательно, механизм интеграции ДНК вируса и клетки хозяина является правилом.Но, как мы хорошо знаем, нет правил без исключений. Есть исключение и из правила превращения нормальной клетки в опухолевую. Речь идет о некоторых ДНК-содержащих вирусах, ДНК которых может персистировать (существовать длительное время) не будучи интегрированной с ДНК клетки, а в свободном (автономном) состоянии. Такие вирусные ДНК располагаются в клеточной цитоплазме, под их влиянием клетка превращается в раковую. В подобных клетках вирус продолжает существовать (персистировать) в виде изолированных вирусных ДНК, не связанных с клеточным геномом.
Однако возможностью интеграции геномов не исчерпываются механизмы вирусной персистенции. Так, несколько лет назад в одной из лабораторий изучали длительную персистенцию вируса ящура в организме теленка. При этом выяснился очень интересный факт: на протяжении года от этого теленка постоянно удавалось выделять вирус, который не размножался в культуре чувствительных клеток, если их после заражения культивировали при температуре 41 °С, т. е. соответствующей температуре тела теленка. Вместе с тем если такие же зараженные вирусом клетки инкубировали при температуре 37 °С, то вирус в них начинал активно размножаться и в конечном счете даже вызывал разрушение клеток.
Чем же вызвано подобное различие в поведении вируса в одних и тех же клетках? Оказалось, все дело в так называемых температурочувствительных мутантах. В результате мутационных изменений в геноме вируса иногда может быть затронут участок, который определяет синтез специального фермента – полимеразы, осуществляющего конструирование вирусных нуклеиновых кислот (геномов) при размножении вируса внутри клетки. При этом изменения в ферменте могут иметь весьма своеобразные последствия: фермент перестает работать или работает плохо при той температуре, при которой обычно вирус хорошо размножается. Но при этом, как оказалось, фермент успешно функционирует при более низкой температуре. Потому-то такие вирусные мутанты и назвали температурочувствительными.
Теперь представим себе, что группа клеток заражена температурочувствительным вирусом, но помещена в обычные для стандартного вируса температурные условия. Понятно, что такой мутантный вирус размножаться будет плохо, что приведет к накоплению в клетках вирусных «полупродуктов», образования же зрелого, полноценного вируса, имеющего в своем составе все необходимое, происходить не будет. Именно вирусные «полупродукты» будут персистировать в клетках. Нередко наличие в клетках таких «полупродуктов» может привести к совершенно неожиданным последствиям.
Вот один из примеров. Реовирус вызываету человека заболевание верхних дыхательных путей, диарею и жирный понос. Введение обычного штамма реовируса в мозг новорожденным крысятам вызывает у них скорое развитие острого энцефалита с высокой смертностью. Если же таких животных заражают температурочувствительным мутантом реовируса, то крысята в течение нескольких месяцев выглядят совершенно здоровыми, но затем у них медленно развивается гидроцефалия, которая постепенно прогрессирует и в конце концов заканчивается гибелью животных.
Конец бесплатного ознакомительного фрагмента
