В настоящее время на суше известно около 850 активных вулканов. Их еще больше на дне морей и океанов. С вулканическими газами выходят огромные массы соединений хлора, серы, фтора, брома, иода, но главным и основным компонентом этих газов служат пары воды. Проявления этих процессов в отдаленном прошлом были значительно более мощными. При выплавлении твердого вещества земной коры выносилось огромное количество паров воды и газов. Если сравнить отношение масс гидросферы и земной коры, то окажется, что вода составляет 6–7 % от массы земной коры. Примечательно, что при излиянии базальтов пары воды выделяются примерно в таком же количестве. Таким образом, выплавление первичной коры базальтового состава сопровождалось выносом паров воды, за счет которых был образован древний океан.
Процесс дегазации мантии и поступавшего метеоритного вещества осуществлялся наиболее активно на первых этапах развития планеты. В образовавшейся газовой оболочке помимо паров воды преобладали газы типа На, HF, HJ, НВг, H2S, H2SO4, CH4, NH3, B(OH)3. В дальнейшем пары воды и некоторые газы сконденсировались и образовались древняя атмосфера и первичный океан, в водах которого было растворено большое количество соляной и других кислот. По мнению одних ученых, основной объем современного Мирового океана был сформирован на первом этапе истории Земли, на протяжении 1 млрд лет. Другие предполагают, что этот процесс был более длительным. В любом случае под воздействием кислых вод гидросферы происходило энергичное выщелачивание катионов из первичной коры и в океанической воде постепенно эволюционировало соотношение анионов и катионов.
Приведенные данные показывают, насколько тесно взаимосвязано образование трех наружных оболочек Земли. Поэтому современное геохимическое состояние Мирового океана можно понять лишь ознакомившись с геохимией атмосферы. Этой проблеме посвящена следующая глава.
Контрольные вопросы
Задания для самостоятельной работы
Глава III
Массообмен газов и паров в географической оболочке
Атмосфера как дисперсная система и геохимия аэрозолей
Процесс дегазации мантии и поступавшего метеоритного вещества осуществлялся наиболее активно на первых этапах развития планеты. В образовавшейся газовой оболочке помимо паров воды преобладали газы типа На, HF, HJ, НВг, H2S, H2SO4, CH4, NH3, B(OH)3. В дальнейшем пары воды и некоторые газы сконденсировались и образовались древняя атмосфера и первичный океан, в водах которого было растворено большое количество соляной и других кислот. По мнению одних ученых, основной объем современного Мирового океана был сформирован на первом этапе истории Земли, на протяжении 1 млрд лет. Другие предполагают, что этот процесс был более длительным. В любом случае под воздействием кислых вод гидросферы происходило энергичное выщелачивание катионов из первичной коры и в океанической воде постепенно эволюционировало соотношение анионов и катионов.
Приведенные данные показывают, насколько тесно взаимосвязано образование трех наружных оболочек Земли. Поэтому современное геохимическое состояние Мирового океана можно понять лишь ознакомившись с геохимией атмосферы. Этой проблеме посвящена следующая глава.
Контрольные вопросы
1. Что понимают под термином «соленость морской воды» и в каких пределах этот показатель меняется в разных точках Мирового океана?
2. Перечислите главные катионы и анионы морской воды. Меняется ли их соотношение при изменении солености?
3. Каковы источники поступления катионов и анионов в систему Мирового океана?
4. Укажите отличительные особенности состава речных вод по сравнению с морскими.
5. Как определяется интенсивность вовлечения химических элементов в водную миграцию? Напишите формулу коэффициента водной миграции (Кв).
6. Какие процессы происходят при преобразовании речной воды в морскую на контакте река – море?
7. Каковы интервалы времени полного выведения массы («время жизни») разных химических элементов, растворенных в объеме Мирового океана?
8. Какие химические элементы называются талассофильны ми? Приведите примеры.
2. Перечислите главные катионы и анионы морской воды. Меняется ли их соотношение при изменении солености?
3. Каковы источники поступления катионов и анионов в систему Мирового океана?
4. Укажите отличительные особенности состава речных вод по сравнению с морскими.
5. Как определяется интенсивность вовлечения химических элементов в водную миграцию? Напишите формулу коэффициента водной миграции (Кв).
6. Какие процессы происходят при преобразовании речной воды в морскую на контакте река – море?
7. Каковы интервалы времени полного выведения массы («время жизни») разных химических элементов, растворенных в объеме Мирового океана?
8. Какие химические элементы называются талассофильны ми? Приведите примеры.
Задания для самостоятельной работы
1. Сопоставьте данные о составе рек Восточно-Европейской равнины, впадающих в Черное и Каспийское моря, и в Белое и Баренцево. Сделайте выводы об общих чертах состава речных вод и имеющихся отклонениях.
2. По имеющимся данным рассчитайте коэффициенты водной миграции химических элементов, содержащихся в воде рек из разных районов, и сделайте выводы об общих закономерностях интенсивности водной миграции.
3. Кратко изложите развитие взглядов на процесс формирования состава воды Мирового океана.
2. По имеющимся данным рассчитайте коэффициенты водной миграции химических элементов, содержащихся в воде рек из разных районов, и сделайте выводы об общих закономерностях интенсивности водной миграции.
3. Кратко изложите развитие взглядов на процесс формирования состава воды Мирового океана.
Глава III
ГЕОХИМИЯ АТМОСФЕРЫ И ПОНЯТИЕ О ЦИКЛАХ МИГРАЦИИ В ГЕОГРАФИЧЕСКОЙ ОБОЛОЧКЕ
Массообмен газов и паров в географической оболочке
Газовое вещество атмосферы на 99,8 % состоит из трех химических элементов: азота (75 %), кислорода (23,01 %) и аргона (1,28 %). Кроме того, присутствуют в сильно варьирующем количестве пары воды, оксид углерода (в среднем около 0,04 %), незначительная примесь неона, гелия, криптона, ксенона, метана, озона, оксидов азота и др.
Масса атмосферы около 5,27–1015 т. Основная часть газового вещества (80 %) заключена в тропосфере, верхняя граница которой расположена на высоте около 17 км на экваторе, а к полюсам снижается до 8—10 км. Тропосфера является областью активного взаимодействия с океаном и сушей, в ней сосредоточена основная масса паров воды и мелких твердых частиц, переносимых воздушными массами. Выше, на протяжении стратосферы и мезосферы, нарастает разреженность газов, сложно меняются термические условия. На высоте 25–30 км под воздействием солнечной радиации происходит фотодиссоциация молекул кислорода и образуется озон. Молекулы озона сильно рассеяны. Если бы они находились в условиях, обычных для поверхности Земли, под давлением в 1 атм., то мощность озонового слоя была бы меньше 1 см. Тем не менее этот очень разреженный слой озона поглощает 97 % ультрафиолетовой части солнечной радиации. Без этого экрана существование жизни на поверхности Земли было бы невозможно.
На удалении от 80 до 800 км от поверхности Земли располагается ионосфера – область сильно разреженного, ионизированного газа. Самая наружная часть газовой оболочки – экзосфера – простирается до 1800 км. Из этой сферы происходит диссипация – потеря Землей наиболее легких атомов, главным образом водорода.
Таково строение самой наружной оболочки Земли, состоящей преимущественно из свободных газов. Но газы находятся не только в свободном состоянии. В воде морей и океанов содержится в растворимом состоянии 4,32–1018 м3 газов. Этот объем в три раза больше всего объема воды Мирового океана.
Между атмосферой, точнее тропосферой, и поверхностным слоем воды океана существует подвижное равновесие. Растворение газов в воде зависит от температуры и солености. Холодные воды растворяют больше газов. Поэтому океан в холодное время года поглощает газы из атмосферы, а в теплое время – выделяет их. В пресных водах газы растворяются больше, чем в соленых. В среднем в 1 л океанической воды содержится растворенных газов: азота – 13 см3, кислорода – от 2 до 8 см3, аргона – 0,32 см3, а углекислого газа – до 50 см3. Столь большое количество углекислого газа имеет весьма важное значение. Растворяясь в воде, он вступает в химическое взаимодействие с Н2О. При этом образуется угольная кислота: СО2 + H^ ^ H2CO3. Эта кислота как двухосновная диссоциирует ступенчато. Сначала идет реакция Н2СО3 ^ Н+ + [НСО3] – и только потом [НСО3] – диссоциирует на на Н+ и СО32-.
В океанической воде растворяется СО2 + Н2СО3 около 1 мг/л, а с продуктами диссоциации содержится как указано выше до 50 мг/л. Согласно подсчетам известного геохимика А.П. Виноградова, в атмосфере находится 2,6-1018 г СО2. В океанической воде суммарное содержание СО2 + [НСО3] – + [СО3]2-около 1,4-1020 г, т. е. почти в 60 раз больше, чем в атмосфере. По нашим подсчетам количество СО2 в океане даже несколько больше.
Присутствие в воде двухосновной угольной кислоты создает химическую буферную систему карбонат-бикарбонатного равновесия:
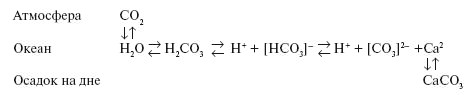
Приведенная реакция является лишь схемой сложных химических и биохимических превращений, в значительной мере происходящих под воздействием жизнедеятельности планктонных оганизмов.
Если в воду поступает избыточное количество кислот (например, при подводных вулканических извержениях), то происходит растворение СаСО3, кислоты нейтрализуются и кислотность (рН) воды поддерживается на исходном уровне. Если же увеличивается щелочность воды (например, при усиленном поступлении натрия), то сразу же усиливается растворение углекислого газа и образующаяся при этом угольная кислота нейтрализует щелочи. Кислотность (рН) воды и в этом случае сохранится на исходном уровне. Итак, благодаря присутствию углекислого газа в воздухе и ионов кальция в воде, действует буферный механизм, обеспечивающий стабильность рН океанической воды и тем самым устойчивость условий жизни морских организмов.
Углекислый газ интенсивно растворяется холодными водами приполярных районов. Охлаждаясь, эти воды увеличивают свою массу и опускаются на глубину. Перемещаясь к экватору, они постепенно нагреваются, поднимаются наверх и освобождаются от избытка СО2. По образному выражению А.П. Виноградова, «океан действует как грандиозный насос, забирая СО2 из атмосферы в холодных областях и отдавая ее в тропических областях»[2].
Итак, в результате растворения газов в воде между гидросферой и атмосферой происходит непрерывный циклический обмен, благодаря которому существует динамическое равновесие. В этом глобальном процессе участвует также сама вода в результате испарения и конденсации. Согласно данным М.И. Львовича (1986), на протяжении года с поверхности Мирового океана испаряется около 456 тыс. км3 воды, с поверхности дренируемой части суши – 62 тыс., выпадает атмосферных осадков на акваторию 411 тыс., на дренируемую часть суши – 106 тыс. км3. Баланс поддерживается за счет 44 тыс. км3 воды, стекающей ежегодно с суши в моря и океаны. Эти данные условны, другие авторы приводят иные величины, однако их порядки подтверждаются. Наиболее точно определена величина стока с суши.
Таким образом, в кругооборот через атмосферу вовлекается примерно 500 тыс. км3 воды ежегодно. Значение этого глобального процесса трудно переоценить: благодаря ему осуществляется регулирование теплового режима планеты и сохраняются условия существования жизни. Вместе с тем природные воды – не только химическое соединение, обладающее определенными физическими свойствами, но также активный носитель химических элементов. Поэтому движение огромных масс воды в системе океан – атмосфера – суша – океан имеет весьма важное значение для геохимии географической оболочки.
Масса атмосферы около 5,27–1015 т. Основная часть газового вещества (80 %) заключена в тропосфере, верхняя граница которой расположена на высоте около 17 км на экваторе, а к полюсам снижается до 8—10 км. Тропосфера является областью активного взаимодействия с океаном и сушей, в ней сосредоточена основная масса паров воды и мелких твердых частиц, переносимых воздушными массами. Выше, на протяжении стратосферы и мезосферы, нарастает разреженность газов, сложно меняются термические условия. На высоте 25–30 км под воздействием солнечной радиации происходит фотодиссоциация молекул кислорода и образуется озон. Молекулы озона сильно рассеяны. Если бы они находились в условиях, обычных для поверхности Земли, под давлением в 1 атм., то мощность озонового слоя была бы меньше 1 см. Тем не менее этот очень разреженный слой озона поглощает 97 % ультрафиолетовой части солнечной радиации. Без этого экрана существование жизни на поверхности Земли было бы невозможно.
На удалении от 80 до 800 км от поверхности Земли располагается ионосфера – область сильно разреженного, ионизированного газа. Самая наружная часть газовой оболочки – экзосфера – простирается до 1800 км. Из этой сферы происходит диссипация – потеря Землей наиболее легких атомов, главным образом водорода.
Таково строение самой наружной оболочки Земли, состоящей преимущественно из свободных газов. Но газы находятся не только в свободном состоянии. В воде морей и океанов содержится в растворимом состоянии 4,32–1018 м3 газов. Этот объем в три раза больше всего объема воды Мирового океана.
Между атмосферой, точнее тропосферой, и поверхностным слоем воды океана существует подвижное равновесие. Растворение газов в воде зависит от температуры и солености. Холодные воды растворяют больше газов. Поэтому океан в холодное время года поглощает газы из атмосферы, а в теплое время – выделяет их. В пресных водах газы растворяются больше, чем в соленых. В среднем в 1 л океанической воды содержится растворенных газов: азота – 13 см3, кислорода – от 2 до 8 см3, аргона – 0,32 см3, а углекислого газа – до 50 см3. Столь большое количество углекислого газа имеет весьма важное значение. Растворяясь в воде, он вступает в химическое взаимодействие с Н2О. При этом образуется угольная кислота: СО2 + H^ ^ H2CO3. Эта кислота как двухосновная диссоциирует ступенчато. Сначала идет реакция Н2СО3 ^ Н+ + [НСО3] – и только потом [НСО3] – диссоциирует на на Н+ и СО32-.
В океанической воде растворяется СО2 + Н2СО3 около 1 мг/л, а с продуктами диссоциации содержится как указано выше до 50 мг/л. Согласно подсчетам известного геохимика А.П. Виноградова, в атмосфере находится 2,6-1018 г СО2. В океанической воде суммарное содержание СО2 + [НСО3] – + [СО3]2-около 1,4-1020 г, т. е. почти в 60 раз больше, чем в атмосфере. По нашим подсчетам количество СО2 в океане даже несколько больше.
Присутствие в воде двухосновной угольной кислоты создает химическую буферную систему карбонат-бикарбонатного равновесия:
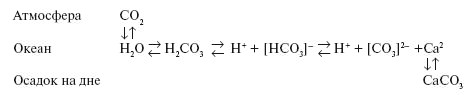
Приведенная реакция является лишь схемой сложных химических и биохимических превращений, в значительной мере происходящих под воздействием жизнедеятельности планктонных оганизмов.
Если в воду поступает избыточное количество кислот (например, при подводных вулканических извержениях), то происходит растворение СаСО3, кислоты нейтрализуются и кислотность (рН) воды поддерживается на исходном уровне. Если же увеличивается щелочность воды (например, при усиленном поступлении натрия), то сразу же усиливается растворение углекислого газа и образующаяся при этом угольная кислота нейтрализует щелочи. Кислотность (рН) воды и в этом случае сохранится на исходном уровне. Итак, благодаря присутствию углекислого газа в воздухе и ионов кальция в воде, действует буферный механизм, обеспечивающий стабильность рН океанической воды и тем самым устойчивость условий жизни морских организмов.
Углекислый газ интенсивно растворяется холодными водами приполярных районов. Охлаждаясь, эти воды увеличивают свою массу и опускаются на глубину. Перемещаясь к экватору, они постепенно нагреваются, поднимаются наверх и освобождаются от избытка СО2. По образному выражению А.П. Виноградова, «океан действует как грандиозный насос, забирая СО2 из атмосферы в холодных областях и отдавая ее в тропических областях»[2].
Итак, в результате растворения газов в воде между гидросферой и атмосферой происходит непрерывный циклический обмен, благодаря которому существует динамическое равновесие. В этом глобальном процессе участвует также сама вода в результате испарения и конденсации. Согласно данным М.И. Львовича (1986), на протяжении года с поверхности Мирового океана испаряется около 456 тыс. км3 воды, с поверхности дренируемой части суши – 62 тыс., выпадает атмосферных осадков на акваторию 411 тыс., на дренируемую часть суши – 106 тыс. км3. Баланс поддерживается за счет 44 тыс. км3 воды, стекающей ежегодно с суши в моря и океаны. Эти данные условны, другие авторы приводят иные величины, однако их порядки подтверждаются. Наиболее точно определена величина стока с суши.
Таким образом, в кругооборот через атмосферу вовлекается примерно 500 тыс. км3 воды ежегодно. Значение этого глобального процесса трудно переоценить: благодаря ему осуществляется регулирование теплового режима планеты и сохраняются условия существования жизни. Вместе с тем природные воды – не только химическое соединение, обладающее определенными физическими свойствами, но также активный носитель химических элементов. Поэтому движение огромных масс воды в системе океан – атмосфера – суша – океан имеет весьма важное значение для геохимии географической оболочки.
Атмосфера как дисперсная система и геохимия аэрозолей
Массообмен химических элементов в океане осуществляется на фоне глобального кругооборота воды. Благодаря этому процессу возможна непрекращающаяся миграция и дифференциация вещества на поверхности Земли. Этот процесс циклический. Движение химических элементов в одной половине этого цикла (суша – океан) достаточно ясно. Каково участие элементов в другой его половине – от океана к суше? Долгое время эта проблема не вызывала интереса, так как в геохимии атмосферы внимание ученых было направлено на изучение газов, включая пары воды. Такой на первый взгляд логичный подход к познанию газовой оболочки содержал существенный просчет.
Идея взаимопроникновения наружных оболочек при изучении атмосферы длительное время воспринималась как некое философское положение, а не явление, подлежащее изучению. В связи с этим следует обратить внимание на то, что подобно тому, как в Мировом океане присутствуют растворенные вещества и тонкие взвеси, в газовой оболочке содержатся не только свободные молекулы и ионы, но также распыленные частицы твердых веществ. Хотя познание их геохимии началось совсем недавно, уже ясно, что они играют в атмосфере не менее важную роль, чем дисперсные взвеси твердого вещества в Мировом океане.
Взвеси твердых частиц в газообразной среде называются аэрозолями. Аэрозольные частицы играют очень важную роль, являясь ядрами конденсации паров воды. Размеры этих частиц колеблются от нескольких микрометров[3] до их сотых и даже тысячных долей. Более мелкие частицы самостоятельно существовать не могут и присоединяются к другим. Есть электронейтральные и заряженные частицы. Последние состоят из нейтральных молекул, группирующихся вокруг иона. Количество электронейтральных частиц меньше 0,1 мкм (так называемых ядер Айткена) очень большое, но в силу своих ничтожных размеров они составляют всего 10–20 % от общей массы аэрозолей.
Как суша, так и океан находятся в состоянии непрерывного циклического обмена с нижними слоями атмосферы, поставляя аэрозольные частицы в воздух и получая их обратно в составе атмосферных осадков и в форме сухих осаждений. Частицы континентального происхождения относительно крупные, их средняя величина около 2–3 мкм. Над океанами преобладают более мелкие частицы, согласно А.П. Лисицину (1978), размером около 0,25 мм.
Концентрация аэрозольных частиц над континентами обычно измеряется десятками микрограммов в 1 м3 воздуха, над океанами на один – два математических порядка меньше. X. Юнге (1965) указывает, что содержание частиц в тропосфере быстро уменьшается до высоты 5 км, далее до 12 км остается более или менее постоянным и от 12 до 16 км вновь сильно убывает. По данным Е.С. Селезневой (1966), концентрация частиц на высоте 2 км в 10 раз меньше по сравнению с высотой 250 м.
Дисперсные частицы, поступившие в тропосферу, могут быть удалены из нее либо в результате осаждения под действием силы тяжести, либо путем вымывания атмосферными осадками. В нижней тропосфере над континентами длительность нахождения частиц в воздухе («время жизни аэрозолей») колеблется от двух дней до двух недель, наиболее обычна длительность около пяти – семи суток (Абрамовский и др., 1976). Время жизни аэрозольных частиц морской соли над океаном – от одних до трех суток (Юнге, 1965). В верхней тропосфере частицы находятся обычно от двух до четырех недель.
Крупные частицы аэрозолей выпадают очень быстро и вблизи от того места, где они вошли в тропосферу. Частицы величиной 3–5 мкм и мельче попадают под действие циркуляции воздуха в тропосфере и переносятся на значительные расстояния.
Хотя миграция основных масс аэрозолей происходит в тропосфере, очень небольшая их часть поступает в стратосферу. В ней отсутствуют пары воды. Предполагается, что удаление частиц связано с образованием хлопьев сульфатов («сульфатное вымывание»). Аэрозольные частицы задерживаются в стратосфере на время от четырех до 14 лет.
Состав и процессы образования континентальных и океанических аэрозолей сильно отличаются. На суше в тропосферу поступают твердые частицы с поверхности почвы, на море – растворимые в воде соли. Переход солей из морской воды в атмосферу широко известен, однако его механизм окончательно не выяснен. Долгое время ученые считали, что главная роль в этом процессе принадлежит сильным волнениям и штормам, во время которых усиленно разбрызгивается вода. В дальнейшем было обнаружено оригинальное явление, возможно имеющее весьма важное значение. За счет растворенных и сорбированных газов в воде океанов образуются микропузырьки, которые, соединяясь, достигают величины около 1 мм. Пузырьки поднимаются со все возрастающей скоростью к поверхности и, достигая ее, лопаются. При разрыве пузырьков в воздух выбрасываются остатки его пленки, которые подхватываются даже слабым ветром и увлекаются в более высокие слои тропосферы. Общее количество солей, поступающее в атмосферу в результате разрыва пленки воздушных пузырьков, по расчетам Д. Бланшера и Э. Эриксона, составляет около 10-12 г/см2 в сутки, т. е. со всей поверхности Мирового океана миллиарды и десятки миллиардов тонн в год.
Представление о массообмене между атмосферой, Мировым океаном и сушей можно получить путем количественного определения растворимых веществ, мигрирующих с атмосферными осадками. Средняя величина минерализации осадков над океаном близка к 10 мг/л, над сушей – 25 мг/л. Следовательно, с учетом данных о кругообороте воды на поверхности Земли с поверхности океана в атмосферу переходит около 4,5-109 т/год солей, суши – более 1,5-109 т/год. Кроме того, некоторое количество солей выпадает из атмосферы не в составе водных осадков, а в виде так называемых «сухих» осаждений, количество которых оценивается в 20 % от массы солей в осадках. Можно предполагать, что с учетом «сухих» осаждений с поверхности океана в атмосферу поступает более 5-109 т/год солей, а с поверхности суши более 2-109 т/год. Так как с океана на сушу переносится с воздушными массами 44–1012 м3 атмосферных осадков, то одновременно с ними переносится около 0,5-109 т/год солей океанического происхождения. Следовательно, в океан возвращается не вся масса солей, поступившая за год в атмосферу, а на 0,5-109 т солей меньше, а на сушу – больше на это количество.
Идея взаимопроникновения наружных оболочек при изучении атмосферы длительное время воспринималась как некое философское положение, а не явление, подлежащее изучению. В связи с этим следует обратить внимание на то, что подобно тому, как в Мировом океане присутствуют растворенные вещества и тонкие взвеси, в газовой оболочке содержатся не только свободные молекулы и ионы, но также распыленные частицы твердых веществ. Хотя познание их геохимии началось совсем недавно, уже ясно, что они играют в атмосфере не менее важную роль, чем дисперсные взвеси твердого вещества в Мировом океане.
Взвеси твердых частиц в газообразной среде называются аэрозолями. Аэрозольные частицы играют очень важную роль, являясь ядрами конденсации паров воды. Размеры этих частиц колеблются от нескольких микрометров[3] до их сотых и даже тысячных долей. Более мелкие частицы самостоятельно существовать не могут и присоединяются к другим. Есть электронейтральные и заряженные частицы. Последние состоят из нейтральных молекул, группирующихся вокруг иона. Количество электронейтральных частиц меньше 0,1 мкм (так называемых ядер Айткена) очень большое, но в силу своих ничтожных размеров они составляют всего 10–20 % от общей массы аэрозолей.
Как суша, так и океан находятся в состоянии непрерывного циклического обмена с нижними слоями атмосферы, поставляя аэрозольные частицы в воздух и получая их обратно в составе атмосферных осадков и в форме сухих осаждений. Частицы континентального происхождения относительно крупные, их средняя величина около 2–3 мкм. Над океанами преобладают более мелкие частицы, согласно А.П. Лисицину (1978), размером около 0,25 мм.
Концентрация аэрозольных частиц над континентами обычно измеряется десятками микрограммов в 1 м3 воздуха, над океанами на один – два математических порядка меньше. X. Юнге (1965) указывает, что содержание частиц в тропосфере быстро уменьшается до высоты 5 км, далее до 12 км остается более или менее постоянным и от 12 до 16 км вновь сильно убывает. По данным Е.С. Селезневой (1966), концентрация частиц на высоте 2 км в 10 раз меньше по сравнению с высотой 250 м.
Дисперсные частицы, поступившие в тропосферу, могут быть удалены из нее либо в результате осаждения под действием силы тяжести, либо путем вымывания атмосферными осадками. В нижней тропосфере над континентами длительность нахождения частиц в воздухе («время жизни аэрозолей») колеблется от двух дней до двух недель, наиболее обычна длительность около пяти – семи суток (Абрамовский и др., 1976). Время жизни аэрозольных частиц морской соли над океаном – от одних до трех суток (Юнге, 1965). В верхней тропосфере частицы находятся обычно от двух до четырех недель.
Крупные частицы аэрозолей выпадают очень быстро и вблизи от того места, где они вошли в тропосферу. Частицы величиной 3–5 мкм и мельче попадают под действие циркуляции воздуха в тропосфере и переносятся на значительные расстояния.
Хотя миграция основных масс аэрозолей происходит в тропосфере, очень небольшая их часть поступает в стратосферу. В ней отсутствуют пары воды. Предполагается, что удаление частиц связано с образованием хлопьев сульфатов («сульфатное вымывание»). Аэрозольные частицы задерживаются в стратосфере на время от четырех до 14 лет.
Состав и процессы образования континентальных и океанических аэрозолей сильно отличаются. На суше в тропосферу поступают твердые частицы с поверхности почвы, на море – растворимые в воде соли. Переход солей из морской воды в атмосферу широко известен, однако его механизм окончательно не выяснен. Долгое время ученые считали, что главная роль в этом процессе принадлежит сильным волнениям и штормам, во время которых усиленно разбрызгивается вода. В дальнейшем было обнаружено оригинальное явление, возможно имеющее весьма важное значение. За счет растворенных и сорбированных газов в воде океанов образуются микропузырьки, которые, соединяясь, достигают величины около 1 мм. Пузырьки поднимаются со все возрастающей скоростью к поверхности и, достигая ее, лопаются. При разрыве пузырьков в воздух выбрасываются остатки его пленки, которые подхватываются даже слабым ветром и увлекаются в более высокие слои тропосферы. Общее количество солей, поступающее в атмосферу в результате разрыва пленки воздушных пузырьков, по расчетам Д. Бланшера и Э. Эриксона, составляет около 10-12 г/см2 в сутки, т. е. со всей поверхности Мирового океана миллиарды и десятки миллиардов тонн в год.
Представление о массообмене между атмосферой, Мировым океаном и сушей можно получить путем количественного определения растворимых веществ, мигрирующих с атмосферными осадками. Средняя величина минерализации осадков над океаном близка к 10 мг/л, над сушей – 25 мг/л. Следовательно, с учетом данных о кругообороте воды на поверхности Земли с поверхности океана в атмосферу переходит около 4,5-109 т/год солей, суши – более 1,5-109 т/год. Кроме того, некоторое количество солей выпадает из атмосферы не в составе водных осадков, а в виде так называемых «сухих» осаждений, количество которых оценивается в 20 % от массы солей в осадках. Можно предполагать, что с учетом «сухих» осаждений с поверхности океана в атмосферу поступает более 5-109 т/год солей, а с поверхности суши более 2-109 т/год. Так как с океана на сушу переносится с воздушными массами 44–1012 м3 атмосферных осадков, то одновременно с ними переносится около 0,5-109 т/год солей океанического происхождения. Следовательно, в океан возвращается не вся масса солей, поступившая за год в атмосферу, а на 0,5-109 т солей меньше, а на сушу – больше на это количество.
Конец бесплатного ознакомительного фрагмента
