Страница:
На утилизацию аминокислот может влиять их сбалансированность в рационе. В экспериментальных исследованиях описаны токсические и антагонистические эффекты при несбалансированном приеме определенных аминокислот. Наиболее выраженными токсическими эффектами при избыточном введении обладают метионин, гистидин и тирозин. При этом отдельные аминокислоты (например аргинин) могут нейтрализовать токсический эффект других. Аминокислотный антагонизм характерен для структурно сходных аминокислот. Хорошо изучены антагонистические взаимоотношения между аминокислотами с ветвящимися цепями: лейцином, изолейцином и валином. Термин «аминокислотный дисбаланс» характеризует состояние, когда недостаток какой-либо лимитирующей аминокислоты ограничивает использование других в процессах синтеза белка. Однако все эти явления едва ли могут наблюдаться при нормальном потреблении пищи.
Потребность в белке при различных состояниях
Потребность в энергии
Глава 6 Роль витаминов в питании и коррекция нарушений витаминного обмена
Классификация витаминов
Причины неадекватной обеспеченности организма витаминами
Водорастворимые витамины
Витамин В1 (тиамин)
Метаболизм витамина В1
Дефицит витамина В1
Потребность в белке при различных состояниях
Зависимость потребности в белке от ряда факторов, прежде всего качественного состава потребляемого протеина и количества энергии, делает затруднительным определение конкретных рекомендуемых значений.
ВОЗ/ФАО (1985) установила суточную потребность в белке в размере 0,75 г/кг массы тела. Этот показатель был определен как «безопасный уровень потребления белка», то есть минимальное количество белка, которое может употребляться человеком без нанесения ущерба здоровью (табл. 5.2).
Отметим, что показатель «безопасного уровня потребления» подразумевает полную абсорбцию вводимого белка. При обычной смешанной диете до 10–15 % белка не усваивается, поэтому рекомендуется соответствующее увеличение квоты белка в рационе (до 0,83-0,86 г/кг массы тела).
Таблица 5.2
Суточные потребности в энергии и безопасный уровень потребления белка в сутки для взрослых (ВОЗ, 1990)
 * Не менее указанного значения.
* Не менее указанного значения.
Рекомендуемые нормы потребления белка значительно отличаются в различных странах. Такие различия во многом объясняются особенностями качественного состава национальных диет. В последние десятилетия в мире наметилась тенденция к снижению белкового компонента в рационе. Низкое, но адекватное содержание протеина в рационе, по мнению большинства исследователей, является более обоснованным, чем принятые ранее рекомендации по высокому потреблению белка. Эта позиция аргументируется нефротоксичным эффектом чрезмерных доз белка и тем, что в высокобелковых продуктах содержится много скрытых жиров. В противоречие с данной концепцией вступают исследования, утверждающие, что организм легко адаптируется к увеличению введения белка, и более высокие потребности и повышенная скорость преобразования белка в мышцах ассоциируются с более высоким уровнем его потребления.
В России традиционно рекомендуется достаточно высокий уровень потребления белка (см. Приложение 2). Экспертами Европейского регионарного отдела ВОЗ в 1992 г. был выделен ряд проблем питания российской популяции, среди которых отмечалось, что в РФ приняты завышенные нормы потребления белка (в особенности животного), насыщенных жиров, соотношения белковых и небелковых калорий в рационе.
Согласно приказу № 330 М3 РФ от 5.08.03 г. стандартной для питания больных в стационарах признана диета, содержащая белков 85–90 г, жиров 70–80 г, углеводов 300–330 г, энергетической ценностью 2170–2400 ккал в сутки.
Количество белка, необходимое для поддержания азотного баланса, при различных физиологических и патологических состояниях весьма разнится.
Во время беременности примерно 1 кг белка откладывается в организме матери и плода, что требует дополнительного введения 6 г белка в сутки. Во время лактации для компенсации секреции белка в молоко к обычному количеству прибавляется 17,7 г белка (см. главу 11).
При тяжелом психологическом стрессе увеличивается потеря азота, однако ежедневные повседневные стрессы не вызывают значимых колебаний в уровне белка.
При ряде состояний (лихорадка, переломы, ожоговая болезнь, хирургическая травма) происходит интенсивная потеря белка в острой фазе заболевания, и необходимо его восстановление при выздоровлении. Так, атрофия тканей при соблюдении постельного режима приводит к утрате 0,3 кг белка тела. К этому количеству может прибавиться потеря до 0,4 кг белка при резекции желудка, 0,7 кг при переломе бедренной кости и 1,2 кг после 35 % ожога. Существуют различные мнения о необходимости увеличения белкового компонента в питании во время пика метаболической реакции организма на повреждение, но усиленное восполнение белковых потерь в период выздоровления однозначно является необходимым (табл. 5.3).
Таблица 5.3
Белковые и энергетические потребности взрослого больного в зависимости от степени метаболического стресса (по Levin М., 1985)
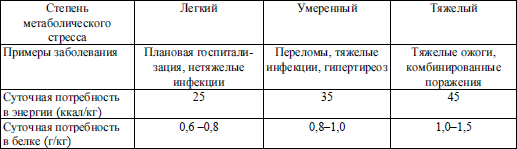
Потребности в белке в зависимости от заболевания при искусственном питании приведены в табл. 5.4.
Таблица 5.4
Потребности в белке при некоторых заболеваниях при энтеральном питании (приказ № 330 М3 РФ от 5.08.03)
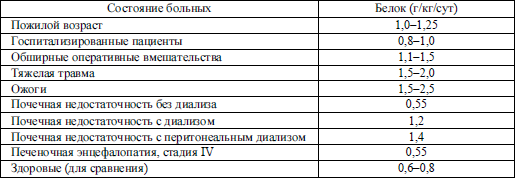 При некоторых заболеваниях потребление белка необходимо ограничивать, например, при уремии (когда ограничена экскреция азотсодержащих соединений) или печеночной недостаточности (для избежания печеночной комы). Тогда возникает проблема: необходимо избежать белкового истощения тканей и, в то же время, не превысить способность организма справиться с белковой нагрузкой. Установлено, что потребление больным с хронической почечной недостаточностью 0,5–0,6 г белка на 1 кг массы тела позволяет организму лучше справляться с вторичными инфекционными осложнениями, чем ранее рекомендовавшиеся минимальные дозы (см. главу 31). При онкологических процессах пищевая реабилитация позволяет раковому больному восстановить утраченные функции клеточного иммунитета и способствует лучшей переносимости химио– и лучевой терапии (см. главу «Лечебное питание в профилактике и лечении онкологических и гематологических заболеваний»).
При некоторых заболеваниях потребление белка необходимо ограничивать, например, при уремии (когда ограничена экскреция азотсодержащих соединений) или печеночной недостаточности (для избежания печеночной комы). Тогда возникает проблема: необходимо избежать белкового истощения тканей и, в то же время, не превысить способность организма справиться с белковой нагрузкой. Установлено, что потребление больным с хронической почечной недостаточностью 0,5–0,6 г белка на 1 кг массы тела позволяет организму лучше справляться с вторичными инфекционными осложнениями, чем ранее рекомендовавшиеся минимальные дозы (см. главу 31). При онкологических процессах пищевая реабилитация позволяет раковому больному восстановить утраченные функции клеточного иммунитета и способствует лучшей переносимости химио– и лучевой терапии (см. главу «Лечебное питание в профилактике и лечении онкологических и гематологических заболеваний»).
В клинической практике достаточность получаемой квоты белка можно оценить путем определения азотного баланса, на основании разницы между поступающим и выводимым азотом:
Азотистый баланс = поступление N – выведение N. [1]
Для подсчета азотного равновесия определяют количество вводимого белка в сутки и азот мочевины (или, что является более точным, общий азот) в суточной моче. Выводимый азот складывается из азота мочевины, немочевинного азота и потерь азота через кишечник, кожные покровы и т. п. Учитывая, что белки содержат примерно 15 % азота, уравнение [1] приобретает следующий вид:
Азотный баланс (г/сут) = (потребляемый белок/6,25) – (AM + 4), [2]
где AM – азот мочевины, AM = 0,466 × мочевина (г/сут).
Для увеличения массы тела необходим положительный азотный баланс не менее 4–6 г в сутки.
ВОЗ/ФАО (1985) установила суточную потребность в белке в размере 0,75 г/кг массы тела. Этот показатель был определен как «безопасный уровень потребления белка», то есть минимальное количество белка, которое может употребляться человеком без нанесения ущерба здоровью (табл. 5.2).
Отметим, что показатель «безопасного уровня потребления» подразумевает полную абсорбцию вводимого белка. При обычной смешанной диете до 10–15 % белка не усваивается, поэтому рекомендуется соответствующее увеличение квоты белка в рационе (до 0,83-0,86 г/кг массы тела).
Таблица 5.2
Суточные потребности в энергии и безопасный уровень потребления белка в сутки для взрослых (ВОЗ, 1990)

Рекомендуемые нормы потребления белка значительно отличаются в различных странах. Такие различия во многом объясняются особенностями качественного состава национальных диет. В последние десятилетия в мире наметилась тенденция к снижению белкового компонента в рационе. Низкое, но адекватное содержание протеина в рационе, по мнению большинства исследователей, является более обоснованным, чем принятые ранее рекомендации по высокому потреблению белка. Эта позиция аргументируется нефротоксичным эффектом чрезмерных доз белка и тем, что в высокобелковых продуктах содержится много скрытых жиров. В противоречие с данной концепцией вступают исследования, утверждающие, что организм легко адаптируется к увеличению введения белка, и более высокие потребности и повышенная скорость преобразования белка в мышцах ассоциируются с более высоким уровнем его потребления.
В России традиционно рекомендуется достаточно высокий уровень потребления белка (см. Приложение 2). Экспертами Европейского регионарного отдела ВОЗ в 1992 г. был выделен ряд проблем питания российской популяции, среди которых отмечалось, что в РФ приняты завышенные нормы потребления белка (в особенности животного), насыщенных жиров, соотношения белковых и небелковых калорий в рационе.
Согласно приказу № 330 М3 РФ от 5.08.03 г. стандартной для питания больных в стационарах признана диета, содержащая белков 85–90 г, жиров 70–80 г, углеводов 300–330 г, энергетической ценностью 2170–2400 ккал в сутки.
Количество белка, необходимое для поддержания азотного баланса, при различных физиологических и патологических состояниях весьма разнится.
Во время беременности примерно 1 кг белка откладывается в организме матери и плода, что требует дополнительного введения 6 г белка в сутки. Во время лактации для компенсации секреции белка в молоко к обычному количеству прибавляется 17,7 г белка (см. главу 11).
При тяжелом психологическом стрессе увеличивается потеря азота, однако ежедневные повседневные стрессы не вызывают значимых колебаний в уровне белка.
При ряде состояний (лихорадка, переломы, ожоговая болезнь, хирургическая травма) происходит интенсивная потеря белка в острой фазе заболевания, и необходимо его восстановление при выздоровлении. Так, атрофия тканей при соблюдении постельного режима приводит к утрате 0,3 кг белка тела. К этому количеству может прибавиться потеря до 0,4 кг белка при резекции желудка, 0,7 кг при переломе бедренной кости и 1,2 кг после 35 % ожога. Существуют различные мнения о необходимости увеличения белкового компонента в питании во время пика метаболической реакции организма на повреждение, но усиленное восполнение белковых потерь в период выздоровления однозначно является необходимым (табл. 5.3).
Таблица 5.3
Белковые и энергетические потребности взрослого больного в зависимости от степени метаболического стресса (по Levin М., 1985)

Потребности в белке в зависимости от заболевания при искусственном питании приведены в табл. 5.4.
Таблица 5.4
Потребности в белке при некоторых заболеваниях при энтеральном питании (приказ № 330 М3 РФ от 5.08.03)

В клинической практике достаточность получаемой квоты белка можно оценить путем определения азотного баланса, на основании разницы между поступающим и выводимым азотом:
Азотистый баланс = поступление N – выведение N. [1]
Для подсчета азотного равновесия определяют количество вводимого белка в сутки и азот мочевины (или, что является более точным, общий азот) в суточной моче. Выводимый азот складывается из азота мочевины, немочевинного азота и потерь азота через кишечник, кожные покровы и т. п. Учитывая, что белки содержат примерно 15 % азота, уравнение [1] приобретает следующий вид:
Азотный баланс (г/сут) = (потребляемый белок/6,25) – (AM + 4), [2]
где AM – азот мочевины, AM = 0,466 × мочевина (г/сут).
Для увеличения массы тела необходим положительный азотный баланс не менее 4–6 г в сутки.
Потребность в энергии
Понятие о потребности в энергии тесно связано с расходом энергии, то есть для сохранения стабильной массы тела поступление энергии должно соответствовать ее расходу. Определение расхода энергии базируется на установлении уровня основного обмена (УОО).
УОО – это энергетические затраты, направленные на поддержание основных жизненных функций организма в условиях состояния покоя в нейтральной температурной среде.
Величина УОО обусловливается рядом факторов, наиболее значимыми из которых являются возраст, пол и масса тела.
Для определения УОО у конкретного человека наиболее точным методом является непрямая калориметрия, связанная с определением объемов вдыхаемого кислорода и выдыхаемого углекислого газа и основанная на известных значениях количества энергии, выделяемой при сгорании белков, жиров и углеводов.
Окисление белков (г) = 6,25 × азот мочи.
Окисление углеводов (г) = (-2,56 × азот мочи)-(2,91 × VO2)+(4,12 × VCO2).
Окисление жиров (г) = (-1,94 × азот мочи) + (1,69 × VO2) – (1,69 × VCO2),
где VO2 – потребление 02, л/сут; VCO2 – выделение СO2 л/сут;
ОAM – общий азот суточной мочи, г/сут.
Респираторный коэффициент (RQ) – отношение выделенной углекислоты к потребленному организмом кислороду за единицу времени (VCO2 / VO2) – величина, характеризующая процессы окисления энергетических субстратов в организме. Поэтому расчет респираторного коэффициента позволяет при непрямой калориметрии получить данные о преимущественном использовании источников энергии организмом. Так, при значении RQ >1 – преобладает липогенез, RQ = 1 – в основном происходит утилизация углеводов, при RQ < 0,7 – утилизируются жиры.
Суммарное уравнение непрямой калориметрии (уравнение Вейра) для определения основного обмена имеет следующий вид:
УОО (ккал/сут)= (3,941 × VO2) + (1,106 × VCO2) – (2,17 × OAM).
Методика может использоваться для установления потребности в калориях у больных с резко измененным весом при значительной задержке жидкости или гиперкатаболических процессах.
Удобным является использование формул уровня УОО, принятых ВОЗ (табл. 5. 5).
Для расчета расхода (а, соответственно, и потребности) энергии требуется прибавить к количеству энергии, потраченной на поддержание основного обмена, затраты, связанные с физической активностью организма, а у больного человека – и обусловленные патологическими метаболическими изменениями.
Таблица 5.5
Уровень основного обмена в зависимости от возраста, пола и массы тела
(ВОЗ, 1985)
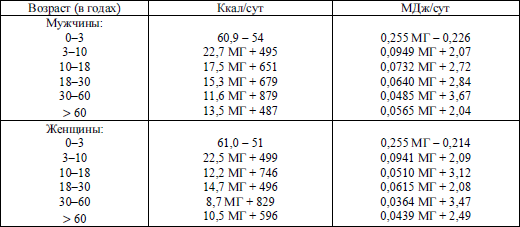 Примечание: МТ – масса тела.
Примечание: МТ – масса тела.
ВОЗ (1985) рекомендует определять потребность в энергии здоровых лиц на основании следующих расчетов (рис. 5.1).
1. Определение возраста, роста, пола.
2. Определение уровня основного обмена (УОО) (по табл. 11).
3. Определение расхода энергии (РЭ).
3.1. Определение времени (t), расходуемого на:
– сон и отдых в постели (tt);
– физическую активность (t2), в том числе профессиональную, обязательную (служебная и домашняя работа) (t1,2) и активность «по собственному усмотрению», «желаемую» (t2,2);
– остального времени («прогулочное время») (t3).
3.2. Определение коэффицентов расхода энергии (К):
– сон и отдых в постели, К1 = 1,0;
– физическая активность (К2) в зависимости от типа активности, времени, затрачиваемого на ее совершение, и физических характеристик индивидуума: профессиональная К2,1 = 1,7–3,8, желаемая – К2,2 = 3–6;
– «прогулочное время», К3 = 1,4.
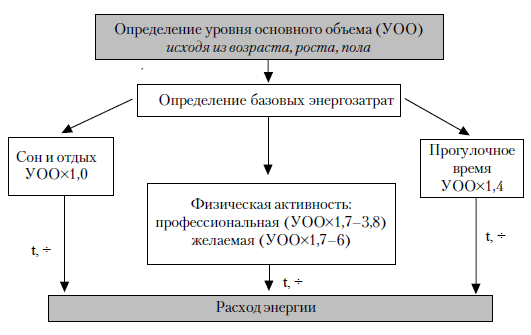 Рис. 5.1. Определение потребности в энергии здоровых лиц.
Рис. 5.1. Определение потребности в энергии здоровых лиц.
3.3. Определение расхода энергии:
P9 = K1t1 + K21t21, + K21t21 + K3t3.
Средние суточные потребности в энергии в зависимости от возраста и пола по ВОЗ (1990) приведены выше.
Таблица 5.6
Коэффиценты (К) определения энергетической потребности для взрослых лиц в зависимости от классификации их профессиональной деятельности как легкая, умеренная, тяжелая (ФАО/ВОЗ, 1985)
РЭ (расход энергии) = К х УОО
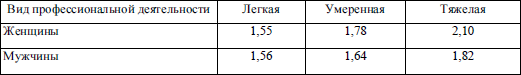
ФАО/ВОЗ рекомендует также коэффиценты определения энергетической потребности для взрослых лиц в зависимости от физической активности, связанной с их профессиональной деятельностью (табл. 5.6).
В РФ установлены «Суточные нормы физиологических потребностей для взрослого населения» (1991). Для лиц с массой тела, близкой среднестатистической, энергоемкость и химический состав рациона можно определить по данной нормативной таблице. При работе с работоспособными контингентами также можно умножать рассчитанную базовую величину УОО на коэффициент физической активности (КФА), принятый у нас в стране (см. Приложение 2).
Потребности здорового человека в энергии составляют в среднем 35 ккал/кг массы тела и преимущественно зависят от величины уровня физической активности. Потребности в энергии больного определяются также степенью метаболического стресса и наличием лихорадки. На величину основного обмена оказывает влияние ряд лекарственных препаратов: так аспирин, кофеин и адреналин повышают обменные процессы, адреноблокаторы, анестетики и наркотические анальгетики, наоборот, снижают их.
Наиболее удобным методом подсчета метаболических потребностей в клинической практике является расчет базальных энергетических показателей по формуле Харриса – Бенедикта с последующими поправками (см. Приложение 1). Именно он рекомендован для использования в ЛПУ приказом № 330 М3 РФ.
УОО = 66,5 + (13,7 × МТ) + (5 × Р) – (6,8 × В) – для мужчин;
УОО = 65,5 + (9,6 × МТ) + (1,8 × Р) – (4,7 × В) – для женщин;
где УОО – уровень основного обмена (ккал/сутп); МТ – масса тела (кг); Р – рост (см); В – возраст (лет).
РЭ = УОО × ФА × ТФ × ПФ.
Коэффициенты данных факторов указаны в приложении 1.
Приводим пример расчета потребности в энергии. Пациент – мужчина 40 лет, масса тела 70 кг, рост 175 см, диагноз – «сепсис», температура тела – 39 °C, находится на постельном режиме.
УОО = 66,5 + (13,7 × 70) + (5 × 175) – (6,8 × 40) = 1628,5 (ккал),
РЭ = 1628,5 × 1,1 × 1,5 × 1,2 = 3224,5 (ккал).
Таким образом, потребность пациента в энергии составляет 3224,5 ккал.
В зависимости от нутриционных показателей, скорости метаболических процессов и выраженности азотистых потерь потребности больного человека в энергии колеблются от 25 до 45 ккал на 1 кг массы тела в сутки.
Энергетический компонент рациона обеспечивается углеводами и жирами. Отношение белковых калорий к общей калорийности рациона значительно различается в разных странах. В российских рекомендациях он достигает 10–15 %.
ВОЗ в последние годы провела ряд исследований, позволивших выработать рекомендации по питанию различных групп населения («Fats and oils in human nutrition», «Preparation and use of food-based dietary guidelines», «Carbohydrates in human nutrition»).
Рекомендации ВОЗ, направленные на профилактическое питание (предотвращение хронических неинфекционных заболеваний), приведены в табл. 5. 7. Следует учитывать, что они имеют популяционную, а не индивидуальную направленность.
Хотя углеводы не являются незаменимым компонентом питания, их минимальное количество в рационе не должно быть менее 50–60 г. В отчете ВОЗ «Углеводы в питании человека» (1997) отмечается, что углеводы должны обеспечивать 55 % энергии рациона, причем менее 10 % приходится на простые сахара.
Таблица 5.7
Рекомендации ВОЗ по содержанию нутриентов при питании,
направленном на предотвращение неинфекционных заболеваний
(2002)
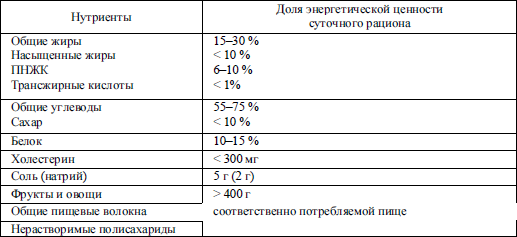
Потребность в пищевых волокнах точно не установлена, ориентировочно она находится в пределах 20–40 г/сут.
При поступлении в организм достаточного количества углеводов они оказывают «белоксберегающий» эффект – то есть экзогенные аминокислоты используются в основном на пластические, а не на энергетические нужды. При резком снижении углеводов в диете происходит усиление окисления липидов, сопряженное с интенсивным кетогенезом, увеличение катаболизма белка. Избыток поступления углеводов приводит к интенсификации липогенеза с возможным развитием ожирения. В РФ оптимальным для здорового человека считается потребление углеводов в количестве 50–65 % от энергетической ценности рациона. Поступающие углеводистые продукты должны обеспечивать не только калорийность пищи, но и достаточное количество необходимых организму растительных волокон.
При оценке состава рациона необходимо учитывать жирнокислотный состав продуктов. Согласно рекомендациям ВОЗ пропорция насыщенных жиров не должна превышать 10 % от общего жира рациона. По принятым в РФ нормативам рекомендуется потребление насыщенных жиров 25 г/сут, полиненасыщенных жирных кислот – 11 г/сут.
Данные о потребности в энергоемких нутриентах при различных состояниях приводятся в соответствующих главах.
УОО – это энергетические затраты, направленные на поддержание основных жизненных функций организма в условиях состояния покоя в нейтральной температурной среде.
Величина УОО обусловливается рядом факторов, наиболее значимыми из которых являются возраст, пол и масса тела.
Для определения УОО у конкретного человека наиболее точным методом является непрямая калориметрия, связанная с определением объемов вдыхаемого кислорода и выдыхаемого углекислого газа и основанная на известных значениях количества энергии, выделяемой при сгорании белков, жиров и углеводов.
Окисление белков (г) = 6,25 × азот мочи.
Окисление углеводов (г) = (-2,56 × азот мочи)-(2,91 × VO2)+(4,12 × VCO2).
Окисление жиров (г) = (-1,94 × азот мочи) + (1,69 × VO2) – (1,69 × VCO2),
где VO2 – потребление 02, л/сут; VCO2 – выделение СO2 л/сут;
ОAM – общий азот суточной мочи, г/сут.
Респираторный коэффициент (RQ) – отношение выделенной углекислоты к потребленному организмом кислороду за единицу времени (VCO2 / VO2) – величина, характеризующая процессы окисления энергетических субстратов в организме. Поэтому расчет респираторного коэффициента позволяет при непрямой калориметрии получить данные о преимущественном использовании источников энергии организмом. Так, при значении RQ >1 – преобладает липогенез, RQ = 1 – в основном происходит утилизация углеводов, при RQ < 0,7 – утилизируются жиры.
Суммарное уравнение непрямой калориметрии (уравнение Вейра) для определения основного обмена имеет следующий вид:
УОО (ккал/сут)= (3,941 × VO2) + (1,106 × VCO2) – (2,17 × OAM).
Методика может использоваться для установления потребности в калориях у больных с резко измененным весом при значительной задержке жидкости или гиперкатаболических процессах.
Удобным является использование формул уровня УОО, принятых ВОЗ (табл. 5. 5).
Для расчета расхода (а, соответственно, и потребности) энергии требуется прибавить к количеству энергии, потраченной на поддержание основного обмена, затраты, связанные с физической активностью организма, а у больного человека – и обусловленные патологическими метаболическими изменениями.
Таблица 5.5
Уровень основного обмена в зависимости от возраста, пола и массы тела
(ВОЗ, 1985)

ВОЗ (1985) рекомендует определять потребность в энергии здоровых лиц на основании следующих расчетов (рис. 5.1).
1. Определение возраста, роста, пола.
2. Определение уровня основного обмена (УОО) (по табл. 11).
3. Определение расхода энергии (РЭ).
3.1. Определение времени (t), расходуемого на:
– сон и отдых в постели (tt);
– физическую активность (t2), в том числе профессиональную, обязательную (служебная и домашняя работа) (t1,2) и активность «по собственному усмотрению», «желаемую» (t2,2);
– остального времени («прогулочное время») (t3).
3.2. Определение коэффицентов расхода энергии (К):
– сон и отдых в постели, К1 = 1,0;
– физическая активность (К2) в зависимости от типа активности, времени, затрачиваемого на ее совершение, и физических характеристик индивидуума: профессиональная К2,1 = 1,7–3,8, желаемая – К2,2 = 3–6;
– «прогулочное время», К3 = 1,4.

3.3. Определение расхода энергии:
P9 = K1t1 + K21t21, + K21t21 + K3t3.
Средние суточные потребности в энергии в зависимости от возраста и пола по ВОЗ (1990) приведены выше.
Таблица 5.6
Коэффиценты (К) определения энергетической потребности для взрослых лиц в зависимости от классификации их профессиональной деятельности как легкая, умеренная, тяжелая (ФАО/ВОЗ, 1985)
РЭ (расход энергии) = К х УОО

ФАО/ВОЗ рекомендует также коэффиценты определения энергетической потребности для взрослых лиц в зависимости от физической активности, связанной с их профессиональной деятельностью (табл. 5.6).
В РФ установлены «Суточные нормы физиологических потребностей для взрослого населения» (1991). Для лиц с массой тела, близкой среднестатистической, энергоемкость и химический состав рациона можно определить по данной нормативной таблице. При работе с работоспособными контингентами также можно умножать рассчитанную базовую величину УОО на коэффициент физической активности (КФА), принятый у нас в стране (см. Приложение 2).
Потребности здорового человека в энергии составляют в среднем 35 ккал/кг массы тела и преимущественно зависят от величины уровня физической активности. Потребности в энергии больного определяются также степенью метаболического стресса и наличием лихорадки. На величину основного обмена оказывает влияние ряд лекарственных препаратов: так аспирин, кофеин и адреналин повышают обменные процессы, адреноблокаторы, анестетики и наркотические анальгетики, наоборот, снижают их.
Наиболее удобным методом подсчета метаболических потребностей в клинической практике является расчет базальных энергетических показателей по формуле Харриса – Бенедикта с последующими поправками (см. Приложение 1). Именно он рекомендован для использования в ЛПУ приказом № 330 М3 РФ.
УОО = 66,5 + (13,7 × МТ) + (5 × Р) – (6,8 × В) – для мужчин;
УОО = 65,5 + (9,6 × МТ) + (1,8 × Р) – (4,7 × В) – для женщин;
где УОО – уровень основного обмена (ккал/сутп); МТ – масса тела (кг); Р – рост (см); В – возраст (лет).
РЭ = УОО × ФА × ТФ × ПФ.
Коэффициенты данных факторов указаны в приложении 1.
Приводим пример расчета потребности в энергии. Пациент – мужчина 40 лет, масса тела 70 кг, рост 175 см, диагноз – «сепсис», температура тела – 39 °C, находится на постельном режиме.
УОО = 66,5 + (13,7 × 70) + (5 × 175) – (6,8 × 40) = 1628,5 (ккал),
РЭ = 1628,5 × 1,1 × 1,5 × 1,2 = 3224,5 (ккал).
Таким образом, потребность пациента в энергии составляет 3224,5 ккал.
В зависимости от нутриционных показателей, скорости метаболических процессов и выраженности азотистых потерь потребности больного человека в энергии колеблются от 25 до 45 ккал на 1 кг массы тела в сутки.
Энергетический компонент рациона обеспечивается углеводами и жирами. Отношение белковых калорий к общей калорийности рациона значительно различается в разных странах. В российских рекомендациях он достигает 10–15 %.
ВОЗ в последние годы провела ряд исследований, позволивших выработать рекомендации по питанию различных групп населения («Fats and oils in human nutrition», «Preparation and use of food-based dietary guidelines», «Carbohydrates in human nutrition»).
Рекомендации ВОЗ, направленные на профилактическое питание (предотвращение хронических неинфекционных заболеваний), приведены в табл. 5. 7. Следует учитывать, что они имеют популяционную, а не индивидуальную направленность.
Хотя углеводы не являются незаменимым компонентом питания, их минимальное количество в рационе не должно быть менее 50–60 г. В отчете ВОЗ «Углеводы в питании человека» (1997) отмечается, что углеводы должны обеспечивать 55 % энергии рациона, причем менее 10 % приходится на простые сахара.
Таблица 5.7
Рекомендации ВОЗ по содержанию нутриентов при питании,
направленном на предотвращение неинфекционных заболеваний
(2002)

Потребность в пищевых волокнах точно не установлена, ориентировочно она находится в пределах 20–40 г/сут.
При поступлении в организм достаточного количества углеводов они оказывают «белоксберегающий» эффект – то есть экзогенные аминокислоты используются в основном на пластические, а не на энергетические нужды. При резком снижении углеводов в диете происходит усиление окисления липидов, сопряженное с интенсивным кетогенезом, увеличение катаболизма белка. Избыток поступления углеводов приводит к интенсификации липогенеза с возможным развитием ожирения. В РФ оптимальным для здорового человека считается потребление углеводов в количестве 50–65 % от энергетической ценности рациона. Поступающие углеводистые продукты должны обеспечивать не только калорийность пищи, но и достаточное количество необходимых организму растительных волокон.
При оценке состава рациона необходимо учитывать жирнокислотный состав продуктов. Согласно рекомендациям ВОЗ пропорция насыщенных жиров не должна превышать 10 % от общего жира рациона. По принятым в РФ нормативам рекомендуется потребление насыщенных жиров 25 г/сут, полиненасыщенных жирных кислот – 11 г/сут.
Данные о потребности в энергоемких нутриентах при различных состояниях приводятся в соответствующих главах.
Глава 6 Роль витаминов в питании и коррекция нарушений витаминного обмена
Витамины – низкомолекулярные органические соединения различного строения, необходимые для поддержания жизненных функций организма. Человек и животные не синтезируют их или синтезируют в недостаточном количестве. В отличие от других незаменимых факторов питания (полиненасыщенные жирные кислоты, незаменимые аминокислоты) витамины не являются пластическим материалом или источником энергии. Водорастворимые витамины, как правило, входят в состав ферментов (энзимовитамины), жирорастворимые – выполняют сигнальные функции экзогенных прогормонов и гормонов (гормоновитамины).
Клинические проявления авитаминозов врачам известны давно. Так, бери-бери была описана в древнекитайском каноне медицины 2500 лет тому назад. В античной Греции была известна клиническая картина авитаминоза А. Цинга часто возникала среди мореплавателей. Однако витаминология как наука стала развиваться в XIX веке. Большой вклад в ее развитие внес русский ученый Н. И. Лунин. В те годы считали, что для нормального функционирования организма достаточно белков, жиров, углеводов, минеральных солей и воды. В 1880 г. Н. И. Лунин установил, что в пищевых продуктах имеются еще неизвестные факторы питания, необходимые для жизни. Он показал, что белые мыши, получавшие цельное молоко, были здоровы, но погибали, когда их кормили смесью из составных частей молока: казеина, жира, сахара, солей и воды. В 1887 г. голландский врач X. Эйкман установил, что у кур, получавших в пищу полированный рис, развивалось сходное с бери-бери заболевание, однако они выздоравливали после того, как им давались рисовые отруби.
Ф. Дж. Хопкинс (1906,1910) в экспериментах на животных установил, что возникновение бери-бери, скорбута и рахита связано с недостатком в пище незаменимых компонентов неаминокислотного характера.
По предложению польского биохимика К. Функа (1911), работавшего над выделением активного начала рисовых отрубей и обнаружившего в них аминогруппы, все вещества подобного рода стали называть витаминами – «жизненными аминами». В XX веке учеными различных стран были открыты, выделены и синтезированы практически все основные витамины.
Клинические проявления авитаминозов врачам известны давно. Так, бери-бери была описана в древнекитайском каноне медицины 2500 лет тому назад. В античной Греции была известна клиническая картина авитаминоза А. Цинга часто возникала среди мореплавателей. Однако витаминология как наука стала развиваться в XIX веке. Большой вклад в ее развитие внес русский ученый Н. И. Лунин. В те годы считали, что для нормального функционирования организма достаточно белков, жиров, углеводов, минеральных солей и воды. В 1880 г. Н. И. Лунин установил, что в пищевых продуктах имеются еще неизвестные факторы питания, необходимые для жизни. Он показал, что белые мыши, получавшие цельное молоко, были здоровы, но погибали, когда их кормили смесью из составных частей молока: казеина, жира, сахара, солей и воды. В 1887 г. голландский врач X. Эйкман установил, что у кур, получавших в пищу полированный рис, развивалось сходное с бери-бери заболевание, однако они выздоравливали после того, как им давались рисовые отруби.
Ф. Дж. Хопкинс (1906,1910) в экспериментах на животных установил, что возникновение бери-бери, скорбута и рахита связано с недостатком в пище незаменимых компонентов неаминокислотного характера.
По предложению польского биохимика К. Функа (1911), работавшего над выделением активного начала рисовых отрубей и обнаружившего в них аминогруппы, все вещества подобного рода стали называть витаминами – «жизненными аминами». В XX веке учеными различных стран были открыты, выделены и синтезированы практически все основные витамины.
Классификация витаминов
Витамины делят на водорастворимые и жирорастворимые (они обозначены как (в) и (ж) в табл. 6.1), кроме того, в настоящее время выделяют энзимовитамины (В1, В2, РР, В6, В12, Н, пантотеновая и фолиевая кислота), гормоновитамины (А, Д, К), а также витамины-антиоксиданты или редокс-витамины (А, С, Е, липоевая кислота, биофлавоноиды, полифенолы).
Таблица 6.1

Таблица 6.1

Причины неадекватной обеспеченности организма витаминами
I. Алиментарная недостаточность витаминов.
1. Недостаточное содержание витаминов в суточном рационе питания.
2. Разрушение витаминов при неправильной кулинарной обработке и хранении пищи.
3. Действие антивитаминных факторов, содержащихся в продуктах.
4. Нарушение соотношений между витаминами и другими нутриентами, а также между отдельными витаминами в рационе.
5. Анорексия.
6. Пищевые извращения, религиозные запреты на ряд продуктов.
II. Угнетение нормальной кишечной микрофлоры.
1. Заболевания желудочно-кишечного тракта.
2. Длительные курсы антибактериальной терапии.
III. Нарушения ассимиляции витаминов.
1. Нарушение всасывания витаминов в желудочно-кишечном тракте:
– врожденные дефекты транспортных и ферментных механизмов всасывания;
– заболевания желудка, кишечника, гепатобилиарной системы;
– конкурентные отношения с всасыванием других витаминов и нутриентов.
2. Утилизация поступающих с пищей витаминов кишечными паразитами и патогенной кишечной микрофлорой.
3. Нарушение образования биологически активных и транспортных форм витаминов:
– наследственные аномалии;
– приобретенные заболевания, действие токсических и инфекционных агентов.
4. Антивитаминное действие лекарственных веществ.
IV. Повышенная потребность организма в витаминах.
1. Дети, подростки.
2. Беременные женщины и кормящие матери.
3. Интенсивная физическая нагрузка.
4. Стрессовые состояния.
5. Особые климатические условия.
6. Заболевания внутренних органов и желез внутренней секреции.
7. Инфекционные заболевания и интоксикации.
Авитаминозы развиваются при отсутствии поступления не синтезируемых эндогенно витаминов и характеризуются яркой клинической картиной (например, цинга при отсутствии аскорбиновой кислоты). Гиповитаминозы встречаются при недостаточном поступлении витаминов, при этом имеют место менее специфичные и яркие клинические проявления.
Коррекция гиповитаминозов только витаминными препаратами иногда не дает должного эффекта без введения в рацион достаточного количества белков, а также тех или иных макро– или микроэлементов. Микроэлементы присутствуют в структуре многих витаминзависимых коферментов, поэтому симптомы витаминной недостаточности часто зависят от дефицита апофермент-витамин-минерального комплекса. Имеет значение взаимодействие самих витаминов. Так, синергистами являются витамины-антиоксиданты (Е, С, А), аскорбиновая кислота и тиамин. Антагонизм присущ тиамину и пиридоксину, ретинолу и филлохинонам, пиридоксину и токоферолам. Существует прямой химический антагонизм витамина С и цианокобаламина, в связи с чем их нельзя назначать в одном шприце. Из-за взаимодействия нескольких витаминов и микроэлементов в одной биохимической цепочке (например участие в биологическом окислении витаминов В1, В2, РР, В15, железа и меди) одни и те же клинические симптомы могут встречаться при дефицитах различных нутриентов. Поражение высокоаэробных эпителиальных клеток кожи и слизистых, изменения волос и ногтей наблюдаются при недостаточном поступлении различных нутриентов, участвующих в биологическом окислении.
1. Недостаточное содержание витаминов в суточном рационе питания.
2. Разрушение витаминов при неправильной кулинарной обработке и хранении пищи.
3. Действие антивитаминных факторов, содержащихся в продуктах.
4. Нарушение соотношений между витаминами и другими нутриентами, а также между отдельными витаминами в рационе.
5. Анорексия.
6. Пищевые извращения, религиозные запреты на ряд продуктов.
II. Угнетение нормальной кишечной микрофлоры.
1. Заболевания желудочно-кишечного тракта.
2. Длительные курсы антибактериальной терапии.
III. Нарушения ассимиляции витаминов.
1. Нарушение всасывания витаминов в желудочно-кишечном тракте:
– врожденные дефекты транспортных и ферментных механизмов всасывания;
– заболевания желудка, кишечника, гепатобилиарной системы;
– конкурентные отношения с всасыванием других витаминов и нутриентов.
2. Утилизация поступающих с пищей витаминов кишечными паразитами и патогенной кишечной микрофлорой.
3. Нарушение образования биологически активных и транспортных форм витаминов:
– наследственные аномалии;
– приобретенные заболевания, действие токсических и инфекционных агентов.
4. Антивитаминное действие лекарственных веществ.
IV. Повышенная потребность организма в витаминах.
1. Дети, подростки.
2. Беременные женщины и кормящие матери.
3. Интенсивная физическая нагрузка.
4. Стрессовые состояния.
5. Особые климатические условия.
6. Заболевания внутренних органов и желез внутренней секреции.
7. Инфекционные заболевания и интоксикации.
Авитаминозы развиваются при отсутствии поступления не синтезируемых эндогенно витаминов и характеризуются яркой клинической картиной (например, цинга при отсутствии аскорбиновой кислоты). Гиповитаминозы встречаются при недостаточном поступлении витаминов, при этом имеют место менее специфичные и яркие клинические проявления.
Коррекция гиповитаминозов только витаминными препаратами иногда не дает должного эффекта без введения в рацион достаточного количества белков, а также тех или иных макро– или микроэлементов. Микроэлементы присутствуют в структуре многих витаминзависимых коферментов, поэтому симптомы витаминной недостаточности часто зависят от дефицита апофермент-витамин-минерального комплекса. Имеет значение взаимодействие самих витаминов. Так, синергистами являются витамины-антиоксиданты (Е, С, А), аскорбиновая кислота и тиамин. Антагонизм присущ тиамину и пиридоксину, ретинолу и филлохинонам, пиридоксину и токоферолам. Существует прямой химический антагонизм витамина С и цианокобаламина, в связи с чем их нельзя назначать в одном шприце. Из-за взаимодействия нескольких витаминов и микроэлементов в одной биохимической цепочке (например участие в биологическом окислении витаминов В1, В2, РР, В15, железа и меди) одни и те же клинические симптомы могут встречаться при дефицитах различных нутриентов. Поражение высокоаэробных эпителиальных клеток кожи и слизистых, изменения волос и ногтей наблюдаются при недостаточном поступлении различных нутриентов, участвующих в биологическом окислении.
Водорастворимые витамины
Витамин В1 (тиамин)
Метаболизм витамина В1
Тиамин, содержащийся в пищевых продуктах, биологически неактивен. В печени под действием фермента тиаминкиназы он фосфорилируется, превращаясь в тиаминдифосфат, тиаминмонофосфат, тиаминтрифосфат.
Биологическая роль тиамина связана с его участием в построении коферментов ряда ферментов:
– пируватдегидрогеназы, которая катализирует окисление пировиноградной кислоты до ацетил-КоА;
– α-кетоглутаратдегидрогеназы, которая участвует в цикле Кребса, превращая α-кетоглутаровую кислоту в сукцинил-КоА;
– транскетолазы, которая участвует в пентозофосфатном цикле.
Перечисленные три фермента обеспечивают метаболизм различных нутриентов, но прежде всего углеводов, а следовательно энергетический обмен (углеводы – основной поставщик энергии). При избытке углеводов в рационе увеличивается потребность в тиамине, и может развиться относительная недостаточность витамина В1. При авитаминозе имеется понижение дыхательного коэффициента, накопление продуктов недоокисления пирувата, которые токсически действуют на ЦНС. Возникающий метаболический ацидоз и энергодефицит ухудшает работу градиентных насосов клеток, в том числе нервных, сердечных и мышечных. В условиях нарушения окисления углеводов организм вынужден использовать белки и жиры, что ведет к мышечной атрофии, задержке физического развития у детей. Нарушается превращение углеводов в жиры и синтез жирных кислот.
Тиамин необходим для биосинтеза важнейшего нейромедиатора – ацетилхолина. При дефиците тиамина затруднено образование ацетил-КоА из пирувата и ацетилирование холина, что приводит к нарушению синтеза ацетилхолина и соответствующей клинической симптоматике (атонические запоры, снижение желудочной секреции, неврологические расстройства).
Биологическая роль тиамина связана с его участием в построении коферментов ряда ферментов:
– пируватдегидрогеназы, которая катализирует окисление пировиноградной кислоты до ацетил-КоА;
– α-кетоглутаратдегидрогеназы, которая участвует в цикле Кребса, превращая α-кетоглутаровую кислоту в сукцинил-КоА;
– транскетолазы, которая участвует в пентозофосфатном цикле.
Перечисленные три фермента обеспечивают метаболизм различных нутриентов, но прежде всего углеводов, а следовательно энергетический обмен (углеводы – основной поставщик энергии). При избытке углеводов в рационе увеличивается потребность в тиамине, и может развиться относительная недостаточность витамина В1. При авитаминозе имеется понижение дыхательного коэффициента, накопление продуктов недоокисления пирувата, которые токсически действуют на ЦНС. Возникающий метаболический ацидоз и энергодефицит ухудшает работу градиентных насосов клеток, в том числе нервных, сердечных и мышечных. В условиях нарушения окисления углеводов организм вынужден использовать белки и жиры, что ведет к мышечной атрофии, задержке физического развития у детей. Нарушается превращение углеводов в жиры и синтез жирных кислот.
Тиамин необходим для биосинтеза важнейшего нейромедиатора – ацетилхолина. При дефиците тиамина затруднено образование ацетил-КоА из пирувата и ацетилирование холина, что приводит к нарушению синтеза ацетилхолина и соответствующей клинической симптоматике (атонические запоры, снижение желудочной секреции, неврологические расстройства).
Дефицит витамина В1
При авитаминозе В1 развивается болезнь бери-бери, для которой характерны следующие признаки:
– головная боль, раздражительность, ослабление памяти, периферические полиневриты, в тяжелых случаях параличи;
– тахикардия, боли в сердце, расширение границ сердца, приглушенность тонов, одышка, отеки;
– снижение аппетита, боли в животе, тошнота, снижение тонуса кишечника, запоры.
Название «бери-бери» происходит от индийского beri (ножные оковы) из-за неуверенной шатающейся походки больных.
Гиповитаминоз В1 встречается довольно часто в цивилизованных странах вследствие избыточного употребления рафинированных углеводистых продуктов и сладостей. Тиаминовая недостаточность имеется у каждого четвертого алкоголика. Недостаточность витамина В1 может развиваться в результате потребления пищи, содержащей значительное количество тиаминазы (фермента, разрушающего тиамин) и других антивитаминных факторов, которыми богата сырая рыба (карп, сельдь и др.) и морские животные. Сочетание морских продуктов с полированным рисом послужило причиной возникновения бери-бери у японских матросов адмирала К. Такаки. Адмирал снизил заболеваемость бери-бери, обогатив рацион моряков овощами, молоком и мясом.
– головная боль, раздражительность, ослабление памяти, периферические полиневриты, в тяжелых случаях параличи;
– тахикардия, боли в сердце, расширение границ сердца, приглушенность тонов, одышка, отеки;
– снижение аппетита, боли в животе, тошнота, снижение тонуса кишечника, запоры.
Название «бери-бери» происходит от индийского beri (ножные оковы) из-за неуверенной шатающейся походки больных.
Гиповитаминоз В1 встречается довольно часто в цивилизованных странах вследствие избыточного употребления рафинированных углеводистых продуктов и сладостей. Тиаминовая недостаточность имеется у каждого четвертого алкоголика. Недостаточность витамина В1 может развиваться в результате потребления пищи, содержащей значительное количество тиаминазы (фермента, разрушающего тиамин) и других антивитаминных факторов, которыми богата сырая рыба (карп, сельдь и др.) и морские животные. Сочетание морских продуктов с полированным рисом послужило причиной возникновения бери-бери у японских матросов адмирала К. Такаки. Адмирал снизил заболеваемость бери-бери, обогатив рацион моряков овощами, молоком и мясом.
