Страница:
Изолированное использование УФГТ (например, для лечения пневмонии, восстановления АХЭ крови) сопровождается не менее выраженными положительными сдвигами в системе иммунитета.
Методологические особенности УФГТ приведены в табл. 7.



 Лазерная гемотерапия (ЛГТ)
Лазерная гемотерапия (ЛГТ)
В терапевтических целях применяют низкоэнергетические лазеры с мягким излучением в синей (385–404 нм, 440–455 нм), зеленой (540–560 нм) и красной (560–580 нм, 620–640 нм и 760 нм) областях спектра. Преимущества лазерного облучения крови – его монохроматичность и когерентность, а также поляризованность, что в сочетании с высокой плотностью излучения обеспечивает оригинальный биологический эффект, отличный от действия естественного света и обусловленный клеточно-тканевыми, нейрорефлекторными и нейрогуморальными реакциями. Под влиянием лазерного излучения повышается активность медьсодержащих белков-ферментов – церулоплазмина, глутадионпероксидазы, супероксиддисмутазы, результатом чего является активация антиоксидантной системы и ингибирование процессов перекисного окисления липидов, что приводит к благоприятным изменениям в липидном слое клеточных мембран и предотвращает потерю клетками их функциональных свойств. Этому может также способствовать инициация вследствие лазерного излучения возбуждения растворенного в крови молекулярного кислорода и улучшение снабжения клеток энергией. Одновременно возрастает амплитуда колебаний диполей воды, находящихся вблизи клеточной мембраны, что приводит к деполяризации последних вследствие очищения от фиксированных на них токсичных веществ. Кроме того, фотохимические реакции, протекающие с участием активных форм кислорода, сопровождаются стимуляцией окислительно-восстановительных процессов в результате активации каталазы и цитохромоксидазы, что оказывает положительное влияние на синтез белка, РНК и ряда ферментов. Многие эффекты лазерного облучения могут быть связаны с увеличением проницаемости цитоплазматических мембран для кальция, что увеличивает бактерицидные свойства лейкоцитов и макрофагов. Имеет место и полевое воздействие лазерного излучения, акцептор которого – важнейшие биополимеры и биологические жидкости, изменения структуры которых играют важную роль в его биологических эффектах.
Использование лазерной гемотерапии при лечении острых отравлений после окончания сорбционно-диализной детоксикации в сочетании с МГТ и УФГТ, а также наряду с методами усиления естественной детоксикации организма сопровождается заметным снижением летальности, а при отравлениях психотропными и снотворными средствами – длительности коматозного состояния. Особенно заметно уменьшаются частота и тяжесть пневмоний. При отравлениях фосфорорганическими соединениями существенно ускоряется восстановление активности холинэстеразы крови.
Изменения показателей гомеостаза на фоне ЛГТ заключаются в длительном снижении агрегационной активности эритроцитов и тромбоцитов – на срок до 2 суток и в улучшении вискозиметрических параметров крови (вязкость, гематокрит и др.). Влияние ЛГТ на иммунные показатели сходно с таковыми при УФГТ, но при этом функциональные резервы фагоцитирующих нейтрофилов оказываются заметно меньшими. Кроме того, для ЛГТ характерно значительное улучшение оксигенации крови с увеличением капиллярно-венозной разницы по кислороду в 1,7–3 раза, а также положительные изменения в состоянии перекисного окисления липидов и антиоксидантной системы в крови.
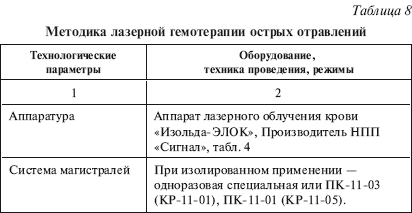
Методологические особенности ЛГТ приведены в табл. 8.




Электрохимическая гемотерапия (ЭХГТ)
Общая характеристика. В процессе химиогемотерапии с помощью внутривенных инфузий гипохлорита натрия (ГХН) удается значительно ускорить биотрансформацию токсичных веществ за счет освобождения активного кислорода и хлора, которые интенсивно окисляют гидрофобные токсичные вещества и воздействуют на липидные структуры бактериальных клеточных мембран, нарушая их проницаемость. Кроме того, гипохлорит-ионы модифицируют деятельность окислительных ферментов, моделируя подобным образом детоксикационную функцию печени, в частности цитохрома P-450. При острых отравлениях введение ГХН сопровождается также умеренной дезагрегацией эритроцитов и тромбоцитов и улучшением оксигенационных характеристик крови (повышение парциального давления кислорода, насыщение крови кислородом, возрастание капиллярно-венозной разницы по кислороду).
Уменьшается выраженность эндотоксикоза за счет быстрого снижения в крови уровня СМ. Кроме того, с помощью инфузий ГХН достигается стабилизация их сорбции на наиболее высоком уровне в процессе проведения гемосорбции. В результате эффективность детоксикации существенно повышается.
В процессе проведения ЭХГТ также следует соблюдать ее определенные параметры, учитывая, что при острых отравлениях ЭХГТ растворами ГХН с концентрацией 300 мг/л сопровождается низкой клинической эффективностью, а растворы с концентрацией 1200 мг/л применяются только наружно. Оптимальная концентрация ГХН, таким образом, – концентрация, равная 600 мг/л.
Методические особенности, связанные с проведением ЭХГТ, отражены в табл. 9.



В клинических условиях этот метод в сочетании с гемосорбцией уже начал применяться для лечения эндотоксикозов при тяжелом абстинентном синдроме и шизофрении. В качестве пирогенного средства используется пирогенал.
Искусственное охлаждение тела с целью снижения интенсивности метаболических процессов и повышения устойчивости к гипоксии находит более широкое применение как метод симптоматической терапии острых отравлений при токсическом отеке мозга, вызванном отравлением наркотическими ядами. С точки зрения возможностей детоксикации организма искусственная гипотермия изучена мало, хотя есть определенные перспективы использования ее антигипоксических свойств при тяжелом экзотоксическом шоке, а также в целях замедления летального синтеза при отравлениях метиловым спиртом, этиленгликолем, хлорированными углеводородами.
При определении показаний к проведению ГБО первостепенное значение имеет стадия отравления. В токсикогенной стадии, когда токсичное вещество циркулирует в крови, ГБО может служить методом усиления естественных процессов детоксикации, но только в тех случаях, когда биотрансформация ядов происходит по типу окисления при непосредственном участии кислорода без образования более токсичных метаболитов (монооксид углерода, метгемоглобинобразующие вещества). Напротив, ГБО противопоказана в токсикогенной стадии отравлений ядами, биотрансформация которых протекает по типу окисления с летальным синтезом, что приводит к образованию более токсичных метаболитов (карбофос, этиленгликоль и т. д.).
Таково общее правило, основанное на теории биотрансформации токсичных веществ в организме, которое имеет ряд исключений. Они касаются случаев, когда опасность гипоксии представляется более реальной, чем отравляющее воздействие токсичных метаболитов.
Рекомендуется два вида гипербарических систем: одноместная кислородная барокамера ОКА-МТ, рассчитанная на 1 ати, и одноместная барокамера БЛ-3 (конструкции ВНИИИМТ) на 3 ати. Практически можно пользоваться любой установкой, предназначенной для медицинских целей.
Перед началом сеанса рекомендуется сделать рентгенографию грудной клетки, определить показатели КОС, записать исходные ЭЭГ и ЭКГ, которые повторяют после сеанса. Учитывая обычно тяжелое состояние больных с отравлениями, компрессию и декомпрессию в барокамере проводят медленно (в течение 15–20 мин) с изменением давления, со скоростью 0,1 ати/мин. Продолжительность пребывания больного под лечебным давлением (1,0–2,5 ати) – 40–50 мин.
Клиническая эффективность ГБО как метода детоксикации наиболее ярко проявляется при раннем его применении для стимуляции процесса биотрансформации карбоксигемоглобина при отравлении угарным газом, мет– и сульфгемоглобина – при отравлении нитритами, нитратами и их производными. Одновременно происходит повышение насыщения кислородом плазмы крови и стимуляция его тканевого метаболизма, что носит характер патогенетической терапии.
При развитии токсической (постгипоксической энцефалопатии в соматогенной фазе отравлений окисью углерода, наркотиками и пр.) рекомендуется применение щадящих режимов ГБО (0,3–0,5 ати) с удлинением курсового лечения (до 30 сеансов) и продолжительности сеанса до 40 мин.
Относительное противопоказание к использованию ГБО при этих отравлениях – крайняя тяжесть состояния больных, связанная с развитием декомпенсированной формы экзотоксического шока, требующего проведения реанимационных мероприятий для коррекции основных показателей гемодинамики.
1.3.3. Медицинские технологии методов искусственной детоксикации
Разведение крови (гемодилюция) для снижения концентрации в ней токсичных веществ давно применяется в практической медицине. Этой цели служат водная нагрузка (обильное питье) и парентеральное введение водно-электролитных и плазмозамещающих растворов. Последние особенно ценны при острых отравлениях, поскольку позволяют одновременно с гемодилюцией восстановить объем циркулирующей крови и создать условия для эффективной стимуляции диуреза.
Среди плазмозамещающих препаратов наиболее выраженными детоксикационными свойствами обладают растворы сухой плазмы или альбумина, а также полимера глюкозы – декстрана, который может иметь различную степень полимеризации и, соответственно, различную молекулярную массу. Растворы декстрана с относительной молекулярной массой около 60 000 (полиглюкин) используются в качестве гемодинамических средств, а с меньшей относительной молекулярной массой 30 000-40 000 (реополиглюкин) – как детоксикационное средство. Все это способствует восстановлению кровотока в капиллярах, уменьшает агрегацию форменных элементов крови, усиливает процесс перемещения жидкостей из тканей в кровеносное русло и, выделяясь через почки, усиливает диурез. Кроме реополиглюкина, к препаратам этой группы относятся гелофузин – 4 %-ный раствор модифицированного желатина и венофундин – 6 %-ный раствор модифицированного крахмала, которые остаются в кровеносном русле 4–6 ч и не вызывают побочных эффектов.
Количество применяемых препаратов зависит от тяжести отравления и целей их применения. Для детоксикации вводят внутривенно капельно 400-1000 мл в сутки, при явлениях экзотоксического шока – до 3000 мл. Длительное применение препаратов декстрана (более 3 суток подряд) опасно вследствие возможного развития осмотического нефроза.
Оценка эффективности инфузионной терапии как метода искусственной детоксикации затруднена, так как она редко применяется отдельно от других методов. Обычно инфузионная терапия служит основой для последующего использования форсированного диуреза, методов диализа или фильтрации крови, поэтому непосредственный критерий ее лечебного действия – улучшение гемодинамических показателей (АД, УОК, МОК, ЦВД) и КОС. Применение полиглюкина непосредственно перед гемосорбцией не рекомендуется, поскольку снижается клиренс токсикантов!
Операция замещения крови
Общая характеристика. К основным лечебным факторам данной процедуры, состоящей в одновременно проводимом и равном по объему кровопускании и переливании крови, относятся следующие: детоксикационный, депурационный, субституирующий и общебиологический.
Детоксикационный фактор основан на возможном удалении с кровью больного различных токсичных веществ. В клинической практике имеется реальная возможность проведения лишь частичной операции замещения крови (ОЗК) в объеме 1,5–3 л, в то время как для практически полного (95 %) замещения крови больного необходимо перелить не менее 15 л крови донора, т. е. в количестве, в 3 раза превышающем средний объем циркулирующей крови человека.
Это обстоятельство значительно снижает эффективность ОЗК как метода детоксикации, так как позволяет вывести из крови не более 15 % токсиканта.
Депурационное действие ОЗК состоит в освобождении организма от крупномолекулярных соединений (свободный гемоглобин плазмы, миоглобин и др.), что принципиально отличает этот метод детоксикации от диализных, при которых подобное очищение невозможно.
Субституирующее действие ОЗК заключается в замещении измененной в морфологическом и функциональном отношении крови больного (метгемоглобинемия и др.) полноценной донорской кровью, в результате чего кровь реципиента по своему составу приближается к донорской.
Общебиологическое действие ОЗК – общая реакция организма на кровопускание, компенсированное переливанием донорской крови, т. е. по сути это пересадка крови как индивидуальной «ткани» организма от нескольких доноров реципиенту. Данная иммунобиологическая реакция при умеренной выраженности оказывает стимулирующее защитное действие на иммунную систему организма.
Целесообразно выделение абсолютных показаний к операции ОЗК, когда она оценивается как патогенетическое лечение и имеет некоторые преимущества перед другими методами, и относительных показаний, которые могут быть продиктованы только конкретными условиями при невозможности использования других более эффективных методов искусственной детоксикации (гемодиализ, гемосорбция и пр.).
Абсолютные показания к ОЗК: отравления веществами, обладающими непосредственным токсичным воздействием на кровь, вызывающими тяжелую метгемоглобинемию (более 50–60 % общего гемоглобина), нарастающий массивный гемолиз (при концентрации свободного гемоглобина более 10 г/л) и снижение холинэстеразной активности крови до 10 %. Существенное преимущество ОЗК – сравнительная простота этого метода, который не требует специальной аппаратуры, и возможность его применения в условиях любого стационара. В настоящее время, учитывая трудность получения донорской крови, ОЗК практически применяется только у детей младшего возраста.
Противопоказание к применению ОЗК: выраженные гемодинамические нарушения (коллапс, отек легких), а также осложненные пороки сердца, тромбофлебиты глубоких вен конечностей.
Осложнения ОЗК: временная гипотония, посттрансфузионные реакции и умеренная анемия в послеоперационном периоде. Осложнения в процессе проведения ОЗК во многом определяются клиническим состоянием больных к моменту операции. Большинство больных, у которых до операции не было выраженных гемодинамических расстройств, переносят ее удовлетворительно. При технически правильно проведенной операции уровень артериального давления остается стабильным или меняется в незначительных пределах. Технические погрешности в операции (диспропорции в объеме вводимой и выводимой крови) приводят к временным колебаниям АД – в пределах 15–20 мм рт. ст. и легко корригируются при восстановлении нарушенного равновесия.
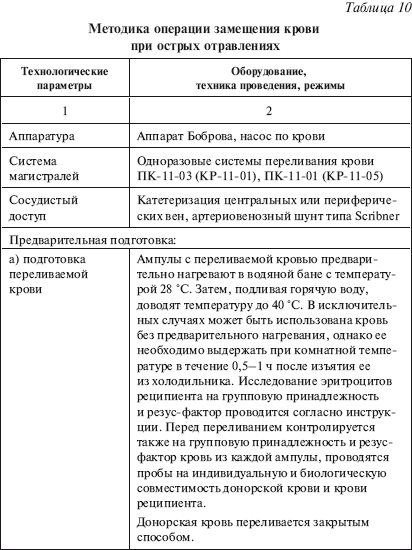
К наиболее тяжелым осложнениям ОЗК относится синдром гомологичной крови, развивающийся при переливании больших объемов донорской крови (свыше 3 л) и протекающий как иммунологическая реакция отторжения. Методику проведения операции ОЗК см. в табл. 10.




Общая характеристика. Диализ – способ удаления токсических веществ (электролитов и неэлектролитов) из коллоидных растворов и растворов высокомолекулярных веществ, основанный на свойствах некоторых мембран пропускать молекулы и ионы, но задерживать коллоидные частицы и макромолекулы. С физической точки зрения диализ – свободная диффузия, сочетающаяся с фильтрацией вещества через полунепроницаемую мембрану.
Применяемые для диализа мембраны можно разделить на два основных вида: искусственные (целлофан, купрофан и др.) и естественные (брюшина, базальная мембрана клубочков почек, плевра и др.). Размер пор мембран (5-10 нм) позволяет проникать через них только свободным молекулам, не связанным с белком и подходящим по своим размерам к величине пор данной мембраны. Только концентрация не связанной с белком части токсичного вещества является исходной для количественной оценки возможного эффекта любого диализа, так как характеризует способность химического вещества проходить через искусственные или естественные мембраны, или его «диализабельность». Решающее значение для диализабельности химического вещества имеют особенности его физико-химических и токсикологических свойств, влияние которых на эффективность гемодиализа формулируется следующим образом.
1. Токсикант должен быть относительно низкомолекулярным (размер молекулы должен быть не более 8 нм) для свободной диффузии через полунепроницаемую мембрану.
2. Токсикант должен растворяться в воде и находиться в плазме в свободном, не связанном с белками состоянии или эта связь должна быть легко обратима, т. е. при уменьшении концентрации свободного токсиканта во время диализа она должна непрерывно пополняться за счет освобождения от его связи с белком.
3. Токсикант должен циркулировать в крови определенное время, достаточное для подключения аппарата «искусственная почка» и прохождения через диализатор не менее одного объема циркулирующей крови, т. е. не менее 6–8 ч.
4. Должна существовать прямая зависимость между концентрацией токсиканта в крови и клиническими проявлениями интоксикации, по которой определяются показания к гемодиализу и его длительность.
К настоящему времени, несмотря на большое количество видов аппаратов «искусственная почка», принцип их работы не изменился. Он заключается в создании потоков крови и диализирующей жидкости по обе стороны полунепроницаемой мембраны, служащей основой для работы диализаторов – массообменных устройств.
Диализирующая жидкость изготовляется таким образом, чтобы по своим осмотическим, электролитным характеристикам и pH соответствовать в основном уровню этих показателей в крови; в процессе гемодиализа она подогревается до 38–38,5 °C – в этом случае ее использование не приводит к нарушениям гомеостаза. Изменение стандартных параметров диализирующей жидкости производится по специальным показаниям. Переход токсиканта из крови в диализирующую жидкость происходит в силу разности (градиента) его концентраций по обе стороны мембраны, что требует большого объема диализирующей жидкости (100–120 л), которая постоянно удаляется после прохождения через диализатор.
Гемодиализ – высокоэффективный метод детоксикации при острых отравлениях многими лекарственными препаратами, хлорированными углеводородами (дихлорэтан, четыреххлористый углерод), соединениями тяжелых металлов и мышьяка, суррогатами алкоголя (метанолом и этиленгликолем), которые по своим физико-химическим свойствам обладают достаточной диализабельностью.
Следует иметь в виду, что при лечении с помощью гемодиализа необходимо динамически определять зависимость между клиническими проявлениями отравления и концентрацией токсиканта в крови, которая наиболее заметна при воздействии психотропных веществ и может изменяться следующим образом.
1. Положительная динамика клинических данных в течение гемодиализа сопровождается выраженным снижением концентрации токсиканта в крови, что указывает на благоприятное течение заболевания, которое обычно наблюдается при раннем применении гемодиализа в первые сутки лечения.
2. Положительная клиническая динамика не сопровождается параллельным снижением концентрации токсиканта в крови. Улучшение клинических данных у этой группы больных можно объяснить благоприятным воздействием оксигенации крови, создаваемой аппаратом «искусственная почка», что подтверждается соответствующими исследованиями газового состава крови. У части больных этой группы через 1–5 ч после гемодиализа наблюдается некоторое ухудшение клинического состояния, параллельно отмечается небольшое повышение концентрации токсиканта. Это, очевидно, связано с его продолжающимся поступлением из желудочно-кишечного тракта или уравниванием его концентрации в крови с концентрацией в других тканях организма.
Методологические особенности УФГТ приведены в табл. 7.




В терапевтических целях применяют низкоэнергетические лазеры с мягким излучением в синей (385–404 нм, 440–455 нм), зеленой (540–560 нм) и красной (560–580 нм, 620–640 нм и 760 нм) областях спектра. Преимущества лазерного облучения крови – его монохроматичность и когерентность, а также поляризованность, что в сочетании с высокой плотностью излучения обеспечивает оригинальный биологический эффект, отличный от действия естественного света и обусловленный клеточно-тканевыми, нейрорефлекторными и нейрогуморальными реакциями. Под влиянием лазерного излучения повышается активность медьсодержащих белков-ферментов – церулоплазмина, глутадионпероксидазы, супероксиддисмутазы, результатом чего является активация антиоксидантной системы и ингибирование процессов перекисного окисления липидов, что приводит к благоприятным изменениям в липидном слое клеточных мембран и предотвращает потерю клетками их функциональных свойств. Этому может также способствовать инициация вследствие лазерного излучения возбуждения растворенного в крови молекулярного кислорода и улучшение снабжения клеток энергией. Одновременно возрастает амплитуда колебаний диполей воды, находящихся вблизи клеточной мембраны, что приводит к деполяризации последних вследствие очищения от фиксированных на них токсичных веществ. Кроме того, фотохимические реакции, протекающие с участием активных форм кислорода, сопровождаются стимуляцией окислительно-восстановительных процессов в результате активации каталазы и цитохромоксидазы, что оказывает положительное влияние на синтез белка, РНК и ряда ферментов. Многие эффекты лазерного облучения могут быть связаны с увеличением проницаемости цитоплазматических мембран для кальция, что увеличивает бактерицидные свойства лейкоцитов и макрофагов. Имеет место и полевое воздействие лазерного излучения, акцептор которого – важнейшие биополимеры и биологические жидкости, изменения структуры которых играют важную роль в его биологических эффектах.
Использование лазерной гемотерапии при лечении острых отравлений после окончания сорбционно-диализной детоксикации в сочетании с МГТ и УФГТ, а также наряду с методами усиления естественной детоксикации организма сопровождается заметным снижением летальности, а при отравлениях психотропными и снотворными средствами – длительности коматозного состояния. Особенно заметно уменьшаются частота и тяжесть пневмоний. При отравлениях фосфорорганическими соединениями существенно ускоряется восстановление активности холинэстеразы крови.
Изменения показателей гомеостаза на фоне ЛГТ заключаются в длительном снижении агрегационной активности эритроцитов и тромбоцитов – на срок до 2 суток и в улучшении вискозиметрических параметров крови (вязкость, гематокрит и др.). Влияние ЛГТ на иммунные показатели сходно с таковыми при УФГТ, но при этом функциональные резервы фагоцитирующих нейтрофилов оказываются заметно меньшими. Кроме того, для ЛГТ характерно значительное улучшение оксигенации крови с увеличением капиллярно-венозной разницы по кислороду в 1,7–3 раза, а также положительные изменения в состоянии перекисного окисления липидов и антиоксидантной системы в крови.
Методологические особенности ЛГТ приведены в табл. 8.





Электрохимическая гемотерапия (ЭХГТ)
Общая характеристика. В процессе химиогемотерапии с помощью внутривенных инфузий гипохлорита натрия (ГХН) удается значительно ускорить биотрансформацию токсичных веществ за счет освобождения активного кислорода и хлора, которые интенсивно окисляют гидрофобные токсичные вещества и воздействуют на липидные структуры бактериальных клеточных мембран, нарушая их проницаемость. Кроме того, гипохлорит-ионы модифицируют деятельность окислительных ферментов, моделируя подобным образом детоксикационную функцию печени, в частности цитохрома P-450. При острых отравлениях введение ГХН сопровождается также умеренной дезагрегацией эритроцитов и тромбоцитов и улучшением оксигенационных характеристик крови (повышение парциального давления кислорода, насыщение крови кислородом, возрастание капиллярно-венозной разницы по кислороду).
Уменьшается выраженность эндотоксикоза за счет быстрого снижения в крови уровня СМ. Кроме того, с помощью инфузий ГХН достигается стабилизация их сорбции на наиболее высоком уровне в процессе проведения гемосорбции. В результате эффективность детоксикации существенно повышается.
В процессе проведения ЭХГТ также следует соблюдать ее определенные параметры, учитывая, что при острых отравлениях ЭХГТ растворами ГХН с концентрацией 300 мг/л сопровождается низкой клинической эффективностью, а растворы с концентрацией 1200 мг/л применяются только наружно. Оптимальная концентрация ГХН, таким образом, – концентрация, равная 600 мг/л.
Методические особенности, связанные с проведением ЭХГТ, отражены в табл. 9.



6. Лечебная гипер– и гипотермия
Согревание тела или его частей с лечебной целью применялось еще в глубокой древности, однако разработка научного обоснования этого метода при острых токсикозах еще далека от завершения. Повышение температуры тела как защитная реакция организма против чужеродных антигенов нашло свое патофизиологическое обоснование для использования в качестве метода пиротерапии различных заболеваний. При острых отравлениях в патогенезе гипертермического синдрома привлекает внимание наблюдающееся при нем выраженное повышение обмена между кровью, межклеточной и внутриклеточной жидкостью. При полном распределении токсических веществ в организме создаются сложности для их выведения из тканей, где некоторые из них имеют возможность депонироваться. В этих случаях в целях усиления детоксикации возможно использование пиротерапии одновременно с форсированным диурезом и ощелачиванием крови, а также гипербарической оксигенацией.В клинических условиях этот метод в сочетании с гемосорбцией уже начал применяться для лечения эндотоксикозов при тяжелом абстинентном синдроме и шизофрении. В качестве пирогенного средства используется пирогенал.
Искусственное охлаждение тела с целью снижения интенсивности метаболических процессов и повышения устойчивости к гипоксии находит более широкое применение как метод симптоматической терапии острых отравлений при токсическом отеке мозга, вызванном отравлением наркотическими ядами. С точки зрения возможностей детоксикации организма искусственная гипотермия изучена мало, хотя есть определенные перспективы использования ее антигипоксических свойств при тяжелом экзотоксическом шоке, а также в целях замедления летального синтеза при отравлениях метиловым спиртом, этиленгликолем, хлорированными углеводородами.
7. Гипербарическая оксигенация
Метод гипербарической оксигенации нашел широкое применение для лечения острых экзогенных отравлений, поскольку при этой патологии встречаются все основные типы и формы гипоксии.При определении показаний к проведению ГБО первостепенное значение имеет стадия отравления. В токсикогенной стадии, когда токсичное вещество циркулирует в крови, ГБО может служить методом усиления естественных процессов детоксикации, но только в тех случаях, когда биотрансформация ядов происходит по типу окисления при непосредственном участии кислорода без образования более токсичных метаболитов (монооксид углерода, метгемоглобинобразующие вещества). Напротив, ГБО противопоказана в токсикогенной стадии отравлений ядами, биотрансформация которых протекает по типу окисления с летальным синтезом, что приводит к образованию более токсичных метаболитов (карбофос, этиленгликоль и т. д.).
Таково общее правило, основанное на теории биотрансформации токсичных веществ в организме, которое имеет ряд исключений. Они касаются случаев, когда опасность гипоксии представляется более реальной, чем отравляющее воздействие токсичных метаболитов.
Рекомендуется два вида гипербарических систем: одноместная кислородная барокамера ОКА-МТ, рассчитанная на 1 ати, и одноместная барокамера БЛ-3 (конструкции ВНИИИМТ) на 3 ати. Практически можно пользоваться любой установкой, предназначенной для медицинских целей.
Перед началом сеанса рекомендуется сделать рентгенографию грудной клетки, определить показатели КОС, записать исходные ЭЭГ и ЭКГ, которые повторяют после сеанса. Учитывая обычно тяжелое состояние больных с отравлениями, компрессию и декомпрессию в барокамере проводят медленно (в течение 15–20 мин) с изменением давления, со скоростью 0,1 ати/мин. Продолжительность пребывания больного под лечебным давлением (1,0–2,5 ати) – 40–50 мин.
Клиническая эффективность ГБО как метода детоксикации наиболее ярко проявляется при раннем его применении для стимуляции процесса биотрансформации карбоксигемоглобина при отравлении угарным газом, мет– и сульфгемоглобина – при отравлении нитритами, нитратами и их производными. Одновременно происходит повышение насыщения кислородом плазмы крови и стимуляция его тканевого метаболизма, что носит характер патогенетической терапии.
При развитии токсической (постгипоксической энцефалопатии в соматогенной фазе отравлений окисью углерода, наркотиками и пр.) рекомендуется применение щадящих режимов ГБО (0,3–0,5 ати) с удлинением курсового лечения (до 30 сеансов) и продолжительности сеанса до 40 мин.
Относительное противопоказание к использованию ГБО при этих отравлениях – крайняя тяжесть состояния больных, связанная с развитием декомпенсированной формы экзотоксического шока, требующего проведения реанимационных мероприятий для коррекции основных показателей гемодинамики.
1.3.3. Медицинские технологии методов искусственной детоксикации
1. Аферетические методы
Методы разведения кровиРазведение крови (гемодилюция) для снижения концентрации в ней токсичных веществ давно применяется в практической медицине. Этой цели служат водная нагрузка (обильное питье) и парентеральное введение водно-электролитных и плазмозамещающих растворов. Последние особенно ценны при острых отравлениях, поскольку позволяют одновременно с гемодилюцией восстановить объем циркулирующей крови и создать условия для эффективной стимуляции диуреза.
Среди плазмозамещающих препаратов наиболее выраженными детоксикационными свойствами обладают растворы сухой плазмы или альбумина, а также полимера глюкозы – декстрана, который может иметь различную степень полимеризации и, соответственно, различную молекулярную массу. Растворы декстрана с относительной молекулярной массой около 60 000 (полиглюкин) используются в качестве гемодинамических средств, а с меньшей относительной молекулярной массой 30 000-40 000 (реополиглюкин) – как детоксикационное средство. Все это способствует восстановлению кровотока в капиллярах, уменьшает агрегацию форменных элементов крови, усиливает процесс перемещения жидкостей из тканей в кровеносное русло и, выделяясь через почки, усиливает диурез. Кроме реополиглюкина, к препаратам этой группы относятся гелофузин – 4 %-ный раствор модифицированного желатина и венофундин – 6 %-ный раствор модифицированного крахмала, которые остаются в кровеносном русле 4–6 ч и не вызывают побочных эффектов.
Количество применяемых препаратов зависит от тяжести отравления и целей их применения. Для детоксикации вводят внутривенно капельно 400-1000 мл в сутки, при явлениях экзотоксического шока – до 3000 мл. Длительное применение препаратов декстрана (более 3 суток подряд) опасно вследствие возможного развития осмотического нефроза.
Оценка эффективности инфузионной терапии как метода искусственной детоксикации затруднена, так как она редко применяется отдельно от других методов. Обычно инфузионная терапия служит основой для последующего использования форсированного диуреза, методов диализа или фильтрации крови, поэтому непосредственный критерий ее лечебного действия – улучшение гемодинамических показателей (АД, УОК, МОК, ЦВД) и КОС. Применение полиглюкина непосредственно перед гемосорбцией не рекомендуется, поскольку снижается клиренс токсикантов!
Операция замещения крови
Общая характеристика. К основным лечебным факторам данной процедуры, состоящей в одновременно проводимом и равном по объему кровопускании и переливании крови, относятся следующие: детоксикационный, депурационный, субституирующий и общебиологический.
Детоксикационный фактор основан на возможном удалении с кровью больного различных токсичных веществ. В клинической практике имеется реальная возможность проведения лишь частичной операции замещения крови (ОЗК) в объеме 1,5–3 л, в то время как для практически полного (95 %) замещения крови больного необходимо перелить не менее 15 л крови донора, т. е. в количестве, в 3 раза превышающем средний объем циркулирующей крови человека.
Это обстоятельство значительно снижает эффективность ОЗК как метода детоксикации, так как позволяет вывести из крови не более 15 % токсиканта.
Депурационное действие ОЗК состоит в освобождении организма от крупномолекулярных соединений (свободный гемоглобин плазмы, миоглобин и др.), что принципиально отличает этот метод детоксикации от диализных, при которых подобное очищение невозможно.
Субституирующее действие ОЗК заключается в замещении измененной в морфологическом и функциональном отношении крови больного (метгемоглобинемия и др.) полноценной донорской кровью, в результате чего кровь реципиента по своему составу приближается к донорской.
Общебиологическое действие ОЗК – общая реакция организма на кровопускание, компенсированное переливанием донорской крови, т. е. по сути это пересадка крови как индивидуальной «ткани» организма от нескольких доноров реципиенту. Данная иммунобиологическая реакция при умеренной выраженности оказывает стимулирующее защитное действие на иммунную систему организма.
Целесообразно выделение абсолютных показаний к операции ОЗК, когда она оценивается как патогенетическое лечение и имеет некоторые преимущества перед другими методами, и относительных показаний, которые могут быть продиктованы только конкретными условиями при невозможности использования других более эффективных методов искусственной детоксикации (гемодиализ, гемосорбция и пр.).
Абсолютные показания к ОЗК: отравления веществами, обладающими непосредственным токсичным воздействием на кровь, вызывающими тяжелую метгемоглобинемию (более 50–60 % общего гемоглобина), нарастающий массивный гемолиз (при концентрации свободного гемоглобина более 10 г/л) и снижение холинэстеразной активности крови до 10 %. Существенное преимущество ОЗК – сравнительная простота этого метода, который не требует специальной аппаратуры, и возможность его применения в условиях любого стационара. В настоящее время, учитывая трудность получения донорской крови, ОЗК практически применяется только у детей младшего возраста.
Противопоказание к применению ОЗК: выраженные гемодинамические нарушения (коллапс, отек легких), а также осложненные пороки сердца, тромбофлебиты глубоких вен конечностей.
Осложнения ОЗК: временная гипотония, посттрансфузионные реакции и умеренная анемия в послеоперационном периоде. Осложнения в процессе проведения ОЗК во многом определяются клиническим состоянием больных к моменту операции. Большинство больных, у которых до операции не было выраженных гемодинамических расстройств, переносят ее удовлетворительно. При технически правильно проведенной операции уровень артериального давления остается стабильным или меняется в незначительных пределах. Технические погрешности в операции (диспропорции в объеме вводимой и выводимой крови) приводят к временным колебаниям АД – в пределах 15–20 мм рт. ст. и легко корригируются при восстановлении нарушенного равновесия.
К наиболее тяжелым осложнениям ОЗК относится синдром гомологичной крови, развивающийся при переливании больших объемов донорской крови (свыше 3 л) и протекающий как иммунологическая реакция отторжения. Методику проведения операции ОЗК см. в табл. 10.





Клинический пример № 14
Больная И., 28 лет,
поступила в центр по лечению острых отравлений НИИ СП им. Н.В. Склифосовского 29.09.1977 г. За 1 ч до госпитализации с суицидальной целью выпила неизвестное количество «клопомора» (хлорофос).
Доставлена в клинику родственниками без оказания первой врачебной помощи.
При поступлении – состояние тяжелое, без сознания. АД крови – 100/60 мм рт. ст., пульс – 60 уд/мин, ритмичный. Дыхание поверхностное, клокочущее, выраженная бронхорея, спонтанные миофибрилляции всех групп мышц. Резкий миоз. Изо рта – запах ФОИ. Непроизвольная дефекация.
Больной произведена экстренная интубация, подключена к аппарату РО-3 для проведения ИВЛ. Внутривенно введены антидоты: атропин (35 мг), дипироксим (2,0 г). Бронхорея прекратилась, число сердечных сокращений – 100 в минуту.
Через зонд промыт желудок, по зонду введено 250 мл касторового масла.
Результаты лабораторного исследования: в крови обнаружен ТХМ-3 в концентрации 8,9 мкг/мл, АХЭ – 20,8 % от нормы, рН венозной крови – 7,12, ВЕ – минус 17,1, РCO2 – 49.
ЭКГ-исследование выявило увеличение систолического показателя на 6 %.
По совокупности анамнестических, клинических и лабораторных данных поставлен диагноз: отравление ФОИ II–III ст. Суицид.
На фоне противошоковой терапии спустя 50 мин после госпитализации начат гемодиализ аппаратом «Травенол». Кровоток через диализатор 200 мл/мин, расход диализирующей жидкости – 500 мл/мин в режиме на слив. Спустя 2 ч от начала ГД больная пришла в сознание. После введения 15 мг тубарина ИВЛ продолжена.
Продолжительность ГД – 6 ч, прекращен ввиду развития гипотензии (АД – 80/50 мм рт. ст., ЦВД – 5 мм водн. ст.).
В дальнейшем проводились симптоматическая, реанимационная и антидотная терапия, форсированный диурез. Через 1 ч после завершения ГД больная была экстубирована. За это время концентрация ТХМ-3 в крови снизилась до 0,35 мкг/мл (на 96,1 %), средний клиренс составил 50,1 мл/мин. АХЭ увеличилась до 30,1 % от нормы; рН крови – 7,35, ВЕ – минус 5,3, РCO2 – 35 мм рт. ст. Спонтанные миофибрилляции исчезли, бронхорея не возобновлялась. Сознание ясное.
На 2-е сутки отмечено новое снижение АХЭ до 20,6 % от нормы. Проведено обменное замещение крови в объеме 2,5 л. На 4-е сутки АХЭ – 62,4 %, на 7-е – 70,8 % от нормы.
Введение атропина прекращено по истечении 5 суток пребывания в клинике: всего было введено 286 мг 0,1 %-ного раствора сернокислого атропина, 2,8 г дипироксима в первые сутки.
Дальнейшее течение заболевания без осложнений, выписана в удовлетворительном состоянии под наблюдение психиатра спустя 12 суток после отравления.
Заключительный клинический диагноз: 1. Отравление ФОИ (ТХМ-3) III ст. Суицид. Коматозное состояние. 2. Астеническое состояние.
P.S. В данном случае тяжелого отравления ФОИ своевременное применение гемодиализа (6 ч) позволило снизить концентрацию ФОИ в крови на 96 %, что явилось основным средством спасения жизни в комплексе с антидотной терапией. В связи с низкой активностью АХЭ (20 % от нормы) проведено ОЗК в объеме 2,5 л, приведшее к сокращению периода реабилитации с восстановлением активности АХЭ до 12 суток (обычно при таком отравлении уходит минимум 1,5 месяца).
2. Методы диализа и фильтрации крови
Гемодиализ (ГД)Общая характеристика. Диализ – способ удаления токсических веществ (электролитов и неэлектролитов) из коллоидных растворов и растворов высокомолекулярных веществ, основанный на свойствах некоторых мембран пропускать молекулы и ионы, но задерживать коллоидные частицы и макромолекулы. С физической точки зрения диализ – свободная диффузия, сочетающаяся с фильтрацией вещества через полунепроницаемую мембрану.
Применяемые для диализа мембраны можно разделить на два основных вида: искусственные (целлофан, купрофан и др.) и естественные (брюшина, базальная мембрана клубочков почек, плевра и др.). Размер пор мембран (5-10 нм) позволяет проникать через них только свободным молекулам, не связанным с белком и подходящим по своим размерам к величине пор данной мембраны. Только концентрация не связанной с белком части токсичного вещества является исходной для количественной оценки возможного эффекта любого диализа, так как характеризует способность химического вещества проходить через искусственные или естественные мембраны, или его «диализабельность». Решающее значение для диализабельности химического вещества имеют особенности его физико-химических и токсикологических свойств, влияние которых на эффективность гемодиализа формулируется следующим образом.
1. Токсикант должен быть относительно низкомолекулярным (размер молекулы должен быть не более 8 нм) для свободной диффузии через полунепроницаемую мембрану.
2. Токсикант должен растворяться в воде и находиться в плазме в свободном, не связанном с белками состоянии или эта связь должна быть легко обратима, т. е. при уменьшении концентрации свободного токсиканта во время диализа она должна непрерывно пополняться за счет освобождения от его связи с белком.
3. Токсикант должен циркулировать в крови определенное время, достаточное для подключения аппарата «искусственная почка» и прохождения через диализатор не менее одного объема циркулирующей крови, т. е. не менее 6–8 ч.
4. Должна существовать прямая зависимость между концентрацией токсиканта в крови и клиническими проявлениями интоксикации, по которой определяются показания к гемодиализу и его длительность.
К настоящему времени, несмотря на большое количество видов аппаратов «искусственная почка», принцип их работы не изменился. Он заключается в создании потоков крови и диализирующей жидкости по обе стороны полунепроницаемой мембраны, служащей основой для работы диализаторов – массообменных устройств.
Диализирующая жидкость изготовляется таким образом, чтобы по своим осмотическим, электролитным характеристикам и pH соответствовать в основном уровню этих показателей в крови; в процессе гемодиализа она подогревается до 38–38,5 °C – в этом случае ее использование не приводит к нарушениям гомеостаза. Изменение стандартных параметров диализирующей жидкости производится по специальным показаниям. Переход токсиканта из крови в диализирующую жидкость происходит в силу разности (градиента) его концентраций по обе стороны мембраны, что требует большого объема диализирующей жидкости (100–120 л), которая постоянно удаляется после прохождения через диализатор.
Гемодиализ – высокоэффективный метод детоксикации при острых отравлениях многими лекарственными препаратами, хлорированными углеводородами (дихлорэтан, четыреххлористый углерод), соединениями тяжелых металлов и мышьяка, суррогатами алкоголя (метанолом и этиленгликолем), которые по своим физико-химическим свойствам обладают достаточной диализабельностью.
Следует иметь в виду, что при лечении с помощью гемодиализа необходимо динамически определять зависимость между клиническими проявлениями отравления и концентрацией токсиканта в крови, которая наиболее заметна при воздействии психотропных веществ и может изменяться следующим образом.
1. Положительная динамика клинических данных в течение гемодиализа сопровождается выраженным снижением концентрации токсиканта в крови, что указывает на благоприятное течение заболевания, которое обычно наблюдается при раннем применении гемодиализа в первые сутки лечения.
2. Положительная клиническая динамика не сопровождается параллельным снижением концентрации токсиканта в крови. Улучшение клинических данных у этой группы больных можно объяснить благоприятным воздействием оксигенации крови, создаваемой аппаратом «искусственная почка», что подтверждается соответствующими исследованиями газового состава крови. У части больных этой группы через 1–5 ч после гемодиализа наблюдается некоторое ухудшение клинического состояния, параллельно отмечается небольшое повышение концентрации токсиканта. Это, очевидно, связано с его продолжающимся поступлением из желудочно-кишечного тракта или уравниванием его концентрации в крови с концентрацией в других тканях организма.
