Страница:
Волновые функции, отвечающие молекулярным орбиталям в двухатомной молекуле, представляют в виде суммы и разности волновых функций, атомных орбиталей, умноженных на постоянные коэффициенты: ?(АВ) = c1?(A)±c2?(B). Это
метод вычисления одноэлектронной волновой функции(молекулярные орбитали в приближении линейной комбинации атомных орбиталей).
Энергии связывающих орбиталейниже энергии атомных орбиталей. Электроны связывающих молекулярных орбиталей находятся в пространстве между связываемыми атомами.
Энергии разрыхляющих орбиталейвыше энергии исходных атомных орбиталей. Заселение разрыхляющих молекулярных орбиталей электронами ослабляет связь.
11. Ионная связь
12. Водородная связь
13. Превращение энергии при химических реакциях
14. Цепные реакции
15. Общие свойства неметаллов
16. Водород
17. Вода
18. Перекись водорода
19. Общая характеристика подгруппы галогенов
20. Хлор. Хлороводород и соляная кислота
Энергии связывающих орбиталейниже энергии атомных орбиталей. Электроны связывающих молекулярных орбиталей находятся в пространстве между связываемыми атомами.
Энергии разрыхляющих орбиталейвыше энергии исходных атомных орбиталей. Заселение разрыхляющих молекулярных орбиталей электронами ослабляет связь.
11. Ионная связь
Связь, возникшая между атомами с резко выраженными противоположными свойствами (типичным металлом и типичным неметаллом), между которыми возникают силы электростатического притяжения, называется
электровалентной,или
ионной связью. Соединения, образовавшиеся путем притяжения ионов, называются
гетерополярными,или
ионными. (FrF – самое типичное ионное соединение, NaCl). Образование таких соединений получается из атомов, резко отличающихся по значению электроотрицательности, в результате перехода электронов от атомов одних элементов к другим. Ионные соединения возникают между элементами I и II групп с элементами главных подгрупп VI и VII групп. Типичные металлы имеют на внешнем энергетическом уровне не более 3-х электронов, которые они отдают, превращаясь в положительно заряженные катионы, а типичные неметаллы, имеющие 6–7 электронов на внешнем валентном уровне, принимают недостающие электроны, превращаясь в отрицательно заряженные катионы, т. е. электронные оболочки соединяющихся элементов превращаются в электронную оболочку (завершенный уровень) благородных газов. Вещества с ионной связью имеют кристаллическую решетку, твердые, являются электролитами, с высокими температурами кипения и плавления, при растворении в воде или плавлении проявляют свойства сильных электролитов. Ионная связь – производная ковалентной связи в результате односторонней поляризации общей электронной пары, переходящей во владение одного из соединяющихся атомов.
Одностороннюю поляризацию осуществляет атом хлора, обладающего ярко выраженными неметаллическими свойствами. Электроны переходят от атома натрия, имеющего типичные металлические свойства, к атому хлора. В результате к атому хлора смещается общее электронное облако. Ионная связь – высшая степень ковалентной неполярной связи. Ко-валентная полярная связь является промежуточной формой между ионной и ковалентной неполярной связью. Природа образования ко-валентной и ионной связи едина, принципиальных отличий не существует. Различие состоит в степени поляризации. Ионной связи характерны ненасыщаемость– каждый ион, взаимодействуя с противоположным во всех направлениях, не компенсирует силовые поля, и ненаправленность– любой ион в любом направлении способен притягивать к себе ион противоположного заряда. В результате этих свойств ионные соединения представляют собой твердые тела с ионной кристаллической решеткой. 100 %-ной ионной связи не существует. Существует степень или доля ионности связи – в соединении СsF ионная связь имеет долю 89 %.
Одностороннюю поляризацию осуществляет атом хлора, обладающего ярко выраженными неметаллическими свойствами. Электроны переходят от атома натрия, имеющего типичные металлические свойства, к атому хлора. В результате к атому хлора смещается общее электронное облако. Ионная связь – высшая степень ковалентной неполярной связи. Ко-валентная полярная связь является промежуточной формой между ионной и ковалентной неполярной связью. Природа образования ко-валентной и ионной связи едина, принципиальных отличий не существует. Различие состоит в степени поляризации. Ионной связи характерны ненасыщаемость– каждый ион, взаимодействуя с противоположным во всех направлениях, не компенсирует силовые поля, и ненаправленность– любой ион в любом направлении способен притягивать к себе ион противоположного заряда. В результате этих свойств ионные соединения представляют собой твердые тела с ионной кристаллической решеткой. 100 %-ной ионной связи не существует. Существует степень или доля ионности связи – в соединении СsF ионная связь имеет долю 89 %.
12. Водородная связь
В 80-х годах XIX в. М.А. Ильинскийи
Н.Н. Бекетовустановили, что атом водорода, соединенный с атомом фтора, кислорода или азота, способен образовывать еще одну дополнительную связь – то есть некоторые водородосодер-жащие группы атомов образуют химическую связь, электроотрицательные атомы которой входят в состав молекулы. Этот вид связи получил название
водородная связь.
Водородная связь– взаимодействие между двумя электроотрицательными атомами одной или нескольких разных молекул при помощи атома водорода: А—Н...В (чертой обозначена ковалентная связь, тремя точками – водородная связь).
Для водородной связи характерноэлектростатическое притяжение водорода (несущего положительный заряд ?+) к атому электроотрицательного элемента, имеющего отрицательный заряд ?-. Чаще всего она слабее ковалентной, но сильнее обычного притяжения молекул друг к другу в твердых и жидких веществах.
Водородная связь отличается от межмолекулярных взаимодействий тем, что обладает свойствами направленности и насыщаемости.
Водородная связь считается разновидностью ковалентной химической связи.Описывается при помощи метода молекулярных орбита-лей в виде трехцентровой двухэлектронной связи.
Признак наличия водородной связи– расстояние между атомом водорода и другим атомом, ее образующим, меньше, чем общая сумма радиусов этих атомов.
Чаще встречаются несимметричные водородные связи (расстояние Н...В>А—В), редко – симметричные ( HF).
Угол между атомами А—Н...В~180o.
Водородная связь присутствует во многих химических соединениях. Образуется между наиболее электроотрицательными элементами (фтор, азот, кислород), реже – в некоторых других (хлор, сера).
Наиболее прочные водородные связи имеются в воде, фтороводороде, кислородсодержащих неорганических кислотах, карбоновых кислотах, фенолах, спиртах, аммиаке, аминах.
При кристаллизации водородные связи сохраняются.
Кристаллические решетки водородных связей:
1) цепи (метанол);
2) плоские двухмерные слои (борная кислота);
3) пространственные трехмерные сетки (лед).
Внутримолекулярная водородная связь– водородная связь, объединяющая части одной молекулы.
Межмолекулярная водородная связь– водородная связь, образующаяся между атомом водорода одной молекулы и атомом неметалла другой молекулы.
Водородная связь– взаимодействие между двумя электроотрицательными атомами одной или нескольких разных молекул при помощи атома водорода: А—Н...В (чертой обозначена ковалентная связь, тремя точками – водородная связь).
Для водородной связи характерноэлектростатическое притяжение водорода (несущего положительный заряд ?+) к атому электроотрицательного элемента, имеющего отрицательный заряд ?-. Чаще всего она слабее ковалентной, но сильнее обычного притяжения молекул друг к другу в твердых и жидких веществах.
Водородная связь отличается от межмолекулярных взаимодействий тем, что обладает свойствами направленности и насыщаемости.
Водородная связь считается разновидностью ковалентной химической связи.Описывается при помощи метода молекулярных орбита-лей в виде трехцентровой двухэлектронной связи.
Признак наличия водородной связи– расстояние между атомом водорода и другим атомом, ее образующим, меньше, чем общая сумма радиусов этих атомов.
Чаще встречаются несимметричные водородные связи (расстояние Н...В>А—В), редко – симметричные ( HF).
Угол между атомами А—Н...В~180o.
Водородная связь присутствует во многих химических соединениях. Образуется между наиболее электроотрицательными элементами (фтор, азот, кислород), реже – в некоторых других (хлор, сера).
Наиболее прочные водородные связи имеются в воде, фтороводороде, кислородсодержащих неорганических кислотах, карбоновых кислотах, фенолах, спиртах, аммиаке, аминах.
При кристаллизации водородные связи сохраняются.
Кристаллические решетки водородных связей:
1) цепи (метанол);
2) плоские двухмерные слои (борная кислота);
3) пространственные трехмерные сетки (лед).
Внутримолекулярная водородная связь– водородная связь, объединяющая части одной молекулы.
Межмолекулярная водородная связь– водородная связь, образующаяся между атомом водорода одной молекулы и атомом неметалла другой молекулы.
13. Превращение энергии при химических реакциях
Химическая реакция– превращение одного или нескольких исходных веществ в другие по химическому составу или строению вещества.
По сравнению с ядерными реакциями общее число атомов и изотопный состав химических элементов при химических реакциях неизменны.
Виды химических реакций:
1) смешение или физический контакт реагентов;
2) нагревание;
3) катализ;
4) фотохимические реакции (с участием света);
5) электродные процессы;
6) механохимические реакции;
7) радиационно-химические реакции;
8) плазмохимические реакции.
Основные типы химических реакций:
1) соединения: 2Cu + O2 = 2CuO;
2) разложения: 2HgO = 2Hg + O2;
3) замещения: Fe + CuSO4 = FeSO4 + Cu;
4) обмена: NaCl + H2SO4 = НСl + NaHSO4.
Химические реакции характеризуются физическими проявлениями:
1) поглощение и выделение энергии;
2) изменение агрегатного состояния реагентов;
3) изменение окраски реакционной смеси и др.
Выделение или поглощение энергии происходит в виде теплоты. Это позволяет судить о наличии в веществах определенного количества некоторой энергии ( внутренней энергией реакции).
При химических реакциях происходит освобождение части энергии, содержащейся в веществах, это носит название теплового эффекта реакции, по которому можно судить об изменении количества внутренней энергии вещества.
У ряда химических реакций можно наблюдать поглощение или выделение лучистой энергии. В этих случаях внутренняя энергия через теплоту превращается в излучение (горение). Существуют также процессы в которых внутренняя энергия сразу превращается в лучистую (лю-минисценция).
В химических реакциях, протекающих с взрывом, внутренняя энергия превращается в механическую, причем частично сразу, частично переходя изначально в теплоту.
Во время химических реакций происходит взаимное превращение энергий – внутренней энергии веществ в тепловую, лучистую, электрическую и механическую, и наоборот.
Экзотермические химические реакциихарактеризуются выделением энергии во внешнюю среду. Эндотермические– поглощением энергии.
В физических процессах вещества не изменяют своих свойств, может измениться внешняя форма или агрегатное состояние. В химических процессах образуются новые вещества с другими свойствами. При ядерных реакциях в атомах обязательно происходят трансформации электронной оболочки.
По сравнению с ядерными реакциями общее число атомов и изотопный состав химических элементов при химических реакциях неизменны.
Виды химических реакций:
1) смешение или физический контакт реагентов;
2) нагревание;
3) катализ;
4) фотохимические реакции (с участием света);
5) электродные процессы;
6) механохимические реакции;
7) радиационно-химические реакции;
8) плазмохимические реакции.
Основные типы химических реакций:
1) соединения: 2Cu + O2 = 2CuO;
2) разложения: 2HgO = 2Hg + O2;
3) замещения: Fe + CuSO4 = FeSO4 + Cu;
4) обмена: NaCl + H2SO4 = НСl + NaHSO4.
Химические реакции характеризуются физическими проявлениями:
1) поглощение и выделение энергии;
2) изменение агрегатного состояния реагентов;
3) изменение окраски реакционной смеси и др.
Выделение или поглощение энергии происходит в виде теплоты. Это позволяет судить о наличии в веществах определенного количества некоторой энергии ( внутренней энергией реакции).
При химических реакциях происходит освобождение части энергии, содержащейся в веществах, это носит название теплового эффекта реакции, по которому можно судить об изменении количества внутренней энергии вещества.
У ряда химических реакций можно наблюдать поглощение или выделение лучистой энергии. В этих случаях внутренняя энергия через теплоту превращается в излучение (горение). Существуют также процессы в которых внутренняя энергия сразу превращается в лучистую (лю-минисценция).
В химических реакциях, протекающих с взрывом, внутренняя энергия превращается в механическую, причем частично сразу, частично переходя изначально в теплоту.
Во время химических реакций происходит взаимное превращение энергий – внутренней энергии веществ в тепловую, лучистую, электрическую и механическую, и наоборот.
Экзотермические химические реакциихарактеризуются выделением энергии во внешнюю среду. Эндотермические– поглощением энергии.
В физических процессах вещества не изменяют своих свойств, может измениться внешняя форма или агрегатное состояние. В химических процессах образуются новые вещества с другими свойствами. При ядерных реакциях в атомах обязательно происходят трансформации электронной оболочки.
14. Цепные реакции
Существуют химические реакции, в которых взаимодействие между компонентами происходит довольно просто. Существует весьма обширная группа реакций, протекающих сложно. В этих реакциях каждый элементарный этап связан с предыдущим, без выполнения которого дальнейшая реакция невозможна. В таких реакциях образование продукта реакции являет собой результат цепи элементарных этапов реакции, что называется
цепными реакциями,
которые проходят при участии активных центров – атомов, ионов или радикалов (осколков молекул).
Радикал– осколок молекулы, имеющий неспаренные электроны и проявляющий высокую реакционную активность (H, Cl, O, OH, CH3).
При взаимодействии активных центров с молекулами исходных компонентов происходит образование продуктов реакции и новых активных частиц, способствующих новому этапу взаимодействия. Активные центры способствуют и создают цепи последовательных превращений веществ.
В качестве примера цепной реакции можно привести реакцию синтеза хлористого водорода:
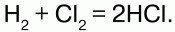 Эту реакцию провоцирует свет. Молекула хлора поглощает квант лучистой энергии
h
vи приходит в возбуждение, то есть атом в ней начинает энергично колебаться. Когда энергия колебаний превышает энергию связи, то происходит распад молекулы (
фотохимическая диссоциация):
Эту реакцию провоцирует свет. Молекула хлора поглощает квант лучистой энергии
h
vи приходит в возбуждение, то есть атом в ней начинает энергично колебаться. Когда энергия колебаний превышает энергию связи, то происходит распад молекулы (
фотохимическая диссоциация):
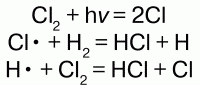 Обрыв цепи –окончание цепи, характеризующееся соударением двух активных частиц и одной неактивной, результатом которой является образование молекулы и унос выделившейся энергии неактивной частицей.
Обрыв цепи –окончание цепи, характеризующееся соударением двух активных частиц и одной неактивной, результатом которой является образование молекулы и унос выделившейся энергии неактивной частицей.
Цепные реакции делятся на:
1) неразветвленные цепные реакции;
2) разветвленные цепные реакции.
Неразветвленная цепная реакцияхарактеризуется тем, что при каждом элементарном взаимодействии один активный центр образует молекулу продукта реакции и один новый активный центр. Разветвленная цепная реакцияхарактеризуется тем, что по ходу взаимодействия свободного радикала с молекулой исходного реагента происходит образование нескольких новых активных центров, одни из которых дают начало новым активным центрам, а другие продолжают старую цепь.
Пример разветвленной цепной реакции – реакция образования воды из простых веществ:
 Теория разветвленных цепных реакцийбыла выдвинута
Н.Н. Семеновым в 20-х годах XXвека при изучении кинетики разнообразных процессов.
Теория цепных реакцийявляется научной основой для отраслей техники.
Ядерные цепные реакциитоже относятся к цепным процессам.
Теория разветвленных цепных реакцийбыла выдвинута
Н.Н. Семеновым в 20-х годах XXвека при изучении кинетики разнообразных процессов.
Теория цепных реакцийявляется научной основой для отраслей техники.
Ядерные цепные реакциитоже относятся к цепным процессам.
Радикал– осколок молекулы, имеющий неспаренные электроны и проявляющий высокую реакционную активность (H, Cl, O, OH, CH3).
При взаимодействии активных центров с молекулами исходных компонентов происходит образование продуктов реакции и новых активных частиц, способствующих новому этапу взаимодействия. Активные центры способствуют и создают цепи последовательных превращений веществ.
В качестве примера цепной реакции можно привести реакцию синтеза хлористого водорода:
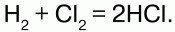
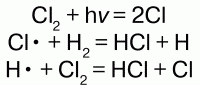
Цепные реакции делятся на:
1) неразветвленные цепные реакции;
2) разветвленные цепные реакции.
Неразветвленная цепная реакцияхарактеризуется тем, что при каждом элементарном взаимодействии один активный центр образует молекулу продукта реакции и один новый активный центр. Разветвленная цепная реакцияхарактеризуется тем, что по ходу взаимодействия свободного радикала с молекулой исходного реагента происходит образование нескольких новых активных центров, одни из которых дают начало новым активным центрам, а другие продолжают старую цепь.
Пример разветвленной цепной реакции – реакция образования воды из простых веществ:

15. Общие свойства неметаллов
Исходя из положения неметаллов в периодической системе
Менделеева, можно выявить свойства для них характерные. Можно определить количество электронов на внешнем энергетическом подуровне, местоположение неметаллов в конце малых и больших периодов, число электронов на внешнем подуровне соответствует номеру группы. В периоде идет возрастание способности присоединять электроны, а в группе это свойство можно наблюдать по мере уменьшения радиуса (в периоде снизу вверх).
Для неметаллов характерно свойство присоединять электроны, проявлять окислительные свойства. Наиболее они выражены у элементов VIи VIIгрупп. Самый сильный окислитель – фтор.
Окислительные свойства неметаллов возрастают в последовательности:
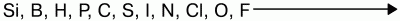 Фторникогда не проявляет восстановительных свойств. Другие неметаллы и вещества, им соответствующие, могут проявлять восстановительные свойства, но они слабее, чем у металлов.
Фторникогда не проявляет восстановительных свойств. Другие неметаллы и вещества, им соответствующие, могут проявлять восстановительные свойства, но они слабее, чем у металлов.
Восстановительная способность неметаллов увеличивается от кислорода к кремнию в ряду:
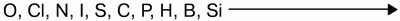 Так, хлор напрямую не взаимодействует с кислородом, но можно получить оксиды хлора (Cl2O, ClO2, Cl2O7), в которых хлор проявляет положительную степень окисления. Азот при высоких температурах вступает в реакцию с кислородом, выказывая восстановительные свойства:
Так, хлор напрямую не взаимодействует с кислородом, но можно получить оксиды хлора (Cl2O, ClO2, Cl2O7), в которых хлор проявляет положительную степень окисления. Азот при высоких температурах вступает в реакцию с кислородом, выказывая восстановительные свойства:
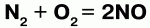 Сера проявляет как окислительные, так и восстановительные свойства:
Сера проявляет как окислительные, так и восстановительные свойства:
S + O2 = SO2 – окислительные свойства серы;
S + H2 = H2S – восстановительные свойства серы.
В нормальных условиях неметаллы:
1) газы (водород, фтор, хлор, кислород, азот и благородные газы);
2) жидкость (бром);
3) твердые вещества (все остальные).
Из-за разницы строения кристаллической решетки свойства неметаллов отличаются друг от друга.
C, B, Si – немолекулярное строение – атомная кристаллическая решетка.
F2 , O2, Cl2, Br2, N2, I2, S8, P4 – молекулярное строение – молекулярная кристаллическая решетка.
С водородом образуют летучие соединения – газы и жидкости.
С кислородом образуют кислотные оксиды.
Атомы инертных газов содержат на внешнем уровне по 8 электронов (у гелия – 2). До середины XXвека считалось, что такие атомы не способны ни отдавать электроны, ни принимать их, ни образовывать общие электронные пары. В 1962 г.был получен тетрафторид ксенона XeF4, первое химическое соединение инертного газа.
Для неметаллов характерно свойство присоединять электроны, проявлять окислительные свойства. Наиболее они выражены у элементов VIи VIIгрупп. Самый сильный окислитель – фтор.
Окислительные свойства неметаллов возрастают в последовательности:
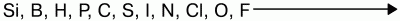
Восстановительная способность неметаллов увеличивается от кислорода к кремнию в ряду:
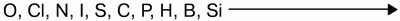
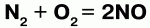
S + O2 = SO2 – окислительные свойства серы;
S + H2 = H2S – восстановительные свойства серы.
В нормальных условиях неметаллы:
1) газы (водород, фтор, хлор, кислород, азот и благородные газы);
2) жидкость (бром);
3) твердые вещества (все остальные).
Из-за разницы строения кристаллической решетки свойства неметаллов отличаются друг от друга.
C, B, Si – немолекулярное строение – атомная кристаллическая решетка.
F2 , O2, Cl2, Br2, N2, I2, S8, P4 – молекулярное строение – молекулярная кристаллическая решетка.
С водородом образуют летучие соединения – газы и жидкости.
С кислородом образуют кислотные оксиды.
Атомы инертных газов содержат на внешнем уровне по 8 электронов (у гелия – 2). До середины XXвека считалось, что такие атомы не способны ни отдавать электроны, ни принимать их, ни образовывать общие электронные пары. В 1962 г.был получен тетрафторид ксенона XeF4, первое химическое соединение инертного газа.
16. Водород
Водород (Н)– 1-й элемент периодической системы Менделеева – I и VII группа, главная подгруппа, 1 период. На внешнем s1-подуровне имеется 1 валентный электрон и 1 s2-подуровень свободный, отчего Н обладает двойной природой: в одних случаях он отдает электрон (восстановительные свойства), в других – принимает (окислительные свойства). Аr – 1,008; электронная конфигурация – 1s1. Н входит в состав всех органических соединений, содержится в некоторых природных газах, составляет 1/2 массы Солнца.
Физические свойства: Н2– бесцветный газ, без запаха, самый легкий из всех газов.
Химические свойства:связь в молекуле Н2 – ковалентная неполярная. Энергия ионизации водорода высока, поэтому водород не образует ионных соединений. В обычных условиях молекула водорода очень устойчива – очень высокая энергия диссоциации и связи.
Соединения водорода с другими элементами носят ковалентный характер. В соединениях Нвсегда одновалентен, степень окисления с неметаллами +1, металлами -1. При высокой температуре водород взаимодействует с щелочными и щелочно-земельными металлами, образуя гидриды:
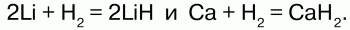 Связь в гидридах частично ионная. С галогенами Н реагирует по-разному: с F на холоде со взрывом:
Связь в гидридах частично ионная. С галогенами Н реагирует по-разному: с F на холоде со взрывом:
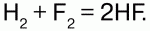 С Cl при нагревании или на свету реакция идет со взрывом по цепному механизму, разлагая атомы на радикалы:
С Cl при нагревании или на свету реакция идет со взрывом по цепному механизму, разлагая атомы на радикалы:
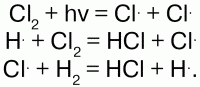 Реакция с Вr происходит при нагревании, с I при сильном нагревании и не полностью, т. к. идет обратная реакция. H восстанавливает многие металлы из их оксидов:
Реакция с Вr происходит при нагревании, с I при сильном нагревании и не полностью, т. к. идет обратная реакция. H восстанавливает многие металлы из их оксидов:
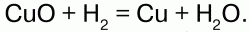 С многими неметаллами H образует газообразные соединения: СН4, SiH4 – силан, Н2S – сероводород и др. Синтезом Н с N получают аммиак:
С многими неметаллами H образует газообразные соединения: СН4, SiH4 – силан, Н2S – сероводород и др. Синтезом Н с N получают аммиак:
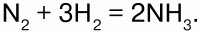 Особо активен атомарный H. Он реагирует с кислородом без поджигания: 2Н? + О2 = Н2О2. Без нагревания восстанавливает многие неметаллы. С галогенами реагирует быстро, даже в темноте.
Особо активен атомарный H. Он реагирует с кислородом без поджигания: 2Н? + О2 = Н2О2. Без нагревания восстанавливает многие неметаллы. С галогенами реагирует быстро, даже в темноте.
Получение:в лаборатории в аппарате Кипа воздействием на него НСl или Н2SО4 с Zn:
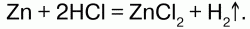 Или электролизом воды с добавлением NаОН.
Или электролизом воды с добавлением NаОН.
В промышленности Н получают:
а) конверсией воды:
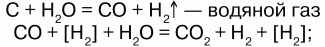 б) конверсией СН4:
б) конверсией СН4:
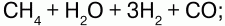 в) кислородной конверсией:
в) кислородной конверсией:
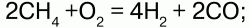 г) нагреванием СН4:
г) нагреванием СН4:
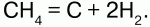
Физические свойства: Н2– бесцветный газ, без запаха, самый легкий из всех газов.
Химические свойства:связь в молекуле Н2 – ковалентная неполярная. Энергия ионизации водорода высока, поэтому водород не образует ионных соединений. В обычных условиях молекула водорода очень устойчива – очень высокая энергия диссоциации и связи.
Соединения водорода с другими элементами носят ковалентный характер. В соединениях Нвсегда одновалентен, степень окисления с неметаллами +1, металлами -1. При высокой температуре водород взаимодействует с щелочными и щелочно-земельными металлами, образуя гидриды:
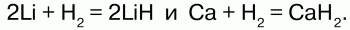
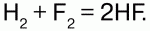
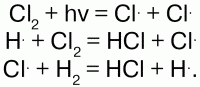
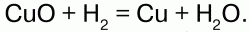
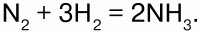
Получение:в лаборатории в аппарате Кипа воздействием на него НСl или Н2SО4 с Zn:
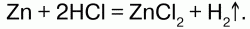
В промышленности Н получают:
а) конверсией воды:
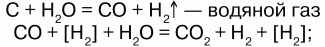
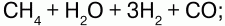
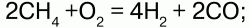
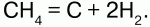
17. Вода
Из оксидов водорода самым распространенным на Земле является
вода.Эмпирическая формула –
Н2О.Молекулярная масса – 18.
Строение молекулы воды(структурная формула):
 Молекулы воды имеют треугольную формулу: атомы водорода образуют с атомом кислорода угол, равный 104,3 %. Вблизи атома кислорода образуется отрицательно заряженное поле, т. к. наибольшая электронная плотность сосредотачивается на атоме кислорода, а вблизи атомов водорода образуется положительно заряженное поле – молекула воды – диполь. Вследствие полярности молекулы воды ассоциируют, образуя водородные связи. Последние обуславливают все физические свойства воды.
Молекулы воды имеют треугольную формулу: атомы водорода образуют с атомом кислорода угол, равный 104,3 %. Вблизи атома кислорода образуется отрицательно заряженное поле, т. к. наибольшая электронная плотность сосредотачивается на атоме кислорода, а вблизи атомов водорода образуется положительно заряженное поле – молекула воды – диполь. Вследствие полярности молекулы воды ассоциируют, образуя водородные связи. Последние обуславливают все физические свойства воды.
Физические свойства:вода – бесцветная жидкость, без вкуса и запаха, плотность – 1 г/см3; температура замерзания – 0 °C (лед), кипения – 100 °C (пар). При 100 °C и нормальном давлении водородные связи рвутся и вода переходит в газообразное состояние – пар. У воды плохая тепло-и электропроводность, но хорошая растворимость.
Химические свойства:вода незначительно диссоциирует:
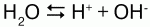 В присутствии воды идет гидролиз солей – разложение их водой с образованием слабого электролита:
В присутствии воды идет гидролиз солей – разложение их водой с образованием слабого электролита:
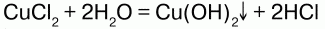 Взаимодействует со многими основными оксидами, металлами:
Взаимодействует со многими основными оксидами, металлами:
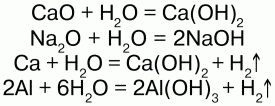 С кислотными оксидами:
С кислотными оксидами:
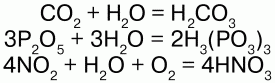 Получение:вода образуется при горении водорода в кислороде: 2Н2 + О2 = 2Н2О
Получение:вода образуется при горении водорода в кислороде: 2Н2 + О2 = 2Н2О
Эта реакция протекает мгновенно при 700 °C. Смесь двух объемов водорода и одного объема кислорода называется гремучей смесью. Методом перегонки получают чистую воду – дистиллированную воду.
Нахождение в природе:вода составляет 2/3 поверхности Земли. Природная вода не бывает чистой, т. к. в ней растворено огромное количество солей. Вода входит в состав многих кристаллогидратов: Nа2СО3 ? 10Н2О; CuSO4 ? 5Н2О; MgSO4? 7Н2О. Тяжелая вода D2Оотличается от обычной, образованной водородом – протием – наличием в ней второго изотопа водорода – D(дейтерия), Аr которого – 2, следовательно, молекулярная масса тяжелой воды – 20. Плотность D2О =1,1050 г/см3; температура кипения – 101,4 °C, замерзания – 3,8 °C. Химически менее активна. Применяется в качестве замедлителя нейтронов в ядерных реакторах. Она непригодна для жизненных процессов, т. к. изменяет скорость биохимических реакций. В обычной воде частично содержится тяжелая вода.

Физические свойства:вода – бесцветная жидкость, без вкуса и запаха, плотность – 1 г/см3; температура замерзания – 0 °C (лед), кипения – 100 °C (пар). При 100 °C и нормальном давлении водородные связи рвутся и вода переходит в газообразное состояние – пар. У воды плохая тепло-и электропроводность, но хорошая растворимость.
Химические свойства:вода незначительно диссоциирует:
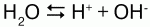
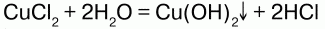
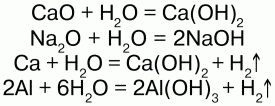
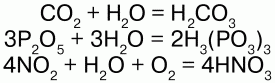
Эта реакция протекает мгновенно при 700 °C. Смесь двух объемов водорода и одного объема кислорода называется гремучей смесью. Методом перегонки получают чистую воду – дистиллированную воду.
Нахождение в природе:вода составляет 2/3 поверхности Земли. Природная вода не бывает чистой, т. к. в ней растворено огромное количество солей. Вода входит в состав многих кристаллогидратов: Nа2СО3 ? 10Н2О; CuSO4 ? 5Н2О; MgSO4? 7Н2О. Тяжелая вода D2Оотличается от обычной, образованной водородом – протием – наличием в ней второго изотопа водорода – D(дейтерия), Аr которого – 2, следовательно, молекулярная масса тяжелой воды – 20. Плотность D2О =1,1050 г/см3; температура кипения – 101,4 °C, замерзания – 3,8 °C. Химически менее активна. Применяется в качестве замедлителя нейтронов в ядерных реакторах. Она непригодна для жизненных процессов, т. к. изменяет скорость биохимических реакций. В обычной воде частично содержится тяжелая вода.
18. Перекись водорода
Пероксид, или перекись водорода– кислородное соединение водорода (перекись). Формула:
Н2О2 Физические свойства:перекись водорода – бесцветная сиропообразная жидкость, плотность – 1,45 г/см3относится к числу очень слабых, т. к. в очень малой степени диссоциирует: по I ступени:
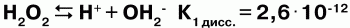 по II ступени:
по II ступени:
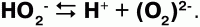 Химические свойства:при взаимодействии концентрированного раствора
Н2О2 сгидроксидами металлов образуются их пероксиды: Na2O2, CaO, MgO2 идр.
Химические свойства:при взаимодействии концентрированного раствора
Н2О2 сгидроксидами металлов образуются их пероксиды: Na2O2, CaO, MgO2 идр.
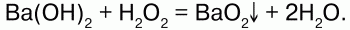 Пероксиды, или перекиси– это соли Н2О2, состоящие из положительно заряженных ионов металлов и отрицательно заряженных ионов О22-, электронное строение их аниона следующее:
Пероксиды, или перекиси– это соли Н2О2, состоящие из положительно заряженных ионов металлов и отрицательно заряженных ионов О22-, электронное строение их аниона следующее:
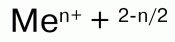 Н2О2 проявляет окислительно-восстановительные свойства: окисляет вещества стандартный электронный потенциал которых (Е°) не превышает 1,776 В; восстанавливает вещества у которых Е° больше 0,682 В. Окислительно-восстановительные свойства
Н2О2объясняются тем, что степень окисления -1 у атомов кислорода имеет промежуточное значение между степенями окисления -2 и 0. Более характерны для него окислительные свойства.
Н2О2 проявляет окислительно-восстановительные свойства: окисляет вещества стандартный электронный потенциал которых (Е°) не превышает 1,776 В; восстанавливает вещества у которых Е° больше 0,682 В. Окислительно-восстановительные свойства
Н2О2объясняются тем, что степень окисления -1 у атомов кислорода имеет промежуточное значение между степенями окисления -2 и 0. Более характерны для него окислительные свойства.
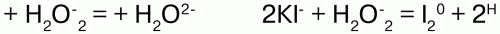 Н2О2 здесь выступает окислителем.
Н2О2 здесь выступает окислителем.
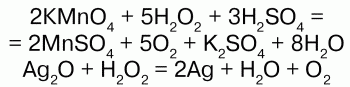 В этих случаях пероксид водорода является восстановителем.
В этих случаях пероксид водорода является восстановителем.
Соли H2O2 –пероксиды (перекиси) также обладают окислительно-восстановительными свойствами:
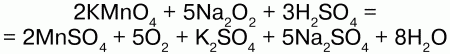 Здесь Na2O2 – восстановитель.
Здесь Na2O2 – восстановитель.
Получение:в промышленности H2O2 получают взаимодействием разбавленной серной кислотой с пероксидом бария ВаО2: H2SO4(разб.) + ВаО2= ВаSO4 + H2O2, а также путем перегонки пергидроля в вакууме получается концентрированный пероксид водорода. Пергидроль– 30 %-ный водный раствор H2O2. Окислительная способность и безвредность применения пероксида водорода дала возможность широкого использования его во многих отраслях народного хозяйства: в промышленности – для отбеливания тканей, мехов; в пищевой промышленности – для консервирования продуктов; в сельском хозяйстве – для протравливания семян, в производстве ряда органических соединений, например, в производстве глицерина: промежуточный продукт при получении глицерина – аллиловый спирт СН2 = СН – СН2ОН окисляют при помощи H2O в глицерин С3Н5(ОН)3, используется в ракетной технике как сильный окислитель. 3 %-ный H2O2 применяется в фармацевтике в медицинских целях как дезинфицирующее средство.
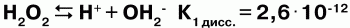
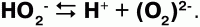
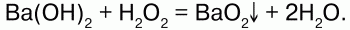
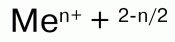
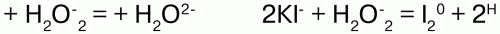
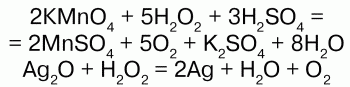
Соли H2O2 –пероксиды (перекиси) также обладают окислительно-восстановительными свойствами:
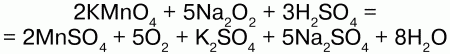
Получение:в промышленности H2O2 получают взаимодействием разбавленной серной кислотой с пероксидом бария ВаО2: H2SO4(разб.) + ВаО2= ВаSO4 + H2O2, а также путем перегонки пергидроля в вакууме получается концентрированный пероксид водорода. Пергидроль– 30 %-ный водный раствор H2O2. Окислительная способность и безвредность применения пероксида водорода дала возможность широкого использования его во многих отраслях народного хозяйства: в промышленности – для отбеливания тканей, мехов; в пищевой промышленности – для консервирования продуктов; в сельском хозяйстве – для протравливания семян, в производстве ряда органических соединений, например, в производстве глицерина: промежуточный продукт при получении глицерина – аллиловый спирт СН2 = СН – СН2ОН окисляют при помощи H2O в глицерин С3Н5(ОН)3, используется в ракетной технике как сильный окислитель. 3 %-ный H2O2 применяется в фармацевтике в медицинских целях как дезинфицирующее средство.
19. Общая характеристика подгруппы галогенов
Галогены– элементы VII группы – фтор, хлор, бром, йод, астат (астат мало изучен в связи с его радиоактивностью). Галогены – ярко выраженные неметаллы. Лишь йод в редких случаях обнаруживает некоторые свойства, схожие с металлами.
В невозбужденном состоянии атомы галогенов имеют общие электронную конфигурацию: ns2np5. Это значит, что галогены имеют 7 валентных электронов, кроме фтора.
 Физические свойства галогенов:F2 – бесцветный, трудно сжижающийся газ; Cl2 – желто-зеленый, легко сжижающийся газ с резким удушливым запахом; Br2 – жидкость красно-бурого цвета; I2 – кристаллическое вещество фиолетового цвета.
Физические свойства галогенов:F2 – бесцветный, трудно сжижающийся газ; Cl2 – желто-зеленый, легко сжижающийся газ с резким удушливым запахом; Br2 – жидкость красно-бурого цвета; I2 – кристаллическое вещество фиолетового цвета.
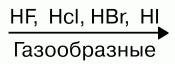 Водные растворы галогеноводородов образуют кислоты. НF – фтороводородная (плавиковая); НCl – хлороводородная (соляная); НBr – бромоводородная; НI – йодоводородная. Силы кислот сверху вниз снижаются. Плавиковая кислота является самой слабой в ряду галогеново-дородных кислот, а йодоводородная – самой сильной. Это объясняется тем, что энергия связи Нг сверху уменьшается. В том же направлении уменьшается и прочность молекулы Н Г, что связано с ростом межъядерного расстояния. Растворимость малорастворимых солей в воде тоже уменьшается:
Водные растворы галогеноводородов образуют кислоты. НF – фтороводородная (плавиковая); НCl – хлороводородная (соляная); НBr – бромоводородная; НI – йодоводородная. Силы кислот сверху вниз снижаются. Плавиковая кислота является самой слабой в ряду галогеново-дородных кислот, а йодоводородная – самой сильной. Это объясняется тем, что энергия связи Нг сверху уменьшается. В том же направлении уменьшается и прочность молекулы Н Г, что связано с ростом межъядерного расстояния. Растворимость малорастворимых солей в воде тоже уменьшается:
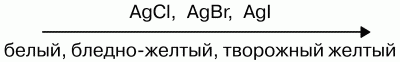 Слева направо растворимость галогенидов уменьшается. АgF хорошо растворим в воде.
Все галогены в свободном состоянии – окислители. Сила их как окислителей снижается от фтора к йоду. В кристаллическом, жидком и газообразном состоянии все галогены существуют в виде отдельных молекул. Атомные радиусы возрастают в том же направлении, что приводит к повышению температуры плавления и кипения. Фтор диссоциирует на атомы лучше йода. Электродные потенциалы при переходе вниз по подгруппе галогенов снижаются. У фтора самый высокий электродный потенциал.
Фтор – самый сильный окислитель. Любой вышестоящий свободный галоген вытеснит нижестоящий, находящийся в состоянии отрицательного однозарядного иона в растворе.
Слева направо растворимость галогенидов уменьшается. АgF хорошо растворим в воде.
Все галогены в свободном состоянии – окислители. Сила их как окислителей снижается от фтора к йоду. В кристаллическом, жидком и газообразном состоянии все галогены существуют в виде отдельных молекул. Атомные радиусы возрастают в том же направлении, что приводит к повышению температуры плавления и кипения. Фтор диссоциирует на атомы лучше йода. Электродные потенциалы при переходе вниз по подгруппе галогенов снижаются. У фтора самый высокий электродный потенциал.
Фтор – самый сильный окислитель. Любой вышестоящий свободный галоген вытеснит нижестоящий, находящийся в состоянии отрицательного однозарядного иона в растворе.
В невозбужденном состоянии атомы галогенов имеют общие электронную конфигурацию: ns2np5. Это значит, что галогены имеют 7 валентных электронов, кроме фтора.

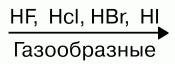
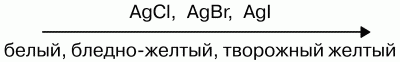
20. Хлор. Хлороводород и соляная кислота
Хлор (Cl) –стоит в 3-м периоде, в VII группе главной подгруппы периодической системы, порядковый номер 17, атомная масса 35,453; относится к галогенам.
Физические свойства:газ желто-зеленого цвета с резким запахом. Плотность 3,214 г/л; температура плавления -101 °C; температура кипения -33,97 °C, При обычной температуре легко сжижается под давлением 0,6 МПа. Растворяясь в воде, образует хлорную воду желтоватого цвета. Хорошо растворим в органических растворителях, особенно в гексане (C6H14), в четырех-хлористом углероде.
Химические свойства хлора:электронная конфигурация: 1s22s22p63s22p5. На внешнем уровне 7 электронов. До завершения уровня нужен 1 электрон, который хлор принимает, проявляя степень окисления -1. Существуют и положительные степени окисления хлора вплоть до + 7. Известны следующие оксиды хлора: Cl2O, ClO2, Cl2O6 и Cl2O7. Все они неустойчивы. Хлор – сильный окислитель. Он непосредственно реагирует с металлами и неметаллами:
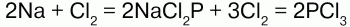 Реагирует с водородом. При обычных условиях реакция идет медленно, при сильном нагревании или освещении – со взрывом, по цепному механизму:
Реагирует с водородом. При обычных условиях реакция идет медленно, при сильном нагревании или освещении – со взрывом, по цепному механизму:
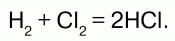 Хлор взаимодействует с растворами щелочей, образуя соли – гипохлориты и хлориды:
Хлор взаимодействует с растворами щелочей, образуя соли – гипохлориты и хлориды:
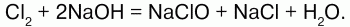 При пропускании хлора в раствор щелочи образуется смесь растворов хлорида и гипохлорита:
При пропускании хлора в раствор щелочи образуется смесь растворов хлорида и гипохлорита:
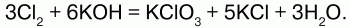 Хлор – восстановитель: Cl2 + 3F2 = 2ClF3.
Хлор – восстановитель: Cl2 + 3F2 = 2ClF3.
Взаимодействие с водой:
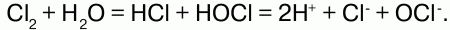 Хлор не взаимодействует непосредственно с углеродом, азотом и кислородом.
Хлор не взаимодействует непосредственно с углеродом, азотом и кислородом.
Получение:2NaCl + F2 = 2NaF + Cl2.
Электролиз:2NaCl + 2H2O = Cl2 + H2 + 2NaOH.
Нахождение в природе:содержится в составе минералов: галит (каменная соль), сильвин, бишофит; морская вода содержит хлориды натрия, калия, магния и других элементов.
Хлороводород HCl. Физические свойства:бесцветный газ, тяжелее воздуха, хорошо растворим в воде с образованием соляной кислоты.
Физические свойства:газ желто-зеленого цвета с резким запахом. Плотность 3,214 г/л; температура плавления -101 °C; температура кипения -33,97 °C, При обычной температуре легко сжижается под давлением 0,6 МПа. Растворяясь в воде, образует хлорную воду желтоватого цвета. Хорошо растворим в органических растворителях, особенно в гексане (C6H14), в четырех-хлористом углероде.
Химические свойства хлора:электронная конфигурация: 1s22s22p63s22p5. На внешнем уровне 7 электронов. До завершения уровня нужен 1 электрон, который хлор принимает, проявляя степень окисления -1. Существуют и положительные степени окисления хлора вплоть до + 7. Известны следующие оксиды хлора: Cl2O, ClO2, Cl2O6 и Cl2O7. Все они неустойчивы. Хлор – сильный окислитель. Он непосредственно реагирует с металлами и неметаллами:
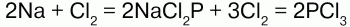
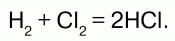
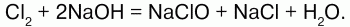
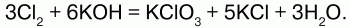
Взаимодействие с водой:
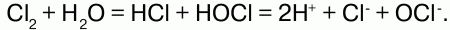
Получение:2NaCl + F2 = 2NaF + Cl2.
Электролиз:2NaCl + 2H2O = Cl2 + H2 + 2NaOH.
Нахождение в природе:содержится в составе минералов: галит (каменная соль), сильвин, бишофит; морская вода содержит хлориды натрия, калия, магния и других элементов.
Хлороводород HCl. Физические свойства:бесцветный газ, тяжелее воздуха, хорошо растворим в воде с образованием соляной кислоты.
