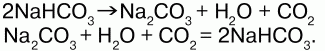Страница:
В 1904 годупоявился циамидный способ, основанный на способности азота при высокой температуре взаимодействовать с карбидом кальция, образуя циамид кальция
CaCN2,который при воздействии с водяным паром при давлении 0,6 МПа легко разлагается на аммиак и карбонат кальция:
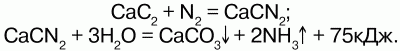 Позднее появился другой способ получения аммиака – прямое взаимодействие азота и кислорода под воздействием электрических разрядов, но эта реакция была обратимой, пока для нее не нашли оптимальные условия. Этими условиями явились высокое давление и низкая температура, использование катализаторов – губчатого железа с добавками активаторов (оксиды алюминия, калия, кальция, кремния, магния).
Позднее появился другой способ получения аммиака – прямое взаимодействие азота и кислорода под воздействием электрических разрядов, но эта реакция была обратимой, пока для нее не нашли оптимальные условия. Этими условиями явились высокое давление и низкая температура, использование катализаторов – губчатого железа с добавками активаторов (оксиды алюминия, калия, кальция, кремния, магния).
31. Соли аммония
32. Оксиды азота
33. Азотная кислота
34. Фосфор
35. Аллотропные модификации фосфора
36. Оксиды фосфора и фосфорные кислоты
37. Минеральные удобрения
38. Углерод и его свойства
39. Аллотропные модификации углерода
40. Оксиды углерода. угольная кислота
31. Соли аммония
Соли аммония– сложные вещества, включающие катионы аммония
NH4+и кислотные остатки.
Физические свойства:соли аммония – твердые кристаллические вещества, хорошо растворимые в воде.
Химические свойства:аммоний обладает свойствами металла, поэтому строение его солей подобно солям щелочных металлов, т. к. ионы NH4+и ионы щелочных металлов (калия) имеют примерно одинаковые радиусы. В свободном виде аммоний не существует, т. к. он химически нестоек и мгновенно разлагается на аммиак и водород. Доказательством металлического характера аммония является наличие амальгамы аммония – сплав аммония с ртутью, схожего с таковой щелочных металлов. При обработке амальгамы аммония холодным раствором сульфата меди, амальгама вытеснит n-е количество меди:
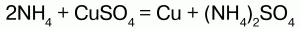 Соли аммония имеют ионную решетку и обладают
всеми свойствами типичных солей:
Соли аммония имеют ионную решетку и обладают
всеми свойствами типичных солей:
1) являются сильными электролитами – подвергаются диссоциации в водных растворах, образуя катион аммония и анион кислоты:
 2) подвергаются гидролизу (соль слабого основания и сильной кислоты):
2) подвергаются гидролизу (соль слабого основания и сильной кислоты):
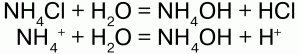 среда кислая, рН<7, лакмус красный;
среда кислая, рН<7, лакмус красный;
3) вступают в обменную реакцию с кислотами и солями:
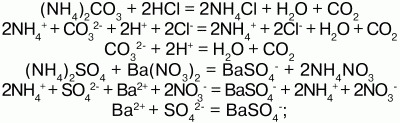 4) взаимодействуют с растворами щелочей с образованием аммиака – качественная реакция на ион аммония:
4) взаимодействуют с растворами щелочей с образованием аммиака – качественная реакция на ион аммония:
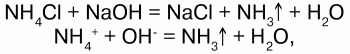 соли аммония определяют по запаху выделившегося в результате реакции аммиака, а также по синей окраске лакмуса;
соли аммония определяют по запаху выделившегося в результате реакции аммиака, а также по синей окраске лакмуса;
5) разлагаются при нагревании:
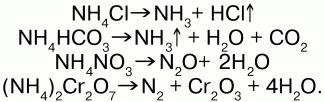 Получение:NH3 + HNO3 = NH4NO3 (нитрат аммония); 2NH4OH + H2SO4 = (NH4)2SO4 (cульфат аммония) + 2Н2O.
Получение:NH3 + HNO3 = NH4NO3 (нитрат аммония); 2NH4OH + H2SO4 = (NH4)2SO4 (cульфат аммония) + 2Н2O.
Применение:соли аммония широко применяются на практике: сульфат аммония – (NH4)2SO4, нитрат аммония – NH4NO3, дигидрофосфат аммония – NH4Н2РO4 и гидрофосфат аммония – (NH4)2НРO4 используются в качестве минерального удобрения. Преимущество удобрения – повышенное содержание в нем аммиака. Используется хлорид аммония (NH4Cl) – нашатырь.
Физические свойства:соли аммония – твердые кристаллические вещества, хорошо растворимые в воде.
Химические свойства:аммоний обладает свойствами металла, поэтому строение его солей подобно солям щелочных металлов, т. к. ионы NH4+и ионы щелочных металлов (калия) имеют примерно одинаковые радиусы. В свободном виде аммоний не существует, т. к. он химически нестоек и мгновенно разлагается на аммиак и водород. Доказательством металлического характера аммония является наличие амальгамы аммония – сплав аммония с ртутью, схожего с таковой щелочных металлов. При обработке амальгамы аммония холодным раствором сульфата меди, амальгама вытеснит n-е количество меди:
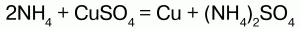
1) являются сильными электролитами – подвергаются диссоциации в водных растворах, образуя катион аммония и анион кислоты:

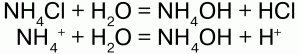
3) вступают в обменную реакцию с кислотами и солями:
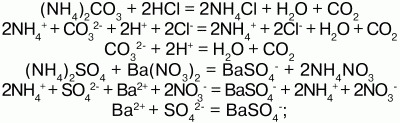
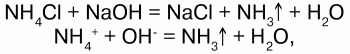
5) разлагаются при нагревании:
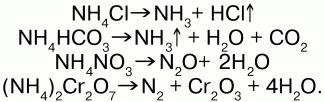
Применение:соли аммония широко применяются на практике: сульфат аммония – (NH4)2SO4, нитрат аммония – NH4NO3, дигидрофосфат аммония – NH4Н2РO4 и гидрофосфат аммония – (NH4)2НРO4 используются в качестве минерального удобрения. Преимущество удобрения – повышенное содержание в нем аммиака. Используется хлорид аммония (NH4Cl) – нашатырь.
32. Оксиды азота
С кислородом
Nобразует оксиды: N2O, NO, N2O3 NO2, N2O5 и NO3.
Оксид азота I – N2O –закись азота, «веселящий газ»
. Физические свойства:бесцветный, со сладковатым запахом, растворим в воде, t плавления -91 °C, t кипения -88,5 °C. Анестезирующее средство.
Химические свойства:разлагается при 700 °C: 2N2O?2N2 + O2 поддерживает горение и является окислителем; взаимодействует с водородом: N2+1O + H2?N20+ Н2O.
Получение:NH4NO3?N2O + 2Н2O. N2O соответствует азотноватистая кислота: Н2N2O2, но при действии Н2O и щелочей он не образует ни Н2N2O2, ни ее солей. N2O – несолеобразующий.
Оксид азота (II) NO –окись азота. Физические свойства:бесцветный газ, плохо растворим в воде, t плавления -164 °C, t кипения -152 °C.
Химические свойства: NO обладает окислительно-восстановительными свойствами:
1) при обычной температуре устойчив, при понижении t димеризуется в N2O2;
2) при 700 °C разлагается: 2NO?2N2 + O2? поддерживая горение, является восстановителем;
3) с водородом. Смесь равных объемов NO и H2 взрывается: 2NO + 2H2 = N2? + Н2O, где NO – окислитель;
4) с галогенами: 2NO + Сl2 = 2NOСl? (нитрозилхлорид). NO – несолеобразующий.
Получение:
1) в лаборатории: 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O;
2) в промышленности: каталитическое окисление аммиака: 4NH3 +5O2 = 4NO? + 6H2O;
3) NO образуется в грозу: N2 + O2 = 2NO?.
Оксид азота (III) N203. Физические свойства:темно-синяя жидкость (при низких t), t плавления -102 °C, t кипения 3,5 °C. Химические свойства:N2O3 – ангидрид азотистой кислоты HN02. При взаимодействии с водой и щелочами соответственно дает НNO2 и ее соли – нитриты: N2O + 2NaOH = 2NaNO2 + H2O.
Получение:NO2 + NO = N2O3.
Оксид азота (IV)– NO2. Физические свойства:ядовитый газ бурого цвета с резким запахом; t плавления —11,2 °C, t кипения – 21 °C. Химические свойства:кислотный ангидрид:
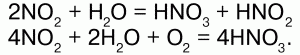 Реагирует со щелочами: 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O.
Реагирует со щелочами: 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O.
Окислитель: N+4O2 + S+4O2 = S+6O3 + N+2O. Димеризуется при низких температурах: 2NO2(бурый газ)?N2O4(бесцветная жидкость).
Получение:2NO + O2 = 2NO2; Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O. Оксид азота (V) – N2O5. Физические свойства:малостойкое белое кристаллическое вещество. Сильный окислитель. Химические свойства:ангидрид HN03.
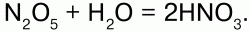 Разлагается со взрывом: 2N2O5?4NO2 + О2.
Разлагается со взрывом: 2N2O5?4NO2 + О2.
Получение:
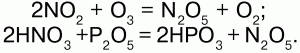
Химические свойства:разлагается при 700 °C: 2N2O?2N2 + O2 поддерживает горение и является окислителем; взаимодействует с водородом: N2+1O + H2?N20+ Н2O.
Получение:NH4NO3?N2O + 2Н2O. N2O соответствует азотноватистая кислота: Н2N2O2, но при действии Н2O и щелочей он не образует ни Н2N2O2, ни ее солей. N2O – несолеобразующий.
Оксид азота (II) NO –окись азота. Физические свойства:бесцветный газ, плохо растворим в воде, t плавления -164 °C, t кипения -152 °C.
Химические свойства: NO обладает окислительно-восстановительными свойствами:
1) при обычной температуре устойчив, при понижении t димеризуется в N2O2;
2) при 700 °C разлагается: 2NO?2N2 + O2? поддерживая горение, является восстановителем;
3) с водородом. Смесь равных объемов NO и H2 взрывается: 2NO + 2H2 = N2? + Н2O, где NO – окислитель;
4) с галогенами: 2NO + Сl2 = 2NOСl? (нитрозилхлорид). NO – несолеобразующий.
Получение:
1) в лаборатории: 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O;
2) в промышленности: каталитическое окисление аммиака: 4NH3 +5O2 = 4NO? + 6H2O;
3) NO образуется в грозу: N2 + O2 = 2NO?.
Оксид азота (III) N203. Физические свойства:темно-синяя жидкость (при низких t), t плавления -102 °C, t кипения 3,5 °C. Химические свойства:N2O3 – ангидрид азотистой кислоты HN02. При взаимодействии с водой и щелочами соответственно дает НNO2 и ее соли – нитриты: N2O + 2NaOH = 2NaNO2 + H2O.
Получение:NO2 + NO = N2O3.
Оксид азота (IV)– NO2. Физические свойства:ядовитый газ бурого цвета с резким запахом; t плавления —11,2 °C, t кипения – 21 °C. Химические свойства:кислотный ангидрид:
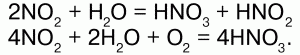
Окислитель: N+4O2 + S+4O2 = S+6O3 + N+2O. Димеризуется при низких температурах: 2NO2(бурый газ)?N2O4(бесцветная жидкость).
Получение:2NO + O2 = 2NO2; Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O. Оксид азота (V) – N2O5. Физические свойства:малостойкое белое кристаллическое вещество. Сильный окислитель. Химические свойства:ангидрид HN03.
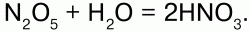
Получение:
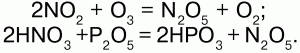
33. Азотная кислота
Азотная кислота– бесцветная, «дымящаяся» на воздухе жидкость с едким запахом. Химическая формула HNO3.
Физические свойства.При температуре 42 °C застывает в виде белых кристаллов. Безводная азотная кислота закипает при атмосферном давлении и 86 °C. С водой смешивается в произвольных соотношениях.
Под воздействием света концентрированная HNO3 разлагается на оксиды азота:
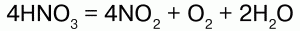 HNO3 хранят в прохладном и темном месте. Валентность азота в ней – 4, степень окисления – +5, координационное число – 3.
HNO3 хранят в прохладном и темном месте. Валентность азота в ней – 4, степень окисления – +5, координационное число – 3.
HNO3 – сильная кислота. В растворах полностью распадается на ионы. Взаимодействует с основными оксидами и основаниями, с солями более слабых кислот. HNO3 обладает сильной окислительной способностью. Способна восстанавливаться с одновременным образованием нитрата до соединений, в зависимости от концентрации, активности взаимодействующего металла и условий:
1) концентрированная HN03, взаимодействуя с малоактивными металлами, восстанавливается до оксида азота (IV) NO2:
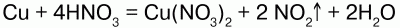 2) если кислота разбавленная, то она восстанавливается до оксида азота (II) NO:
2) если кислота разбавленная, то она восстанавливается до оксида азота (II) NO:
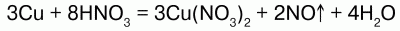 3) более активные металлы восстанавливают разбавленную кислоту до оксида азота (I) N2O:
3) более активные металлы восстанавливают разбавленную кислоту до оксида азота (I) N2O:
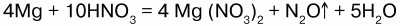 До солей аммония восстанавливается очень разбавленная кислота:
До солей аммония восстанавливается очень разбавленная кислота:
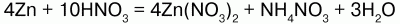 Au, Pt, Rh, Ir, Ta, Ti не реагируют с концентрированной HNO3, а Al, Fe, Co и Cr – «пассивируются».
Au, Pt, Rh, Ir, Ta, Ti не реагируют с концентрированной HNO3, а Al, Fe, Co и Cr – «пассивируются».
4) с неметаллами HNO3 реагирует, восстанавливая их до соответствующих кислот, а сама восстанавливается до оксидов:
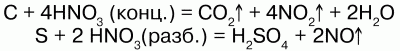 5) HNO3 окисляет некоторые катионы и анионы и неорганические ковалентные соединения.
5) HNO3 окисляет некоторые катионы и анионы и неорганические ковалентные соединения.
6) вступает во взаимодействие со многими органическими соединениями – реакция нитрования.
Промышленное получение азотной кислоты:4NH3 + 5O2 = 4NO + 6H2O.
Аммиак– NO переходит в NO2, который с водой в присутствии кислорода воздуха дает азотную кислоту.
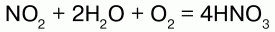 Катализатор – платиновые сплавы. Получаемая HNO3 не более 60 %. При необходимости ее концентрируют. Промышленностью выпускается разбавленная HNO3 (47–45 %), а концентрированная HNO3 (98–97 %). Концентрированную кислоту перевозят в алюминиевых цистернах, разбавленную – в цистернах из кислотоупорной стали.
Катализатор – платиновые сплавы. Получаемая HNO3 не более 60 %. При необходимости ее концентрируют. Промышленностью выпускается разбавленная HNO3 (47–45 %), а концентрированная HNO3 (98–97 %). Концентрированную кислоту перевозят в алюминиевых цистернах, разбавленную – в цистернах из кислотоупорной стали.
Физические свойства.При температуре 42 °C застывает в виде белых кристаллов. Безводная азотная кислота закипает при атмосферном давлении и 86 °C. С водой смешивается в произвольных соотношениях.
Под воздействием света концентрированная HNO3 разлагается на оксиды азота:
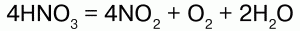
HNO3 – сильная кислота. В растворах полностью распадается на ионы. Взаимодействует с основными оксидами и основаниями, с солями более слабых кислот. HNO3 обладает сильной окислительной способностью. Способна восстанавливаться с одновременным образованием нитрата до соединений, в зависимости от концентрации, активности взаимодействующего металла и условий:
1) концентрированная HN03, взаимодействуя с малоактивными металлами, восстанавливается до оксида азота (IV) NO2:
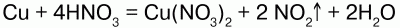
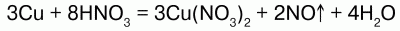
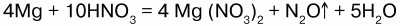
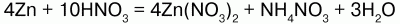
4) с неметаллами HNO3 реагирует, восстанавливая их до соответствующих кислот, а сама восстанавливается до оксидов:
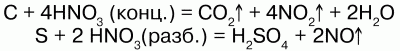
6) вступает во взаимодействие со многими органическими соединениями – реакция нитрования.
Промышленное получение азотной кислоты:4NH3 + 5O2 = 4NO + 6H2O.
Аммиак– NO переходит в NO2, который с водой в присутствии кислорода воздуха дает азотную кислоту.
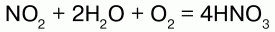
34. Фосфор
Фосфор(
Р)находится в 3-м периоде, в V группе, главной подгруппы периодической системы Д.И. Менделеева. Порядковый номер 15, заряд ядра +15, Аr = 30,9738 а.е. м... имеет 3 энергетических уровня, на энергетической оболочке 15 электронов, из них 5 валентных. У фосфора появляется d-подуровень. Электронная конфигурация Р: 1
s22
s22p63
s23p33d0. Характерна sp3-гибридизация, реже sp3d1. Валентность фосфора – III, V. Наиболее характерная степень окисления +5 и -3, менее характерные: +4, +1, -2, -3. Фосфор может проявлять и окислительные и восстановительные свойства: принимать и отдавать электроны.
Строение молекулы:способность образования ?-связи менее выражена, чем у азота – при обычной температуре в газовой фазе фосфор представлен в виде молекул Р4, имеющих форму равносторонних пирамид с углами по 60°. Связи между атомами ковалентные, неполярные. Каждый атом Р в молекуле связан стремя другими атомами ?-связями.
Физические свойства: фосфор образует три аллотропных модификации: белый, красный и черный. Каждая модификация имеет свою температуру плавления и замерзания.
Химические свойства:
1) при нагревании Р4 обратимо диссоциирует:
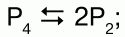 2) свыше 2000 °C Р2 распадается на атомы:
2) свыше 2000 °C Р2 распадается на атомы:
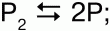 3) фосфор образует соединения с неметаллами:
3) фосфор образует соединения с неметаллами:
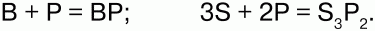 Непосредственно соединяется со всеми галогенами: 2Р + 5Cl2 = 2РCl5.
Непосредственно соединяется со всеми галогенами: 2Р + 5Cl2 = 2РCl5.
При взаимодействии с металлами фосфор образует фосфиды:
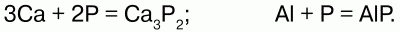 Соединяясь с водородом, образует газ фос-фин: Р4 + 6Н2 = 4РН3?.
Соединяясь с водородом, образует газ фос-фин: Р4 + 6Н2 = 4РН3?.
При взаимодействии с кислородом образует ангидрид Р2О5: Р4 + 5О2 = 2Р2О5.
Получение:фосфор получают прокаливанием смеси Са3(РO4 )2с песком и коксом в электропечи при температуре 1500 °C без доступа воздуха: 2Са3(РO4)2 + 1 °C + 6SiO2 = 6СаSiO3 + 1 °CO + P4?.
В природе фосфор в чистом виде не встречается, а образуется в результате химической активности. Основными природными соединениями фосфора являются минералы: Са3(РO4)2 – фосфорит; Са3(РO4)2?СаF2 (или СаCl) или Са3(РO4)2?Са(ОН)2 – апатит. Велико биологическое значение фосфора. Фосфор входит в состав некоторых растительных и животных белков: белок молока, крови, мозговой и нервной ткани. Большое его количество содержится в костях позвоночных животных в виде соединений: 3Са3(РO4)2?Са(ОН)2 и 3Са3(РO4)2?СаСО3?Н2О. Фосфор является обязательным компонентом нуклеиновых кислот, играя роль в передачи наследственной информации. Фосфор содержится в зубной эмали, в тканях в форме лецитина – соединения жиров с фосфорноглицериновыми эфирами.
Строение молекулы:способность образования ?-связи менее выражена, чем у азота – при обычной температуре в газовой фазе фосфор представлен в виде молекул Р4, имеющих форму равносторонних пирамид с углами по 60°. Связи между атомами ковалентные, неполярные. Каждый атом Р в молекуле связан стремя другими атомами ?-связями.
Физические свойства: фосфор образует три аллотропных модификации: белый, красный и черный. Каждая модификация имеет свою температуру плавления и замерзания.
Химические свойства:
1) при нагревании Р4 обратимо диссоциирует:
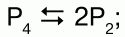
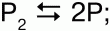
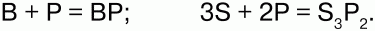
При взаимодействии с металлами фосфор образует фосфиды:
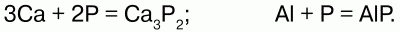
При взаимодействии с кислородом образует ангидрид Р2О5: Р4 + 5О2 = 2Р2О5.
Получение:фосфор получают прокаливанием смеси Са3(РO4 )2с песком и коксом в электропечи при температуре 1500 °C без доступа воздуха: 2Са3(РO4)2 + 1 °C + 6SiO2 = 6СаSiO3 + 1 °CO + P4?.
В природе фосфор в чистом виде не встречается, а образуется в результате химической активности. Основными природными соединениями фосфора являются минералы: Са3(РO4)2 – фосфорит; Са3(РO4)2?СаF2 (или СаCl) или Са3(РO4)2?Са(ОН)2 – апатит. Велико биологическое значение фосфора. Фосфор входит в состав некоторых растительных и животных белков: белок молока, крови, мозговой и нервной ткани. Большое его количество содержится в костях позвоночных животных в виде соединений: 3Са3(РO4)2?Са(ОН)2 и 3Са3(РO4)2?СаСО3?Н2О. Фосфор является обязательным компонентом нуклеиновых кислот, играя роль в передачи наследственной информации. Фосфор содержится в зубной эмали, в тканях в форме лецитина – соединения жиров с фосфорноглицериновыми эфирами.
35. Аллотропные модификации фосфора
Фосфор образует несколько аллотропных видоизменений – модификаций. Явление аллотропных модификаций у фосфора вызвано образованием различных кристаллических форм.
Белый фосфор (Р4)имеет молекулярную кристаллическую решетку, красный и черный – атомную. Различие в строении кристаллической решетки обуславливает и различие в их физических и химических свойствах.
Белый фосфор –сильный яд, даже в малых дозах действует смертельно. В твердом состоянии получается при быстром охлаждении паров фосфора. В чистом виде совершенно бесцветен, прозрачен, по внешнему виду похож на воск: на холоде хрупок, при температуре выше 15 °C – мягкий, легко режется ножом; в воде нерастворим, но хорошо растворяется в сероуглероде – СS2 и в органических растворителях; легко плавится, летуч. Прочность связи в молекуле невелика, чем обусловлена высокая химическая активность. Белый фосфор быстро окисляется на воздухе, при этом светится в темноте – превращение химической энергии в световую; самовоспламеняется на воздухе, при слабом нагревании, незначительном трении. С кислородом реагирует без поджигания, даже под водой, образуя сначала
Р2О3, затем
P2O5:
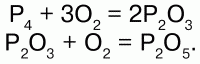 При длительном нагревании белый фосфор превращается в красный. Белый фосфор применяется для изготовления боеприпасов артиллерийских снарядов, авиабомб, предназначенных для образования дымовых завес. Широкого применения не имеет.
При длительном нагревании белый фосфор превращается в красный. Белый фосфор применяется для изготовления боеприпасов артиллерийских снарядов, авиабомб, предназначенных для образования дымовых завес. Широкого применения не имеет.
Красный фосфор –порошок красно-бурого цвета, неядовит, нелетуч, нерастворим в воде и во многих органических растворителях и сероуглероде; не воспламеняется на воздухе и не светится в темноте. Только при нагревании до 260 °C воспламеняется. При сильном нагревании, без доступа воздуха, не плавясь (минуя жидкое состояние) испаряется – сублимируется. При охлаждении превращается в белый фосфор. Идет на изготовление спичек: красный фосфор в смеси с сульфидом сурьмы, железным суриком, с примесью кварца и клея наносят на поверхность спичечной коробки. Головка спичек состоит в основном из бертолетовой соли, молотого стекла, серы и клея. При трении головки о намазку коробки красный фосфор воспламеняется, поджигает состав головки, а от него загорается дерево. Также красный фосфор применяется в приготовлении фармацевтических препаратов.
Черный фосфорполучается при сильном нагревании и при высоком давлении белого фосфора. Черный фосфор тяжелее других модификаций. Применяется очень редко – как полупроводник в составе фосфата галлия и индия в металлургии.
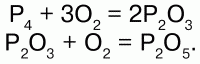
Красный фосфор –порошок красно-бурого цвета, неядовит, нелетуч, нерастворим в воде и во многих органических растворителях и сероуглероде; не воспламеняется на воздухе и не светится в темноте. Только при нагревании до 260 °C воспламеняется. При сильном нагревании, без доступа воздуха, не плавясь (минуя жидкое состояние) испаряется – сублимируется. При охлаждении превращается в белый фосфор. Идет на изготовление спичек: красный фосфор в смеси с сульфидом сурьмы, железным суриком, с примесью кварца и клея наносят на поверхность спичечной коробки. Головка спичек состоит в основном из бертолетовой соли, молотого стекла, серы и клея. При трении головки о намазку коробки красный фосфор воспламеняется, поджигает состав головки, а от него загорается дерево. Также красный фосфор применяется в приготовлении фармацевтических препаратов.
Черный фосфорполучается при сильном нагревании и при высоком давлении белого фосфора. Черный фосфор тяжелее других модификаций. Применяется очень редко – как полупроводник в составе фосфата галлия и индия в металлургии.
36. Оксиды фосфора и фосфорные кислоты
Элемент фосфор образует ряд оксидов, наиболее важными из них являются оксид фосфора (III)
P2O3и оксид фосфора (V)
P2O5.
Оксид фосфора (III), или фосфористый ангидрид (P2O3)получают при медленном окислении фосфора, сжигая его в недостатке кислорода. Представляет собой воскообразную кристаллическую белую массу с температурой плавления 22,5 °C. Ядовит.
Химические свойства:
1) вступает в реакцию с холодной водой, образуя при этом фосфористую кислоту H3PO3;
2) взаимодействуя с щелочами, образует соли – фосфиты;
3) является сильным восстановителем.
Взаимодействуя с кислородом, окисляется до оксида фосфора (V) P2O5.
Оксид фосфора (V), или фосфорный ангидрид (P2O5)получают при горении фосфора на воздухе или в кислороде. Представляет собой белый кристаллический порошок, с температурой плавления 36 °C.
Химические свойства:
1) взаимодействуя с водой, образует орто-фосфорную кислоту H3PO4;
2) имея свойства кислотного оксида, вступает в реакции с основными оксидами и гидроксидами;
3) способен к поглощению паров воды.
Фосфорные кислоты.
Фосфорному ангидриду соответствует несколько кислот. Главная из них – ортофосфорная кислота H3PO4. Фосфорная кислота обезвоженная представлена в виде бесцветных прозрачных кристаллов, имеющих температуру плавления 42,35 °C и хорошо растворяющихся в воде.
Образует три вида солей:
1) средние соли – ортофосфаты;
2) кислые соли с одним атомом водорода;
3) кислые соли с двумя атомами водорода.
Получение фосфорной кислоты:
1) в лаборатории: 3P + 5HNO3 + 2H2O = 3H3PO4 +5NO?;
2) в промышленности: а) термический метод; б) экстракционный метод: Ca3(PO4)2 + 3H2SO4 = CaSO4? + 2 H3PO4.
Природные фосфаты восстанавливают до свободного фосфора, который сжигают на воздухе, либо в кислороде. Продукт реакции растворяют в воде.
Остальные фосфорные кислоты в зависимости от способа соединения групп PO4 образуют 2 вида кислот:полифосфорные кислоты, которые состоят из цепочек – PO3—О—PO3—... и метафосфорные кислоты, которые состоят из колец, образованных PO4.
Применение:ортофосфорную кислоту используют при производстве удобрений, химических реактивов, органических соединений, для приготовления защитных покрытий на металлах. Фосфаты используют в производстве эмалей и фармацевтике. Метафосфаты входят в состав моющих средств.
Оксид фосфора (III), или фосфористый ангидрид (P2O3)получают при медленном окислении фосфора, сжигая его в недостатке кислорода. Представляет собой воскообразную кристаллическую белую массу с температурой плавления 22,5 °C. Ядовит.
Химические свойства:
1) вступает в реакцию с холодной водой, образуя при этом фосфористую кислоту H3PO3;
2) взаимодействуя с щелочами, образует соли – фосфиты;
3) является сильным восстановителем.
Взаимодействуя с кислородом, окисляется до оксида фосфора (V) P2O5.
Оксид фосфора (V), или фосфорный ангидрид (P2O5)получают при горении фосфора на воздухе или в кислороде. Представляет собой белый кристаллический порошок, с температурой плавления 36 °C.
Химические свойства:
1) взаимодействуя с водой, образует орто-фосфорную кислоту H3PO4;
2) имея свойства кислотного оксида, вступает в реакции с основными оксидами и гидроксидами;
3) способен к поглощению паров воды.
Фосфорные кислоты.
Фосфорному ангидриду соответствует несколько кислот. Главная из них – ортофосфорная кислота H3PO4. Фосфорная кислота обезвоженная представлена в виде бесцветных прозрачных кристаллов, имеющих температуру плавления 42,35 °C и хорошо растворяющихся в воде.
Образует три вида солей:
1) средние соли – ортофосфаты;
2) кислые соли с одним атомом водорода;
3) кислые соли с двумя атомами водорода.
Получение фосфорной кислоты:
1) в лаборатории: 3P + 5HNO3 + 2H2O = 3H3PO4 +5NO?;
2) в промышленности: а) термический метод; б) экстракционный метод: Ca3(PO4)2 + 3H2SO4 = CaSO4? + 2 H3PO4.
Природные фосфаты восстанавливают до свободного фосфора, который сжигают на воздухе, либо в кислороде. Продукт реакции растворяют в воде.
Остальные фосфорные кислоты в зависимости от способа соединения групп PO4 образуют 2 вида кислот:полифосфорные кислоты, которые состоят из цепочек – PO3—О—PO3—... и метафосфорные кислоты, которые состоят из колец, образованных PO4.
Применение:ортофосфорную кислоту используют при производстве удобрений, химических реактивов, органических соединений, для приготовления защитных покрытий на металлах. Фосфаты используют в производстве эмалей и фармацевтике. Метафосфаты входят в состав моющих средств.
37. Минеральные удобрения
Минеральные удобрения– неорганические вещества, в основном соли, включающие в себя необходимые для растений элементы питания и используемые для повышения плодородия почвы. Бывают простые (азотные, фосфорные, калийные, микроудобрения) и комплексные.
Простые (односторонние) удобрениясодержат один главный питательный элемент – азотные удобрения (аммиачная селитра), фосфорные удобрения (простой и двойной суперфосфаты), калийные удобрения (КСl) и др.
Комплексные (многосторонние) удобрениясодержат два или три главных питательных элемента и по их числу называются двойными (азотно-фосфорные, фосфорно-калийные и др.) либо тройными или полными (например, азотно-фосфорно-калийные).
Сложныминазываются комплексные удобрения, полученные в результате взаимодействия исходных неорганических солей, кристаллизацией или сплавлением основных компонентов, смешением простых и сложных удобрений.
В зависимости от агрегатного состояния минеральные удобрения бывают:
1) жидкие;
2) твердые;
3) порошковидные (размер частиц < 1 мм);
4) кристаллические (> 0,5 мм);
5) гранулированные (1–4 мм).
По концентрации действующих веществ минеральные удобрения подразделяются на:
1) низкоконцентрированные (до 25 %);
2) концентрированные (до 60 %);
3) высококонцентрированные (более 60 %).
Производство минеральных удобрений – важная отрасль химической промышленности. Наиболее важными минеральными удобрениями считаются фосфорные (суперфосфат, двойной суперфосфат, преципитат).
Суперфосфатполучают из размолотого фосфорита, смешивая его с серной кислотой, и непрерывно перемешивают:
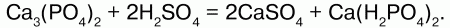 Суперфосфат легкорастворим в воде.
Суперфосфат легкорастворим в воде.
Двойной суперфосфат получают в результате разложения природного фосфата под воздействием фосфорной кислоты:
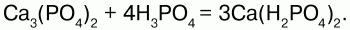 В этом удобрении отсутствует сульфат кальция, упрощая внесение удобрения в почву.
В этом удобрении отсутствует сульфат кальция, упрощая внесение удобрения в почву.
Преципитат– фосфорное удобрение, компонентом которого является гидрофосфат кальция.
Указанные выше минеральные удобрения являются простыми. Сложные минеральные удобрения более перспективны.
Аммофосполучается в результате взаимодействия фосфорной кислоты и аммиака – NH4H2PO4 или (NH4)2H2PO4.
Нитрофоскаполучается при сплавлении гидрофосфата аммония, нитрата аммония и хлорида (сульфата) натрия.
Простые (односторонние) удобрениясодержат один главный питательный элемент – азотные удобрения (аммиачная селитра), фосфорные удобрения (простой и двойной суперфосфаты), калийные удобрения (КСl) и др.
Комплексные (многосторонние) удобрениясодержат два или три главных питательных элемента и по их числу называются двойными (азотно-фосфорные, фосфорно-калийные и др.) либо тройными или полными (например, азотно-фосфорно-калийные).
Сложныминазываются комплексные удобрения, полученные в результате взаимодействия исходных неорганических солей, кристаллизацией или сплавлением основных компонентов, смешением простых и сложных удобрений.
В зависимости от агрегатного состояния минеральные удобрения бывают:
1) жидкие;
2) твердые;
3) порошковидные (размер частиц < 1 мм);
4) кристаллические (> 0,5 мм);
5) гранулированные (1–4 мм).
По концентрации действующих веществ минеральные удобрения подразделяются на:
1) низкоконцентрированные (до 25 %);
2) концентрированные (до 60 %);
3) высококонцентрированные (более 60 %).
Производство минеральных удобрений – важная отрасль химической промышленности. Наиболее важными минеральными удобрениями считаются фосфорные (суперфосфат, двойной суперфосфат, преципитат).
Суперфосфатполучают из размолотого фосфорита, смешивая его с серной кислотой, и непрерывно перемешивают:
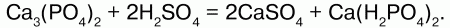
Двойной суперфосфат получают в результате разложения природного фосфата под воздействием фосфорной кислоты:
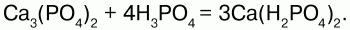
Преципитат– фосфорное удобрение, компонентом которого является гидрофосфат кальция.
Указанные выше минеральные удобрения являются простыми. Сложные минеральные удобрения более перспективны.
Аммофосполучается в результате взаимодействия фосфорной кислоты и аммиака – NH4H2PO4 или (NH4)2H2PO4.
Нитрофоскаполучается при сплавлении гидрофосфата аммония, нитрата аммония и хлорида (сульфата) натрия.
38. Углерод и его свойства
Углерод (С)– типичный неметалл; в периодической системе находится в 2-м периоде IV группе, главной подгруппе. Порядковый номер 6, Ar = 12,011 а.е.м., заряд ядра +6.
Физические свойства:углерод образует множество аллотропных модификаций:
алмаз– одно из самых твердых веществ,
графит, уголь, сажа.
Химические свойства:электронная конфигурация: 1s2 2s2 2p2.На электронной оболочке атома – 6 электронов; на внешнем валентном уровне – 4 электрона. Наиболее характерные степени окисления: +4, +2 – в неорганических соединениях, – 4, -2 – в органических. Углерод в любом гибридном состоянии способен использовать все свои валентные электроны и орбитали. У 4-валентного углерода нет неподеленных электронных пар и нет свободных орбиталей – углерод химически относительно устойчив. Характерно несколько типов гибридизации: sp, s p2, sp3. При низких температурах углерод инертен, но при нагревании его активность возрастает. Углерод – хороший восстановитель, но соединяясь с металлами и образуя карбиды, он выступает окислителем:
 Углерод (кокс) вступает в реакции с оксидами металлов:
Углерод (кокс) вступает в реакции с оксидами металлов:
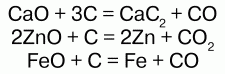
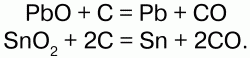 Таким образом выплавляют металл из руды. При очень высоких температурах углерод реагирует со многими неметаллами. Огромное количество органических соединений он образует с водородом – углеводороды. В присутствии никеля (Ni) углерод, реагируя с водородом, образует предельный углеводород – метан: С + Н2 = СН4.
Таким образом выплавляют металл из руды. При очень высоких температурах углерод реагирует со многими неметаллами. Огромное количество органических соединений он образует с водородом – углеводороды. В присутствии никеля (Ni) углерод, реагируя с водородом, образует предельный углеводород – метан: С + Н2 = СН4.
При взаимодействии с серой образует сероуглерод: С + 2S2 = СS2.
При температуре электрической дуги углерод соединяется с азотом, образуя ядовитый газ дициан: 2С + N2 = С2N2?.
В соединении с водородом дициан образует синильную кислоту – НСN. С галогенами углерод реагирует в зависимости от их химической активности, образуя галогениды. На холоде реагирует со фтором: С + 2F2 = СF2.
При 2000 °C в электропечи углерод соединяется с кремнием, образуя карборунд: Si + C = SiC.
Нахождение в природе:свободный углерод встречается в виде алмаза и графита. В виде соединений углерод находится в составе минералов: мела, мрамора, известняка – СаСО3, доломита – MgCO3?CaCO3; гидрокарбонатов – Mg(НCO3)2 и Са(НCO3)2, СО2 входит в состав воздуха; углерод является главной составной частью природных органических соединений – газа, нефти, каменного угля, торфа, входит в состав органических веществ, белков, жиров, углеводов, аминокислот, входящих в состав живых организмов.
Химические свойства:электронная конфигурация: 1s2 2s2 2p2.На электронной оболочке атома – 6 электронов; на внешнем валентном уровне – 4 электрона. Наиболее характерные степени окисления: +4, +2 – в неорганических соединениях, – 4, -2 – в органических. Углерод в любом гибридном состоянии способен использовать все свои валентные электроны и орбитали. У 4-валентного углерода нет неподеленных электронных пар и нет свободных орбиталей – углерод химически относительно устойчив. Характерно несколько типов гибридизации: sp, s p2, sp3. При низких температурах углерод инертен, но при нагревании его активность возрастает. Углерод – хороший восстановитель, но соединяясь с металлами и образуя карбиды, он выступает окислителем:

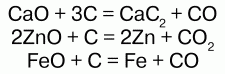
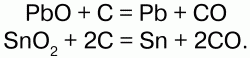
При взаимодействии с серой образует сероуглерод: С + 2S2 = СS2.
При температуре электрической дуги углерод соединяется с азотом, образуя ядовитый газ дициан: 2С + N2 = С2N2?.
В соединении с водородом дициан образует синильную кислоту – НСN. С галогенами углерод реагирует в зависимости от их химической активности, образуя галогениды. На холоде реагирует со фтором: С + 2F2 = СF2.
При 2000 °C в электропечи углерод соединяется с кремнием, образуя карборунд: Si + C = SiC.
Нахождение в природе:свободный углерод встречается в виде алмаза и графита. В виде соединений углерод находится в составе минералов: мела, мрамора, известняка – СаСО3, доломита – MgCO3?CaCO3; гидрокарбонатов – Mg(НCO3)2 и Са(НCO3)2, СО2 входит в состав воздуха; углерод является главной составной частью природных органических соединений – газа, нефти, каменного угля, торфа, входит в состав органических веществ, белков, жиров, углеводов, аминокислот, входящих в состав живых организмов.
39. Аллотропные модификации углерода
Углерод образует 5 аллотропных модификаций:
кубический алмаз, гексагональный алмаз, графит и две формы карбина. Гексагональный алмаз найден в метеоритах (минерал
лонсдейлит) и получен искусственно при очень высоком давлении и длительном нагревании.
Алмаз– самый твердый из всех природных веществ – используют для резки стекла и для бурения горных пород. Алмаз – прозрачное, бесцветное, кристаллическое вещество, обладающее высокой светопреломляемостью. Алмазы образуют отдельные кристаллы, образующие кубическую гранецентрированную решетку – одна половина атомов в кристалле расположена в вершинах и центрах граней одного куба, а другая – в вершинах и центрах граней другого куба, смещенного относительно первого в направлении его пространственной диагонали. sp3-гибридизация. Атомы образует трехмерную тетраэдрическую сетку, где они связаны ковалентными связями.
Из простых веществ алмаз имеет максимальное число атомов, расположенных плотно друг к другу, отчего он прочный и твердый. Прочность связей в углеродных тетраэдрах (?-связи) обуславливает высокую химическую устойчивость алмаза. На него действует лишьF2 иO2 при 800 °C.
При сильном нагревании без доступа воздуха алмаз переходит в графит. Графит– кристаллы темно-серого цвета, со слабым металлическим блеском, маслянистый на ощупь. sp3-гибридизация. Каждый атом образует по 3 ковалентных ?-связи с соседними атомами под углом 120° – образуется плоская сетка, состоящая из правильных шестиугольников, в вершинах которых находятся атомы С. Образовавшиеся слои С идут параллельно друг другу. Связи между ними слабые, их обеспечивают электроны, не участвующие в гибридизации орбиталей. Последние образуют ?-связи. Связь атомов С в разных слоях носит частично металлический характер – обобществление электронов всеми атомами.
Графит обладает относительно высокой электро– и теплопроводностью, стоек к нагреванию. Из графита изготавливают карандаши.
Карбинполучен синтетически ? и ?-формы ( поликумулен) каталитическим окислением ацетилена. Это твердые, черные вещества со стеклянным блеском. При нагревании без доступа воздуха переходят в графит.
Уголь– аморфный углерод – неупорядоченная структура графита – получается при нагревании углеродосодержащих соединений.
В природе имеется большие залежи угля.
Уголь имеет несколько сортов:
1) кокс;
2) костяной уголь;
3) сажа.
Алмаз– самый твердый из всех природных веществ – используют для резки стекла и для бурения горных пород. Алмаз – прозрачное, бесцветное, кристаллическое вещество, обладающее высокой светопреломляемостью. Алмазы образуют отдельные кристаллы, образующие кубическую гранецентрированную решетку – одна половина атомов в кристалле расположена в вершинах и центрах граней одного куба, а другая – в вершинах и центрах граней другого куба, смещенного относительно первого в направлении его пространственной диагонали. sp3-гибридизация. Атомы образует трехмерную тетраэдрическую сетку, где они связаны ковалентными связями.
Из простых веществ алмаз имеет максимальное число атомов, расположенных плотно друг к другу, отчего он прочный и твердый. Прочность связей в углеродных тетраэдрах (?-связи) обуславливает высокую химическую устойчивость алмаза. На него действует лишьF2 иO2 при 800 °C.
При сильном нагревании без доступа воздуха алмаз переходит в графит. Графит– кристаллы темно-серого цвета, со слабым металлическим блеском, маслянистый на ощупь. sp3-гибридизация. Каждый атом образует по 3 ковалентных ?-связи с соседними атомами под углом 120° – образуется плоская сетка, состоящая из правильных шестиугольников, в вершинах которых находятся атомы С. Образовавшиеся слои С идут параллельно друг другу. Связи между ними слабые, их обеспечивают электроны, не участвующие в гибридизации орбиталей. Последние образуют ?-связи. Связь атомов С в разных слоях носит частично металлический характер – обобществление электронов всеми атомами.
Графит обладает относительно высокой электро– и теплопроводностью, стоек к нагреванию. Из графита изготавливают карандаши.
Карбинполучен синтетически ? и ?-формы ( поликумулен) каталитическим окислением ацетилена. Это твердые, черные вещества со стеклянным блеском. При нагревании без доступа воздуха переходят в графит.
Уголь– аморфный углерод – неупорядоченная структура графита – получается при нагревании углеродосодержащих соединений.
В природе имеется большие залежи угля.
Уголь имеет несколько сортов:
1) кокс;
2) костяной уголь;
3) сажа.
40. Оксиды углерода. угольная кислота
Углерод с кислородом образует оксиды: СО, СО2, С3О2, С5О2, С6О9 и др.
Оксид углерода(II) –
СО.
Физические свойства:угарный газ, без цвета и запаха, ядовит, в воде почти не растворим, растворим в органических растворителях, t кипения = -192 °C, t плавления = -205 °C.
Химические свойства:несолеобразующий оксид. В обычных условиях малоактивен, при нагревании проявляет восстановительные свойства:
1) с кислородом: 2C+2O + O2 = 2C+4O2;
2) восстанавливает металлы из руд: C+2O + CuO = Сu + C+4O2;
3) с хлором (на свету): CO + Cl2 = COCl2(фосген);
4) с водородом: СО + Н2 = СН3ОН (метанол);
5) с серой: СО + S = СОS (сульфоксид углерода);
6) реагирует с расплавами щелочей: CO + NaOH = HCOONa (формиат натрия);
7) с переходными металлами образует карбонилы: Ni + 4CO = Ni(CO)4, Fe + 5CO = Fe(CO)5.
СО легко соединяется с гемоглобином – Hb крови, образуя карбоксигемоглобин,препятствуя переносу О2 от легких к тканям: Hb + CO = HbCO.
При вдохе воздуха карбогемоглобин распадается на исходные продукты: HbCO?Hb + CO.
Получение:
1) в лаборатории – термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
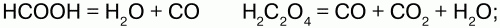 2) в промышленности (в газогенераторах):
2) в промышленности (в газогенераторах):
 Оксид углерода (IV) СO2. Физические свойства:углекислый газ, без цвета и запаха, малорастворим в воде, тяжелее воздуха, t плавления = -78,5 °C, твердый CO2 – сухой лед, не поддерживает горение.
Оксид углерода (IV) СO2. Физические свойства:углекислый газ, без цвета и запаха, малорастворим в воде, тяжелее воздуха, t плавления = -78,5 °C, твердый CO2 – сухой лед, не поддерживает горение.
Получение:
1) в промышленности (обжиг известняка): CaCO3?CaO + CO2;
2) действием сильных кислот на карбонаты и гидрокарбонаты: CaCO3(мрамор) + 2HCl =CaCl2 + H2O + CO2; NaHCO3 + HCl = NaCl + H2O + CO2.
Химические свойства:кислотный оксид, реагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
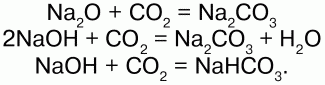 При повышенной температуре проявляет окислительные свойства: С+4O2 + 2Mg = 2Mg+2O + C0.
При повышенной температуре проявляет окислительные свойства: С+4O2 + 2Mg = 2Mg+2O + C0.
Качественная реакция– помутнение известковой воды: Ca(OH)2 + CO2 = CaCO3(белый осадок) + H2O.
Угольная кислота –слабая, существует в водном растворе: CO2 + H2O = H2CO3.
Соли: средние – карбонаты (СО3 2-), кислые – бикарбонаты, гидрокарбонаты (НС03-).
Карбонаты и гидрокарбонаты превращаются друг в друга:
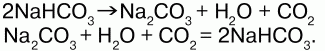 Качественная реакция –«вскипание» при действии сильной кислоты: Na2CO3 + 2HCl = 2NaCl + H2O + CO2; CO32-+ 2H+= H2O + CO2.
Качественная реакция –«вскипание» при действии сильной кислоты: Na2CO3 + 2HCl = 2NaCl + H2O + CO2; CO32-+ 2H+= H2O + CO2.
1) с кислородом: 2C+2O + O2 = 2C+4O2;
2) восстанавливает металлы из руд: C+2O + CuO = Сu + C+4O2;
3) с хлором (на свету): CO + Cl2 = COCl2(фосген);
4) с водородом: СО + Н2 = СН3ОН (метанол);
5) с серой: СО + S = СОS (сульфоксид углерода);
6) реагирует с расплавами щелочей: CO + NaOH = HCOONa (формиат натрия);
7) с переходными металлами образует карбонилы: Ni + 4CO = Ni(CO)4, Fe + 5CO = Fe(CO)5.
СО легко соединяется с гемоглобином – Hb крови, образуя карбоксигемоглобин,препятствуя переносу О2 от легких к тканям: Hb + CO = HbCO.
При вдохе воздуха карбогемоглобин распадается на исходные продукты: HbCO?Hb + CO.
Получение:
1) в лаборатории – термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
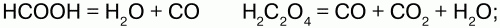

Получение:
1) в промышленности (обжиг известняка): CaCO3?CaO + CO2;
2) действием сильных кислот на карбонаты и гидрокарбонаты: CaCO3(мрамор) + 2HCl =CaCl2 + H2O + CO2; NaHCO3 + HCl = NaCl + H2O + CO2.
Химические свойства:кислотный оксид, реагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
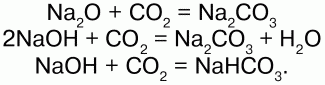
Качественная реакция– помутнение известковой воды: Ca(OH)2 + CO2 = CaCO3(белый осадок) + H2O.
Угольная кислота –слабая, существует в водном растворе: CO2 + H2O = H2CO3.
Соли: средние – карбонаты (СО3 2-), кислые – бикарбонаты, гидрокарбонаты (НС03-).
Карбонаты и гидрокарбонаты превращаются друг в друга: