Страница:
41. Кремний и его свойства
Кремний (Si) –стоит в 3 периоде, IV группе главной подгруппы периодической системы.
Физические свойства:кремний существует в двух модификациях: аморфной и кристаллической. Аморфный кремний – порошок бурого цвета, плотностью 2,33 г/см3, растворяется в расплавах металлов. Кристаллический кремний – это кристаллы темно-серого цвета, обладающие стальным блеском, твердый и хрупкий, плотностью 2,4 г/см3. Кремний состоит из трех изотопов: Si (28), Si (29), Si (30).
Химические свойства:электронная конфигурация: 1s22s22p6 3s2 3p2.Кремний – неметалл. На внешнем энергетическом уровне кремний имеет 4 электрона, что обуславливает его степени окисления: +4, -4, -2. Валентность – 2, 4. Аморфный кремний обладает большей реакционной способностью, чем кристаллический. При обычных условиях он взаимодействует со фтором: Si + 2F2 = SiF4. При 1000 °C Si реагирует с неметаллами: с CL2, N2, C, S.
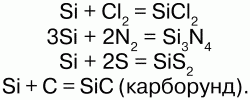 Из кислот кремний взаимодействует только со смесью азотной и плавиковой кислот:
Из кислот кремний взаимодействует только со смесью азотной и плавиковой кислот:
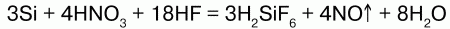 По отношению к металлам ведет себя по-разному: в расплавленных Zn, Al, Sn, Pb он хорошо растворяется, но не реагирует с ними; с другими расплавами металлов – с Mg, Cu, Fe кремний взаимодействует с образованием силицидов: Si + 2Mg = Mg2Si. Кремний горит в кислороде: Si + O2 = SiO2 (песок).
По отношению к металлам ведет себя по-разному: в расплавленных Zn, Al, Sn, Pb он хорошо растворяется, но не реагирует с ними; с другими расплавами металлов – с Mg, Cu, Fe кремний взаимодействует с образованием силицидов: Si + 2Mg = Mg2Si. Кремний горит в кислороде: Si + O2 = SiO2 (песок).
Диоксид кремния или кремнезем– стойкое соединение Si, широко распространен в природе. Реагирует со сплавлением его с щелочами, основными оксидами, образуя соли кремниевой кислоты – силикаты. Получение:в промышленности кремний в чистом виде получают восстановлением диоксида кремния коксом в электропечах: SiO2 + 2С = Si + 2СO?.
В лаборатории кремний получают прокаливанием с магнием или алюминием белого песка:
SiO2 + 2Mg = 2MgO + Si.
3SiO2 + 4Al = Al2О3 + 3Si.
Кремний образует кислоты:Н2 SiO3 – мета-кремниевая кислота;Н2 Si2O5 – двуметакремниевая кислота.
Нахождение в природе:минерал кварц – SiO2. Кристаллы кварца имеют форму шестигранной призмы, бесцветные и прозрачные, называются горным хрусталем. Аметист – горный хрусталь, окрашенный примесями в лиловый цвет; дымчатый топаз окрашен в буроватый цвет; агат и яшма – кристаллические разновидности кварца. Аморфный кремнезем менее распространен и существует в виде минерала опала – SiO2 nН2О. Диатомит, трепел или кизельгур (инфузорная земля) – землистые формы аморфного кремния.
Химические свойства:электронная конфигурация: 1s22s22p6 3s2 3p2.Кремний – неметалл. На внешнем энергетическом уровне кремний имеет 4 электрона, что обуславливает его степени окисления: +4, -4, -2. Валентность – 2, 4. Аморфный кремний обладает большей реакционной способностью, чем кристаллический. При обычных условиях он взаимодействует со фтором: Si + 2F2 = SiF4. При 1000 °C Si реагирует с неметаллами: с CL2, N2, C, S.
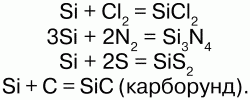
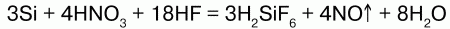
Диоксид кремния или кремнезем– стойкое соединение Si, широко распространен в природе. Реагирует со сплавлением его с щелочами, основными оксидами, образуя соли кремниевой кислоты – силикаты. Получение:в промышленности кремний в чистом виде получают восстановлением диоксида кремния коксом в электропечах: SiO2 + 2С = Si + 2СO?.
В лаборатории кремний получают прокаливанием с магнием или алюминием белого песка:
SiO2 + 2Mg = 2MgO + Si.
3SiO2 + 4Al = Al2О3 + 3Si.
Кремний образует кислоты:Н2 SiO3 – мета-кремниевая кислота;Н2 Si2O5 – двуметакремниевая кислота.
Нахождение в природе:минерал кварц – SiO2. Кристаллы кварца имеют форму шестигранной призмы, бесцветные и прозрачные, называются горным хрусталем. Аметист – горный хрусталь, окрашенный примесями в лиловый цвет; дымчатый топаз окрашен в буроватый цвет; агат и яшма – кристаллические разновидности кварца. Аморфный кремнезем менее распространен и существует в виде минерала опала – SiO2 nН2О. Диатомит, трепел или кизельгур (инфузорная земля) – землистые формы аморфного кремния.
42. Понятие коллоидных растворов
Коллоидные растворы– высокодисперсные двухфазные системы, состоящие из дисперсионной среды и дисперсной фазы. По размерам частиц являются промежуточными между истинными растворами, суспензиями и эмульсиями. У
коллоидных частицмолекулярный или ионный состав.
Существуют три типа внутренней структуры первичных частиц.
1. Суспензоиды (или необратимые коллоиды)– гетерогенные системы, свойства которых можно определить развитой межфазовой поверхностью. По сравнению с суспензиями более высокодисперсные. Не могут долго существовать без стабилизатора дисперсности. Их называют необратимыми коллоидамииз-за того, что их осадки после выпаривания вновь не образуют золей. Их концентрация мала – 0,1 %. От вязкости дисперсной среды отличаются незначительно.
Суспензоиды можно получить:
1) методами диспергирования (измельчение крупных тел);
2) методами конденсации (получение нерастворимых соединений при помощи реакций обмена, гидролиза и т. п.).
Самопроизвольное уменьшение дисперсности у суспензоидов зависит от свободной поверхностной энергии. Чтобы получить длительно сохраняющуюся суспензию, необходимы условия для ее стабилизации.
Устойчивые дисперсные системы:
1) дисперсионная среда;
2) дисперсная фаза;
3) стабилизатор дисперсной системы.
Стабилизатор может быть ионный, молекулярный, но чаще всего – высокомолекулярный.
Защитные коллоиды– высокомолекулярные соединения, которые добавляют для стабилизации (белки, пептиды, поливиниловый спирт и др.).
2. Ассоциативные (или мицеллярные коллоиды) –полуколлоиды, возникающие при достаточной концентрации молекул, состоящих из углеводородных радикалов (дифильные молекулы) низкомолекулярных веществ при ассоциации их в агрегаты молекул (мицеллы). Мицеллыобразуются в водных растворах моющих средств (мыл), органических красителей.
3. Молекулярные коллоиды (обратимые или лиофильные коллоиды) –природные и синтетические высокомолекулярные вещества с большим молекулярным весом. Молекулы их имеют размер коллоидных частиц (макромолекулы).
Разбавленные растворы коллоидов высокомолекулярных соединений – гомогенные растворы. При сильном разбавлении эти растворы подчиняются законам разбавленных растворов.
Неполярные макромолекулы растворяются в углеводородах, полярные – в полярных растворителях.
Обратимые коллоиды– вещества, сухой остаток которых при добавлении новой порции растворителя вновь переходит в раствор.
Существуют три типа внутренней структуры первичных частиц.
1. Суспензоиды (или необратимые коллоиды)– гетерогенные системы, свойства которых можно определить развитой межфазовой поверхностью. По сравнению с суспензиями более высокодисперсные. Не могут долго существовать без стабилизатора дисперсности. Их называют необратимыми коллоидамииз-за того, что их осадки после выпаривания вновь не образуют золей. Их концентрация мала – 0,1 %. От вязкости дисперсной среды отличаются незначительно.
Суспензоиды можно получить:
1) методами диспергирования (измельчение крупных тел);
2) методами конденсации (получение нерастворимых соединений при помощи реакций обмена, гидролиза и т. п.).
Самопроизвольное уменьшение дисперсности у суспензоидов зависит от свободной поверхностной энергии. Чтобы получить длительно сохраняющуюся суспензию, необходимы условия для ее стабилизации.
Устойчивые дисперсные системы:
1) дисперсионная среда;
2) дисперсная фаза;
3) стабилизатор дисперсной системы.
Стабилизатор может быть ионный, молекулярный, но чаще всего – высокомолекулярный.
Защитные коллоиды– высокомолекулярные соединения, которые добавляют для стабилизации (белки, пептиды, поливиниловый спирт и др.).
2. Ассоциативные (или мицеллярные коллоиды) –полуколлоиды, возникающие при достаточной концентрации молекул, состоящих из углеводородных радикалов (дифильные молекулы) низкомолекулярных веществ при ассоциации их в агрегаты молекул (мицеллы). Мицеллыобразуются в водных растворах моющих средств (мыл), органических красителей.
3. Молекулярные коллоиды (обратимые или лиофильные коллоиды) –природные и синтетические высокомолекулярные вещества с большим молекулярным весом. Молекулы их имеют размер коллоидных частиц (макромолекулы).
Разбавленные растворы коллоидов высокомолекулярных соединений – гомогенные растворы. При сильном разбавлении эти растворы подчиняются законам разбавленных растворов.
Неполярные макромолекулы растворяются в углеводородах, полярные – в полярных растворителях.
Обратимые коллоиды– вещества, сухой остаток которых при добавлении новой порции растворителя вновь переходит в раствор.
43. Соли кремниевой кислоты
Общая формула кремниевых кислот –
nSiO2?
mH2O.В природе находятся в основном в виде солей, в свободной форме выделены немногие, например, HSiO (ортокремниевая) и H2SiO3 (кремниевая или метакремниевая).
Получение кремниевой кислоты:
1) взаимодействие силикатов щелочных металлов с кислотами: Na2SiO3 + 2HCl = H2SiO3 + 2NaCl;
2) кремневая кислота является термически неустойчивой: H2SiO3 = H2O + SiO2.
H2SiO3 образует пересыщенные растворы, в которых в результате полимеризации образует коллоиды. Используя стабилизаторы, можно получить стойкие коллоиды (золи). Их используют в производстве. Без стабилизаторов из раствора кремниевой кислоты образуется гель, осушив который можно получить силикагель (используют как адсорбент).
Силикаты– соли кремниевой кислоты. Силикаты распространены в природе, земная кора состоит в большинстве из кремнезема и силикатов (полевые шпаты, слюда, глина, тальк и др.). Гранит, базальт и другие горные породы имеют в своем составе силикаты. Изумруд, топаз, аквамарин – кристаллы силикатов. Растворимы только силикаты натрия и калия, остальные – нерастворимы. Силикаты имеют сложный химический состав:
Каолин Al2O3; 2SiO2; 2H2Oили H4Al2SiO9.
Асбест CaO; 3MgO; 4SiO 2или CaMgSi4O12.
Получение:сплавление оксида кремния со щелочами или карбонатами:
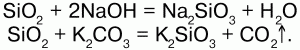 Растворимое стекло– силикаты натрия и калия.
Жидкое стекло– водные растворы силикатов калия и натрия. Его используют для изготовления кислотоупорного цемента и бетона, керосинонепроницаемых штукатурок, огнезащитных красок.
Алюмосиликаты– силикаты, содержащие алюминий (
полевой шпат, слюда).
Полевые шпатысостоят помимо оксидов кремния и алюминия из оксидов калия, натрия, кальция – K2O?Al2O3?6SiO2 – ортоклаз.
Растворимое стекло– силикаты натрия и калия.
Жидкое стекло– водные растворы силикатов калия и натрия. Его используют для изготовления кислотоупорного цемента и бетона, керосинонепроницаемых штукатурок, огнезащитных красок.
Алюмосиликаты– силикаты, содержащие алюминий (
полевой шпат, слюда).
Полевые шпатысостоят помимо оксидов кремния и алюминия из оксидов калия, натрия, кальция – K2O?Al2O3?6SiO2 – ортоклаз.
Слюдыимеют в своем составе, кроме кремния и алюминия, еще водород, натрий или калий, реже – кальций, магний, железо.
Граниты и гнейсы (горные породы)– состоят из кварца, полевого шпата и слюды. Горные породы и минералы, находясь на поверхности Земли, вступают во взаимодействие с водой и воздухом, что вызывает их изменение и разрушение. Этот процесс называется выветриванием.
Выветривание ортоклаза:
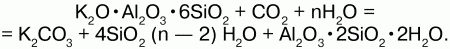 Применение:силикатные породы (гранит) используют как строительный материал, силикаты – в качестве сырья при производстве цемента, стекла, керамики, наполнителей; слюду и асбест – как электро– и термоизоляцию.
Применение:силикатные породы (гранит) используют как строительный материал, силикаты – в качестве сырья при производстве цемента, стекла, керамики, наполнителей; слюду и асбест – как электро– и термоизоляцию.
Получение кремниевой кислоты:
1) взаимодействие силикатов щелочных металлов с кислотами: Na2SiO3 + 2HCl = H2SiO3 + 2NaCl;
2) кремневая кислота является термически неустойчивой: H2SiO3 = H2O + SiO2.
H2SiO3 образует пересыщенные растворы, в которых в результате полимеризации образует коллоиды. Используя стабилизаторы, можно получить стойкие коллоиды (золи). Их используют в производстве. Без стабилизаторов из раствора кремниевой кислоты образуется гель, осушив который можно получить силикагель (используют как адсорбент).
Силикаты– соли кремниевой кислоты. Силикаты распространены в природе, земная кора состоит в большинстве из кремнезема и силикатов (полевые шпаты, слюда, глина, тальк и др.). Гранит, базальт и другие горные породы имеют в своем составе силикаты. Изумруд, топаз, аквамарин – кристаллы силикатов. Растворимы только силикаты натрия и калия, остальные – нерастворимы. Силикаты имеют сложный химический состав:
Каолин Al2O3; 2SiO2; 2H2Oили H4Al2SiO9.
Асбест CaO; 3MgO; 4SiO 2или CaMgSi4O12.
Получение:сплавление оксида кремния со щелочами или карбонатами:
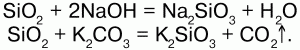
Слюдыимеют в своем составе, кроме кремния и алюминия, еще водород, натрий или калий, реже – кальций, магний, железо.
Граниты и гнейсы (горные породы)– состоят из кварца, полевого шпата и слюды. Горные породы и минералы, находясь на поверхности Земли, вступают во взаимодействие с водой и воздухом, что вызывает их изменение и разрушение. Этот процесс называется выветриванием.
Выветривание ортоклаза:
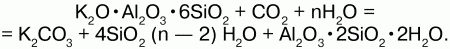
44. Получение цемента и керамики
Цементявляется важнейшим материалом в строительстве. Цемент получают обжигом смеси глины с известняком. При обжиге смеси
CaCO3 (кальцированная сода)разлагается на
CaOи углекислый газ
CO2?.
CaOвступает во взаимодействие с глиной и получаются силикаты и алюминаты кальция. Химический состав цемента выражают в виде содержащихся в нем оксидов, главным из них является
CaO:
Al2O3, SiO2, Fe2O3.
Прокаливание производится в специальных цилиндрических вращающихся печах при температуре 1400–1600 °C. Получаемая спекшаяся масса называется клинкером. Клинкерсдо-бавками размалывают в порошок в шаровых мельницах и получают окончательный продукт – цемент– порошкообразное вещество, при смешивании с водой на воздухе затвердевает в каменнообразную массу (применяется для скрепления кирпича, камня в качестве связующего материала).
Смесь цемента с песком и водой – цементный раствор. Смесь такого раствора с гравием или щебнем – бетон.Залитый бетоном железный каркас – железобетон. Из него строят своды, мосты, арки, бассейны, кладут перекрытия зданий, электростанций. В природе встречаются известняково-глинистые породы, по составу соответствующие цементной массе – мергели.
Виды цемента:1) быстротвердеющий; 2) морозостойкий; 3) коррозийностойкий; 4) кислотоупорный.
Керамика– изделия или материалы, изготовленные из огнеупорных веществ: глины, карбидов, оксидов некоторых металлов.
Виды керамики:
1) строительная керамика (облицовочные плиты, кирпич, черепица, трубы канализации);
2) огнеупорная керамика (огнеупорный кирпич, материалы для внутренней облицовки доменных, сталелитейных, стеклоплавильных печей);
3) химически стойкая керамика (используется в химической промышленности);
4) бытовая керамика (фаянсовые и фарфоровые изделия);
5) техническая керамика.
Процесс изготовления керамических изделий включает:1) изготовление керамической смеси; 2) формование; 3) сушка; 4) обжиг.
В зависимости от природы исходных материалов и дальнейшего использования продукции операция проводится по разному, строго определенному режиму.
При изготовлении кирпича сырье измельчается, перемешивается и увлажняется. Получившуюся массу формуют, сушат, а затем при температуре 900 °C подвергают обжигу. При обжиге происходит спеканиемассы, обусловленное химическим процессом.
Основная реакция при обжиге глины: 3 [Al2O3?2SiO2?2H2O] = 3Al2O3?2SiO2 + 4SiO2 + 6H2O.
Прокаливание производится в специальных цилиндрических вращающихся печах при температуре 1400–1600 °C. Получаемая спекшаяся масса называется клинкером. Клинкерсдо-бавками размалывают в порошок в шаровых мельницах и получают окончательный продукт – цемент– порошкообразное вещество, при смешивании с водой на воздухе затвердевает в каменнообразную массу (применяется для скрепления кирпича, камня в качестве связующего материала).
Смесь цемента с песком и водой – цементный раствор. Смесь такого раствора с гравием или щебнем – бетон.Залитый бетоном железный каркас – железобетон. Из него строят своды, мосты, арки, бассейны, кладут перекрытия зданий, электростанций. В природе встречаются известняково-глинистые породы, по составу соответствующие цементной массе – мергели.
Виды цемента:1) быстротвердеющий; 2) морозостойкий; 3) коррозийностойкий; 4) кислотоупорный.
Керамика– изделия или материалы, изготовленные из огнеупорных веществ: глины, карбидов, оксидов некоторых металлов.
Виды керамики:
1) строительная керамика (облицовочные плиты, кирпич, черепица, трубы канализации);
2) огнеупорная керамика (огнеупорный кирпич, материалы для внутренней облицовки доменных, сталелитейных, стеклоплавильных печей);
3) химически стойкая керамика (используется в химической промышленности);
4) бытовая керамика (фаянсовые и фарфоровые изделия);
5) техническая керамика.
Процесс изготовления керамических изделий включает:1) изготовление керамической смеси; 2) формование; 3) сушка; 4) обжиг.
В зависимости от природы исходных материалов и дальнейшего использования продукции операция проводится по разному, строго определенному режиму.
При изготовлении кирпича сырье измельчается, перемешивается и увлажняется. Получившуюся массу формуют, сушат, а затем при температуре 900 °C подвергают обжигу. При обжиге происходит спеканиемассы, обусловленное химическим процессом.
Основная реакция при обжиге глины: 3 [Al2O3?2SiO2?2H2O] = 3Al2O3?2SiO2 + 4SiO2 + 6H2O.
45. Физические свойства металлов
Все металлы имеют ряд общих, характерных для них свойств. Общими свойствами считаются: высокая электропроводность и теплопроводность, пластичность.
Разброс параметров у металлов очень велик, например, температура плавления может варьировать от 38,87 °C ( Hg – ртуть) до 3380 °C ( W – вольфрам), плотность – от 0,531 г/см3( Li – литий) до 22,5 г/см3( Os – осмий).
Коэффициент электропроводности металлов храктеризует их способность к проведению электричества. Коэффициент зависит от строения и свойств металла, у каждого металла он индивидуальный. Теория электропроводностисостоит в том, что фактором электрического сопротивления металлов являются потери на излучение. Пользуясь теорией, можно вычислить коэффициент для любого металла.
Металлы способны испускать электроны при высокой температуре, это явление называется термоэлектронной эмиссией,возникающее также под воздействием других факторов (электро-магнитое поле, воздействие УФ и др.). Перепад температуры провоцирует в металлах появление электрического тока. Движения электронов в металлах обуславливают их теплопроводность.Отношение теплопроводности металлов и их электрической проводимости является постоянной величиной для всех металлов.
По магнитной восприимчивости металлы делятся на диамагнетики и парамагнетики.
Металлы непрозрачны, обладают металлическим блеском, сочетают в себе такие качества как: пластичность, вязкость, прочность, твердость и упругость. Все эти свойства зависят от целостности кристаллической решетки и состава.
Пластичность металлов находит большое практическое применение.Благодаря ей металлы можно подвергать различным воздействиям – ковке, вытягиванию, прокатке, штамповке. Это свойство можно объяснить специфическими свойствами металлической связи, которая связывает атомы металлов в кристаллической решетке.
Механические свойства реальных металлов характеризуются присутствием дефектов, в первую очередь дислокаций, потому что перемещение дислокаций по плоскостям кристаллической решетки с наиболее плотной упаковкой считается основным механизмом пластической деформации металлов. При взаимодействии дислокаций с другими дефектами вызывается увеличение сопротивления пластической деформации. Во время деформации количество дислокаций растет, одновременно с ними растет сопротивление деформации (деформационное упрочнение или наклеп). Подобные дефекты металла можно устранить при отжиге. В локализациях «сгущения» рост напряжений способен привести к образованию трещин, являющихся очагами разрушения металла.
Разброс параметров у металлов очень велик, например, температура плавления может варьировать от 38,87 °C ( Hg – ртуть) до 3380 °C ( W – вольфрам), плотность – от 0,531 г/см3( Li – литий) до 22,5 г/см3( Os – осмий).
Коэффициент электропроводности металлов храктеризует их способность к проведению электричества. Коэффициент зависит от строения и свойств металла, у каждого металла он индивидуальный. Теория электропроводностисостоит в том, что фактором электрического сопротивления металлов являются потери на излучение. Пользуясь теорией, можно вычислить коэффициент для любого металла.
Металлы способны испускать электроны при высокой температуре, это явление называется термоэлектронной эмиссией,возникающее также под воздействием других факторов (электро-магнитое поле, воздействие УФ и др.). Перепад температуры провоцирует в металлах появление электрического тока. Движения электронов в металлах обуславливают их теплопроводность.Отношение теплопроводности металлов и их электрической проводимости является постоянной величиной для всех металлов.
По магнитной восприимчивости металлы делятся на диамагнетики и парамагнетики.
Металлы непрозрачны, обладают металлическим блеском, сочетают в себе такие качества как: пластичность, вязкость, прочность, твердость и упругость. Все эти свойства зависят от целостности кристаллической решетки и состава.
Пластичность металлов находит большое практическое применение.Благодаря ей металлы можно подвергать различным воздействиям – ковке, вытягиванию, прокатке, штамповке. Это свойство можно объяснить специфическими свойствами металлической связи, которая связывает атомы металлов в кристаллической решетке.
Механические свойства реальных металлов характеризуются присутствием дефектов, в первую очередь дислокаций, потому что перемещение дислокаций по плоскостям кристаллической решетки с наиболее плотной упаковкой считается основным механизмом пластической деформации металлов. При взаимодействии дислокаций с другими дефектами вызывается увеличение сопротивления пластической деформации. Во время деформации количество дислокаций растет, одновременно с ними растет сопротивление деформации (деформационное упрочнение или наклеп). Подобные дефекты металла можно устранить при отжиге. В локализациях «сгущения» рост напряжений способен привести к образованию трещин, являющихся очагами разрушения металла.
46. Химические свойства металлов
Металлыобладают низким потенциалом ионизации и сродством к электрону, поэтому в химических реакциях выступают в качестве восстановителей, в растворах образуют
катионы. Электроотрицательность у металлов ниже, чем у неметаллов. Могут входить в состав сложных анионов или комплексов, но при этом являются центрами положительного заряда. Лишь у
амфотерных металлов(проявляющих как окислительные, так и восстановительные свойства) –
Sn олово, Po полоний, Sb сурьмаи др. – существуют соединения с отрицательной степенью окисления.
Во всех химических соединениях у металлов химическая ковалентная полярная связь.
Сильно варьируется способность металлов к окислению. Основная часть металлов взаимодействует с кислородом воздуха при комнатной температуре, но скорость и механизм протекания реакции зависят от состава и чистоты металла (чаще образуются оксиды, у щелочных металлов – пероксиды). Некоторые металлы на воздухе образуют оксидную пленку, которая предохраняет металл от дальнейшего окисления ( Al– алюминий, Ti– титан, Сr– хром).
Металлы, имеющие стандартный электродный потенциал отрицательнее -0,413 В, окисляются водой, выделяя при этом Н2. Щелочные и щелочноземельные металлы вступают во взаимодействие с водой при комнатной температуре, другие ( Zn– цинк, Fe– железои др.) – при высоких температурах. Растворимые анионные комплексы бериллия, цинка, алюминия, галлия, олова вступают в реакцию с растворами щелочей.
Основная часть металлов окисляется определенными кислотами. Металлы, стоящие в ряду напряжений до водорода, окисляются ионом водорода, входящего в состав кислот и образуют раствор соли, если не происходит образования нерастворимых продуктов реакции. С азотной кислотой в зависимости от ее концентрации металлы взаимодействуют по-разному. Концентрированная азотная кислота пассивирует некоторые металлы, например, железо, а разбавленная вступает во взаимодействие с ними, образуя катионные комплексы. Чтобы получить раствор малоактивных металлов, например, золотаили платины, используют смеси, содержащие окислитель и поставщика лигандов, такие как царская водкаили смесь HNO3 и HF.
Важным характерным свойством металлов является способность образовывать основные оксиды и гидроксиды.В главных подгруппах периодической системы основность оксидов и гидроксидов идет на возрастание сверху вниз, а в побочных подгруппах (исключение составляют I–III) – наоборот – снизу вверх. С ростом порядкового номера в периодах и рядах основность металла убывает. Металлы, имеющие несколько степеней окисления, имеют кислотные оксиды.
Сильно варьируется способность металлов к окислению. Основная часть металлов взаимодействует с кислородом воздуха при комнатной температуре, но скорость и механизм протекания реакции зависят от состава и чистоты металла (чаще образуются оксиды, у щелочных металлов – пероксиды). Некоторые металлы на воздухе образуют оксидную пленку, которая предохраняет металл от дальнейшего окисления ( Al– алюминий, Ti– титан, Сr– хром).
Металлы, имеющие стандартный электродный потенциал отрицательнее -0,413 В, окисляются водой, выделяя при этом Н2. Щелочные и щелочноземельные металлы вступают во взаимодействие с водой при комнатной температуре, другие ( Zn– цинк, Fe– железои др.) – при высоких температурах. Растворимые анионные комплексы бериллия, цинка, алюминия, галлия, олова вступают в реакцию с растворами щелочей.
Основная часть металлов окисляется определенными кислотами. Металлы, стоящие в ряду напряжений до водорода, окисляются ионом водорода, входящего в состав кислот и образуют раствор соли, если не происходит образования нерастворимых продуктов реакции. С азотной кислотой в зависимости от ее концентрации металлы взаимодействуют по-разному. Концентрированная азотная кислота пассивирует некоторые металлы, например, железо, а разбавленная вступает во взаимодействие с ними, образуя катионные комплексы. Чтобы получить раствор малоактивных металлов, например, золотаили платины, используют смеси, содержащие окислитель и поставщика лигандов, такие как царская водкаили смесь HNO3 и HF.
Важным характерным свойством металлов является способность образовывать основные оксиды и гидроксиды.В главных подгруппах периодической системы основность оксидов и гидроксидов идет на возрастание сверху вниз, а в побочных подгруппах (исключение составляют I–III) – наоборот – снизу вверх. С ростом порядкового номера в периодах и рядах основность металла убывает. Металлы, имеющие несколько степеней окисления, имеют кислотные оксиды.
47. Металлы и сплавы в технике
В периодической системе из 110 известных элементов 88 – металлы. В
XX векепри помощи ядерных реакций были получены радиоактивные металлы, которых не существует в природе. В современной металлургии получают более 60 металлов, на основе которых – 5000 сплавов.
Основой структуры металлов является металлическая связь (кристаллическая решетка из положительных ионов, погруженная в плотный газ подвижных электронов). Она обуславливает физические свойства металлов: пластичность, электропроводность, теплопроводность, металлический блеск.
Пластичность– способность металлов изменять форму, уменьшается в ряду Au, Ag, Cu, Sn, Pb, Zn. Fe.
Высокая электропроводность металлов связана с наличием свободных электронов, которые под влиянием даже небольшой разности потенциалов перемещаются от отрицательного полюса к положительному. Лучший проводник электричества – серебро, за ним идут медь, золото, алюминий, железо.
Самый легкий металл – литий (плотность 0,53 г/см3), самый тяжелый – осмий (22,6 г/см3).
Легкие металлы– металлы с плотностью меньше 5 г/см3.
Тяжелые металлы– металлы с плотностью больше 5 г/см3.
Сильно разнятся температуры плавления металлов. Металлы различаются по твердости. Прочность металлической связи влияет на прочность, температуру плавления и твердость металлов.
Сплавы– системы, в состав которых входят два или более металлов, реже могут входить неметаллы (углерод, кремний, бор). Все сплавы на основе железа (чугун, сталь), в том числе и само железо называют черными металлами. Все остальные – цветные металлы (дуралюмин, латунь).
Компоненты, входящие в состав сплава:
1) механическая смесь (между простыми веществами без взаимодействия);
2) химические соединения (вещества в сплаве, вступающие во взаимодействие);
3) твердые растворы (вещества взаиморастворяющиеся);
4) промежуточные соединения.
В расплавленном состоянии большая часть металлов при растворении друг в друге образуют однородный жидкий сплав. Но, кристаллизуясь, ведут себя по-разному. В твердом состоянии металлы не растворяются и не взаимодействуют друг с другом. Сплав представлен механической смесью из кристаллитов компонентов. Металлы сплавляемые вступают в реакцию друг с другом, образуя новое химическое соединение. Твердый раствор –образование однородных кристаллов в результате сохранения растворимости металлов друг в друге. Сталь– сплав железа и углерода, имеющий примеси марганца, кремния, серы и фосфора.
Основой структуры металлов является металлическая связь (кристаллическая решетка из положительных ионов, погруженная в плотный газ подвижных электронов). Она обуславливает физические свойства металлов: пластичность, электропроводность, теплопроводность, металлический блеск.
Пластичность– способность металлов изменять форму, уменьшается в ряду Au, Ag, Cu, Sn, Pb, Zn. Fe.
Высокая электропроводность металлов связана с наличием свободных электронов, которые под влиянием даже небольшой разности потенциалов перемещаются от отрицательного полюса к положительному. Лучший проводник электричества – серебро, за ним идут медь, золото, алюминий, железо.
Самый легкий металл – литий (плотность 0,53 г/см3), самый тяжелый – осмий (22,6 г/см3).
Легкие металлы– металлы с плотностью меньше 5 г/см3.
Тяжелые металлы– металлы с плотностью больше 5 г/см3.
Сильно разнятся температуры плавления металлов. Металлы различаются по твердости. Прочность металлической связи влияет на прочность, температуру плавления и твердость металлов.
Сплавы– системы, в состав которых входят два или более металлов, реже могут входить неметаллы (углерод, кремний, бор). Все сплавы на основе железа (чугун, сталь), в том числе и само железо называют черными металлами. Все остальные – цветные металлы (дуралюмин, латунь).
Компоненты, входящие в состав сплава:
1) механическая смесь (между простыми веществами без взаимодействия);
2) химические соединения (вещества в сплаве, вступающие во взаимодействие);
3) твердые растворы (вещества взаиморастворяющиеся);
4) промежуточные соединения.
В расплавленном состоянии большая часть металлов при растворении друг в друге образуют однородный жидкий сплав. Но, кристаллизуясь, ведут себя по-разному. В твердом состоянии металлы не растворяются и не взаимодействуют друг с другом. Сплав представлен механической смесью из кристаллитов компонентов. Металлы сплавляемые вступают в реакцию друг с другом, образуя новое химическое соединение. Твердый раствор –образование однородных кристаллов в результате сохранения растворимости металлов друг в друге. Сталь– сплав железа и углерода, имеющий примеси марганца, кремния, серы и фосфора.
48. Основные способы получения металлов
Большое количество металлов находится в природе в виде соединений.
Самородными металламиназываются те, которые встречаются в свободном состоянии (золото, платина, ртуть, олово). Золото добывают либо отделяя механически от примесей, либо извлекая из породы при помощи реагентов. Остальные металлы получают с помощью химической обработки их соединений.
Руды– горные породы и минералы, имеющие в составе соединения металлов, пригодные для получения их промышленным способом (оксиды, сульфиды и карбонаты металлов).
Способы получения металлов:
1) одним из главных способов получения металлов из руд основан на восстановлении их оксидов углем: Cu2O + C = 2Cu + CO?;
2) производят выплавку чугуна из железных руд, получение олова из оловянного камня SnO2 и восстановление других металлов из оксидов;
3) для получения металлов из сернистых руд, последние вначале переводят в сернистые соединения с помощью обжигания в специальных печах:
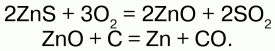 Руду, представляющую собой соль угольной кислоты, можно сразу восстанавливать при помощи угля: ZnCO3 = ZnO + CO2?.
Руду, представляющую собой соль угольной кислоты, можно сразу восстанавливать при помощи угля: ZnCO3 = ZnO + CO2?.
Руды содержат в себе немало примесей (песок, известняк, глина). Для облегчения выплавки металла смеси устраняют, добавляя разнообразные вещества ( флюсы), образующие с ними легкоплавкие соединения – шлаки. В тех случаях, когда примесей в руде много, ее обогащают путем удаления части примесей. Самый распространенный способ обогащения – флотация. Пример: руду, состоящую из сернистого металла и пустой породы, измельчают, заливают водой, прибавляя малополярное органическое вещество (для образования пены) и небольшое количество реагента «коллектора», который адсорбируется поверхностью минерала. Через смесь снизу пропускают струю воздуха. В результате частицы минерала со слоем молекул «коллектора» прилипают к пузырькам воздуха, а частицы пустой породы, смоченные водой, опускаются на дно. Затем пену собирают, отжимают и получают руду с большим содержанием металла. Существует также гравитационное обогащение,основанное на различии плотности и разнице падения частиц металлов и воды. Магнитный способ– разделение металлов по магнитным свойствам.
4) Металл можно получить путем электролиза. С его помощью получают одни из наиболее активных металлов.
5) Промышленные способы получения металлов: пирометаллургический, электрохимический, гидрометаллургический.
Способы получения металлов:
1) одним из главных способов получения металлов из руд основан на восстановлении их оксидов углем: Cu2O + C = 2Cu + CO?;
2) производят выплавку чугуна из железных руд, получение олова из оловянного камня SnO2 и восстановление других металлов из оксидов;
3) для получения металлов из сернистых руд, последние вначале переводят в сернистые соединения с помощью обжигания в специальных печах:
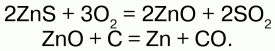
Руды содержат в себе немало примесей (песок, известняк, глина). Для облегчения выплавки металла смеси устраняют, добавляя разнообразные вещества ( флюсы), образующие с ними легкоплавкие соединения – шлаки. В тех случаях, когда примесей в руде много, ее обогащают путем удаления части примесей. Самый распространенный способ обогащения – флотация. Пример: руду, состоящую из сернистого металла и пустой породы, измельчают, заливают водой, прибавляя малополярное органическое вещество (для образования пены) и небольшое количество реагента «коллектора», который адсорбируется поверхностью минерала. Через смесь снизу пропускают струю воздуха. В результате частицы минерала со слоем молекул «коллектора» прилипают к пузырькам воздуха, а частицы пустой породы, смоченные водой, опускаются на дно. Затем пену собирают, отжимают и получают руду с большим содержанием металла. Существует также гравитационное обогащение,основанное на различии плотности и разнице падения частиц металлов и воды. Магнитный способ– разделение металлов по магнитным свойствам.
4) Металл можно получить путем электролиза. С его помощью получают одни из наиболее активных металлов.
5) Промышленные способы получения металлов: пирометаллургический, электрохимический, гидрометаллургический.
49. Коррозия металлов
Коррозия металлов(corrosio – разъедание) – физико-химическая реакция металлов и сплавов с окружающей средой, в результате чего они теряют свои свойства. В основе коррозии лежит реакция на границе раздела фаз между материалом и средой: 3Fe+2О2=Fe3O4.
По условиям протекания коррозия подразделяется на:1) контактную; 2) щелевую; 3) по ватерлинии; 4) в зонах обрызгивания; 5) в зонах переменного смачивания; 6) протекающую по конденсации кислых паров; 7) радиационную; 8) происходящую при теплоотдаче; 9) образованную блуждающими токами.
Типы коррозии:
Химическая или газовая коррозия (металлы и сплавы разрушаются, взаимодействуя с кислородом, водородом и другими газами при отсутствии влаги).
Электрохимическая коррозия (возникновение контакта металла или сплава в растворе электролита).
Химическая коррозия. Представлена процессами окисления металла и восстановления агента коррозии (чаще всего – кислород): 2Ме + О2 = 2МеО.
Важную роль играет газовая коррозия – коррозия металлов при высоких температурах в сухих газах (продукты сгорания топлива и др.).
Факторы, воздействующие на скорость газовой коррозии:
1) природа металла (сплава);
2) состав газовой среды;
3) механические свойства образующихся продуктов коррозии (оксидных пленок);
4) температура.
Электрохимическая коррозияболее распространена, включает в себя процессы окисления металла и восстановления коррозийного агента, протекающие раздельно в электролитной среде (растворы солей, кислот, почва и др.).
Ход электрохимической коррозии является совокупностью двух сопряженно протекающих реакций: анодной реакции (окисления) Ме = Меz+ + ze-и катодной реакции (восстановления) D + ze-+ (Dze-), где D– деполяризатор (окислитель), присоединяющий к себе электроны металла (кислород, ионы водорода и некоторых металлов).
Процесс ржавления железа:2Fe + 2H2O + O2 = 2Fe2++ 4OH-.
В углеродистых сталях нередко возникают гальванические элементы «катод—анод». Это происходит в связи с дифференциацией поверхностей сталей на участки, имеющие различные электронные потенциалы.
Электрохимическая коррозия в зависимости от коррозийной среды делится на:
1) атмосферную; 2) почвенную; 3) микробиологическую; 4) жидкостную.
Интенсивность коррозии зависит от химического состава металла (его сплавов), содержания примесей и самого окислителя, его концентрации, влажности воздуха.
По условиям протекания коррозия подразделяется на:1) контактную; 2) щелевую; 3) по ватерлинии; 4) в зонах обрызгивания; 5) в зонах переменного смачивания; 6) протекающую по конденсации кислых паров; 7) радиационную; 8) происходящую при теплоотдаче; 9) образованную блуждающими токами.
Типы коррозии:
Химическая или газовая коррозия (металлы и сплавы разрушаются, взаимодействуя с кислородом, водородом и другими газами при отсутствии влаги).
Электрохимическая коррозия (возникновение контакта металла или сплава в растворе электролита).
Химическая коррозия. Представлена процессами окисления металла и восстановления агента коррозии (чаще всего – кислород): 2Ме + О2 = 2МеО.
Важную роль играет газовая коррозия – коррозия металлов при высоких температурах в сухих газах (продукты сгорания топлива и др.).
Факторы, воздействующие на скорость газовой коррозии:
1) природа металла (сплава);
2) состав газовой среды;
3) механические свойства образующихся продуктов коррозии (оксидных пленок);
4) температура.
Электрохимическая коррозияболее распространена, включает в себя процессы окисления металла и восстановления коррозийного агента, протекающие раздельно в электролитной среде (растворы солей, кислот, почва и др.).
Ход электрохимической коррозии является совокупностью двух сопряженно протекающих реакций: анодной реакции (окисления) Ме = Меz+ + ze-и катодной реакции (восстановления) D + ze-+ (Dze-), где D– деполяризатор (окислитель), присоединяющий к себе электроны металла (кислород, ионы водорода и некоторых металлов).
Процесс ржавления железа:2Fe + 2H2O + O2 = 2Fe2++ 4OH-.
В углеродистых сталях нередко возникают гальванические элементы «катод—анод». Это происходит в связи с дифференциацией поверхностей сталей на участки, имеющие различные электронные потенциалы.
Электрохимическая коррозия в зависимости от коррозийной среды делится на:
1) атмосферную; 2) почвенную; 3) микробиологическую; 4) жидкостную.
Интенсивность коррозии зависит от химического состава металла (его сплавов), содержания примесей и самого окислителя, его концентрации, влажности воздуха.
50. Защита металлов от коррозии
Защита металлов и сплавов от коррозии в агрессивных средах основывается на:
1) повышении коррозионной стойкости самого материала; 2) снижении агрессивности среды; 3) предотвращении контакта материала со средой с помощью изолирующего покрытия; 4) регулировании электродного потенциала защищаемого изделия в данной среде.
Существуют методы, используемые для защиты от электрохимической коррозии:
1) использование химически стойких сплавов; 2) защита покрытием поверхности металла или сплава; 3) снижение активности коррозийной среды; 4) электрохимические методы.
Самыми химически устойчивыми сплавами считаются нержавеющие (13 % хрома) и кислотоупорные (18 % хрома, 8—10 % никеля) стали.
Для покрытия металлов используются различные виды покрытий – металлические, неметаллические, покрытия, образующиеся при электрохимической и химической обработке поверхности металлов. Металлические покрытия– хром, никель, цинк, кадмий, алюминий, олово и др. Их наносят, используя методы гальванотехники.
Неметаллические покрытия– лаки, краски, эмали, фенолформальдегидные смолы и др.
Покрытия, получающиеся в результате обработки металла, – оксидные или солевые пленки (оксидирование алюминия).
Метод снижения агрессивности среды наиболее эффективен для изделий, используемых в малом количестве жидкости. Самыми распространенными агрессивными средами являются вода, водные растворы щелочей и кислот, почва и атмосфера. От концентрации растворенных кислорода и углекислого газа зависит агрессивность водных сред. Физически кислород и углекислый газ можно удалить, нагревая воду при пониженном давлении, химически – пропуская через слой стальных или железных стружек или обрабатывая восстановителем. Еще агрессивность водных сред снимают, используя ингибиторы коррозии. Анодные ингибиторы– гидроксид, карбонат, фосфаты, нитрит и бензоат натрия.
1) повышении коррозионной стойкости самого материала; 2) снижении агрессивности среды; 3) предотвращении контакта материала со средой с помощью изолирующего покрытия; 4) регулировании электродного потенциала защищаемого изделия в данной среде.
Существуют методы, используемые для защиты от электрохимической коррозии:
1) использование химически стойких сплавов; 2) защита покрытием поверхности металла или сплава; 3) снижение активности коррозийной среды; 4) электрохимические методы.
Самыми химически устойчивыми сплавами считаются нержавеющие (13 % хрома) и кислотоупорные (18 % хрома, 8—10 % никеля) стали.
Для покрытия металлов используются различные виды покрытий – металлические, неметаллические, покрытия, образующиеся при электрохимической и химической обработке поверхности металлов. Металлические покрытия– хром, никель, цинк, кадмий, алюминий, олово и др. Их наносят, используя методы гальванотехники.
Неметаллические покрытия– лаки, краски, эмали, фенолформальдегидные смолы и др.
Покрытия, получающиеся в результате обработки металла, – оксидные или солевые пленки (оксидирование алюминия).
Метод снижения агрессивности среды наиболее эффективен для изделий, используемых в малом количестве жидкости. Самыми распространенными агрессивными средами являются вода, водные растворы щелочей и кислот, почва и атмосфера. От концентрации растворенных кислорода и углекислого газа зависит агрессивность водных сред. Физически кислород и углекислый газ можно удалить, нагревая воду при пониженном давлении, химически – пропуская через слой стальных или железных стружек или обрабатывая восстановителем. Еще агрессивность водных сред снимают, используя ингибиторы коррозии. Анодные ингибиторы– гидроксид, карбонат, фосфаты, нитрит и бензоат натрия.
