Страница:
5. В медико-генетическую консультацию обратилась женщина 20 лет. Ее родная сестра больна тяжелой формой серповидно-клеточной анемии, у пациентки никаких заболеваний крови не было, супруг здоров. Женщину интересует, каков риск развития этой болезни у планируемого ребенка. При обследовании крови супругов на типы гемоглобина получены результаты: у мужчины HbA 98 %, HbS 1 %; у женщины HbA 70 %, HbS 29 %.
Каков ответ на вопрос женщины? Были ли основания для беспокойства? Возможна ли профилактика при планировании конкретного ребенка? Связано ли заболевание с полом ребенка?
6. Какие группы крови невозможны у детей от родителей со следующими группами крови по системе АВ0: I(0) и III(В)? III(В) и IV(АВ)? IV(АВ) и IV(АВ)? II(А) и III(В)? Какое значение при рождении второго ребенка имеет установленная группа крови первого?
7. В медико-генетическую консультацию обратилась беременная, которая сообщила, что ее сестра больна фенилкетонурией, сама наследственные заболевания отрицает. Супруг здоров. В его роду были браки между близкими родственниками, но случаев фенилкетонурии не отмечалось.
Какова вероятность появления фенилкетонурии у ребенка? Имеет ли значение вероятный пол ребенка? Можно ли лечить эту болезнь после ее появления?
Глава 4
4.1. ПОВРЕЖДЕНИЕ КЛЕТКИ: ПРИЧИНЫ И ОБЩИЕ МЕХАНИЗМЫ
4.2. ПАТОЛОГИЯ КЛЕТОЧНЫХ МЕМБРАН
4.3. ПАТОЛОГИЯ КЛЕТОЧНОГО ЯДРА
Каков ответ на вопрос женщины? Были ли основания для беспокойства? Возможна ли профилактика при планировании конкретного ребенка? Связано ли заболевание с полом ребенка?
6. Какие группы крови невозможны у детей от родителей со следующими группами крови по системе АВ0: I(0) и III(В)? III(В) и IV(АВ)? IV(АВ) и IV(АВ)? II(А) и III(В)? Какое значение при рождении второго ребенка имеет установленная группа крови первого?
7. В медико-генетическую консультацию обратилась беременная, которая сообщила, что ее сестра больна фенилкетонурией, сама наследственные заболевания отрицает. Супруг здоров. В его роду были браки между близкими родственниками, но случаев фенилкетонурии не отмечалось.
Какова вероятность появления фенилкетонурии у ребенка? Имеет ли значение вероятный пол ребенка? Можно ли лечить эту болезнь после ее появления?
Глава 4
ПАТОЛОГИЯ КЛЕТКИ
Клетка – структурная и функциональная единица всех живых организмов. В клетке сосредоточено уникальное свойство живого – способность размножаться, видоизменяться и реагировать на изменения окружающей среды. Эукариотическая клетка состоит из трех основных компонентов: плазматической мембраны, ядра, цитоплазмы. Главной функцией клетки является осуществление обмена со средой веществом, энергией и информацией, что подчинено в конечном счете задаче сохранения клетки как целого при изменении условий существования (рис. 4.1 на с. 52).
Органоиды клетки, обладая определенными морфологическими особенностями, обеспечивают основные проявления жизнедеятельности клетки. С ними связаны дыхание и энергетические запасы (митохондрии), синтез белков (рибосомы, шероховатая эндоплазматическая сеть), накопление и транспорт липидов и гликогена, обезвреживание токсинов (гладкая эндоплазматическая сеть), синтез продуктов и их выделение из клетки (комплекс Гольджи), внутриклеточное пищеварение и защитная функция (лизосомы). Важно подчеркнуть, что функции субклеточных органелл не строго разграничены, поэтому они могут участвовать в разных внутриклеточных процессах.
Все перечисленное делает познание основ патологии клетки абсолютно необходимым для понимания закономерностей развития патологии на уровне тканей, органов и систем, болезни в целом – на уровне организма человека.
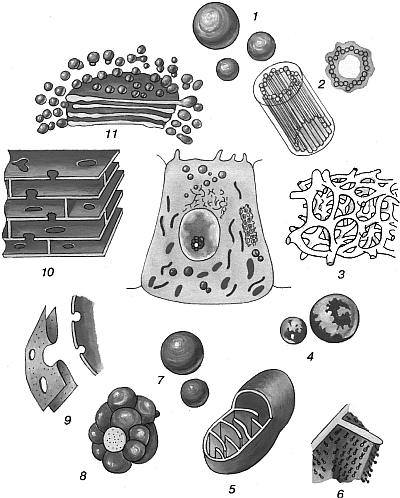 Рис. 4.1. Общее строение эукариотической клетки и ее основных органелл [Fuller G. M., Shields D., 2003]:
Рис. 4.1. Общее строение эукариотической клетки и ее основных органелл [Fuller G. M., Shields D., 2003]:
1 – секреторные гранулы (накопление продуктов секреции); 2 – центриоли (центр полимеризации микротрубочек); 3 – гладкая эндоплазматическая сеть (детоксикация и синтез стероидов); 4 – лизосомы (внутриклеточное переваривание); 5 – митохондрия (синтез АТФ и стероидов); 6 – сферические единицы (превращение энергии); 7 – липидные капельки (накопление); 8 – ядрышко (синтез рРНК); 9 – ядерная оболочка (разделение хроматина и цитоплазмы); 10 – шероховатая эндоплазматическая сеть (синтез и сегрегация белков, посттрансляционные изменения); 11 – комплекс Гольджи (конечные посттрансляционные изменения, упаковка и транспорт)
Органоиды клетки, обладая определенными морфологическими особенностями, обеспечивают основные проявления жизнедеятельности клетки. С ними связаны дыхание и энергетические запасы (митохондрии), синтез белков (рибосомы, шероховатая эндоплазматическая сеть), накопление и транспорт липидов и гликогена, обезвреживание токсинов (гладкая эндоплазматическая сеть), синтез продуктов и их выделение из клетки (комплекс Гольджи), внутриклеточное пищеварение и защитная функция (лизосомы). Важно подчеркнуть, что функции субклеточных органелл не строго разграничены, поэтому они могут участвовать в разных внутриклеточных процессах.
Все перечисленное делает познание основ патологии клетки абсолютно необходимым для понимания закономерностей развития патологии на уровне тканей, органов и систем, болезни в целом – на уровне организма человека.

1 – секреторные гранулы (накопление продуктов секреции); 2 – центриоли (центр полимеризации микротрубочек); 3 – гладкая эндоплазматическая сеть (детоксикация и синтез стероидов); 4 – лизосомы (внутриклеточное переваривание); 5 – митохондрия (синтез АТФ и стероидов); 6 – сферические единицы (превращение энергии); 7 – липидные капельки (накопление); 8 – ядрышко (синтез рРНК); 9 – ядерная оболочка (разделение хроматина и цитоплазмы); 10 – шероховатая эндоплазматическая сеть (синтез и сегрегация белков, посттрансляционные изменения); 11 – комплекс Гольджи (конечные посттрансляционные изменения, упаковка и транспорт)
4.1. ПОВРЕЖДЕНИЕ КЛЕТКИ: ПРИЧИНЫ И ОБЩИЕ МЕХАНИЗМЫ
Повреждение – процесс, проявляющийся нарушением структурной и функциональной организации живой системы, вызванный различными причинами. В наиболее общем смысле повреждение на любом уровне представляет собой такое изменение структуры и функции, которое не способствует, а мешает жизни и существованию организма в окружающей среде. Повреждение является начальным моментом в развитии патологии, внутренней стороной взаимодействия причинного фактора с организмом. В этом смысле термины «этиологический фактор», «болезнетворный фактор» и «повреждающий фактор» являются синонимами.
Любое повреждение проявляется на различных уровнях:
• молекулярном (повреждение клеточных рецепторов, молекул ферментов, нуклеиновых кислот вплоть до их дезинтеграции);
• субклеточном – ультраструктурном (повреждение митохондрий, эндоплазматической сети, мембран и других ультраструктур вплоть до их деструкции);
• клеточном (различные дистрофии из-за нарушения разных видов обмена с возможным развитием некроза по типу рексиса или лизиса клетки);
• тканевом и органном (дистрофические изменения в большинстве клеток и строме с возможным развитием некроза (по типу инфаркта, секвестра и др.);
• организменном (болезнь с возможным смертельным исходом).
Иногда дополнительно выделяют уровень тканевых комплексов, или гистионов, включающих в свой состав сосуды микроциркуляторного русла (артериола, капилляры, венула) и питаемые ими клетки паренхимы, соединительную ткань и терминальные нервные окончания. Морфологически повреждение может быть представлено двумя патологическими процессами: дистрофией и некрозом, которые нередко являются последовательными стадиями (рис. 4.2).
Причины повреждения клетки. Вовлечение клеток во все патологические процессы, происходящие в организме, объясняет и универсальность причин, вызывающих повреждение клеток, которые соответствуют по структуре классификации этиологических факторов болезни вообще (табл. 4.1).
 Рис. 4.2. Обратимые и необратимые клеточные повреждения [Cortran R.S. et al. 2000]:
Рис. 4.2. Обратимые и необратимые клеточные повреждения [Cortran R.S. et al. 2000]:
А – нормальная клетка: 1 – ядро; 2 – лизосома; 3 – эндоплазмолитическая сеть; 4 – митохондрии.
Б – обратимое повреждение: 1 – объединение внутримембранных частиц;
2 – разбухание эдоплазматической сети;
3 – дисперсия рибосом; 4 – разбухание митохондрий; 5 – уменьшение плотности митохондрий; 6 – самопереваривание лизосом; 7 – агрегация ядерного хроматина; 8 – выпячивание.
В – необратимые повреждения: 1 – миелиновые тельца; 2 – лизис эндоплазматической сети; 3 – дефект клеточной мембраны; 4 – большая разряженность митохондрий; 5 – пикноз ядра; 6 – разрыв лизосом и аутолиз
Причиной повреждения клетки может стать фактор как экзогенной, так и эндогенной природы. Применительно к клетке наиболее важные механические и физические агенты (механическая травма, колебания температуры окружающей среды и атмосферного давления, радиация, электрический ток, электромагнитные волны); химические агенты (изменение pH, снижение содержания кислорода, соли тяжелых металлов, органические растворители и др.); всевозможные инфекционные агенты; иммунные реакции, генетические нарушения, дисбаланс питания.
Таблица 4.1
Этиологические факторы повреждения клетки

Психогенные факторы повреждения для организма на уровне клеток воспринимаются через вторичные воздействия, которые являются физическими или химическими по своей природе. Например, при эмоциональном стрессе повреждение миокарда объясняется воздействием адреналина и изменением электрической активности симпатических волокон автономной нервной системы.
Общий патогенез клеточного повреждения. С точки зрения развития процессов в самой общей форме повреждения клетки могут проявляться нарушениями клеточного обмена веществ, развитием дистрофии, парабиоза и, наконец, некроза, когда клетка погибает.
Повреждения клетки могут быть обратимыми и необратимыми. Например, обратимым является повреждение лизосом в клетках эпителия кишечника под влиянием эндотоксина микроорганизмов кишечной группы. После прекращения интоксикации лизосомы в поврежденной клетке восстанавливаются. В случае повреждения клеток энтеровирусом повреждение выражается дегрануляцией лизосом, которую может вызвать, например, любая вирусная инфекция.
По своему течению повреждения могут быть острыми и хроническими. Функциональные проявления острого повреждения клетки делятся на преддепрессионную гиперактивность, парциальный некроз и тотальное повреждение (клеточный некроз).
Первое и наиболее общее неспецифическое выражение повреждения клетки при действии любого агента – это нарушение состояния неустойчивого равновесия клетки и среды, являющегося общей характеристикой всего живого, независимо от уровня его организации.
Преддепрессионная гиперактивность (по Ф. З. Меерсону) возникает вследствие обратимого повреждения клетки умеренными воздействиями патогенных факторов. В результате в мембране клетки происходят неспецифическое возбуждение и усиление деятельности органелл, в первую очередь митохондрий. Это приводит к усилению окисления субстратов и синтеза АТФ, сопровождается повышением резистентности клетки к патологическому фактору. Если воздействие этого фактора ограничено, может произойти ликвидация повреждения с последующим восстановлением первоначальной структуры и функции. Считают, что после такого воздействия в генетическом аппарате клетки сохраняется информация о происшедшем воздействии, так что в дальнейшем при повторном действии этого же фактора приспособление клетки значительно облегчается.
В случае парциального некроза поврежденная часть клетки отделяется от функционирующей части вновь образующейся мембраной и уничтожается фагоцитами. После этого структура и функция клетки восстанавливаются за счет гиперплазии субклеточных единиц.
Если повреждающий фактор имеет выраженную интенсивность и время действия, то происходит тотальное повреждение клетки, что приводит к прекращению функции митохондрий, нарушению клеточного транспорта и всех энергозависимых процессов. В дальнейшем происходит массивное разрушение лизосом, выход гидролитических ферментов в цитоплазму и расплавление остальных органелл, ядра и мембран. Фаза острого повреждения клетки, когда еще сохраняется небольшой градиент концентрации ионов между цитоплазмой и внеклеточной средой, называется агонией клетки. Она необратима и завершается некрозом клетки, при этом резкое увеличение проницаемости и частичное разрушение клеточных мембран способствуют доступу в клетку из окружающей среды ферментов, которые продолжают разрушение всех ее структурных элементов.
Специфическое и неспецифическое в повреждении клетки. Специфические повреждения можно усмотреть при анализе любого его вида. Например, при механической травме – это нарушение целостности структуры ткани, при аутоиммунной гемолитической анемии – изменение свойств мембраны эритроцитов под влиянием гемолизина и комплемента, при радиационном повреждении – образование свободных радикалов с последующим нарушением окислительных процессов.
Неспецифическими повреждениями клетки, т. е. мало зависящими от вида повреждающего фактора, являются следующие:
• нарушение неравновесного состояния клетки и внешней среды;
• нарушение структуры и функции мембран: проницаемости и мембранного транспорта, мембранного электрического потенциала, рецепторного аппарата, формы клеток;
• нарушение обмена и электролитного состава клетки и ее отдельных частей;
• нарушение активности ферментных систем клетки (вплоть до ферментативного разрушения клетки);
• уменьшение объема и интенсивности биологического окисления;
• нарушение хранения и передачи генетической информации;
• снижение специфической функции (для специализированных клеток).
Повреждение специфических функций, нужных для организма в целом, прямо не отражается на судьбе клеток, но определяет суть изменений в органах и системах, поэтому рассматривается в курсе частной патологии.
Большинство повреждений на субклеточном уровне имеет неспецифический характер и не зависит от вида повреждающих факторов. Так, например, в миокарде при острой ишемии, воздействии адреналина, отравлении морфином, разлитом гнойном перитоните, облучении наблюдаются аналогичные изменения поврежденных клеток в виде набухания митохондрий и разрушения их мембран, вакуолизации эндоплазматической сети, очаговой деструкции миофибрилл и появления избыточного количества липидных включений. Такие идентичные изменения структур под влиянием различных факторов называются стереотипными.
При одинаковом воздействии на весь орган какого-либо повреждающего фактора обычно проявляется весь спектр возможных состояний клетки от практически нормального и даже усиленно функционирующего до гибели (некроза). Это явление называется мозаичностью. Например, при действии вируса ветряной оспы на клетки кожи некрозы развиваются в виде мелких очагов, образуя характерную сыпь в виде пузырьков (везикул).
Повреждения на клеточном уровне иногда могут иметь специфический характер. Специфические изменения обусловлены внутриклеточной репликацией вируса (с появлением в ядре или цитоплазме включений, представляющих собой или скопления вирусных частиц, или реактивные изменения клеточного вещества в ответ на их репликацию), опухолевым метаморфозом и врожденными или приобретенными ферментопатиями, приводящими к накоплению в клетке нормальных метаболитов в избыточном количестве или аномальных в виде включений.
Любое повреждение проявляется на различных уровнях:
• молекулярном (повреждение клеточных рецепторов, молекул ферментов, нуклеиновых кислот вплоть до их дезинтеграции);
• субклеточном – ультраструктурном (повреждение митохондрий, эндоплазматической сети, мембран и других ультраструктур вплоть до их деструкции);
• клеточном (различные дистрофии из-за нарушения разных видов обмена с возможным развитием некроза по типу рексиса или лизиса клетки);
• тканевом и органном (дистрофические изменения в большинстве клеток и строме с возможным развитием некроза (по типу инфаркта, секвестра и др.);
• организменном (болезнь с возможным смертельным исходом).
Иногда дополнительно выделяют уровень тканевых комплексов, или гистионов, включающих в свой состав сосуды микроциркуляторного русла (артериола, капилляры, венула) и питаемые ими клетки паренхимы, соединительную ткань и терминальные нервные окончания. Морфологически повреждение может быть представлено двумя патологическими процессами: дистрофией и некрозом, которые нередко являются последовательными стадиями (рис. 4.2).
Причины повреждения клетки. Вовлечение клеток во все патологические процессы, происходящие в организме, объясняет и универсальность причин, вызывающих повреждение клеток, которые соответствуют по структуре классификации этиологических факторов болезни вообще (табл. 4.1).

А – нормальная клетка: 1 – ядро; 2 – лизосома; 3 – эндоплазмолитическая сеть; 4 – митохондрии.
Б – обратимое повреждение: 1 – объединение внутримембранных частиц;
2 – разбухание эдоплазматической сети;
3 – дисперсия рибосом; 4 – разбухание митохондрий; 5 – уменьшение плотности митохондрий; 6 – самопереваривание лизосом; 7 – агрегация ядерного хроматина; 8 – выпячивание.
В – необратимые повреждения: 1 – миелиновые тельца; 2 – лизис эндоплазматической сети; 3 – дефект клеточной мембраны; 4 – большая разряженность митохондрий; 5 – пикноз ядра; 6 – разрыв лизосом и аутолиз
Причиной повреждения клетки может стать фактор как экзогенной, так и эндогенной природы. Применительно к клетке наиболее важные механические и физические агенты (механическая травма, колебания температуры окружающей среды и атмосферного давления, радиация, электрический ток, электромагнитные волны); химические агенты (изменение pH, снижение содержания кислорода, соли тяжелых металлов, органические растворители и др.); всевозможные инфекционные агенты; иммунные реакции, генетические нарушения, дисбаланс питания.
Таблица 4.1
Этиологические факторы повреждения клетки

Психогенные факторы повреждения для организма на уровне клеток воспринимаются через вторичные воздействия, которые являются физическими или химическими по своей природе. Например, при эмоциональном стрессе повреждение миокарда объясняется воздействием адреналина и изменением электрической активности симпатических волокон автономной нервной системы.
Общий патогенез клеточного повреждения. С точки зрения развития процессов в самой общей форме повреждения клетки могут проявляться нарушениями клеточного обмена веществ, развитием дистрофии, парабиоза и, наконец, некроза, когда клетка погибает.
Повреждения клетки могут быть обратимыми и необратимыми. Например, обратимым является повреждение лизосом в клетках эпителия кишечника под влиянием эндотоксина микроорганизмов кишечной группы. После прекращения интоксикации лизосомы в поврежденной клетке восстанавливаются. В случае повреждения клеток энтеровирусом повреждение выражается дегрануляцией лизосом, которую может вызвать, например, любая вирусная инфекция.
По своему течению повреждения могут быть острыми и хроническими. Функциональные проявления острого повреждения клетки делятся на преддепрессионную гиперактивность, парциальный некроз и тотальное повреждение (клеточный некроз).
Первое и наиболее общее неспецифическое выражение повреждения клетки при действии любого агента – это нарушение состояния неустойчивого равновесия клетки и среды, являющегося общей характеристикой всего живого, независимо от уровня его организации.
Преддепрессионная гиперактивность (по Ф. З. Меерсону) возникает вследствие обратимого повреждения клетки умеренными воздействиями патогенных факторов. В результате в мембране клетки происходят неспецифическое возбуждение и усиление деятельности органелл, в первую очередь митохондрий. Это приводит к усилению окисления субстратов и синтеза АТФ, сопровождается повышением резистентности клетки к патологическому фактору. Если воздействие этого фактора ограничено, может произойти ликвидация повреждения с последующим восстановлением первоначальной структуры и функции. Считают, что после такого воздействия в генетическом аппарате клетки сохраняется информация о происшедшем воздействии, так что в дальнейшем при повторном действии этого же фактора приспособление клетки значительно облегчается.
В случае парциального некроза поврежденная часть клетки отделяется от функционирующей части вновь образующейся мембраной и уничтожается фагоцитами. После этого структура и функция клетки восстанавливаются за счет гиперплазии субклеточных единиц.
Если повреждающий фактор имеет выраженную интенсивность и время действия, то происходит тотальное повреждение клетки, что приводит к прекращению функции митохондрий, нарушению клеточного транспорта и всех энергозависимых процессов. В дальнейшем происходит массивное разрушение лизосом, выход гидролитических ферментов в цитоплазму и расплавление остальных органелл, ядра и мембран. Фаза острого повреждения клетки, когда еще сохраняется небольшой градиент концентрации ионов между цитоплазмой и внеклеточной средой, называется агонией клетки. Она необратима и завершается некрозом клетки, при этом резкое увеличение проницаемости и частичное разрушение клеточных мембран способствуют доступу в клетку из окружающей среды ферментов, которые продолжают разрушение всех ее структурных элементов.
Специфическое и неспецифическое в повреждении клетки. Специфические повреждения можно усмотреть при анализе любого его вида. Например, при механической травме – это нарушение целостности структуры ткани, при аутоиммунной гемолитической анемии – изменение свойств мембраны эритроцитов под влиянием гемолизина и комплемента, при радиационном повреждении – образование свободных радикалов с последующим нарушением окислительных процессов.
Неспецифическими повреждениями клетки, т. е. мало зависящими от вида повреждающего фактора, являются следующие:
• нарушение неравновесного состояния клетки и внешней среды;
• нарушение структуры и функции мембран: проницаемости и мембранного транспорта, мембранного электрического потенциала, рецепторного аппарата, формы клеток;
• нарушение обмена и электролитного состава клетки и ее отдельных частей;
• нарушение активности ферментных систем клетки (вплоть до ферментативного разрушения клетки);
• уменьшение объема и интенсивности биологического окисления;
• нарушение хранения и передачи генетической информации;
• снижение специфической функции (для специализированных клеток).
Повреждение специфических функций, нужных для организма в целом, прямо не отражается на судьбе клеток, но определяет суть изменений в органах и системах, поэтому рассматривается в курсе частной патологии.
Большинство повреждений на субклеточном уровне имеет неспецифический характер и не зависит от вида повреждающих факторов. Так, например, в миокарде при острой ишемии, воздействии адреналина, отравлении морфином, разлитом гнойном перитоните, облучении наблюдаются аналогичные изменения поврежденных клеток в виде набухания митохондрий и разрушения их мембран, вакуолизации эндоплазматической сети, очаговой деструкции миофибрилл и появления избыточного количества липидных включений. Такие идентичные изменения структур под влиянием различных факторов называются стереотипными.
При одинаковом воздействии на весь орган какого-либо повреждающего фактора обычно проявляется весь спектр возможных состояний клетки от практически нормального и даже усиленно функционирующего до гибели (некроза). Это явление называется мозаичностью. Например, при действии вируса ветряной оспы на клетки кожи некрозы развиваются в виде мелких очагов, образуя характерную сыпь в виде пузырьков (везикул).
Повреждения на клеточном уровне иногда могут иметь специфический характер. Специфические изменения обусловлены внутриклеточной репликацией вируса (с появлением в ядре или цитоплазме включений, представляющих собой или скопления вирусных частиц, или реактивные изменения клеточного вещества в ответ на их репликацию), опухолевым метаморфозом и врожденными или приобретенными ферментопатиями, приводящими к накоплению в клетке нормальных метаболитов в избыточном количестве или аномальных в виде включений.
4.2. ПАТОЛОГИЯ КЛЕТОЧНЫХ МЕМБРАН
Основной структурной частью мембраны является липидный бислой, состоящий из фосфолипидов и холестерина с включенными в него молекулами разных белков. Снаружи клеточная мембрана покрыта слоем гликопротеидов. К функциям мембраны клетки относятся избирательная проницаемость, реакции межклеточных взаимодействий, поглощение и выделение специфических веществ (рецепция и секреция). Плазматическая мембрана – место приложения физических, химических, механических раздражителей внешней среды и сигналов информационного характера из внутренней среды организма. Информационная функция обеспечивается рецепторами мембраны, защитная – самой мембраной, контактная – клеточными стыками (рис. 4.3).
Способность формировать мембраны является решающей в образовании клетки и ее субклеточных органелл. Любое нарушение сопровождается изменением проницаемости клеточных мембран и состояния цитоплазмы поврежденной клетки. Повреждение клеточных мембран может быть обусловлено деструкцией их липидных или белковых (ферментных и рецепторных) компонентов.
К патологии клетки могут вести нарушения следующих функций мембран: мембранного транспорта, проницаемости мембран, коммуникации клеток и их «узнавания», подвижности мембран и формы клеток, синтеза и обмена мембран (схема 4.1).
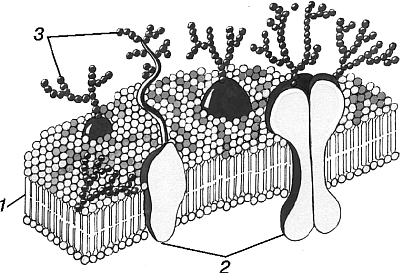 Рис. 4.3. Структура мембраны клетки (схема):
Рис. 4.3. Структура мембраны клетки (схема):
1 –двойной слой фосфолипидов; 2 – мембраные белки; 3 – полисахаридные цепи
Схема 4.1. Общие механизмы повреждения мембран клеток [Литвицкий П. Ф. , 1995]
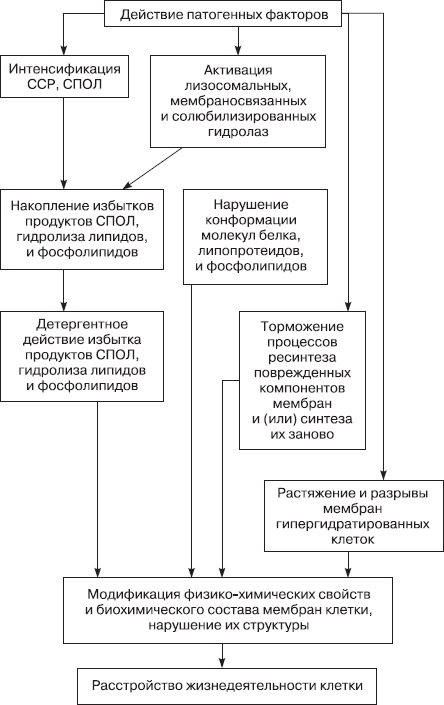
Повреждение липидных компонентов клеточных и субклеточных мембран возникает несколькими путями. Важнейшими из них являются перекисное окисление липидов, активация мембранных фосфолипаз, осмотическое растяжение белковой основы мембран, повреждающее воздействие иммунных комплексов.
Мембранный транспорт предполагает перенос ионов и других субстратов против избытка (градиента) их концентрации. При этом нарушаются функция клеточных насосов и процессы регуляции обмена веществ между клеткой и окружающей ее средой.
Энергетической основой работы клеточных насосов являются процессы, зависящие от энергии АТФ. Эти ферменты «вмонтированы» в белковую часть клеточных мембран. В зависимости от вида проходящих по каналу ионов различают Na – K-АТФазу, Ca – Mg-АТФазу, Н – АТФазу и др. Особое значение имеет работа первого насоса, результатом которой является превышение концентрации К+ внутри клетки приблизительно в 20–30 раз по сравнению с внеклеточной. Соответственно этому концентрация Na+ внутри клетки приблизительно в 10 раз меньше, чем снаружи.
Повреждение Na – K-насоса вызывает освобождение К+ из клетки и накопление в ней Na+, что характерно для гипоксии, инфекционных поражений, аллергии, снижения температуры тела и многих других патологических состояний. С транспортом Na+ и К+ тесно связан транспорт Ca2+. Интегральное выражение этих нарушений хорошо иллюстрируется на примере гипоксии миокарда, которая проявляется прежде всего патологией митохондрий.
Известно участие Са2+ в освобождении медиаторов аллергии из лабиринтов (тучных клеток). По современным данным, их аллергическая травма сопровождается разжижением мембраны, разрыхлением и увеличением проводимости кальциевых каналов. Ионы кальция, проникая в большом количестве внутрь клетки, способствуют освобождению гистамина и других медиаторов из гранул.
Морфологически нарушение проницаемости плазматической мембраны проявляется усиленным образованием ультрамикроскопических пузырьков, что приводит к дефициту поверхности или, напротив, увеличению поверхности за счет мембран микропиноцитозных пузырьков. В отдельных случаях выявляются утолщение и извитость участков мембраны, отделение части цитоплазмы, окруженной мембраной, от клетки. Это свидетельствует об активизации цитоплазматической мембраны. Другим наблюдаемым при электронной микроскопии признаком повреждения мембраны является образование крупных микропор – «брешей», что ведет к набуханию клетки, перерастяжению и разрыву клеточных мембран.
С формой и подвижностью мембраны непосредственно связаны изменения формы и подвижности клетки в целом, хотя при патологии обычно происходит упрощение формы клеточной поверхности (например, потеря микроворсинок энтероцитами).
Отдельного внимания заслуживает патология, развивающаяся при повреждении межклеточных взаимодействий. Поверхность мембраны клетки содержит множество рецепторов, воспринимающих различные раздражители. Рецепторы представлены сложными белками (гликопротеидами), способными свободно перемещаться как по поверхности клеточной мембраны, так и внутри ее. Механизм рецепции является энергозависимым, поскольку для передачи сигнала с поверхности внутрь клетки требуется АТФ. Особый интерес представляют рецепторы, одновременно являющиеся поверхностными антигенами-маркерами определенных типов клеток.
При разных патологических процессах (воспаление, регенерация, опухолевый рост) могут изменяться поверхностные антигены, причем различия могут касаться как типа антигена, так и его доступности со стороны внеклеточного пространства. Например, повреждения гликолипидов мембраны делают ее более доступной воздействию антител.
Патология клеточной рецепции ведет к нарушению восприятия информации. Например, наследственное отсутствие апо-Е– и апо-В-рецепторов у клеток печени и жировой клетчатки ведет к развитию семейных типов ожирения и гиперлипопротеинемии. Аналогичные дефекты выявлены при некоторых формах сахарного диабета.
Межклеточное взаимодействие и кооперация клеток определяются состоянием клеточных стыков, которые могут повреждаться при различных патологических состояниях и болезнях. Клеточные стыки выполняют три главные функции: межклеточную адгезию, «тесное общение» клеток и герметизацию слоя эпителиальных клеток. Межклеточная адгезия ослабевает при опухолевом росте уже на ранних этапах онкогенеза и является одним из критериев роста опухоли. «Тесное общение» заключается в прямом обмене клеток через щелевидные стыки информационными молекулами. Дефекты «тесного общения» играют значительную роль в поведении и возникновении злокачественных опухолей. Нарушения межмембранных связей клеток тканевых барьеров (кровь – мозг, кровь – легкие, кровь – желчь, кровь – почки) ведут к увеличению проницаемости плотных стыков клеток и повышенной проницаемости барьеров.
Способность формировать мембраны является решающей в образовании клетки и ее субклеточных органелл. Любое нарушение сопровождается изменением проницаемости клеточных мембран и состояния цитоплазмы поврежденной клетки. Повреждение клеточных мембран может быть обусловлено деструкцией их липидных или белковых (ферментных и рецепторных) компонентов.
К патологии клетки могут вести нарушения следующих функций мембран: мембранного транспорта, проницаемости мембран, коммуникации клеток и их «узнавания», подвижности мембран и формы клеток, синтеза и обмена мембран (схема 4.1).

1 –двойной слой фосфолипидов; 2 – мембраные белки; 3 – полисахаридные цепи
Схема 4.1. Общие механизмы повреждения мембран клеток [Литвицкий П. Ф. , 1995]

Повреждение липидных компонентов клеточных и субклеточных мембран возникает несколькими путями. Важнейшими из них являются перекисное окисление липидов, активация мембранных фосфолипаз, осмотическое растяжение белковой основы мембран, повреждающее воздействие иммунных комплексов.
Мембранный транспорт предполагает перенос ионов и других субстратов против избытка (градиента) их концентрации. При этом нарушаются функция клеточных насосов и процессы регуляции обмена веществ между клеткой и окружающей ее средой.
Энергетической основой работы клеточных насосов являются процессы, зависящие от энергии АТФ. Эти ферменты «вмонтированы» в белковую часть клеточных мембран. В зависимости от вида проходящих по каналу ионов различают Na – K-АТФазу, Ca – Mg-АТФазу, Н – АТФазу и др. Особое значение имеет работа первого насоса, результатом которой является превышение концентрации К+ внутри клетки приблизительно в 20–30 раз по сравнению с внеклеточной. Соответственно этому концентрация Na+ внутри клетки приблизительно в 10 раз меньше, чем снаружи.
Повреждение Na – K-насоса вызывает освобождение К+ из клетки и накопление в ней Na+, что характерно для гипоксии, инфекционных поражений, аллергии, снижения температуры тела и многих других патологических состояний. С транспортом Na+ и К+ тесно связан транспорт Ca2+. Интегральное выражение этих нарушений хорошо иллюстрируется на примере гипоксии миокарда, которая проявляется прежде всего патологией митохондрий.
Известно участие Са2+ в освобождении медиаторов аллергии из лабиринтов (тучных клеток). По современным данным, их аллергическая травма сопровождается разжижением мембраны, разрыхлением и увеличением проводимости кальциевых каналов. Ионы кальция, проникая в большом количестве внутрь клетки, способствуют освобождению гистамина и других медиаторов из гранул.
Морфологически нарушение проницаемости плазматической мембраны проявляется усиленным образованием ультрамикроскопических пузырьков, что приводит к дефициту поверхности или, напротив, увеличению поверхности за счет мембран микропиноцитозных пузырьков. В отдельных случаях выявляются утолщение и извитость участков мембраны, отделение части цитоплазмы, окруженной мембраной, от клетки. Это свидетельствует об активизации цитоплазматической мембраны. Другим наблюдаемым при электронной микроскопии признаком повреждения мембраны является образование крупных микропор – «брешей», что ведет к набуханию клетки, перерастяжению и разрыву клеточных мембран.
С формой и подвижностью мембраны непосредственно связаны изменения формы и подвижности клетки в целом, хотя при патологии обычно происходит упрощение формы клеточной поверхности (например, потеря микроворсинок энтероцитами).
Отдельного внимания заслуживает патология, развивающаяся при повреждении межклеточных взаимодействий. Поверхность мембраны клетки содержит множество рецепторов, воспринимающих различные раздражители. Рецепторы представлены сложными белками (гликопротеидами), способными свободно перемещаться как по поверхности клеточной мембраны, так и внутри ее. Механизм рецепции является энергозависимым, поскольку для передачи сигнала с поверхности внутрь клетки требуется АТФ. Особый интерес представляют рецепторы, одновременно являющиеся поверхностными антигенами-маркерами определенных типов клеток.
При разных патологических процессах (воспаление, регенерация, опухолевый рост) могут изменяться поверхностные антигены, причем различия могут касаться как типа антигена, так и его доступности со стороны внеклеточного пространства. Например, повреждения гликолипидов мембраны делают ее более доступной воздействию антител.
Патология клеточной рецепции ведет к нарушению восприятия информации. Например, наследственное отсутствие апо-Е– и апо-В-рецепторов у клеток печени и жировой клетчатки ведет к развитию семейных типов ожирения и гиперлипопротеинемии. Аналогичные дефекты выявлены при некоторых формах сахарного диабета.
Межклеточное взаимодействие и кооперация клеток определяются состоянием клеточных стыков, которые могут повреждаться при различных патологических состояниях и болезнях. Клеточные стыки выполняют три главные функции: межклеточную адгезию, «тесное общение» клеток и герметизацию слоя эпителиальных клеток. Межклеточная адгезия ослабевает при опухолевом росте уже на ранних этапах онкогенеза и является одним из критериев роста опухоли. «Тесное общение» заключается в прямом обмене клеток через щелевидные стыки информационными молекулами. Дефекты «тесного общения» играют значительную роль в поведении и возникновении злокачественных опухолей. Нарушения межмембранных связей клеток тканевых барьеров (кровь – мозг, кровь – легкие, кровь – желчь, кровь – почки) ведут к увеличению проницаемости плотных стыков клеток и повышенной проницаемости барьеров.
4.3. ПАТОЛОГИЯ КЛЕТОЧНОГО ЯДРА
Ядро обеспечивает координацию работы клетки в интерфазу, хранение генетической информации, передачу генетического материала при клеточном делении. В ядре происходят репликация ДНК и транскрипция РНК. При повреждении могут наблюдаться отек ядра, его сморщивание (пикноз), разрыв и разрушение (кариорексис и кариолизис). Ультрамикроскопическое исследование позволяет различить несколько типовых нарушений ядра и генетического аппарата клетки.
1. Изменение структуры и размеров ядра зависит от содержания в нем ДНК. В нормальном интерфазном ядре содержится диплоидный (2n) набор хромосом. Если после окончания синтеза ДНК не происходит митоза, появляется полиплоидия – кратное увеличение набора ДНК. Полиплоидия может встречаться в нормально функционирующих клетках печени, почек, в миокарде; она особенно ярко выражена в тканях при регенерации и опухолевом росте, причем чем более злокачественна опухоль, тем более выражена гетероплоидия. Анеуплоидия – изменение в виде неполного набора хромосом – связана с хромосомными мутациями. Ее проявления встречаются в большом количестве в злокачественных опухолях.
Вещество ДНК в ядре распределено неравномерно. В наружных отделах ядер находят конденсированный хроматин (гетерохроматин), который считается неактивным, а в остальных отделах – неконденсированный (эухроматин), активный. Конденсация хроматина в ядре рассматривается как признак метаболической депрессии и предвестник гибели клетки. К патологическим изменениям ядра относят также его токсическое набухание. Уменьшение размеров ядра характерно для снижении обмена веществ в клетке и сопутствует ее атрофии.
2. Изменение формы ядра может вызываться цитоплазматическими включениями (перстневидные клетки при слизьобразующем раке, ожиревшие гепатоциты), образованием множественных выпячиваний ядра в цитоплазму вследствие повышения синтетической активности ядра (полиморфизм ядер при воспалении, опухолевом росте). Как крайний вариант в ядре могут встречаться включения (цитоплазматические или вирусные).
3. Изменение количества ядер проявляется многоядерностью в гигантских клетках при воспалении (клетки Пирогова–Лангханса при туберкулезе), опухолях (клетки Штернберга–Березовского при лимфогранулематозе). Безъядерность может наблюдаться в нормальных клетках (эритроциты, тромбоциты), в жизнеспособных фрагментах опухолевых клеток и как свидетельство гибели клеток (кариолизис).
4. Изменение структуры и размеров ядрышек заключается в их увеличении и повышении плотности (соответствует повышению функциональной активности) или дезорганизации (встречается при энергодефиците в клетке и сопровождается патологией митозов).
5. Изменение ядерной оболочки (двойной мембраны) состоит в нарушениях связи ее с эндоплазматической сетью, выпячивании и искривлении обеих мембран, изменении количества и размеров пор, появлению включений в межмембранном пространстве. Данные изменения свидетельствуют о вовлеченности ядра в повреждение клетки и характерны для интоксикации, вирусных инфекций, радиационных повреждений, опухолевого перерождения клетки.
6. Процессы клеточного деления (митоза) могут нарушаться при различных воздействиях, при этом может страдать любое из его звеньев. Наибольшую известность получила классификация патологии митозов, предложенная И.А. Аловым (1972):
I тип – повреждение хромосом (задержка деления в профазе);
II тип – повреждение митотического аппарата (задержка в метафазе);
III тип – нарушение цитотомии (задержка в телофазе).
Можно считать установленным, что задержка вступления клеток в митоз возникает в основном в связи с нарушением их метаболизма, в частности синтеза нуклеиновых кислот и белков, а нарушение хромосом при репродукции клетки, обнаруживаемое в условиях патологии, – вследствие разрыва цепей ДНК и расстройства репродукции ДНК хромосом.
Особенности реакции клетки на повреждающий фактор зависят как от его характеристики, так и от типа клетки по ее способности к делению, обеспечивающей возможность рекомпенсации. Считают, что в организме имеется три категории специализированных клеток по их способности к делению.
Клетки I категории с самого рождения организма достигают высокоспециализированного состояния структур за счет минимизации функций. В организме отсутствует источник возобновления этих клеток в случае их дисфункции. К таким клеткам относятся нейроны. Клетки I категории способны к внутриклеточной регенерации, в результате которой восстанавливаются утраченные части клеток, если сохранены ядерный аппарат и трофическое обеспечение.
Клетки II категории – это высокоспециализированные клетки, выполняющие какие-либо определенные функции и затем либо «изнашивающиеся», либо слущивающиеся с различных поверхностей, причем иногда очень быстро. Подобно клеткам I категории, они не способны размножаться, однако в организме имеется механизм для их непрерывного воспроизводства. Такие клеточные популяции называют обновляющимися, а состояние, в котором они находятся, – стационарным. К таким клеткам относятся, например, клетки, выстилающие большую часть кишечника.
1. Изменение структуры и размеров ядра зависит от содержания в нем ДНК. В нормальном интерфазном ядре содержится диплоидный (2n) набор хромосом. Если после окончания синтеза ДНК не происходит митоза, появляется полиплоидия – кратное увеличение набора ДНК. Полиплоидия может встречаться в нормально функционирующих клетках печени, почек, в миокарде; она особенно ярко выражена в тканях при регенерации и опухолевом росте, причем чем более злокачественна опухоль, тем более выражена гетероплоидия. Анеуплоидия – изменение в виде неполного набора хромосом – связана с хромосомными мутациями. Ее проявления встречаются в большом количестве в злокачественных опухолях.
Вещество ДНК в ядре распределено неравномерно. В наружных отделах ядер находят конденсированный хроматин (гетерохроматин), который считается неактивным, а в остальных отделах – неконденсированный (эухроматин), активный. Конденсация хроматина в ядре рассматривается как признак метаболической депрессии и предвестник гибели клетки. К патологическим изменениям ядра относят также его токсическое набухание. Уменьшение размеров ядра характерно для снижении обмена веществ в клетке и сопутствует ее атрофии.
2. Изменение формы ядра может вызываться цитоплазматическими включениями (перстневидные клетки при слизьобразующем раке, ожиревшие гепатоциты), образованием множественных выпячиваний ядра в цитоплазму вследствие повышения синтетической активности ядра (полиморфизм ядер при воспалении, опухолевом росте). Как крайний вариант в ядре могут встречаться включения (цитоплазматические или вирусные).
3. Изменение количества ядер проявляется многоядерностью в гигантских клетках при воспалении (клетки Пирогова–Лангханса при туберкулезе), опухолях (клетки Штернберга–Березовского при лимфогранулематозе). Безъядерность может наблюдаться в нормальных клетках (эритроциты, тромбоциты), в жизнеспособных фрагментах опухолевых клеток и как свидетельство гибели клеток (кариолизис).
4. Изменение структуры и размеров ядрышек заключается в их увеличении и повышении плотности (соответствует повышению функциональной активности) или дезорганизации (встречается при энергодефиците в клетке и сопровождается патологией митозов).
5. Изменение ядерной оболочки (двойной мембраны) состоит в нарушениях связи ее с эндоплазматической сетью, выпячивании и искривлении обеих мембран, изменении количества и размеров пор, появлению включений в межмембранном пространстве. Данные изменения свидетельствуют о вовлеченности ядра в повреждение клетки и характерны для интоксикации, вирусных инфекций, радиационных повреждений, опухолевого перерождения клетки.
6. Процессы клеточного деления (митоза) могут нарушаться при различных воздействиях, при этом может страдать любое из его звеньев. Наибольшую известность получила классификация патологии митозов, предложенная И.А. Аловым (1972):
I тип – повреждение хромосом (задержка деления в профазе);
II тип – повреждение митотического аппарата (задержка в метафазе);
III тип – нарушение цитотомии (задержка в телофазе).
Можно считать установленным, что задержка вступления клеток в митоз возникает в основном в связи с нарушением их метаболизма, в частности синтеза нуклеиновых кислот и белков, а нарушение хромосом при репродукции клетки, обнаруживаемое в условиях патологии, – вследствие разрыва цепей ДНК и расстройства репродукции ДНК хромосом.
Особенности реакции клетки на повреждающий фактор зависят как от его характеристики, так и от типа клетки по ее способности к делению, обеспечивающей возможность рекомпенсации. Считают, что в организме имеется три категории специализированных клеток по их способности к делению.
Клетки I категории с самого рождения организма достигают высокоспециализированного состояния структур за счет минимизации функций. В организме отсутствует источник возобновления этих клеток в случае их дисфункции. К таким клеткам относятся нейроны. Клетки I категории способны к внутриклеточной регенерации, в результате которой восстанавливаются утраченные части клеток, если сохранены ядерный аппарат и трофическое обеспечение.
Клетки II категории – это высокоспециализированные клетки, выполняющие какие-либо определенные функции и затем либо «изнашивающиеся», либо слущивающиеся с различных поверхностей, причем иногда очень быстро. Подобно клеткам I категории, они не способны размножаться, однако в организме имеется механизм для их непрерывного воспроизводства. Такие клеточные популяции называют обновляющимися, а состояние, в котором они находятся, – стационарным. К таким клеткам относятся, например, клетки, выстилающие большую часть кишечника.
