Страница:
Специфические вещества, облегчающие реакцию организма на гипоксию, повышающие резистентность или ускоряющие нормализацию функций в постгипоксическом периоде, называют антигипоксантами.
Для коррекции гипоксии как процесса возможно следующее:
– применение газообразного кислорода и легкоусвояемых субстратов окисления (в том числе глюкозы);
– улучшение транспорта кислорода к тканям;
– уменьшение потребности тканей в кислороде, в том числе функциональный покой;
– защита клеток от повреждающего действия гипоксии;
– применение искусственных переносчиков электронов;
– поддержание эффективного расходования АТФ.
5.6. АДАПТАЦИЯ НА ТКАНЕВОМ УРОВНЕ
5.7. ОБЩИЙ АДАПТАЦИОННЫЙ СИНДРОМ
Задания для самопроверки знаний
Глава 6
6.1. ПРИЧИНЫ И ОБЩИЕ МЕХАНИЗМЫ НАРУШЕНИЙ МЕТАБОЛИЗМА
6.2. ПАТОЛОГИЯ БЕЛКОВОГО ОБМЕНА. БЕЛКОВЫЕ ДИСТРОФИИ
6.3. ГИПЕР-, ГИПО– И АВИТАМИНОЗЫ
Для коррекции гипоксии как процесса возможно следующее:
– применение газообразного кислорода и легкоусвояемых субстратов окисления (в том числе глюкозы);
– улучшение транспорта кислорода к тканям;
– уменьшение потребности тканей в кислороде, в том числе функциональный покой;
– защита клеток от повреждающего действия гипоксии;
– применение искусственных переносчиков электронов;
– поддержание эффективного расходования АТФ.
5.6. АДАПТАЦИЯ НА ТКАНЕВОМ УРОВНЕ
Адаптация – понятие, включающее в себя весь сложный комплекс процессов, направленных на оптимизацию взаимоотношений между организмом и внешней средой. С точки зрения патологии, адаптация может быть полной, без последующего ограничения приспособляемости организма, и неполной, с ограничением приспособительных возможностей (т. е. компенсацией).
На тканевом уровне к процессам адаптации и компенсации относят атрофию, гипертрофию, организацию и перестройку тканей, а также метаплазию и дисплазию. На системном уровне адаптация может быть представлена в виде временной (неустойчивой) адаптации и устойчивого адаптационного синдрома – стресса.
Атрофия – это уменьшение клетки, ткани или органа в объеме. Как правило, атрофия сопровождается снижением метаболизма и гипофункцией клетки, ткани или органа. Атрофия может быть физиологической (при снижении нагрузки на орган) или патологической (при действии болезнетворных факторов). Близка к физиологической старческая атрофия (половых желез, межпозвоночных дисков, кожи), развивающаяся с возрастом. В зависимости от глубины повреждения атрофия может быть обратимой или необратимой, хотя степень обратимости атрофии всегда достаточно велика. По распространенности различают общую и местную атрофию.
Общая атрофия называется кахексией и возникает при голодании (алиментарная), на поздних стадиях опухолей (раковая), при нейрогуморальном дисбалансе (церебральная и гормональная формы), хронических инфекциях.
Анатомические проявления местной атрофии: уменьшение объема и уплотнение органа, малокровие. Гистологические признаки: уменьшение размеров и количества клеток, числа сосудов, замещение паренхимы жировой и соединительной тканями. Причины местной атрофии: местный нейрогуморальный дисбаланс, физико-химические воздействия, нарушение кровообращения органа или ткани (обычно хроническая недостаточность кровоснабжения), сдавление окружающими тканями.
Гипертрофия – это увеличение клетки, ткани или органа в объеме. Она может быть физиологической (рабочей) и патологической, обычно имеет выраженный местный характер. Увеличение количества клеток в органе называется гиперплазией. Патологическая гипертрофия может быть вызвана нейрогуморальными, внешними и другими причинами. При отсутствии или гипофункции парного органа гипертрофию здорового органа называют викарной, а при заполнении органом освободившегося пространства – вакантной. Отмечают рабочую гипертрофию миокарда (рис. 5.2), скелетных мышц, стенок желудка, кишки, мочевого пузыря; викарную – легких, почки, надпочечника; нейрогуморальную – слизистой оболочки матки, молочной железы, кости (при акромегалии).
Перестройка органа или ткани заключается в появлении новых структурно-функциональных элементов. Наиболее часто перестраиваются стромальные элементы, в частности сосудистое русло (коллатеральное кровообращение) и соединительная ткань (организация и склероз).
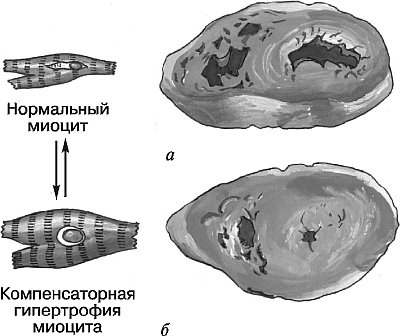 Рис. 5.2. Нормальный (а) и гипертрофированный (б) миокард
Рис. 5.2. Нормальный (а) и гипертрофированный (б) миокард
Регенерация – это восстановление структуры ткани взамен погибшей или утраченной. Выделяют виды регенерации: физиологическую, репаративную, патологическую. Основные формы регенерации зависят в первую очередь от ткани: клеточная регенерация происходит преимущественно за счет митозов, внутриклеточная – за счет восстановления поврежденных органелл и других внутриклеточных структур. Клеточная регенерация характерна для кроветворной системы, эпителия кожи, слизистых оболочек, рыхлой соединительной ткани, костей. Внутриклеточная регенерация протекает преимущественно в миокарде, скелетных мышцах, исключительно – в ганглиозных клетках центральной нервной системы (ЦНС). Обычно наблюдается смешанная (клеточная и внутриклеточная) регенерация. Она характерна для ткани легких, печени, почек, поджелудочной железы, эндокринных желез, автономной нервной системы.
Организация – это замещение участка органа или ткани соединительной тканью. Могут организовываться очаги некроза, тромбы, экссудаты, эмболы. Инородные тела, паразиты, крупные очаги некроза и хронического воспаления замещаются только по периферии, т. е. окружаются капсулой – инкапсулируются. Диффузное замещение соединительной тканью (только погибших функциональных элементов) называется склерозом. Разрастание соединительной ткани, сопровождающееся перестройкой структуры и сосудистой системы, а также иннервации органа, свидетельствует о циррозе.
Виды склероза: послевоспалительный, при диффузных заболеваниях соединительной ткани, после некроза (например, постинфарктный), после травматических дефектов (заместительный склероз, рубец), после отложения фибрина в сосудах и полостях (организация тромба, спайки).
По своему течению склероз может быть лабильным, стабильным или прогрессирующим.
На тканевом уровне к процессам адаптации и компенсации относят атрофию, гипертрофию, организацию и перестройку тканей, а также метаплазию и дисплазию. На системном уровне адаптация может быть представлена в виде временной (неустойчивой) адаптации и устойчивого адаптационного синдрома – стресса.
Атрофия – это уменьшение клетки, ткани или органа в объеме. Как правило, атрофия сопровождается снижением метаболизма и гипофункцией клетки, ткани или органа. Атрофия может быть физиологической (при снижении нагрузки на орган) или патологической (при действии болезнетворных факторов). Близка к физиологической старческая атрофия (половых желез, межпозвоночных дисков, кожи), развивающаяся с возрастом. В зависимости от глубины повреждения атрофия может быть обратимой или необратимой, хотя степень обратимости атрофии всегда достаточно велика. По распространенности различают общую и местную атрофию.
Общая атрофия называется кахексией и возникает при голодании (алиментарная), на поздних стадиях опухолей (раковая), при нейрогуморальном дисбалансе (церебральная и гормональная формы), хронических инфекциях.
Анатомические проявления местной атрофии: уменьшение объема и уплотнение органа, малокровие. Гистологические признаки: уменьшение размеров и количества клеток, числа сосудов, замещение паренхимы жировой и соединительной тканями. Причины местной атрофии: местный нейрогуморальный дисбаланс, физико-химические воздействия, нарушение кровообращения органа или ткани (обычно хроническая недостаточность кровоснабжения), сдавление окружающими тканями.
Гипертрофия – это увеличение клетки, ткани или органа в объеме. Она может быть физиологической (рабочей) и патологической, обычно имеет выраженный местный характер. Увеличение количества клеток в органе называется гиперплазией. Патологическая гипертрофия может быть вызвана нейрогуморальными, внешними и другими причинами. При отсутствии или гипофункции парного органа гипертрофию здорового органа называют викарной, а при заполнении органом освободившегося пространства – вакантной. Отмечают рабочую гипертрофию миокарда (рис. 5.2), скелетных мышц, стенок желудка, кишки, мочевого пузыря; викарную – легких, почки, надпочечника; нейрогуморальную – слизистой оболочки матки, молочной железы, кости (при акромегалии).
Перестройка органа или ткани заключается в появлении новых структурно-функциональных элементов. Наиболее часто перестраиваются стромальные элементы, в частности сосудистое русло (коллатеральное кровообращение) и соединительная ткань (организация и склероз).

Регенерация – это восстановление структуры ткани взамен погибшей или утраченной. Выделяют виды регенерации: физиологическую, репаративную, патологическую. Основные формы регенерации зависят в первую очередь от ткани: клеточная регенерация происходит преимущественно за счет митозов, внутриклеточная – за счет восстановления поврежденных органелл и других внутриклеточных структур. Клеточная регенерация характерна для кроветворной системы, эпителия кожи, слизистых оболочек, рыхлой соединительной ткани, костей. Внутриклеточная регенерация протекает преимущественно в миокарде, скелетных мышцах, исключительно – в ганглиозных клетках центральной нервной системы (ЦНС). Обычно наблюдается смешанная (клеточная и внутриклеточная) регенерация. Она характерна для ткани легких, печени, почек, поджелудочной железы, эндокринных желез, автономной нервной системы.
Организация – это замещение участка органа или ткани соединительной тканью. Могут организовываться очаги некроза, тромбы, экссудаты, эмболы. Инородные тела, паразиты, крупные очаги некроза и хронического воспаления замещаются только по периферии, т. е. окружаются капсулой – инкапсулируются. Диффузное замещение соединительной тканью (только погибших функциональных элементов) называется склерозом. Разрастание соединительной ткани, сопровождающееся перестройкой структуры и сосудистой системы, а также иннервации органа, свидетельствует о циррозе.
Виды склероза: послевоспалительный, при диффузных заболеваниях соединительной ткани, после некроза (например, постинфарктный), после травматических дефектов (заместительный склероз, рубец), после отложения фибрина в сосудах и полостях (организация тромба, спайки).
По своему течению склероз может быть лабильным, стабильным или прогрессирующим.
5.7. ОБЩИЙ АДАПТАЦИОННЫЙ СИНДРОМ
Общий адаптационный синдром, или стресс, – это универсальная неспецифическая, эволюционно закрепленная реакция на воздействие внешнего раздражителя, направленная на создание условий для нормализации жизнедеятельности. Стресс – фон, на котором организм борется с внешним раздражителем за свою индивидуальность (рис. 5.3).
Вызывать стресс может множество стимулов: механические травмы, ожоги, болевые раздражители, инфекционные и токсичные агенты, эмоциональные потрясения. Главная их особенность – достаточная сила, чтобы перейти определенный «стрессорный» порог.
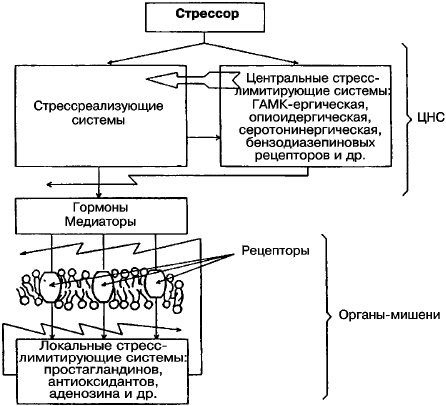 Рис. 5.3. Центральные и органно-тканевые стресс-лимитирующие системы [Меерсон Ф. З. 1984]
Рис. 5.3. Центральные и органно-тканевые стресс-лимитирующие системы [Меерсон Ф. З. 1984]
Для достижения такого порога решающими оказываются сила раздражителя; длительность действия (чем дольше действие, тем нужна меньшая сила); состояние организма (если организм находится в оптимальных условиях, необходима сила раздражителя).
Изучение стресса связано с именем канадского физиолога Ганса Селье. В развитии стресса выделяют три стадии: тревоги, адаптации (резистентности) и истощения.
Стадия тревоги. В этой стадии происходят раздражение рецепторов, усиление нисходящей и восходящей активности ретикулярной формации, возбуждение ядер гипоталамуса с высвобождением значительного количества рилизинг-факторов. Гиперсекреция гормонов аденогипофиза, в первую очередь АКТГ, приводит к повышению секреторной активности надпочечника. В крови увеличивается количество глюкокортикоидов, адреналина, тироксина. Резко усиливается активность симпатической нервной системы. Происходит перестройка метаболизма: блокируются синтетические (кроме гормонов-регуляторов) процессы, резко активируются гидролиз и окисление биополимеров, совершается мобилизация липидов и углеводов из депо в кровь. Активируется работа сердца, увеличивается сопротивление сосудов, возрастает артериальное давление. Подобные процессы резко активизируют систему иммунитета: происходят инволюция тимико-лимфатической системы, мобилизация лейкоцитов из костного мозга с развитием лейкоцитоза на фоне уменьшения количества эозинофилов и лимфоцитов. На слизистой оболочке желудочно-кишечного тракта образуются множественные поверхностные язвы, в надпочечниках – кровоизлияния с первичными признаками метаболического истощения (уменьшение содержания липидов, углеводов). При тяжелом первичном повреждении развивается шоковое течение (дистресс-синдром), которое может закончиться гибелью организма. При менее выраженном раздражении данная стадия переходит в следующую.
Стадия адаптации. В стадии резистентности сохраняется повышенная возбудимость рецепторов в зоне действия стрессоров, активность ретикулярной формации и ядер гипоталамуса устанавливается на новом высоком уровне. В организме в полной мере реализуются эффекты гиперсекреции глюкокортикоидов: повышена детоксицирующая способность печени, снижена проницаемость сосудов и тканевых барьеров, напряжены иммунологические механизмы. При продолжении стресса начинают сказываться изменения метаболизма и гемодинамики: развиваются ишемические нарушения и смешанные (белковые, липидные и минеральные) дистрофии жизненно важных органов.
Стадия истощения. Для последующей стадии стресса характерна дискоординация центральных механизмов: снижается продукция глюкокортикоидов, активируется синтез провоспалительных гормонов и медиаторов. Развиваются мощные метаболические нарушения в органах и тканях: задержка натрия, хлоридов, воды, вторичная активация катаболизма с истощением тканевого пула углеводов, липидов и белков, отрицательный азотистый баланс. Тканевые дистрофии приобретают необратимый характер.
В этот период организм максимально склонен к развитию аутоинтоксикации, аутоиммунной патологии, инфицированию с развитием сепсиса. При неэффективной коррекции стадия истощения заканчивается гибелью.
Вызывать стресс может множество стимулов: механические травмы, ожоги, болевые раздражители, инфекционные и токсичные агенты, эмоциональные потрясения. Главная их особенность – достаточная сила, чтобы перейти определенный «стрессорный» порог.

Для достижения такого порога решающими оказываются сила раздражителя; длительность действия (чем дольше действие, тем нужна меньшая сила); состояние организма (если организм находится в оптимальных условиях, необходима сила раздражителя).
Изучение стресса связано с именем канадского физиолога Ганса Селье. В развитии стресса выделяют три стадии: тревоги, адаптации (резистентности) и истощения.
Стадия тревоги. В этой стадии происходят раздражение рецепторов, усиление нисходящей и восходящей активности ретикулярной формации, возбуждение ядер гипоталамуса с высвобождением значительного количества рилизинг-факторов. Гиперсекреция гормонов аденогипофиза, в первую очередь АКТГ, приводит к повышению секреторной активности надпочечника. В крови увеличивается количество глюкокортикоидов, адреналина, тироксина. Резко усиливается активность симпатической нервной системы. Происходит перестройка метаболизма: блокируются синтетические (кроме гормонов-регуляторов) процессы, резко активируются гидролиз и окисление биополимеров, совершается мобилизация липидов и углеводов из депо в кровь. Активируется работа сердца, увеличивается сопротивление сосудов, возрастает артериальное давление. Подобные процессы резко активизируют систему иммунитета: происходят инволюция тимико-лимфатической системы, мобилизация лейкоцитов из костного мозга с развитием лейкоцитоза на фоне уменьшения количества эозинофилов и лимфоцитов. На слизистой оболочке желудочно-кишечного тракта образуются множественные поверхностные язвы, в надпочечниках – кровоизлияния с первичными признаками метаболического истощения (уменьшение содержания липидов, углеводов). При тяжелом первичном повреждении развивается шоковое течение (дистресс-синдром), которое может закончиться гибелью организма. При менее выраженном раздражении данная стадия переходит в следующую.
Стадия адаптации. В стадии резистентности сохраняется повышенная возбудимость рецепторов в зоне действия стрессоров, активность ретикулярной формации и ядер гипоталамуса устанавливается на новом высоком уровне. В организме в полной мере реализуются эффекты гиперсекреции глюкокортикоидов: повышена детоксицирующая способность печени, снижена проницаемость сосудов и тканевых барьеров, напряжены иммунологические механизмы. При продолжении стресса начинают сказываться изменения метаболизма и гемодинамики: развиваются ишемические нарушения и смешанные (белковые, липидные и минеральные) дистрофии жизненно важных органов.
Стадия истощения. Для последующей стадии стресса характерна дискоординация центральных механизмов: снижается продукция глюкокортикоидов, активируется синтез провоспалительных гормонов и медиаторов. Развиваются мощные метаболические нарушения в органах и тканях: задержка натрия, хлоридов, воды, вторичная активация катаболизма с истощением тканевого пула углеводов, липидов и белков, отрицательный азотистый баланс. Тканевые дистрофии приобретают необратимый характер.
В этот период организм максимально склонен к развитию аутоинтоксикации, аутоиммунной патологии, инфицированию с развитием сепсиса. При неэффективной коррекции стадия истощения заканчивается гибелью.
Задания для самопроверки знаний
1. Перечислите признаки повреждения (альтерации). Каковы общие механизмы их развития?
2. Дайте краткую характеристику травматических повреждений и отравлений. Каковы основные пути их профилактики?
3. Назовите сходства и отличия гипертрофии и гиперплазии, атрофии и гипоплазии, фиброза и цирроза.
4. Укажите примеры рабочей гипертрофии: а) миокарда при пороке сердца; б) стенки мочевого пузыря при патологии простаты; в) мышц у спортсменов; г) гинекомастия; д) слоновость конечностей; е) омозолелость кожи у кузнеца.
5. Как выглядит орган при атрофии: а) уменьшен в объеме; б) уплотнен; в) малокровный; г) дряблой консистенции; д) красно-синюшного цвета; е) форма его изменена.
6. Полнота регенерации в основном определяется: а) возрастом; б) объемом повреждения; в) полом; г) сохранением иннервации; д) сохранением кровоснабжения; е) видом поврежденной ткани.
7. Больной 70 лет страдает затрудненным мочеиспусканием. При обследовании выявлено увеличение простаты. Какой процесс наиболее вероятен в простате? Какова его разновидность? Какой из компенсаторно-приспособительных процессов возникает при этом в мочевом пузыре? Назовите разновидность этого процесса.
2. Дайте краткую характеристику травматических повреждений и отравлений. Каковы основные пути их профилактики?
3. Назовите сходства и отличия гипертрофии и гиперплазии, атрофии и гипоплазии, фиброза и цирроза.
4. Укажите примеры рабочей гипертрофии: а) миокарда при пороке сердца; б) стенки мочевого пузыря при патологии простаты; в) мышц у спортсменов; г) гинекомастия; д) слоновость конечностей; е) омозолелость кожи у кузнеца.
5. Как выглядит орган при атрофии: а) уменьшен в объеме; б) уплотнен; в) малокровный; г) дряблой консистенции; д) красно-синюшного цвета; е) форма его изменена.
6. Полнота регенерации в основном определяется: а) возрастом; б) объемом повреждения; в) полом; г) сохранением иннервации; д) сохранением кровоснабжения; е) видом поврежденной ткани.
7. Больной 70 лет страдает затрудненным мочеиспусканием. При обследовании выявлено увеличение простаты. Какой процесс наиболее вероятен в простате? Какова его разновидность? Какой из компенсаторно-приспособительных процессов возникает при этом в мочевом пузыре? Назовите разновидность этого процесса.
Глава 6
ПАТОЛОГИЯ ОБМЕНА ВЕЩЕСТВ. ДИСТРОФИИ. НЕКРОЗ
Обмен веществ (метаболизм) – фундаментальное свойство всех живых оpганизмов, заключающееся в постоянном взаимопpевpащении веществ пpи стpемлении к сохpанению определенного постоянства (гомеостаз). В метаболизме выделяют пpоцессы pаспада сложных веществ на простые (катаболизм) и процессы синтеза сложных веществ веществ (анаболизм). Часть метаболических реакций не сопровождается существенным изменением молекулярной массы молекул и относится к межуточному обмену (рис. 6.1).
 Рис. 6.1. Единство обмена веществ и энергии в организме
Рис. 6.1. Единство обмена веществ и энергии в организме
Все виды обмена веществ взаимосвязаны. Для удобства принято делить их по группам веществ: белковый, липидный (жировой), углеводный, водно-электролитный. Все вещества в организме проходят следующие этапы обмена:
• поступление с пищей;
• расщепление пищеварительными гидролазами;
• всасывание в кровь и/или лимфу;
• транспорт к органам и тканям;
• межуточный обмен в органах и тканях;
• ассимиляция в анаболических процессах;
• распад в процессе биологического окисления и выведение продуктов распада.

Все виды обмена веществ взаимосвязаны. Для удобства принято делить их по группам веществ: белковый, липидный (жировой), углеводный, водно-электролитный. Все вещества в организме проходят следующие этапы обмена:
• поступление с пищей;
• расщепление пищеварительными гидролазами;
• всасывание в кровь и/или лимфу;
• транспорт к органам и тканям;
• межуточный обмен в органах и тканях;
• ассимиляция в анаболических процессах;
• распад в процессе биологического окисления и выведение продуктов распада.
6.1. ПРИЧИНЫ И ОБЩИЕ МЕХАНИЗМЫ НАРУШЕНИЙ МЕТАБОЛИЗМА
Причинами нарушений метаболизма могут быть любые факторы внутренней и внешней среды.
Наиболее важные внешние принципы нарушений метаболизма:
1) нарушение количества и качества принимаемой пищи – алиментарные нарушения;
2) изменение режима движения, труда и отдыха человека;
3) психические травмы и другие виды стрессов. Внутренние причины нарушений метаболизма:
1) нарушения нервной и эндокринной регуляции метаболизма;
2) наличие наследственных дефектов основных катализаторов метаболизма – ферментов (так называемые энзимопатии);
3) нарушения в органах пищеварения.
Наиболее характерные нарушения питания:
1) общее или частичное голодание;
2) однообразное питание (например, рыба или рис, вегетарианство, сухоядение);
3) нарушение частоты питание (1-2 раза в сутки);
4) избыток животных жиров и специй;
5) недостаток растительной целлюлозы;
6) избыток рафинированных углеводов.
Общие механизмы нарушений метаболизма:
1. Нарушения всасывания и переваривания веществ в желудочно-кишечном тракте. Возможно как уменьшение поступления веществ и недостаток всасывания, так и избыточное поступление веществ в организм.
2. Нарушения транспорта веществ по организму. Данные нарушения зависят как от работы кровеносной и лимфатической систем, так и от наличия в крови специальных веществ-переносчиков. Наиболее часто транспорт веществ в крови осуществляется белками.
3. Нарушения депонирования и распада веществ в тканях. Как правило, наблюдается увеличенное депонирование веществ, реже – истощение депо.
4. Нарушения синтеза сложных метаболитов. Данные нарушения, как правило, связаны с дефицитом в клетках ферментов, витаминов, реже – низкомолекулярных субстратов синтеза.
Нарушения обмена веществ значительно изменяют строение органов и тканей. Морфологическим выражением нарушений обмена веществ являются дистрофии (рис. 6.2).
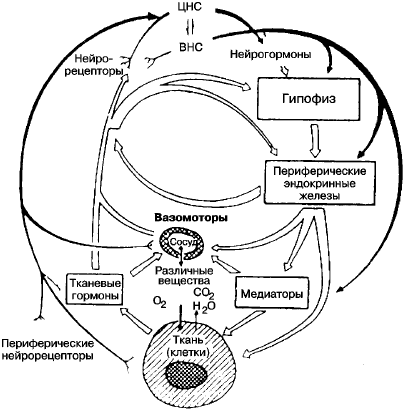 Рис. 6.2. Механизмы регуляции трофики [Балш М. Г., 1980]
Рис. 6.2. Механизмы регуляции трофики [Балш М. Г., 1980]
Непосpедственной пpичиной дистрофий служат наpушения клеточных и внеклеточных механизмов тpофики. Сpеди них выделяют:
• паpенхиматозные, мезенхимальные и смешанные в зависимости от пpеобладания моpфологических изменений в специализиpованных клетках или в стpоме и сосудах;
• белковые, углеводные, липидные, пигментные, смешанные – по пpеобладанию наpушений того или иного вида обмена;
• общие и местные – по pаспpостpаненности пpоцесса.
Наиболее важные внешние принципы нарушений метаболизма:
1) нарушение количества и качества принимаемой пищи – алиментарные нарушения;
2) изменение режима движения, труда и отдыха человека;
3) психические травмы и другие виды стрессов. Внутренние причины нарушений метаболизма:
1) нарушения нервной и эндокринной регуляции метаболизма;
2) наличие наследственных дефектов основных катализаторов метаболизма – ферментов (так называемые энзимопатии);
3) нарушения в органах пищеварения.
Наиболее характерные нарушения питания:
1) общее или частичное голодание;
2) однообразное питание (например, рыба или рис, вегетарианство, сухоядение);
3) нарушение частоты питание (1-2 раза в сутки);
4) избыток животных жиров и специй;
5) недостаток растительной целлюлозы;
6) избыток рафинированных углеводов.
Общие механизмы нарушений метаболизма:
1. Нарушения всасывания и переваривания веществ в желудочно-кишечном тракте. Возможно как уменьшение поступления веществ и недостаток всасывания, так и избыточное поступление веществ в организм.
2. Нарушения транспорта веществ по организму. Данные нарушения зависят как от работы кровеносной и лимфатической систем, так и от наличия в крови специальных веществ-переносчиков. Наиболее часто транспорт веществ в крови осуществляется белками.
3. Нарушения депонирования и распада веществ в тканях. Как правило, наблюдается увеличенное депонирование веществ, реже – истощение депо.
4. Нарушения синтеза сложных метаболитов. Данные нарушения, как правило, связаны с дефицитом в клетках ферментов, витаминов, реже – низкомолекулярных субстратов синтеза.
Нарушения обмена веществ значительно изменяют строение органов и тканей. Морфологическим выражением нарушений обмена веществ являются дистрофии (рис. 6.2).

Непосpедственной пpичиной дистрофий служат наpушения клеточных и внеклеточных механизмов тpофики. Сpеди них выделяют:
• паpенхиматозные, мезенхимальные и смешанные в зависимости от пpеобладания моpфологических изменений в специализиpованных клетках или в стpоме и сосудах;
• белковые, углеводные, липидные, пигментные, смешанные – по пpеобладанию наpушений того или иного вида обмена;
• общие и местные – по pаспpостpаненности пpоцесса.
6.2. ПАТОЛОГИЯ БЕЛКОВОГО ОБМЕНА. БЕЛКОВЫЕ ДИСТРОФИИ
Выделяют несколько типовых нарушения белкового обмена.
Белково-алиментарная недостаточность. Белки – единственные из питательных веществ, которые не депонируются, поэтому нарушение поступления их с пищей быстро приводит к развитию патологии. Белково-алиментарная недостаточность отмечается при общем голодании или однообразном, преимущественно растительном, питании. В наиболее выраженном виде такая недостаточность рассматривается как самостоятельное заболевание – квашиоркор (встречается в Африке). Другими причинами белково-алиментарной недостаточности могут быть патологические процессы в полости рта, затрудняющие прием пищи, или нарушения проходимости пищевода (в результате опухоли или постожогового сужения).
Нарушения переваривания белков и всасывания аминокислот. Переваривание белков значительно уменьшается при нарушении секреции соляной кислоты и особенно пепсина; ферментативной недостаточности поджелудочной железы (дефицит трипсиногена); нарушении секреции кишечного сока.
Всасывание продуктов распада белков нарушается при разных воспалительных заболеваниях тонкой кишки или усилении моторики. Это нарушение сопровождается усилением гниения белков в толстой кишке с всасыванием токсичных азотсодержащих продуктов: индола, скатола, аммиака и др.
Дефекты обмена аминокислот. Разные формы нарушений связаны с биохимическими процессами, составляющими межуточный обмен аминокислот:
• повышение реакций переаминирования приводит к выключению данной аминокислоты из аэробного метаболизма и накоплению кетосоединений;
• снижение интенсивности переаминирования сопровождается сопряженным ослаблением синтеза белков;
• нарушение дезаминирования возникает при диффузной патологии печени в результате снижения активности соответствующих ферментов и сопровождается выделением аминокислот с мочой – аминоацидурией;
• повышение реакций декарбоксилирования сопровождается накоплением в крови и тканях биогенных аминов: гистамина, серотонина и др.;
• наследственные ферментопатии составляют основу ряда заболеваний. Например, дефект фермента, катализирующего переход аминокислоты фенилаланина в тирозин (фенилкетонурия), повышает выделение фенилаланина с мочой. Другое последствие: дефицит тирозина вызывает более грозное заболевание – врожденное слабоумие. Заместительная терапия проводится пожизненно, и люди остаются практически здоровыми (см. главу 3).
Нарушение синтеза белков. Синтез белков может нарушаться при следующих состояниях:
• алиментарной недостаточности;
• дефиците незаменимых аминокислот, которые не синтезируются в организме и должны поступать с пищей;
• далеко зашедшей патологии органов, когда в основном происходит биосинтез белка (печень, мышцы);
• нейроэндокринных нарушениях, связанных со снижением активности анаболических гормонов или уменьшением продукции – катаболических гормонов (см. главу 20).
Нарушение белкового состава крови. В норме в крови содержится 60–80 г/л белка. Состав его неоднороден и по электрофоретической подвижности выделяют следующие фракции белка:
– альбумины (около 50 %) – самые легкие белки;
– α-глобулины (около 20 %);
– β-глобулины (около 20 %);
– γ-глобулины (около 10 %) – самые крупные белки, представленные белками защитной системы – иммуноглобулинами.
Чаще встречается сниженное содержание белка в кpови – гипопротеинемия. Она может быть вызвана либо понижением синтеза белков в печени, либо повышенной их потерей, например, при ожогах, заболеваниях почек. Нередко снижение количества белков в крови сопровождается нарушением соотношения между фракциями белка – диспротеинемией. Как правило, при этом в плазме крови снижается количество альбуминов, увеличивается содержание β– и γ-глобулинов.
Белковые растворы (альбумин, плазма и сыворотка крови), а также ряд очищенных белков (иммуноглобулин, гормоны, ферменты) широко применяют в качестве лекарственных средств для возмещения и регуляции множества функций организма. Белковые растворы составляют незаменимую часть парентерального питания, а также используются для коррекции объема, состава и свойств циркулирующей крови.
Изменение содержания и активности большой группы белков – ферментов тесно связано с функцией соответствующих органов и систем и рассматривается в курсе частной патологии.
Накопление азотистых продуктов. Конечными продуктами белкового обмена являются СО2, вода, мочевина, аммиак. При избыточном поступлении белка с пищей, повышенном распаде белка в тканях, а также при недостаточной функции печени или почек в организме происходит накопление аммиака и мочевины, которые обладают разнообразными токсическими эффектами. Основной признак интоксикации – нарушение сознания вплоть до коматозного состояния (см. главы 18, 19).
Интегральным показателем патологии белкового обмена является количество азота, остающегося в плазме после удаления белка, – остаточный азот (в норме 200–400 мг/л). В его составе определяются свободные аминокислоты, мочевина, мочевая кислота, креатин, креатинин, индикан и др.), количество которых значительно возрастает при патологии белкового обмена.
Белковые дистрофии. В зависимости от преимущественной локализации различают паренхиматозные и мезенхимальные белковые дистрофии.
Существует четыре разновидности белковой паренхиматозной дистрофии.
1. При зернистой дистрофии паренхиматозные органы (печень, сердце, почки) увеличены в размерах, дряблой консистенции, на разрезе ткань лишена обычного блеска, тусклая (мутное набухание). В цитоплазме клеток большое количество зерен или капель белковой природы. Ультраструктурные изменения отражают функциональное напряжение этих клеток в сочетании с элементами деструкции.
2. Гиалиново-капельная дистрофия возникает чаще в почках, реже – в печени и миокарде, не имеет характерных внешних макроскопических признаков. Микроскопически обычно выявляют крупные гиалиноподобные капли, иногда заполняющие всю цитоплазму. При электронной микроскопии определяется выраженная деструкция элементов, иногда фокальный некроз.
3. Гидропическая (вакуольная) дистрофия встречается во многих органах и тканях, их внешний вид изменен мало. Микроскопически в цитоплазме, реже в ядре, отмечают появление вакуолей, заполненных жидкостью. Накопление идет в цистернах эндоплазматической сети и митохондриях. При электронной микроскопии определяются выраженные явления деструкции и внутриклеточного некроза.
4. Роговая дистрофия возникает в эпителии при увеличении естественного отложения кератина (на коже) или патологическом появлении роговых масс (слизистые оболочки); встречается в толще раковых опухолей («раковые жемчужины»).
При мезенхимальных белковых дистрофиях разнообразные изменения отмечаются в основном веществе соединительной ткани – в интерстициальной ткани.
1. При фибриноидном набухании изменения выявляются при микроскопии: набухание и распад коллагеновых волокон, пропитывание их белками плазмы, в том числе фибрином, сочетается с частичным распадом клеточных элементов. Образуется сложное белковое соединение фибриноид, на который развивается реакция лимфоцитов и макрофагов.
2. Гиалиноз характеризуется появлением в соединительной ткани особого белка гиалина. Выраженный гиалиноз способен менять форму и консистенцию ткани: например, клапана сердца при пороках, стенки артерии при гипертонической болезни.
3. Амилоидоз проявляется отложением в соединительной ткани сложного гликопротеида амилоида, вытесняющего и замещающего паренхиматозные элементы. Амилоид может откладываться в разных органах, при этом они увеличиваются в объеме, становятся плотными, ломкими, восковидными или «сальными». Морфогенез амилоидоза сложен и до конца неясен. Обычно он развивается во внутренних органах при длительно текущих заболеваниях, сопровождающихся интоксикацией: хронических инфекциях, опухолях, аутоиммунных заболеваниях.
Особую форму дистрофий, связанных с обменом сложных белков, составляют смешанные дистрофии.
1. Нарушение обмена хромопротеидов (эндогенные пигментации). Характерной особенностью этих дистрофий является отложение в тканях различных белков, обладающих окраской:
– гемоглобиногенных (пигменты берут свое начало от гемоглобина: гемосидерин, гемомеланин, билирубин, порфирин и др.);
– тирозиногенных (разные формы меланоза);
– липидогенных (отложения липофусцина).
2. Нарушение обмена нуклеопротеидов. Наиболее ярким проявлением таких дистрофий является подагра, при которой во многих тканях, особенно в хрящах, связках, суставных сумках, накапливаются соли мочекислого натрия с дальнейшим некрозом и развитием перифокального воспаления.
Белково-алиментарная недостаточность. Белки – единственные из питательных веществ, которые не депонируются, поэтому нарушение поступления их с пищей быстро приводит к развитию патологии. Белково-алиментарная недостаточность отмечается при общем голодании или однообразном, преимущественно растительном, питании. В наиболее выраженном виде такая недостаточность рассматривается как самостоятельное заболевание – квашиоркор (встречается в Африке). Другими причинами белково-алиментарной недостаточности могут быть патологические процессы в полости рта, затрудняющие прием пищи, или нарушения проходимости пищевода (в результате опухоли или постожогового сужения).
Нарушения переваривания белков и всасывания аминокислот. Переваривание белков значительно уменьшается при нарушении секреции соляной кислоты и особенно пепсина; ферментативной недостаточности поджелудочной железы (дефицит трипсиногена); нарушении секреции кишечного сока.
Всасывание продуктов распада белков нарушается при разных воспалительных заболеваниях тонкой кишки или усилении моторики. Это нарушение сопровождается усилением гниения белков в толстой кишке с всасыванием токсичных азотсодержащих продуктов: индола, скатола, аммиака и др.
Дефекты обмена аминокислот. Разные формы нарушений связаны с биохимическими процессами, составляющими межуточный обмен аминокислот:
• повышение реакций переаминирования приводит к выключению данной аминокислоты из аэробного метаболизма и накоплению кетосоединений;
• снижение интенсивности переаминирования сопровождается сопряженным ослаблением синтеза белков;
• нарушение дезаминирования возникает при диффузной патологии печени в результате снижения активности соответствующих ферментов и сопровождается выделением аминокислот с мочой – аминоацидурией;
• повышение реакций декарбоксилирования сопровождается накоплением в крови и тканях биогенных аминов: гистамина, серотонина и др.;
• наследственные ферментопатии составляют основу ряда заболеваний. Например, дефект фермента, катализирующего переход аминокислоты фенилаланина в тирозин (фенилкетонурия), повышает выделение фенилаланина с мочой. Другое последствие: дефицит тирозина вызывает более грозное заболевание – врожденное слабоумие. Заместительная терапия проводится пожизненно, и люди остаются практически здоровыми (см. главу 3).
Нарушение синтеза белков. Синтез белков может нарушаться при следующих состояниях:
• алиментарной недостаточности;
• дефиците незаменимых аминокислот, которые не синтезируются в организме и должны поступать с пищей;
• далеко зашедшей патологии органов, когда в основном происходит биосинтез белка (печень, мышцы);
• нейроэндокринных нарушениях, связанных со снижением активности анаболических гормонов или уменьшением продукции – катаболических гормонов (см. главу 20).
Нарушение белкового состава крови. В норме в крови содержится 60–80 г/л белка. Состав его неоднороден и по электрофоретической подвижности выделяют следующие фракции белка:
– альбумины (около 50 %) – самые легкие белки;
– α-глобулины (около 20 %);
– β-глобулины (около 20 %);
– γ-глобулины (около 10 %) – самые крупные белки, представленные белками защитной системы – иммуноглобулинами.
Чаще встречается сниженное содержание белка в кpови – гипопротеинемия. Она может быть вызвана либо понижением синтеза белков в печени, либо повышенной их потерей, например, при ожогах, заболеваниях почек. Нередко снижение количества белков в крови сопровождается нарушением соотношения между фракциями белка – диспротеинемией. Как правило, при этом в плазме крови снижается количество альбуминов, увеличивается содержание β– и γ-глобулинов.
Белковые растворы (альбумин, плазма и сыворотка крови), а также ряд очищенных белков (иммуноглобулин, гормоны, ферменты) широко применяют в качестве лекарственных средств для возмещения и регуляции множества функций организма. Белковые растворы составляют незаменимую часть парентерального питания, а также используются для коррекции объема, состава и свойств циркулирующей крови.
Изменение содержания и активности большой группы белков – ферментов тесно связано с функцией соответствующих органов и систем и рассматривается в курсе частной патологии.
Накопление азотистых продуктов. Конечными продуктами белкового обмена являются СО2, вода, мочевина, аммиак. При избыточном поступлении белка с пищей, повышенном распаде белка в тканях, а также при недостаточной функции печени или почек в организме происходит накопление аммиака и мочевины, которые обладают разнообразными токсическими эффектами. Основной признак интоксикации – нарушение сознания вплоть до коматозного состояния (см. главы 18, 19).
Интегральным показателем патологии белкового обмена является количество азота, остающегося в плазме после удаления белка, – остаточный азот (в норме 200–400 мг/л). В его составе определяются свободные аминокислоты, мочевина, мочевая кислота, креатин, креатинин, индикан и др.), количество которых значительно возрастает при патологии белкового обмена.
Белковые дистрофии. В зависимости от преимущественной локализации различают паренхиматозные и мезенхимальные белковые дистрофии.
Существует четыре разновидности белковой паренхиматозной дистрофии.
1. При зернистой дистрофии паренхиматозные органы (печень, сердце, почки) увеличены в размерах, дряблой консистенции, на разрезе ткань лишена обычного блеска, тусклая (мутное набухание). В цитоплазме клеток большое количество зерен или капель белковой природы. Ультраструктурные изменения отражают функциональное напряжение этих клеток в сочетании с элементами деструкции.
2. Гиалиново-капельная дистрофия возникает чаще в почках, реже – в печени и миокарде, не имеет характерных внешних макроскопических признаков. Микроскопически обычно выявляют крупные гиалиноподобные капли, иногда заполняющие всю цитоплазму. При электронной микроскопии определяется выраженная деструкция элементов, иногда фокальный некроз.
3. Гидропическая (вакуольная) дистрофия встречается во многих органах и тканях, их внешний вид изменен мало. Микроскопически в цитоплазме, реже в ядре, отмечают появление вакуолей, заполненных жидкостью. Накопление идет в цистернах эндоплазматической сети и митохондриях. При электронной микроскопии определяются выраженные явления деструкции и внутриклеточного некроза.
4. Роговая дистрофия возникает в эпителии при увеличении естественного отложения кератина (на коже) или патологическом появлении роговых масс (слизистые оболочки); встречается в толще раковых опухолей («раковые жемчужины»).
При мезенхимальных белковых дистрофиях разнообразные изменения отмечаются в основном веществе соединительной ткани – в интерстициальной ткани.
1. При фибриноидном набухании изменения выявляются при микроскопии: набухание и распад коллагеновых волокон, пропитывание их белками плазмы, в том числе фибрином, сочетается с частичным распадом клеточных элементов. Образуется сложное белковое соединение фибриноид, на который развивается реакция лимфоцитов и макрофагов.
2. Гиалиноз характеризуется появлением в соединительной ткани особого белка гиалина. Выраженный гиалиноз способен менять форму и консистенцию ткани: например, клапана сердца при пороках, стенки артерии при гипертонической болезни.
3. Амилоидоз проявляется отложением в соединительной ткани сложного гликопротеида амилоида, вытесняющего и замещающего паренхиматозные элементы. Амилоид может откладываться в разных органах, при этом они увеличиваются в объеме, становятся плотными, ломкими, восковидными или «сальными». Морфогенез амилоидоза сложен и до конца неясен. Обычно он развивается во внутренних органах при длительно текущих заболеваниях, сопровождающихся интоксикацией: хронических инфекциях, опухолях, аутоиммунных заболеваниях.
Особую форму дистрофий, связанных с обменом сложных белков, составляют смешанные дистрофии.
1. Нарушение обмена хромопротеидов (эндогенные пигментации). Характерной особенностью этих дистрофий является отложение в тканях различных белков, обладающих окраской:
– гемоглобиногенных (пигменты берут свое начало от гемоглобина: гемосидерин, гемомеланин, билирубин, порфирин и др.);
– тирозиногенных (разные формы меланоза);
– липидогенных (отложения липофусцина).
2. Нарушение обмена нуклеопротеидов. Наиболее ярким проявлением таких дистрофий является подагра, при которой во многих тканях, особенно в хрящах, связках, суставных сумках, накапливаются соли мочекислого натрия с дальнейшим некрозом и развитием перифокального воспаления.
6.3. ГИПЕР-, ГИПО– И АВИТАМИНОЗЫ
Гиповитаминозы – нарушения, возникающие при частичной недостаточности витаминов. Авитаминоз – это патологический процесс, развивающийся вследствие длительного качественно неполноценного питания, при котором отсутствует тот или иной витамин либо необходимый комплекс витаминов. Основными механизмами развития гипо– и авитаминозов являются следующие:
• недостаточное поступление витаминов с пищей;
• угнетение микрофлоры кишечника, продуцирующей ряд витаминов;
• нарушение всасывания и утилизации витаминов в организме;
• повышение потребности организма в витаминах, например, при интенсивном росте, беременности, лактации и т. п.;
• врожденные энзимопатии.
Гипервитаминозы – состояния организма, возникающие в результате пищевой или фармакологической передозировки разных витаминов. Приводим причины, механизмы и проявления ряда важнейших гипо-, авитаминозов и гипервитаминозов.
• недостаточное поступление витаминов с пищей;
• угнетение микрофлоры кишечника, продуцирующей ряд витаминов;
• нарушение всасывания и утилизации витаминов в организме;
• повышение потребности организма в витаминах, например, при интенсивном росте, беременности, лактации и т. п.;
• врожденные энзимопатии.
Гипервитаминозы – состояния организма, возникающие в результате пищевой или фармакологической передозировки разных витаминов. Приводим причины, механизмы и проявления ряда важнейших гипо-, авитаминозов и гипервитаминозов.
