Страница:
Гипернатриемия может быть связана с потерями преимущественно осмотически свободной воды (например, при несахарном диабете), уменьшением объема вне– и внутриклеточной жидкости, сопряженным с избыточной эксрецией некоторых ионов, а также может быть обусловлена избыточным поступлением в организм натрия (табл. 1.4). Уточнение состояния водного гомеостаза у больных с гипернатриемией необходимо в первую очередь для определения рациональной тактики ведения пациентов.
Гипернатриемия, обусловленная снижением содержания в организме воды, в том числе осмотически свободной, может наблюдаться у пациентов со сниженным чувством жажды, употребляющих в связи с этим значительно меньшие по сравнению с необходимым объемы жидкости. Уменьшение (в ряде случаев – полное отсутствие) чувства жажды наблюдают при заболеваниях, непосредственно поражающих гипоталамус (первичная гиподипсия), или болезнях, обусловливающих «общемозговую» неврологическую симптоматику (вторичная гиподипсия) (табл. 1.5).
Таблица 1.4
Патогенетические варианты гипернатриемии

 Таблица 1.5
Таблица 1.5
Причины снижения чувства жажды (гиподипсии)
Наиболее значимые факторы риска гипернатриемии:
• пожилой возраст (особенно при наличии сосудистой деменции, нейродегенеративных / демиелинизирующих заболеваний);
• госпитализация, особенно в отделение интенсивной терапии;
• инфузия гипертонических растворов;
• кормление через желудочный зонд;
• применение осмотических диуретиков (маннитол);
• применение лактулозы;
• искусственная вентиляция легких;
• нарушения сознания;
• заболевания, сопровождающиеся полиурией.
Лечение гипернатриемии должно обязательно включать устранение возможных факторов риска. Кроме того, для определения тактики ведения таких пациентов необходим расчет возможного дефицита воды.
Дефицит воды (л) = 0,6 х масса тела (кг) х (плазменная концентрация натрия (мЭк/л)/140) – 1
Стратегия лечения гипернатриемии включает:
• обильное питье воды и инфузию 5 %-ного водного раствора декстрозы (темп инфузии должен обеспечивать снижение концентрации натрия в плазме, составляющее 2 мЭкв/л/час);
• контроль неврологической симптоматики;
• мониторинг концентрации натрия и калия в плазме крови.
В течение первых 12–24 часов должна быть восполнена половина от рассчитанного дефицита воды. Оставшуюся половину восполняют в течение последующих 24 часов.
Нарушение калиевого гомеостаза
Подъем или снижение плазменной концентрации калия, зачастую не демонстрирующие специфических клинических проявлений, могут очень быстро приводить к смерти. Распознавание нарушений калиевого гомеостаза основано в первую очередь на выделении типичных групп риска и тщательном мониторинге динамики калиемии.
Гипокалиемия
Гипокалиемией считают стойкое снижение плазменной концентрации калия ниже 3,5 мЭкв/л. Гипокалиемию нередко обнаруживают у госпитализированных больных. Так, при обследовании 1178 больных, госпитализированных в терапевтическую клинику в течение 3 месяцев, у 140 из них (12 %) была обнаружена гипокалиемия, при этом у 104 (74 %) человек она возникла в период пребывания в стационаре.
Клинические проявления гипокалиемии включают:
• миопатию (мышечные боли, слабость, при выраженном снижении сывороточного уровня калия возможен рабдомиолиз, иногда фатальный);
• тахикардию, наджелудочковую экстрасистолию, фибрилляцию предсердий;
• снижение интенсивности перистальтики кишечника, запоры;
• периферическую полинейропатию с парестезиями.
Гипокалиемия, как правило, сопровождается изменениями ЭКГ. Риск провоцируемых гипокалиемией фибрилляции предсердий и желудочковой экстрасистолии максимален у пациентов, страдающих заболеваниями сердечно-сосудистой системы, а также у принимающих дигоксин и другие сердечные гликозиды. ЭКГ-признак гипокалиемии включает:
• увеличение частоты сердечных сокращений;
• уменьшение амплитуды зубца Т;
• удлинение интервала Q—T;
• расширение комплекса QRS;
• появление зубца U;
• атриовентрикулярную блокаду;
• наджелудочковые и желудочковые экстрасистолы;
• пароксизмальную фибрилляцию предсердий.
Стойкая гипокалиемия ассоциирована со значительным ухудшением сердечно-сосудистого прогноза, обусловленным появлением эктопических очагов в желудочках сердца и удлинением интервала Q—T, считающихся факторами риска внезапной смерти. Так, увеличение вероятности внезапной смерти выявлено у лиц с гипокалиемией, обусловленной постоянным приемом тиазидовых диуретиков, не получавших калийсберегающих препаратов. В пользу «вклада» гипокалиемии в развитие внезапной смерти свидетельствует и частое обнаружение сниженной сывороточной концентрации калия у пациентов, перенесших сердечно-легочную реанимацию. Уровень плазменного калия менее 3,5 мЭкв/л был зарегистрирован у 23 % больных с желудочковой тахикардией.
Другой мишенью гипокалиемии являются структуры почечного тубулоинтерстиция, прогрессирование поражения которых происходит несколько медленнее, чем развитие нарушений ритма сердца. При длительно существующем снижении сывороточного уровня калия наблюдают нарастающий тубулоинтерстициальный фиброз, проявляющийся полиурией и снижением относительной плотности мочи и способный приводить к терминальной почечной недостаточности, чаще наблюдаемой при «злокачественной» гипокалиемии (синдром Барттера, синдром Лиддла). Характерным признаком пораженной почки являются множественные кисты.
Длительно существующая гипокалиемия, в том числе индуцированная приемом тиазидовых диуретиков, сопровождается увеличением риска развития сахарного диабета II типа. Вероятность дебюта сахарного диабета II типа максимальна у лиц с тенденцией к повышению сывороточного уровня глюкозы, а также у больных, получающих тиазидовые диуретики в сочетании с b-адреноблокаторами. Считают, что гипокалиемия обусловливает усугубление нарушения секреции инсулина b-клетками островков Лангерганса поджелудочной железы. Рост риска сахарного диабета II типа под действием тиазидовых диуретиков установлен в нескольких крупных контролируемых исследованиях, в частности в широко известном исследовании ASCOT (blood pressure lowering arm).
Таким образом, гипокалиемия ухудшает общий прогноз за счет значительного увеличения рисков нарушения сердечного ритма и внезапной смерти, а также поражения почечного тубулоинтерстиция и при ее длительном существовании – сахарного диабета II типа.
Причины гипокалиемии разнообразны (табл. 1.6). Одной из самых частых считают «внепочечную» потерю калия при обильной рвоте или диарее, а также недостаток калия в пищевых продуктах при особом типе питания – так называемой диете «чай с тостом» («tea and toast diet»), а также у голодающих людей. Существенную роль среди причин гипокалиемии играют лекарства, в том числе часто назначаемые в популяции.
Отдельно рассматривают гипокалиемию, не связанную с потерями калия, а обусловленную его перемещением из плазмы крови и внеклеточного пространства внутрь клеток. Снижение сывороточного уровня калия, индуцированное избытком инсулина, секретировавшегося в ответ на гипергликемию, или введением его препаратов, нередко наблюдают у больных сахарным диабетом. Гипокалиемию также регистрируют при эндогенном избытке катехоламинов или передозировке b2-агонистов.
Значительная часть случаев стойкого снижения сывороточного уровня калия связана с избыточным выделением его с мочой (так называемые «почечные» потери калия). В дифференциальном диагнозе этого варианта гипокалиемических состояний следует учитывать наличие или отсутствие у пациента артериальной гипертонии.
Таблица 1.6
Причины гипокалиемии
 В основе развития клинических признаков первичного гиперальдостеронизма лежит гиперсекреция альдостерона аденомой или диффузно гиперплазированной тканью одного или обоих надпочечников.
В основе развития клинических признаков первичного гиперальдостеронизма лежит гиперсекреция альдостерона аденомой или диффузно гиперплазированной тканью одного или обоих надпочечников.
При первичном гиперальдостеронизме выделение альдостерона происходит независимо от плазменной активности ренина, в связи с чем первичный гиперальдостеронизм всегда является гипо– или норморенинемическим. Выделяют несколько основных причин и, соответственно, несколько морфологических вариантов первичного гиперальдостеронизма:
• аденома надпочечников, продуцирующая альдостерон (альдостерома);
• билатеральная идиопатическая гиперплазия надпочечников;
• гиперальдостеронизм, подавляемый глюкокортикоидами;
• карцинома надпочечников.
Более 2/3 всех случаев первичного гиперальдостеронизма обусловлены солитарной аденомой надпочечника, продуцирующей альдостерон (альдостеромой). Размер ее, как правило, не превышает 0,5–2,0 см. Установлено, что альдостеромы встречаются почти в 3 раза чаще у мужчин, чем у женщин. Этиология альдостером неясна, однако нельзя исключить значение генетических факторов: так, эти опухоли рассматривают в качестве одного из компонентов синдрома множественной эндокринной неоплазии (МЭН) I типа.
Гиперальдостеронизм, подавляемый глюкокортикоидами, и карцинома надпочечников встречаются крайне редко.
Самым частым клиническом признаком первичного гиперальдостеронизма считают высокую систоло-диастолическую артериальную гипертонию, как правило, дебютирующую в относительно молодом возрасте. Полагают, что на первичный гиперальдостеронизм приходится не менее 7 % всех случаев трудно контролируемой артериальной гипертонии, считающейся эссенциальной. Частота первичного гиперальдостеронизма максимальна среди больных артериальной гипертензией III степени.
Одной из современных тенденций считают увеличение числа случаев первичного гиперальдостеронизма, не сопровождающихся типичными клиническими признаками синдрома Конна (в первую очередь явной гипокалиемией), и отсутствие у многих больных четкого морфологического субстрата, объясняющего стойкое повышение сывороточной концентрации альдостерона при сниженной или нормальной активности ренина плазмы. Взаимосвязь между лабораторными признаками первичного гиперальдостеронизма (в том числе соотношением «сывороточная концентрация альдостерона / активность ренина плазмы») и ростом АД подтверждена в настоящее время результатами эпидемиологических исследований. Так, данные, полученные при наблюдении за 1688 представителями популяции – потомками участников оригинальной когорты The Framingham Heart Study (исследование Framingham Offspring), свидетельствуют о том, что по мере увеличения сывороточной концентрации альдостерона достоверно возрастает вероятность развития артериальной гипертонии. У лиц из 4-й квартили (с максимальными величинами этого показателя) риск возникновения артериальной гипертонии в течение 4 лет оказался в 1,6 раза выше, чем у представителей 1-й квартили, у которых сывороточный уровень альдостерона был минимален.
Гипертензивное действие альдостерона складывается главным образом из его так называемых негеномных эффектов – индукции фосфолирирования цГМФ и увеличения концентрации ионов кальция в гладкомышечных клетках сосудов, способствующих стойкой вазоконстрикции. Кроме того, избыток альдостерона обусловливает ухудшение опосредуемого NO процесса вазодилатации (за счет снижения чувствительности к нему эндотелиоцитов) и увеличение жесткости аорты и крупных артерий.
Гипокалиемия может быть умеренной и длительно оставаться практически бессимптомной. Заподозрить первичный гиперальдостеронизм возможно на основании значительного увеличения экскреции калия с мочой при одновременном уменьшении выделения натрия. Сывороточная концентрация калия нередко остается сниженной даже после назначения антигипертензивных препаратов, способствующих «псевдонормализации» этого показателя – ингибиторов АПФ и блокаторов рецепторов ангиотензина II. Выраженная гипокалиемия, наблюдающаяся у 15–20 % больных, всегда указывает на тяжелое поражение надпочечников.
Диагноз первичного гиперальдостеронизма подтверждают определением плазменной активности ренина и сывороточной концентрации альдостерона. До выполнения этого исследования следует заблаговременно (желательно не менее чем за 3 недели) отменить ингибиторы АПФ, блокаторы рецепторов ангиотензина II, антагонисты альдостерона, петлевые и тиазидовые диуретики, а также b-адреноблокаторы. Считают, что препаратами выбора в период, предшествующий забору крови, являются a-адреноблокаторы, при их недостаточной эффективности рекомендуют присоединение антагонистов кальция.
При обследовании больных первичным гиперальдостеронизмом обязательно применение визуализирующих методов исследования, из которых преимуществами обладают компьютерная и магнитно-резонансная томография, позволяющие четко определить его морфологический вариант. При ультразвуковом исследовании брюшной полости надпочечники не видны, но если их удается обнаружить, это всегда указывает на их гиперплазию.
Подтверждают диагноз первичного гиперальдостеронизма лабораторные и визуализирующие методы исследования (табл. 1.7). Его своевременное распознавание важно, прежде всего, потому, что первичный гиперальдостеронизм представляет собой относительно часто встречающуюся в популяции и потенциально полностью устранимую причину высокой артериальной гипертонии и гипокалиемии.
Таблица 1.7
Ориентировочная программа диагностики первичного гиперальдостеронизма
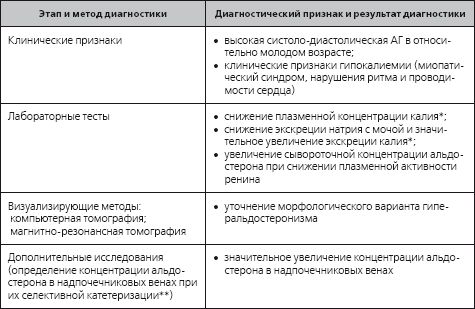 * Иногда сохраняющиеся, несмотря на прием ингибиторов АПФ и блокаторов рецепторов ангиотензина II.
* Иногда сохраняющиеся, несмотря на прием ингибиторов АПФ и блокаторов рецепторов ангиотензина II.
** Не является обязательным. Проводят только у лиц с крупными аденомами в обоих надпочечниках; удаляют тот надпочечник, в вене которого концентрация альдостерона значительно выше.
Выраженная гипокалиемия может наблюдаться при так называемых канальцевых дисфункциях с гипокалиемией (синдром Барттера, вариант Гительмана). Развитие большинства канальцевых дисфункций с гипокалиемией связано с мутациями генов, кодирующих структурные белки ионных каналов эпителиоцитов.
Синдром Барттера обусловлен гиперпродукцией почечных простагландинов. Синдром Барттера проявляется гипокалиемией, гипонатриемией и метаболическим алкалозом. Экскреция натрия и калия, а также хлоридов, как правило, значительно повышена. Артериальное давление всегда остается нормальным, значительные потери натрия могут обусловливать тенденцию к артериальной гипотонии.
При развитии гиперальдостеронизма по варианту Гительмана помимо уже названных признаков у пациентов выявляют гипомагниемию и гипокальциурию, а при гистологическом исследовании почечной ткани не обнаруживают гиперплазии юкстагломерулярного аппарата.
Все варианты cиндрома Барттера наследуются по аутосомно-рецессивному типу. Отдельно рассматривают неонатальный вариант синдрома Барттера, для которого характерно тяжелое течение с выраженными полиурией, дегидратацией, гипертермией, гиперкальциурией и ранним развитием кальциевого нефролитиаза. Дети с неонатальным вариантом синдрома Барттера, как правило, быстро погибают.
Синдром Барттера, проявившийся позднее («классический» вариант), протекает более доброкачественно. Вариант Гительмана может быть впервые диагностирован у взрослого человека. Большинство больных начинают предъявлять жалобы в возрасте до 25 лет. Типичными симптомами являются признаки гипокалиемии: мышечная слабость, парестезии, судороги. Значительное снижение уровня сывороточного калия может приводить к рабдомиолизу, осложняющемуся острой почечной недостаточностью.
Снижение осмотического давления крови, связанное с уменьшением концентрации натрия, может сопровождаться появлением небольших отеков, для борьбы с которыми пациенты самостоятельно начинают принимать петлевые и тиазидовые диуретики. Эти препараты оказываются малоэффективными, но реализуют свои побочные эффекты – способствуют усугублению потерь натрия и калия, а также развитию гиперурикемии, которая наряду с гипокалиемией повреждает почечный тубулоинтерстиций с последующим необратимым ухудшением функции почек.
Длительно существующий синдром Барттера с гипонатриемией может сопровождаться развитием вторичного гиперальдостеронизма. У таких больных гипокалиемия может быть особенно выраженной.
Гипомагниемия (при варианте Гительмана) сопровождается кальцификацией суставных хрящей, проявляющейся упорными артралгиями. Кроме того, у этих больных описаны депозиты кальция в склере и радужной оболочке глаза.
Примером канальцевой дисфункции с гипокалиемией и тяжелой артериальной гипертонией является псевдогиперальдостеронизм (синдром Лиддла) – заболевание, наследующееся по аутосомно-доминантному типу, при котором обнаруживают выраженную гипокалиемию и метаболический алкалоз с одновременной задержкой натрия. Концентрация альдостерона в крови не изменена или снижена.
Как правило, удается установить генетическую предрасположенность к псевдогиперальдостеронизму. G.W. Liddle и соавт. (1963) описали семью, у членов которой рано развивалась тяжелая артериальная гипертония и отмечалась стойкая гипокалиемия. Концентрации ренина и альдостерона при этом оставались пониженными.
Назначение блокаторов трансмембранного транспорта натрия (триамтерена) позволяет уменьшить выраженность симптомов этого заболевания. Спиронолактон, напротив, не эффективен. Это свидетельствует о том, что альдостерон не участвует в патогенезе синдрома Лиддла. Именно поэтому последний и обозначают термином «псевдогиперальдостеронизм».
Положительное действие триамтерена позволило предположить, что в основе развития синдрома Лиддла лежит генерализованный дефект трансмембранного переноса натрия, в частности, нарушение транспорта этого иона при псевдогиперальдостеронизме было обнаружено и в эритроцитах.
Задержка натрия при синдроме Лиддла обусловлена мутациями генов, кодирующих b– и g-субъединицы натриевых каналов эпителиоцитов почечных канальцев. Эти гены расположены на хромосоме 16. Идентифицировано несколько вариантов мутаций, вызывающих развитие псевдогиперальдостеронизма.
Синдром Лиддла наследуется по аутосомно-рецессивному типу. Заболевание протекает, как правило, тяжело: выявляют выраженный метаболический алкалоз, гипокалиемию, артериальное давление может достигать высоких величин. Псевдогиперальдостеронизм может приводить к хронической почечной недостаточности, однако описан полный регресс его симптомов после трансплантации почки.
Дистальный почечный канальцевый ацидоз, характеризующийся отсутствием экскреции протонов в дистальном сегменте нефрона или их избыточной реабсорбцией, нередко сочетается с фосфат-диабетом и гипокалиемией. Заболевание может быть наследственным (синдром Баттлера—Олбрайта) или вторичным, что наблюдается при синдроме Шегрена, системной красной волчанке, криоглобулинемическом гломерулонефрите, первичном билиарном циррозе.
Клиническая картина, сходная с первичным гиперальдостеронизмом, в том числе гипокалиемия, наблюдается при увеличении плазменной концентрации кортизола, вызывающего эффекты, присущие минералкортикоидам. Синдром мнимого избытка минералкортикоидов наследуется по аутосомно-рецессивному типу и проявляется главным образом артериальной гипертонией, при этом содержание ренина и альдостерона в крови снижено.
Развитие синдрома мнимого избытка минералкортикоидов обусловлено генетически детерминированной недостаточностью 11b-гидроксистероид-дегидрогеназы. В норме этот фермент, существующий в двух изоформах, участвует в преобразовании кортизола в малоактивный кортизон. Изоформа 2, экспрессирующаяся преимущественно в органах-мишенях альдостерона, определенным образом модулирует его активность за счет инактивации кортизола – потенциального конкурента за рецепторы к минералкортикоидам.
Таблица 1.8
Дифференциальный диагноз гипокалиемии, обусловленной почечными потерями калия

 *ГКС – глюкокортикостероиды; МК – минералокортикоиды.
*ГКС – глюкокортикостероиды; МК – минералокортикоиды.
Мутации в гене, кодирующем изоформу 2 11b-гидроксистероид-дегидрогеназы, приводят к недостаточности этого фермента, что сопровождается развитием синдрома мнимого избытка минералкортикоидов. У больных развивается артериальная гипертония, обусловленная связыванием кортизола с рецепторами к минералкортикоидам, также возможно cнижение сывороточной концентрации калия. При синдроме мнимого избытка минералкортикоидов отмечают увеличение содержания метаболитов кортизола (тетрагидрокортизола), в то время как концентрация метаболитов кортизона (тетрагидрокортизона) остается нормальной.
Употребление лакрицы и препаратов, изготовленных на ее основе (карбеноксонолона, использовавшегося для лечения диспепсии), также приводит к увеличению концентрации в крови кортизола. Почти 50 % больных, принимавших карбеноксолон, страдали артериальной гипертонией, связанной с действием кортизола на минералкортикоидные рецепторы, а нередко и гипокалиемией.
Лакрица и ее производные содержат глицирризиновую кислоту, при гидролизе которой образуется глицирретиновая кислота. Оба вещества являются ингибиторами 11b-гидроксистероид-дегидрогеназы. В связи с этим у больных, употребляющих лакрицу или принимающих карбеноксонолон, развивается приобретенная форма синдрома мнимого избытка минералкортикоидов.
Дифференциальный диагноз преимущественно почечных потерь калия проводят с учетом возраста дебюта заболевания и сопутствующих электролитных нарушений (табл. 1.8). Кроме того, как уже было сказано выше, следует учитывать величину АД и темп развития почечной недостаточности.
К редко встречающимся формам гипокалиемии относят семейный периодический паралич с гипокалиемией, который представляет собой редкое генетически детерминированное заболевание, проявляющееся эпизодами мышечной слабости, провоцируемыми воздействием холода или длительным пребыванием в покое, а также пищей, богатой углеводами. Мужчины болеют в два раза чаще, чем женщины.
На ЭКГ всегда выявляют признаки гипокалиемии, особенно типичным считают удлинение интервала Q—T. У пациентов, страдающих семейным периодическим параличом с гипокалиемией, часто развиваются желудочковые нарушения ритма сердца, иногда фатальные.
Развитие семейного периодического паралича с гипокалиемией связывают с мутацией гена, кодирующего a-субъединицу кальциевого канала, чувствительного к дигидропиридинам (локализация – 1q31-32). Кроме того, это заболевание может быть обусловлено мутациями в гене, кодирующем натриевый канал поперечно-полосатых мышц (SCN4A). Нормализация сывороточного уровня калия позволяет устранить мышечную слабость, но малоэффективна в предупреждении нарушений ритма сердца. Антиаритмическая терапия не разработана; противоаритмические препараты I класса противопоказаны.
Хорошо отвечает на назначение препаратов калия своеобразный вариант семейного периодического паралича с гипокалиемией, получивший название синдрома Андерсона. Для больных синдромом Андерсона характерно низкое расположение ушных раковин и гипоплазия нижней челюсти. Генетическая основа синдрома Андерсона не идентифицирована.
Снижение сывороточной концентрации калия, связанное с повышением интенсивности транспорта этого электролита в клетки, может наблюдаться при назначении препаратов инсулина. Гипокалиемия, возникающая при длительном приеме кортикостероидов, связана с минералкортикоидными эффектами, присущими этим препаратам, и может принимать участие в формировании «кортикостероидного» миопатического синдрома.
Основная причина лекарственной гипокалиемии – петлевые и тиазидовые диуретики. Их длительное применение требует увеличения потребления пищевых продуктов, содержащих калий, также оправдано назначение антагонистов альдостерона и препаратов калия.
Гипокалиемия, развивающаяся у пациентов, получающих тиазидовые диуретики в качестве антигипертензивных препаратов, всегда требует устранения. В исследовании SHEP снижение сывороточного уровня калия было зарегистрировано у 7,2 % больных, получавших хлорталидон, и только у 1 % из группы плацебо (р<0,001). Развитие гипокалиемии у больных, получавших хлорталидон, сопровождалось значительным снижением его способности предупреждать сердечно-сосудистые осложнения. Риск сердечно-сосудистых осложнений, сердечно-сосудистой смерти и мозгового инсульта у пациентов с гипокалиемией, индуцированной хлорталидоном, оказался, соответственно, на 51 %, 52 % и 71 % выше, чем у тех, у кого на фоне приема тиазидового диуретика сывороточный уровень калия остался нормальным.
Больным с гипокалиемией целесообразно назначать препараты калия. Пероральное их назначение более безопасно; при однократном приеме доза калия не должна превышать 20–40 мЭкв. При тяжелой гипокалиемии (калий плазмы < 3 мЭкв/л) растворы калия хлорида вводят внутривенно; оптимальная скорость инфузии – не более 10 ммоль/час. При внутривенном введении калия необходимы мониторинг ЭКГ и определение уровня калиемии каждые 2–3 часа. Кроме того, целесообразно увеличение потребления пищевых продуктов, содержащих достаточное количество калия (табл. 1.9).
Гипернатриемия, обусловленная снижением содержания в организме воды, в том числе осмотически свободной, может наблюдаться у пациентов со сниженным чувством жажды, употребляющих в связи с этим значительно меньшие по сравнению с необходимым объемы жидкости. Уменьшение (в ряде случаев – полное отсутствие) чувства жажды наблюдают при заболеваниях, непосредственно поражающих гипоталамус (первичная гиподипсия), или болезнях, обусловливающих «общемозговую» неврологическую симптоматику (вторичная гиподипсия) (табл. 1.5).
Таблица 1.4
Патогенетические варианты гипернатриемии


Причины снижения чувства жажды (гиподипсии)
Наиболее значимые факторы риска гипернатриемии:
• пожилой возраст (особенно при наличии сосудистой деменции, нейродегенеративных / демиелинизирующих заболеваний);
• госпитализация, особенно в отделение интенсивной терапии;
• инфузия гипертонических растворов;
• кормление через желудочный зонд;
• применение осмотических диуретиков (маннитол);
• применение лактулозы;
• искусственная вентиляция легких;
• нарушения сознания;
• заболевания, сопровождающиеся полиурией.
Лечение гипернатриемии должно обязательно включать устранение возможных факторов риска. Кроме того, для определения тактики ведения таких пациентов необходим расчет возможного дефицита воды.
Дефицит воды (л) = 0,6 х масса тела (кг) х (плазменная концентрация натрия (мЭк/л)/140) – 1
Стратегия лечения гипернатриемии включает:
• обильное питье воды и инфузию 5 %-ного водного раствора декстрозы (темп инфузии должен обеспечивать снижение концентрации натрия в плазме, составляющее 2 мЭкв/л/час);
• контроль неврологической симптоматики;
• мониторинг концентрации натрия и калия в плазме крови.
В течение первых 12–24 часов должна быть восполнена половина от рассчитанного дефицита воды. Оставшуюся половину восполняют в течение последующих 24 часов.
Нарушение калиевого гомеостаза
Подъем или снижение плазменной концентрации калия, зачастую не демонстрирующие специфических клинических проявлений, могут очень быстро приводить к смерти. Распознавание нарушений калиевого гомеостаза основано в первую очередь на выделении типичных групп риска и тщательном мониторинге динамики калиемии.
Гипокалиемия
Гипокалиемией считают стойкое снижение плазменной концентрации калия ниже 3,5 мЭкв/л. Гипокалиемию нередко обнаруживают у госпитализированных больных. Так, при обследовании 1178 больных, госпитализированных в терапевтическую клинику в течение 3 месяцев, у 140 из них (12 %) была обнаружена гипокалиемия, при этом у 104 (74 %) человек она возникла в период пребывания в стационаре.
Клинические проявления гипокалиемии включают:
• миопатию (мышечные боли, слабость, при выраженном снижении сывороточного уровня калия возможен рабдомиолиз, иногда фатальный);
• тахикардию, наджелудочковую экстрасистолию, фибрилляцию предсердий;
• снижение интенсивности перистальтики кишечника, запоры;
• периферическую полинейропатию с парестезиями.
Гипокалиемия, как правило, сопровождается изменениями ЭКГ. Риск провоцируемых гипокалиемией фибрилляции предсердий и желудочковой экстрасистолии максимален у пациентов, страдающих заболеваниями сердечно-сосудистой системы, а также у принимающих дигоксин и другие сердечные гликозиды. ЭКГ-признак гипокалиемии включает:
• увеличение частоты сердечных сокращений;
• уменьшение амплитуды зубца Т;
• удлинение интервала Q—T;
• расширение комплекса QRS;
• появление зубца U;
• атриовентрикулярную блокаду;
• наджелудочковые и желудочковые экстрасистолы;
• пароксизмальную фибрилляцию предсердий.
Стойкая гипокалиемия ассоциирована со значительным ухудшением сердечно-сосудистого прогноза, обусловленным появлением эктопических очагов в желудочках сердца и удлинением интервала Q—T, считающихся факторами риска внезапной смерти. Так, увеличение вероятности внезапной смерти выявлено у лиц с гипокалиемией, обусловленной постоянным приемом тиазидовых диуретиков, не получавших калийсберегающих препаратов. В пользу «вклада» гипокалиемии в развитие внезапной смерти свидетельствует и частое обнаружение сниженной сывороточной концентрации калия у пациентов, перенесших сердечно-легочную реанимацию. Уровень плазменного калия менее 3,5 мЭкв/л был зарегистрирован у 23 % больных с желудочковой тахикардией.
Другой мишенью гипокалиемии являются структуры почечного тубулоинтерстиция, прогрессирование поражения которых происходит несколько медленнее, чем развитие нарушений ритма сердца. При длительно существующем снижении сывороточного уровня калия наблюдают нарастающий тубулоинтерстициальный фиброз, проявляющийся полиурией и снижением относительной плотности мочи и способный приводить к терминальной почечной недостаточности, чаще наблюдаемой при «злокачественной» гипокалиемии (синдром Барттера, синдром Лиддла). Характерным признаком пораженной почки являются множественные кисты.
Длительно существующая гипокалиемия, в том числе индуцированная приемом тиазидовых диуретиков, сопровождается увеличением риска развития сахарного диабета II типа. Вероятность дебюта сахарного диабета II типа максимальна у лиц с тенденцией к повышению сывороточного уровня глюкозы, а также у больных, получающих тиазидовые диуретики в сочетании с b-адреноблокаторами. Считают, что гипокалиемия обусловливает усугубление нарушения секреции инсулина b-клетками островков Лангерганса поджелудочной железы. Рост риска сахарного диабета II типа под действием тиазидовых диуретиков установлен в нескольких крупных контролируемых исследованиях, в частности в широко известном исследовании ASCOT (blood pressure lowering arm).
Таким образом, гипокалиемия ухудшает общий прогноз за счет значительного увеличения рисков нарушения сердечного ритма и внезапной смерти, а также поражения почечного тубулоинтерстиция и при ее длительном существовании – сахарного диабета II типа.
Причины гипокалиемии разнообразны (табл. 1.6). Одной из самых частых считают «внепочечную» потерю калия при обильной рвоте или диарее, а также недостаток калия в пищевых продуктах при особом типе питания – так называемой диете «чай с тостом» («tea and toast diet»), а также у голодающих людей. Существенную роль среди причин гипокалиемии играют лекарства, в том числе часто назначаемые в популяции.
Отдельно рассматривают гипокалиемию, не связанную с потерями калия, а обусловленную его перемещением из плазмы крови и внеклеточного пространства внутрь клеток. Снижение сывороточного уровня калия, индуцированное избытком инсулина, секретировавшегося в ответ на гипергликемию, или введением его препаратов, нередко наблюдают у больных сахарным диабетом. Гипокалиемию также регистрируют при эндогенном избытке катехоламинов или передозировке b2-агонистов.
Значительная часть случаев стойкого снижения сывороточного уровня калия связана с избыточным выделением его с мочой (так называемые «почечные» потери калия). В дифференциальном диагнозе этого варианта гипокалиемических состояний следует учитывать наличие или отсутствие у пациента артериальной гипертонии.
Таблица 1.6
Причины гипокалиемии

При первичном гиперальдостеронизме выделение альдостерона происходит независимо от плазменной активности ренина, в связи с чем первичный гиперальдостеронизм всегда является гипо– или норморенинемическим. Выделяют несколько основных причин и, соответственно, несколько морфологических вариантов первичного гиперальдостеронизма:
• аденома надпочечников, продуцирующая альдостерон (альдостерома);
• билатеральная идиопатическая гиперплазия надпочечников;
• гиперальдостеронизм, подавляемый глюкокортикоидами;
• карцинома надпочечников.
Более 2/3 всех случаев первичного гиперальдостеронизма обусловлены солитарной аденомой надпочечника, продуцирующей альдостерон (альдостеромой). Размер ее, как правило, не превышает 0,5–2,0 см. Установлено, что альдостеромы встречаются почти в 3 раза чаще у мужчин, чем у женщин. Этиология альдостером неясна, однако нельзя исключить значение генетических факторов: так, эти опухоли рассматривают в качестве одного из компонентов синдрома множественной эндокринной неоплазии (МЭН) I типа.
Гиперальдостеронизм, подавляемый глюкокортикоидами, и карцинома надпочечников встречаются крайне редко.
Самым частым клиническом признаком первичного гиперальдостеронизма считают высокую систоло-диастолическую артериальную гипертонию, как правило, дебютирующую в относительно молодом возрасте. Полагают, что на первичный гиперальдостеронизм приходится не менее 7 % всех случаев трудно контролируемой артериальной гипертонии, считающейся эссенциальной. Частота первичного гиперальдостеронизма максимальна среди больных артериальной гипертензией III степени.
Одной из современных тенденций считают увеличение числа случаев первичного гиперальдостеронизма, не сопровождающихся типичными клиническими признаками синдрома Конна (в первую очередь явной гипокалиемией), и отсутствие у многих больных четкого морфологического субстрата, объясняющего стойкое повышение сывороточной концентрации альдостерона при сниженной или нормальной активности ренина плазмы. Взаимосвязь между лабораторными признаками первичного гиперальдостеронизма (в том числе соотношением «сывороточная концентрация альдостерона / активность ренина плазмы») и ростом АД подтверждена в настоящее время результатами эпидемиологических исследований. Так, данные, полученные при наблюдении за 1688 представителями популяции – потомками участников оригинальной когорты The Framingham Heart Study (исследование Framingham Offspring), свидетельствуют о том, что по мере увеличения сывороточной концентрации альдостерона достоверно возрастает вероятность развития артериальной гипертонии. У лиц из 4-й квартили (с максимальными величинами этого показателя) риск возникновения артериальной гипертонии в течение 4 лет оказался в 1,6 раза выше, чем у представителей 1-й квартили, у которых сывороточный уровень альдостерона был минимален.
Гипертензивное действие альдостерона складывается главным образом из его так называемых негеномных эффектов – индукции фосфолирирования цГМФ и увеличения концентрации ионов кальция в гладкомышечных клетках сосудов, способствующих стойкой вазоконстрикции. Кроме того, избыток альдостерона обусловливает ухудшение опосредуемого NO процесса вазодилатации (за счет снижения чувствительности к нему эндотелиоцитов) и увеличение жесткости аорты и крупных артерий.
Гипокалиемия может быть умеренной и длительно оставаться практически бессимптомной. Заподозрить первичный гиперальдостеронизм возможно на основании значительного увеличения экскреции калия с мочой при одновременном уменьшении выделения натрия. Сывороточная концентрация калия нередко остается сниженной даже после назначения антигипертензивных препаратов, способствующих «псевдонормализации» этого показателя – ингибиторов АПФ и блокаторов рецепторов ангиотензина II. Выраженная гипокалиемия, наблюдающаяся у 15–20 % больных, всегда указывает на тяжелое поражение надпочечников.
Диагноз первичного гиперальдостеронизма подтверждают определением плазменной активности ренина и сывороточной концентрации альдостерона. До выполнения этого исследования следует заблаговременно (желательно не менее чем за 3 недели) отменить ингибиторы АПФ, блокаторы рецепторов ангиотензина II, антагонисты альдостерона, петлевые и тиазидовые диуретики, а также b-адреноблокаторы. Считают, что препаратами выбора в период, предшествующий забору крови, являются a-адреноблокаторы, при их недостаточной эффективности рекомендуют присоединение антагонистов кальция.
При обследовании больных первичным гиперальдостеронизмом обязательно применение визуализирующих методов исследования, из которых преимуществами обладают компьютерная и магнитно-резонансная томография, позволяющие четко определить его морфологический вариант. При ультразвуковом исследовании брюшной полости надпочечники не видны, но если их удается обнаружить, это всегда указывает на их гиперплазию.
Подтверждают диагноз первичного гиперальдостеронизма лабораторные и визуализирующие методы исследования (табл. 1.7). Его своевременное распознавание важно, прежде всего, потому, что первичный гиперальдостеронизм представляет собой относительно часто встречающуюся в популяции и потенциально полностью устранимую причину высокой артериальной гипертонии и гипокалиемии.
Таблица 1.7
Ориентировочная программа диагностики первичного гиперальдостеронизма

** Не является обязательным. Проводят только у лиц с крупными аденомами в обоих надпочечниках; удаляют тот надпочечник, в вене которого концентрация альдостерона значительно выше.
Выраженная гипокалиемия может наблюдаться при так называемых канальцевых дисфункциях с гипокалиемией (синдром Барттера, вариант Гительмана). Развитие большинства канальцевых дисфункций с гипокалиемией связано с мутациями генов, кодирующих структурные белки ионных каналов эпителиоцитов.
Синдром Барттера обусловлен гиперпродукцией почечных простагландинов. Синдром Барттера проявляется гипокалиемией, гипонатриемией и метаболическим алкалозом. Экскреция натрия и калия, а также хлоридов, как правило, значительно повышена. Артериальное давление всегда остается нормальным, значительные потери натрия могут обусловливать тенденцию к артериальной гипотонии.
При развитии гиперальдостеронизма по варианту Гительмана помимо уже названных признаков у пациентов выявляют гипомагниемию и гипокальциурию, а при гистологическом исследовании почечной ткани не обнаруживают гиперплазии юкстагломерулярного аппарата.
Все варианты cиндрома Барттера наследуются по аутосомно-рецессивному типу. Отдельно рассматривают неонатальный вариант синдрома Барттера, для которого характерно тяжелое течение с выраженными полиурией, дегидратацией, гипертермией, гиперкальциурией и ранним развитием кальциевого нефролитиаза. Дети с неонатальным вариантом синдрома Барттера, как правило, быстро погибают.
Синдром Барттера, проявившийся позднее («классический» вариант), протекает более доброкачественно. Вариант Гительмана может быть впервые диагностирован у взрослого человека. Большинство больных начинают предъявлять жалобы в возрасте до 25 лет. Типичными симптомами являются признаки гипокалиемии: мышечная слабость, парестезии, судороги. Значительное снижение уровня сывороточного калия может приводить к рабдомиолизу, осложняющемуся острой почечной недостаточностью.
Снижение осмотического давления крови, связанное с уменьшением концентрации натрия, может сопровождаться появлением небольших отеков, для борьбы с которыми пациенты самостоятельно начинают принимать петлевые и тиазидовые диуретики. Эти препараты оказываются малоэффективными, но реализуют свои побочные эффекты – способствуют усугублению потерь натрия и калия, а также развитию гиперурикемии, которая наряду с гипокалиемией повреждает почечный тубулоинтерстиций с последующим необратимым ухудшением функции почек.
Длительно существующий синдром Барттера с гипонатриемией может сопровождаться развитием вторичного гиперальдостеронизма. У таких больных гипокалиемия может быть особенно выраженной.
Гипомагниемия (при варианте Гительмана) сопровождается кальцификацией суставных хрящей, проявляющейся упорными артралгиями. Кроме того, у этих больных описаны депозиты кальция в склере и радужной оболочке глаза.
Примером канальцевой дисфункции с гипокалиемией и тяжелой артериальной гипертонией является псевдогиперальдостеронизм (синдром Лиддла) – заболевание, наследующееся по аутосомно-доминантному типу, при котором обнаруживают выраженную гипокалиемию и метаболический алкалоз с одновременной задержкой натрия. Концентрация альдостерона в крови не изменена или снижена.
Как правило, удается установить генетическую предрасположенность к псевдогиперальдостеронизму. G.W. Liddle и соавт. (1963) описали семью, у членов которой рано развивалась тяжелая артериальная гипертония и отмечалась стойкая гипокалиемия. Концентрации ренина и альдостерона при этом оставались пониженными.
Назначение блокаторов трансмембранного транспорта натрия (триамтерена) позволяет уменьшить выраженность симптомов этого заболевания. Спиронолактон, напротив, не эффективен. Это свидетельствует о том, что альдостерон не участвует в патогенезе синдрома Лиддла. Именно поэтому последний и обозначают термином «псевдогиперальдостеронизм».
Положительное действие триамтерена позволило предположить, что в основе развития синдрома Лиддла лежит генерализованный дефект трансмембранного переноса натрия, в частности, нарушение транспорта этого иона при псевдогиперальдостеронизме было обнаружено и в эритроцитах.
Задержка натрия при синдроме Лиддла обусловлена мутациями генов, кодирующих b– и g-субъединицы натриевых каналов эпителиоцитов почечных канальцев. Эти гены расположены на хромосоме 16. Идентифицировано несколько вариантов мутаций, вызывающих развитие псевдогиперальдостеронизма.
Синдром Лиддла наследуется по аутосомно-рецессивному типу. Заболевание протекает, как правило, тяжело: выявляют выраженный метаболический алкалоз, гипокалиемию, артериальное давление может достигать высоких величин. Псевдогиперальдостеронизм может приводить к хронической почечной недостаточности, однако описан полный регресс его симптомов после трансплантации почки.
Дистальный почечный канальцевый ацидоз, характеризующийся отсутствием экскреции протонов в дистальном сегменте нефрона или их избыточной реабсорбцией, нередко сочетается с фосфат-диабетом и гипокалиемией. Заболевание может быть наследственным (синдром Баттлера—Олбрайта) или вторичным, что наблюдается при синдроме Шегрена, системной красной волчанке, криоглобулинемическом гломерулонефрите, первичном билиарном циррозе.
Клиническая картина, сходная с первичным гиперальдостеронизмом, в том числе гипокалиемия, наблюдается при увеличении плазменной концентрации кортизола, вызывающего эффекты, присущие минералкортикоидам. Синдром мнимого избытка минералкортикоидов наследуется по аутосомно-рецессивному типу и проявляется главным образом артериальной гипертонией, при этом содержание ренина и альдостерона в крови снижено.
Развитие синдрома мнимого избытка минералкортикоидов обусловлено генетически детерминированной недостаточностью 11b-гидроксистероид-дегидрогеназы. В норме этот фермент, существующий в двух изоформах, участвует в преобразовании кортизола в малоактивный кортизон. Изоформа 2, экспрессирующаяся преимущественно в органах-мишенях альдостерона, определенным образом модулирует его активность за счет инактивации кортизола – потенциального конкурента за рецепторы к минералкортикоидам.
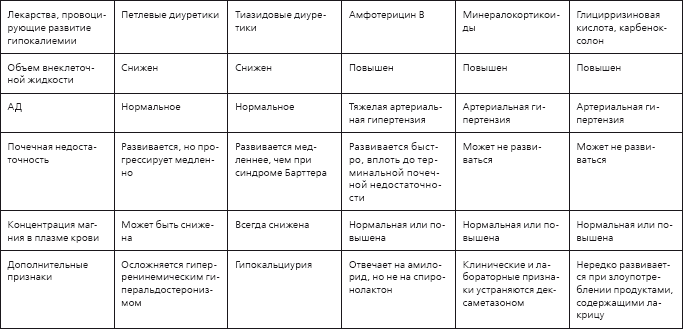
Таблица 1.8
Дифференциальный диагноз гипокалиемии, обусловленной почечными потерями калия


Мутации в гене, кодирующем изоформу 2 11b-гидроксистероид-дегидрогеназы, приводят к недостаточности этого фермента, что сопровождается развитием синдрома мнимого избытка минералкортикоидов. У больных развивается артериальная гипертония, обусловленная связыванием кортизола с рецепторами к минералкортикоидам, также возможно cнижение сывороточной концентрации калия. При синдроме мнимого избытка минералкортикоидов отмечают увеличение содержания метаболитов кортизола (тетрагидрокортизола), в то время как концентрация метаболитов кортизона (тетрагидрокортизона) остается нормальной.
Употребление лакрицы и препаратов, изготовленных на ее основе (карбеноксонолона, использовавшегося для лечения диспепсии), также приводит к увеличению концентрации в крови кортизола. Почти 50 % больных, принимавших карбеноксолон, страдали артериальной гипертонией, связанной с действием кортизола на минералкортикоидные рецепторы, а нередко и гипокалиемией.
Лакрица и ее производные содержат глицирризиновую кислоту, при гидролизе которой образуется глицирретиновая кислота. Оба вещества являются ингибиторами 11b-гидроксистероид-дегидрогеназы. В связи с этим у больных, употребляющих лакрицу или принимающих карбеноксонолон, развивается приобретенная форма синдрома мнимого избытка минералкортикоидов.
Дифференциальный диагноз преимущественно почечных потерь калия проводят с учетом возраста дебюта заболевания и сопутствующих электролитных нарушений (табл. 1.8). Кроме того, как уже было сказано выше, следует учитывать величину АД и темп развития почечной недостаточности.
К редко встречающимся формам гипокалиемии относят семейный периодический паралич с гипокалиемией, который представляет собой редкое генетически детерминированное заболевание, проявляющееся эпизодами мышечной слабости, провоцируемыми воздействием холода или длительным пребыванием в покое, а также пищей, богатой углеводами. Мужчины болеют в два раза чаще, чем женщины.
На ЭКГ всегда выявляют признаки гипокалиемии, особенно типичным считают удлинение интервала Q—T. У пациентов, страдающих семейным периодическим параличом с гипокалиемией, часто развиваются желудочковые нарушения ритма сердца, иногда фатальные.
Развитие семейного периодического паралича с гипокалиемией связывают с мутацией гена, кодирующего a-субъединицу кальциевого канала, чувствительного к дигидропиридинам (локализация – 1q31-32). Кроме того, это заболевание может быть обусловлено мутациями в гене, кодирующем натриевый канал поперечно-полосатых мышц (SCN4A). Нормализация сывороточного уровня калия позволяет устранить мышечную слабость, но малоэффективна в предупреждении нарушений ритма сердца. Антиаритмическая терапия не разработана; противоаритмические препараты I класса противопоказаны.
Хорошо отвечает на назначение препаратов калия своеобразный вариант семейного периодического паралича с гипокалиемией, получивший название синдрома Андерсона. Для больных синдромом Андерсона характерно низкое расположение ушных раковин и гипоплазия нижней челюсти. Генетическая основа синдрома Андерсона не идентифицирована.
Снижение сывороточной концентрации калия, связанное с повышением интенсивности транспорта этого электролита в клетки, может наблюдаться при назначении препаратов инсулина. Гипокалиемия, возникающая при длительном приеме кортикостероидов, связана с минералкортикоидными эффектами, присущими этим препаратам, и может принимать участие в формировании «кортикостероидного» миопатического синдрома.
Основная причина лекарственной гипокалиемии – петлевые и тиазидовые диуретики. Их длительное применение требует увеличения потребления пищевых продуктов, содержащих калий, также оправдано назначение антагонистов альдостерона и препаратов калия.
Гипокалиемия, развивающаяся у пациентов, получающих тиазидовые диуретики в качестве антигипертензивных препаратов, всегда требует устранения. В исследовании SHEP снижение сывороточного уровня калия было зарегистрировано у 7,2 % больных, получавших хлорталидон, и только у 1 % из группы плацебо (р<0,001). Развитие гипокалиемии у больных, получавших хлорталидон, сопровождалось значительным снижением его способности предупреждать сердечно-сосудистые осложнения. Риск сердечно-сосудистых осложнений, сердечно-сосудистой смерти и мозгового инсульта у пациентов с гипокалиемией, индуцированной хлорталидоном, оказался, соответственно, на 51 %, 52 % и 71 % выше, чем у тех, у кого на фоне приема тиазидового диуретика сывороточный уровень калия остался нормальным.
Больным с гипокалиемией целесообразно назначать препараты калия. Пероральное их назначение более безопасно; при однократном приеме доза калия не должна превышать 20–40 мЭкв. При тяжелой гипокалиемии (калий плазмы < 3 мЭкв/л) растворы калия хлорида вводят внутривенно; оптимальная скорость инфузии – не более 10 ммоль/час. При внутривенном введении калия необходимы мониторинг ЭКГ и определение уровня калиемии каждые 2–3 часа. Кроме того, целесообразно увеличение потребления пищевых продуктов, содержащих достаточное количество калия (табл. 1.9).
