Чтобы ответить на этот и подобные вопросы, химики должны были начать систематическое изучение газов, должны были научиться работать со столь трудно уловимыми веществами.
Важный шаг в этом направлении в начале XVIII в. сделал английский ботаник и химик Стивен Гейлс (1677—1761). Он изобрел прибор для собирания газов над водой. Этот прибор известен нам под названием «пневматической ванны». Пары, образующиеся в результате химической реакции, Гейлс отводил через трубку в сосуде водой, опущенный вверх дном в ванну с водой. Пузырьки газа поднимались в верхнюю часть сосуда и вытесняли оттуда воду. Таким образом Гейлс собирал газ или газы, образующиеся в результате реакции. Сам Гейлс не идентифицировал собранные газы и не изучал их свойств, однако сконструированный им прибор для собирания газов сыграл важную роль в развитии пневматической химии.
Другой важный шаг был сделан шотландским химиком Джозефом Блэком (1728—1799). Диссертация, которая принесла ему степень магистра медицины в 1754 г., была связана с химической проблемой и непосредственно касалась свойств газов, выделяющихся при действии кислот на «мягкие» (углекислые) щелочи. (Во времена Блэка химия и медицина были тесно взаимосвязаны.) Блэк установил, что известковый минерал (карбонат кальция) при нагревании разлагается с выделением газа и образует известь (оксид кальция). Выделяющийся газ можно было вновь соединить с оксидом кальция и вновь получить карбонат кальция. Этот газ (диоксид углерода) был идентичен открытому Ван Гельмонтом «лесному газу» (см. гл. 3), но Блэк назвал его «связанным воздухом», так как этот газ можно было связать и вновь получить твердую субстанцию.
Открытие Блэка было важным по ряду причин. Во-первых, он показал, что углекислый газ может образовываться при нагревании минерала подобно тому, как этот газ образуется при горении дерева. Таким образом была установлена очевидная взаимосвязь между живой и неживой природой.
Кроме того, Блэк показал, что газообразные вещества не только выделяются твердыми телами или жидкостями, но могут активно с ними соединяться, вступать в химические реакции. Это открытие сделало газы менее загадочными. Теперь на них стали смотреть как на обычные вещества, несколько отличающиеся по свойствам (по крайней мере химическим) от более знакомых твердых и жидких веществ.
Далее Блэк показал, что если оксид кальция оставить на воздухе, то он медленно превращается в карбонат кальция. Исходя из этого, Блэк заключил (правильно!), что в атмосфере присутствует небольшое количество углекислого газа. Это было первое четкое указание на то, что воздух не простое вещество и, следовательно, вопреки представлениям древних греков он не является элементом в определении Бойля, а представляет собой смесь по крайней мере двух различных веществ: обычного воздуха и углекислого газа. Изучая влияние нагревания на примере карбоната кальция, Блэк установил, как меняется вес вещества при нагревании. Он также определил, какое количество карбоната кальция нейтрализует заданное количество кислоты. Таким образом, Блэк изучал химические реакции, используя метод количественного измерения. Этот метод был развит и усовершенствован Лавуазье [28].
Изучая свойства углекислого газа, Блэк обнаружил, что свеча в нем не горит. Свеча, горящая в закрытом сосуде с обычным воздухом, в конце концов гаснет, и оставшийся воздух уже не поддерживает горения. Такое явление, конечно же, не казалось беспричинным, поскольку было известно, что при горении свечи образуется углекислый газ. Но когда Блэк абсорбировал углекислый газ, оставшийся воздух, который заведомо не был углекислым газом, горение не поддерживал.
Блэк предложил изучить эту проблему одному из своих учеников — шотландскому химику Даниелю Резерфорду (1749—1819). Резерфорд поставил следующий опыт: он держал мышь в ограниченном объеме воздуха до тех пор, пока она не погибла. Затем в оставшемся воздухе он держал горящую свечу, пока она не гасла. В оставшийся после всего этого воздух он поместил горящий фосфор, который горел там очень недолго. Далее Резерфорд пропустил воздух через раствор, способный абсорбировать углекислый газ. В оставшемся в результате воздухе свеча не горела, а мышь гибла.
Резерфорд сообщил об этом опыте в 1772 г. Поскольку и Резерфорд, и Блэк были убежденными сторонниками теории флогистона, то, объясняя результаты проведенных ими опытов, они пользовались представлениями этой теории. Пока мыши дышали и пока свечи и фосфор горели, флогистон выделялся и поступал в воздух вместе с образующимся углекислым газом. Воздух, из которого удалили углекислый газ, содержал так много флогистона, что был как бы «пропитан» им. Этот воздух больше принять флогистона уже не мог, и поэтому ни свеча, ни фосфор в нем не горели.
В связи с этим Резерфорд назвал выделенный им газ «флогистированным воздухом». Сегодня мы называем его азотом.
Водород и кислород
Триумф измерения
Горение
Важный шаг в этом направлении в начале XVIII в. сделал английский ботаник и химик Стивен Гейлс (1677—1761). Он изобрел прибор для собирания газов над водой. Этот прибор известен нам под названием «пневматической ванны». Пары, образующиеся в результате химической реакции, Гейлс отводил через трубку в сосуде водой, опущенный вверх дном в ванну с водой. Пузырьки газа поднимались в верхнюю часть сосуда и вытесняли оттуда воду. Таким образом Гейлс собирал газ или газы, образующиеся в результате реакции. Сам Гейлс не идентифицировал собранные газы и не изучал их свойств, однако сконструированный им прибор для собирания газов сыграл важную роль в развитии пневматической химии.
Другой важный шаг был сделан шотландским химиком Джозефом Блэком (1728—1799). Диссертация, которая принесла ему степень магистра медицины в 1754 г., была связана с химической проблемой и непосредственно касалась свойств газов, выделяющихся при действии кислот на «мягкие» (углекислые) щелочи. (Во времена Блэка химия и медицина были тесно взаимосвязаны.) Блэк установил, что известковый минерал (карбонат кальция) при нагревании разлагается с выделением газа и образует известь (оксид кальция). Выделяющийся газ можно было вновь соединить с оксидом кальция и вновь получить карбонат кальция. Этот газ (диоксид углерода) был идентичен открытому Ван Гельмонтом «лесному газу» (см. гл. 3), но Блэк назвал его «связанным воздухом», так как этот газ можно было связать и вновь получить твердую субстанцию.
Открытие Блэка было важным по ряду причин. Во-первых, он показал, что углекислый газ может образовываться при нагревании минерала подобно тому, как этот газ образуется при горении дерева. Таким образом была установлена очевидная взаимосвязь между живой и неживой природой.
Кроме того, Блэк показал, что газообразные вещества не только выделяются твердыми телами или жидкостями, но могут активно с ними соединяться, вступать в химические реакции. Это открытие сделало газы менее загадочными. Теперь на них стали смотреть как на обычные вещества, несколько отличающиеся по свойствам (по крайней мере химическим) от более знакомых твердых и жидких веществ.
Далее Блэк показал, что если оксид кальция оставить на воздухе, то он медленно превращается в карбонат кальция. Исходя из этого, Блэк заключил (правильно!), что в атмосфере присутствует небольшое количество углекислого газа. Это было первое четкое указание на то, что воздух не простое вещество и, следовательно, вопреки представлениям древних греков он не является элементом в определении Бойля, а представляет собой смесь по крайней мере двух различных веществ: обычного воздуха и углекислого газа. Изучая влияние нагревания на примере карбоната кальция, Блэк установил, как меняется вес вещества при нагревании. Он также определил, какое количество карбоната кальция нейтрализует заданное количество кислоты. Таким образом, Блэк изучал химические реакции, используя метод количественного измерения. Этот метод был развит и усовершенствован Лавуазье [28].
Изучая свойства углекислого газа, Блэк обнаружил, что свеча в нем не горит. Свеча, горящая в закрытом сосуде с обычным воздухом, в конце концов гаснет, и оставшийся воздух уже не поддерживает горения. Такое явление, конечно же, не казалось беспричинным, поскольку было известно, что при горении свечи образуется углекислый газ. Но когда Блэк абсорбировал углекислый газ, оставшийся воздух, который заведомо не был углекислым газом, горение не поддерживал.
Блэк предложил изучить эту проблему одному из своих учеников — шотландскому химику Даниелю Резерфорду (1749—1819). Резерфорд поставил следующий опыт: он держал мышь в ограниченном объеме воздуха до тех пор, пока она не погибла. Затем в оставшемся воздухе он держал горящую свечу, пока она не гасла. В оставшийся после всего этого воздух он поместил горящий фосфор, который горел там очень недолго. Далее Резерфорд пропустил воздух через раствор, способный абсорбировать углекислый газ. В оставшемся в результате воздухе свеча не горела, а мышь гибла.
Резерфорд сообщил об этом опыте в 1772 г. Поскольку и Резерфорд, и Блэк были убежденными сторонниками теории флогистона, то, объясняя результаты проведенных ими опытов, они пользовались представлениями этой теории. Пока мыши дышали и пока свечи и фосфор горели, флогистон выделялся и поступал в воздух вместе с образующимся углекислым газом. Воздух, из которого удалили углекислый газ, содержал так много флогистона, что был как бы «пропитан» им. Этот воздух больше принять флогистона уже не мог, и поэтому ни свеча, ни фосфор в нем не горели.
В связи с этим Резерфорд назвал выделенный им газ «флогистированным воздухом». Сегодня мы называем его азотом.
Водород и кислород
Одновременно с Блэком и Резерфордом успехов в изучении газов добились два других английских химика — Кавендиш и Пристли, также принадлежавшие к числу сторонников флогистонной теории.
Генри Кавендиш (1731—1810) был богатым чудаком, который занимался исследованиями в самых различных областях. Замкнутый по натуре, он не всегда публиковал результаты проведенных им работ. К счастью, результаты своих работ с газами он все же опубликовал.
Кавендиша (возможно, под влиянием Дж. Блэка) особенно заинтересовал газ, образующийся при взаимодействии кислот с некоторыми металлами. Ранее этот газ был выделен Бойлем и Гейлсом, а возможно, и другими исследователями, но Кавендиш первым в 1766 г. провел систематическое изучение его свойств, поэтому ему обычно и приписывается честь открытия этого газа, получившего название водород.
Кавендиш первым установил вес определенных объемов различных газов и в результате сумел установить плотность каждого из них. Он обнаружил, что водород необычайно легок и что его плотность составляет лишь 1/14 плотности воздуха. (И в настоящее время это самый легкий из известных нам газов.) Как выяснилось, водород обладает еще одним необычным свойством: в отличие от углекислого газа и собственно воздуха он легко воспламеняется, и Кавендиш не исключал вероятности того, что он получил сам флогистон.
Вторым химиком, добившимся успехов в изучении газов, был Джозеф Пристли (1733—1804) — протестантский священник, глубоко увлеченный химией. В конце 60-х годов XVIII в. он принял пасторство в Лидсе (Англия). Рядом с Лидсом находился пивоваренный завод, откуда Пристли мог получать углекислый газ в количествах, достаточных для проведения опытов (углекислый газ; образуется при брожении пивного сусла).
Собирая углекислый газ над водой, Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий привкус. По сути дела Пристли получил напиток типа сельтерской или содовой воды. Поскольку для получения «ситро» необходимо прибавить только сахар и ароматизировать напиток, Пристли можно считать отцом современной индустрии безалкогольных напитков.
В начале 70-х годов XVIII в., когда Пристли вновь занялся изучением газов, химики четко различали только три газа — собственно воздух, углекислый газ Ван Гельмонта и Блэка и водород. Кавендиша; Резерфорд был близок к открытию четвертого газа — азота. Пристли сопутствовала удача: он выделил и изучил еще ряд. газов.
Опыты Пристли с углекислым газом показали, что газы могут растворяться в воде и, следовательно «теряться», поэтому он попытался собирать газы не над водой, а над ртутью. Таким образом, Пристли сумел собрать и изучить такие газы, как оксид азота (I), аммиак, хлорид водорода и диоксид серы (мы даем современные названия газов). Все эти газы настолько хорошо растворяются в воде, что, проходя через нее, полностью поглощаются.
В 1774 г. Пристли сделал, возможно, самое важное свое открытие. Как уже говорилось выше, он собирал газы над ртутью. При нагревании на воздухе ртуть образует кирпично-красную «окалину»-(оксид ртути). Пристли клал немного окалины в пробирку и нагревал ее, фокусируя на ней с помощью линзы солнечные лучи. Окалина при этом вновь превращалась в ртуть, и в верхней части пробирки появлялись блестящие шарики металла. При разложении окалины выделялся газ с весьма необычными свойствами. Горючие вещества горели в этом газе быстрее и ярче, чем на воздухе. Тлеющая лучина, брошенная в сосуд с этим газом, вспыхивала ярким пламенем.
Пристли пытался объяснить это явление, используя теорию флогистона. Поскольку горючие вещества горели в этом газе весьма ярко, то они должны были очень легко выделять флогистон. Чем объяснить это? Как следует из теории флогистона, воздух легко поглощает флогистон, но до определенного предела, после чего горение прекращается. В открытом Пристли газе горение шло лучше, чем в воздухе, и он решил, что этот газ совсем не содержит флогистона. Пристли назвал открытый им газ «дефлогистированным» воздухом». (Однако через несколько лет его переименовали в кислород; этим названием мы пользуемся и сегодня.)
«Дефлогистированный воздух» Пристли казался своего рода антиподом «флогистированного воздуха» Резерфорда. В последнем газе мыши умирали, тогда как в первом были весьма деятельными. Пристли сам попробовал подышать «дефлогистированным воздухом» и почувствовал при этом себя «легко и свободно».
Однако в открытии кислорода и Резерфорда и Пристли опередил шведский химик Карл Вильгельм Шееле (1742—1786) — представитель той плеяды химиков, которые вывели Швецию в XVIII в. на передовые позиции науки.
Приблизительно в 1735 г. шведский химик Георг Брандт (1694—1768) начал изучать голубоватый минерал, напоминавший медную руду. Несмотря на такое сходство, получить из этого минерала медь при обычной обработке не удавалось. Рудокопы полагали, что эта руда заколдована земными духами «кобольдами». В 1742—1744 гг. Брандт сумел показать, что голубоватый минерал содержит не медь, а совершенно иной металл, напоминающий по своим химическим свойствам железо. Этот металл получил название кобальт.
В 1751 г. Аксель Фредрик Кронстедт (1722—1765) открыл новый металл никель, очень похожий на кобальт; Иоганн Готлиб Ган (1745—1818) выделил в 1774 г. марганец, а Петер Якоб Гьельм (1746—1813) получил в 1782 г. молибден.
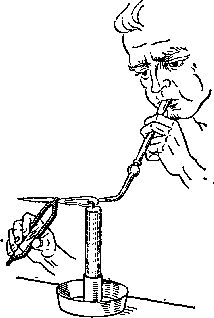
Рис. 6. Паяльная трубка, введенная в лабораторную практику шведским химиком Кронстедтом (1722—1765), более века была ключевым инструментом химического анализа; этот метод используется до сих пор. Струя воздуха повышает температуру пламени и может менять его направление.
Кронстедт при изучении минералов впервые применил паяльную трубку (рис. 6). Это была длинная постепенно сужающаяся трубка, из узкого конца которой выходила струя сжатого воздуха. Когда такую струю направляли в пламя, температура его повышалась. Минералы, нагреваемые в пламени паяльной трубки, окрашивали его в различные цвета, поэтому по цвету пламени можно было судить о природе и составе минерала, о природе образовавшихся паров и твердого остатка. На протяжении столетия паяльная трубка оставалась основным инструментом химического анализа.
Благодаря использованию новых технических приемов, подобных анализу в пламени паяльной трубки, химикам удалось накопить достаточно много данных о минералах. Исходя из этих данных,. Кронстедт вполне справедливо полагал, что минералы следует классифицировать не только в соответствии с их внешним видом, но и в соответствии с их химической структурой. В 1758 г. он выпустил книгу «Система минералогии», в которой детально описал. новую систему классификации.
Эта работа была продолжена другим шведским минералогом Торберном Улафом Бергманом (1735—1784). Бергман развил теорию, объясняющую, почему одно вещество реагирует с другим веществом, но не реагирует с третьим. Он же предположил, что между веществами существует «сродство» (affinities), и составил тщательно выверенные таблицы различных величин сродства. Эти таблицы пользовались широкой известностью при жизни их создателя и пережили его на несколько десятилетий.
Шееле, еще будучи помощником аптекаря, обратил на себя внимание Бергмана, который помогал ему и поддерживал его. Шееле открыл ряд кислот растительного и животного происхождения, в том числе винную, лимонную, бензойную, яблочную, щавелевую, галловую, молочную, мочевую, а также такие минеральные кислоты, как молибденовая и мышьяковая.
Шееле получил и изучил три сильно ядовитых газа: фторид водорода, сульфид водорода и цианид водорода. (Предполагают, что его ранняя смерть явилась результатом медленного отравления химикалиями, так как он имел обыкновение пробовать на вкус те вещества, с которыми работал.)
Шееле был в числе тех химиков, исследования которых привели к открытию многих элементов, и пользовался большим уважением шведских коллег. Наиболее важные его открытия — получение кислорода и азота (соответственно в 1771 и 1772 гг.). Шееле получал кислород, нагревая вещества, непрочно его удерживающие. В частности, он нагревал тот самый красный оксид ртути, которым несколько лет спустя воспользовался Пристли.
Шееле подробно описал свои опыты по получению и столь же подробно описал свойства «огненного воздуха» (так он называл кислород), но из-за небрежности его издателя эти описания непоявлялись в печати до 1777 г. К этому времени вышли труды Резерфорда и Пристли, которые и завоевали честь первооткрывателей.
Генри Кавендиш (1731—1810) был богатым чудаком, который занимался исследованиями в самых различных областях. Замкнутый по натуре, он не всегда публиковал результаты проведенных им работ. К счастью, результаты своих работ с газами он все же опубликовал.
Кавендиша (возможно, под влиянием Дж. Блэка) особенно заинтересовал газ, образующийся при взаимодействии кислот с некоторыми металлами. Ранее этот газ был выделен Бойлем и Гейлсом, а возможно, и другими исследователями, но Кавендиш первым в 1766 г. провел систематическое изучение его свойств, поэтому ему обычно и приписывается честь открытия этого газа, получившего название водород.
Кавендиш первым установил вес определенных объемов различных газов и в результате сумел установить плотность каждого из них. Он обнаружил, что водород необычайно легок и что его плотность составляет лишь 1/14 плотности воздуха. (И в настоящее время это самый легкий из известных нам газов.) Как выяснилось, водород обладает еще одним необычным свойством: в отличие от углекислого газа и собственно воздуха он легко воспламеняется, и Кавендиш не исключал вероятности того, что он получил сам флогистон.
Вторым химиком, добившимся успехов в изучении газов, был Джозеф Пристли (1733—1804) — протестантский священник, глубоко увлеченный химией. В конце 60-х годов XVIII в. он принял пасторство в Лидсе (Англия). Рядом с Лидсом находился пивоваренный завод, откуда Пристли мог получать углекислый газ в количествах, достаточных для проведения опытов (углекислый газ; образуется при брожении пивного сусла).
Собирая углекислый газ над водой, Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий привкус. По сути дела Пристли получил напиток типа сельтерской или содовой воды. Поскольку для получения «ситро» необходимо прибавить только сахар и ароматизировать напиток, Пристли можно считать отцом современной индустрии безалкогольных напитков.
В начале 70-х годов XVIII в., когда Пристли вновь занялся изучением газов, химики четко различали только три газа — собственно воздух, углекислый газ Ван Гельмонта и Блэка и водород. Кавендиша; Резерфорд был близок к открытию четвертого газа — азота. Пристли сопутствовала удача: он выделил и изучил еще ряд. газов.
Опыты Пристли с углекислым газом показали, что газы могут растворяться в воде и, следовательно «теряться», поэтому он попытался собирать газы не над водой, а над ртутью. Таким образом, Пристли сумел собрать и изучить такие газы, как оксид азота (I), аммиак, хлорид водорода и диоксид серы (мы даем современные названия газов). Все эти газы настолько хорошо растворяются в воде, что, проходя через нее, полностью поглощаются.
В 1774 г. Пристли сделал, возможно, самое важное свое открытие. Как уже говорилось выше, он собирал газы над ртутью. При нагревании на воздухе ртуть образует кирпично-красную «окалину»-(оксид ртути). Пристли клал немного окалины в пробирку и нагревал ее, фокусируя на ней с помощью линзы солнечные лучи. Окалина при этом вновь превращалась в ртуть, и в верхней части пробирки появлялись блестящие шарики металла. При разложении окалины выделялся газ с весьма необычными свойствами. Горючие вещества горели в этом газе быстрее и ярче, чем на воздухе. Тлеющая лучина, брошенная в сосуд с этим газом, вспыхивала ярким пламенем.
Пристли пытался объяснить это явление, используя теорию флогистона. Поскольку горючие вещества горели в этом газе весьма ярко, то они должны были очень легко выделять флогистон. Чем объяснить это? Как следует из теории флогистона, воздух легко поглощает флогистон, но до определенного предела, после чего горение прекращается. В открытом Пристли газе горение шло лучше, чем в воздухе, и он решил, что этот газ совсем не содержит флогистона. Пристли назвал открытый им газ «дефлогистированным» воздухом». (Однако через несколько лет его переименовали в кислород; этим названием мы пользуемся и сегодня.)
«Дефлогистированный воздух» Пристли казался своего рода антиподом «флогистированного воздуха» Резерфорда. В последнем газе мыши умирали, тогда как в первом были весьма деятельными. Пристли сам попробовал подышать «дефлогистированным воздухом» и почувствовал при этом себя «легко и свободно».
Однако в открытии кислорода и Резерфорда и Пристли опередил шведский химик Карл Вильгельм Шееле (1742—1786) — представитель той плеяды химиков, которые вывели Швецию в XVIII в. на передовые позиции науки.
Приблизительно в 1735 г. шведский химик Георг Брандт (1694—1768) начал изучать голубоватый минерал, напоминавший медную руду. Несмотря на такое сходство, получить из этого минерала медь при обычной обработке не удавалось. Рудокопы полагали, что эта руда заколдована земными духами «кобольдами». В 1742—1744 гг. Брандт сумел показать, что голубоватый минерал содержит не медь, а совершенно иной металл, напоминающий по своим химическим свойствам железо. Этот металл получил название кобальт.
В 1751 г. Аксель Фредрик Кронстедт (1722—1765) открыл новый металл никель, очень похожий на кобальт; Иоганн Готлиб Ган (1745—1818) выделил в 1774 г. марганец, а Петер Якоб Гьельм (1746—1813) получил в 1782 г. молибден.

Рис. 6. Паяльная трубка, введенная в лабораторную практику шведским химиком Кронстедтом (1722—1765), более века была ключевым инструментом химического анализа; этот метод используется до сих пор. Струя воздуха повышает температуру пламени и может менять его направление.
Кронстедт при изучении минералов впервые применил паяльную трубку (рис. 6). Это была длинная постепенно сужающаяся трубка, из узкого конца которой выходила струя сжатого воздуха. Когда такую струю направляли в пламя, температура его повышалась. Минералы, нагреваемые в пламени паяльной трубки, окрашивали его в различные цвета, поэтому по цвету пламени можно было судить о природе и составе минерала, о природе образовавшихся паров и твердого остатка. На протяжении столетия паяльная трубка оставалась основным инструментом химического анализа.
Благодаря использованию новых технических приемов, подобных анализу в пламени паяльной трубки, химикам удалось накопить достаточно много данных о минералах. Исходя из этих данных,. Кронстедт вполне справедливо полагал, что минералы следует классифицировать не только в соответствии с их внешним видом, но и в соответствии с их химической структурой. В 1758 г. он выпустил книгу «Система минералогии», в которой детально описал. новую систему классификации.
Эта работа была продолжена другим шведским минералогом Торберном Улафом Бергманом (1735—1784). Бергман развил теорию, объясняющую, почему одно вещество реагирует с другим веществом, но не реагирует с третьим. Он же предположил, что между веществами существует «сродство» (affinities), и составил тщательно выверенные таблицы различных величин сродства. Эти таблицы пользовались широкой известностью при жизни их создателя и пережили его на несколько десятилетий.
Шееле, еще будучи помощником аптекаря, обратил на себя внимание Бергмана, который помогал ему и поддерживал его. Шееле открыл ряд кислот растительного и животного происхождения, в том числе винную, лимонную, бензойную, яблочную, щавелевую, галловую, молочную, мочевую, а также такие минеральные кислоты, как молибденовая и мышьяковая.
Шееле получил и изучил три сильно ядовитых газа: фторид водорода, сульфид водорода и цианид водорода. (Предполагают, что его ранняя смерть явилась результатом медленного отравления химикалиями, так как он имел обыкновение пробовать на вкус те вещества, с которыми работал.)
Шееле был в числе тех химиков, исследования которых привели к открытию многих элементов, и пользовался большим уважением шведских коллег. Наиболее важные его открытия — получение кислорода и азота (соответственно в 1771 и 1772 гг.). Шееле получал кислород, нагревая вещества, непрочно его удерживающие. В частности, он нагревал тот самый красный оксид ртути, которым несколько лет спустя воспользовался Пристли.
Шееле подробно описал свои опыты по получению и столь же подробно описал свойства «огненного воздуха» (так он называл кислород), но из-за небрежности его издателя эти описания непоявлялись в печати до 1777 г. К этому времени вышли труды Резерфорда и Пристли, которые и завоевали честь первооткрывателей.
Триумф измерения
К концу XVIII в. был накоплен большой экспериментальный материал, который необходимо было систематизировать в рамках единой теории. Создателем такой теории стал французский химик Антуан-Лоран Лавуазье (1743—1794). С самого начала своей деятельности на поприще химии Лавуазье понял важность точного измерения. Его первая значительная работа (1764 г.) была посвящена изучению состава минерального гипса. Нагревая этот минерал, Лавуазье удалял из него воду и определял количество полученной таким образом воды. Лавуазье принял сторону тех химиков, которые, подобно Блэку и Кавендишу, применяли измерение при изучении химических реакций. Однако Лавуазье использовал более систематический подход, что позволило ему доказать несостоятельность старых теорий, уже не только бесполезных, но и мешавших развитию химии.
Даже в 1770 г. ряд ученых придерживались старого определения элементов и утверждали, что трансмутация возможна, поскольку воду, например, при длительном нагревании можно превратить в землю. Предположение о возможности превращения воды в землю считалось справедливым (вначале даже самим Лавуазье), так как при длительном нагревании воды (в течение нескольких дней) в стеклянном сосуде образовывался твердый осадок.
Лавуазье решил проверить возможность превращения воды экспериментальным путем. С этой целью он в течение 101 дня кипятил воду в сосуде, в котором водяной пар конденсировался и возвращался обратно в колбу, так что возможность какой-либо потери вещества в процессе опыта была исключена. И, разумеется, Лавуазье не забывал о точности эксперимента. Он взвешивал и сосуд и воду до и после нагревания.
Осадок при этом действительно появился, но вес воды не изменился. Следовательно, вода не могла образовать осадок. Однако вес самого сосуда, как выяснилось, уменьшился как раз на столько, сколько весил осадок. Другими словами, осадок появился не в результате превращения воды в землю, а в результате медленного разъедания стеклянных стенок сосуда горячей водой. Осадок образовывало выщелоченное стекло, осаждавшееся в виде твердых пластинок. Этот пример наглядно показывает, что простое наблюдение может привести к ошибочным выводам, тогда как количественное измерение позволяет установить истинные причины явления.
Вопрос о том, что такое процесс горения, интересовал всех химиков XVIII в., и Лавуазье также не мог не заинтересоваться им. В 60-х годах XVIII в. он получил золотую медаль за исследование, посвященное улучшению способов уличного освещения. В 1772 г. Лавуазье в складчину с другими химиками приобрел алмаз. Он поместил этот алмаз в закрытый сосуд и нагревал до тех пор, пока алмаз не исчез. При этом образовался углекислый газ. Таким образом было убедительно доказано, что алмаз состоит из углерода и, следовательно, алмаз ближе всех других веществ к углю.
Продолжая свои опыты, Лавуазье нагревал в закрытых сосудах с ограниченным объемом воздуха такие металлы, как олово и свинец. Сначала на поверхности обоих металлов образовывался слой окалины, но в определенный момент ржавление прекращалось. Сторонники теории флогистона сказали бы, что воздух поглотил из металла весь содержащийся в нем флогистон. В то время уже доподлинно было известно, что окалина весит больше, чем сам металл; однако, когда после нагревания Лавуазье взвесил сосуд вместе со всем содержимым (металлом, окалиной, воздухом и пр.), оказалось, что он весит ровно столько же, сколько и до нагревания.
Из этих данных следовало, что, если частично превратившись в окалину, металл увеличил свой вес, то что-то еще из содержащегося в сосуде потеряло эквивалентное количество веса. Это «что-то еще» могло быть и воздухом. Однако в этом случае в сосуде должен был образоваться вакуум. Действительно, когда Лавуазье открыл сосуд, туда устремился воздух, и вес сосуда и его содержимого увеличился.
Таким образом Лавуазье показал, что металл превращается в окалину не в результате потери мистического флогистона, а вследствие присоединения порции самого обычного воздуха.
Это открытие позволило выдвинуть новую теорию образования металлов и руд. Согласно этой теории, в руде металл соединен с газом. Когда руду нагревают на древесном угле, уголь адсорбирует газ из руды; при этом образуются углекислый газ и свободный металл.
Таким образом, в отличие от Шталя, который считал, что плавка металла включает переход флогистона из древесного угля в руду, Лавуазье представлял себе этот процесс как переход газа из руды в уголь. Однако имело ли смысл толкование Лавуазье предпочесть толкованию Шталя? Да, имело, поскольку предположение Лавуазье о переходе газа позволяло объяснить причины изменения веса веществ в результате горения.
Окалина тяжелее металла, из которого она образовалась, ровно на столько, сколько весит соединившееся с металлом количество воздуха. Горение дерева также сопровождается присоединением воздуха, но увеличения веса в этом случае не наблюдается, так как образовавшееся новое вещество — углекислый газ улетучивается в атмосферу. Оставшаяся зола легче сгоревшего дерева. Если бы горение дерева проходило в закрытом сосуде и образующиеся при этом газы оставались бы в сосуде, тогда можно было бы показать, что вес золы плюс вес образовавшихся газов плюс вес того, что осталось от воздуха, равняется начальному весу дерева и воздуха.
Обдумывая результаты проведенных им опытов, Лавуазье пришел к мысли, что если учитывать все вещества, участвующие в химической реакции, и все образующиеся продукты, то изменения в весе никогда наблюдаться не будет (Говоря более точным языком физиков, не произойдет изменения массы.) [29]Другими словами, Лавуазье пришел к выводу, что масса никогда не создается и не уничтожается, а лишь переходит от одного вещества к другому. Это положение, известное как закон сохранения массы, стало краеугольным камнем химии XIX в. [30]
Успехи, достигнутые Лавуазье благодаря использованию метода количественных измерений, были настолько велики и очевидны, что этот метод был безоговорочно принят всеми химиками. [31]
Даже в 1770 г. ряд ученых придерживались старого определения элементов и утверждали, что трансмутация возможна, поскольку воду, например, при длительном нагревании можно превратить в землю. Предположение о возможности превращения воды в землю считалось справедливым (вначале даже самим Лавуазье), так как при длительном нагревании воды (в течение нескольких дней) в стеклянном сосуде образовывался твердый осадок.
Лавуазье решил проверить возможность превращения воды экспериментальным путем. С этой целью он в течение 101 дня кипятил воду в сосуде, в котором водяной пар конденсировался и возвращался обратно в колбу, так что возможность какой-либо потери вещества в процессе опыта была исключена. И, разумеется, Лавуазье не забывал о точности эксперимента. Он взвешивал и сосуд и воду до и после нагревания.
Осадок при этом действительно появился, но вес воды не изменился. Следовательно, вода не могла образовать осадок. Однако вес самого сосуда, как выяснилось, уменьшился как раз на столько, сколько весил осадок. Другими словами, осадок появился не в результате превращения воды в землю, а в результате медленного разъедания стеклянных стенок сосуда горячей водой. Осадок образовывало выщелоченное стекло, осаждавшееся в виде твердых пластинок. Этот пример наглядно показывает, что простое наблюдение может привести к ошибочным выводам, тогда как количественное измерение позволяет установить истинные причины явления.
Вопрос о том, что такое процесс горения, интересовал всех химиков XVIII в., и Лавуазье также не мог не заинтересоваться им. В 60-х годах XVIII в. он получил золотую медаль за исследование, посвященное улучшению способов уличного освещения. В 1772 г. Лавуазье в складчину с другими химиками приобрел алмаз. Он поместил этот алмаз в закрытый сосуд и нагревал до тех пор, пока алмаз не исчез. При этом образовался углекислый газ. Таким образом было убедительно доказано, что алмаз состоит из углерода и, следовательно, алмаз ближе всех других веществ к углю.
Продолжая свои опыты, Лавуазье нагревал в закрытых сосудах с ограниченным объемом воздуха такие металлы, как олово и свинец. Сначала на поверхности обоих металлов образовывался слой окалины, но в определенный момент ржавление прекращалось. Сторонники теории флогистона сказали бы, что воздух поглотил из металла весь содержащийся в нем флогистон. В то время уже доподлинно было известно, что окалина весит больше, чем сам металл; однако, когда после нагревания Лавуазье взвесил сосуд вместе со всем содержимым (металлом, окалиной, воздухом и пр.), оказалось, что он весит ровно столько же, сколько и до нагревания.
Из этих данных следовало, что, если частично превратившись в окалину, металл увеличил свой вес, то что-то еще из содержащегося в сосуде потеряло эквивалентное количество веса. Это «что-то еще» могло быть и воздухом. Однако в этом случае в сосуде должен был образоваться вакуум. Действительно, когда Лавуазье открыл сосуд, туда устремился воздух, и вес сосуда и его содержимого увеличился.
Таким образом Лавуазье показал, что металл превращается в окалину не в результате потери мистического флогистона, а вследствие присоединения порции самого обычного воздуха.
Это открытие позволило выдвинуть новую теорию образования металлов и руд. Согласно этой теории, в руде металл соединен с газом. Когда руду нагревают на древесном угле, уголь адсорбирует газ из руды; при этом образуются углекислый газ и свободный металл.
Таким образом, в отличие от Шталя, который считал, что плавка металла включает переход флогистона из древесного угля в руду, Лавуазье представлял себе этот процесс как переход газа из руды в уголь. Однако имело ли смысл толкование Лавуазье предпочесть толкованию Шталя? Да, имело, поскольку предположение Лавуазье о переходе газа позволяло объяснить причины изменения веса веществ в результате горения.
Окалина тяжелее металла, из которого она образовалась, ровно на столько, сколько весит соединившееся с металлом количество воздуха. Горение дерева также сопровождается присоединением воздуха, но увеличения веса в этом случае не наблюдается, так как образовавшееся новое вещество — углекислый газ улетучивается в атмосферу. Оставшаяся зола легче сгоревшего дерева. Если бы горение дерева проходило в закрытом сосуде и образующиеся при этом газы оставались бы в сосуде, тогда можно было бы показать, что вес золы плюс вес образовавшихся газов плюс вес того, что осталось от воздуха, равняется начальному весу дерева и воздуха.
Обдумывая результаты проведенных им опытов, Лавуазье пришел к мысли, что если учитывать все вещества, участвующие в химической реакции, и все образующиеся продукты, то изменения в весе никогда наблюдаться не будет (Говоря более точным языком физиков, не произойдет изменения массы.) [29]Другими словами, Лавуазье пришел к выводу, что масса никогда не создается и не уничтожается, а лишь переходит от одного вещества к другому. Это положение, известное как закон сохранения массы, стало краеугольным камнем химии XIX в. [30]
Успехи, достигнутые Лавуазье благодаря использованию метода количественных измерений, были настолько велики и очевидны, что этот метод был безоговорочно принят всеми химиками. [31]
Горение
Однако сам Лавуазье был не вполне доволен полученными результатами. При соединении воздуха с металлом образовывалась окалина, а при соединении с деревом — газы. Но почему в таком взаимодействии участвовал не весь воздух, а только примерно пятая часть его?
В октябре 1774 г. Париж посетил Пристли и рассказал Лавуазье о своем открытии «дефлогистированного воздуха». Лавуазье сразу же оценил значение этого открытия. В 1775 г. он выступил с докладом в Академии наук, а вскоре подготовил и статью, в которой утверждал, что воздух является не простым веществом, а смесью двух газов. Одну пятую воздуха, по мнению Лавуазье, составляет «дефлогистированный воздух» Пристли (Лавуазье, к сожалению, оспаривал у Пристли честь открытия кислорода). И именно эта часть воздуха соединяется с горящими или ржавеющими предметами, переходит из руд в древесный уголь и необходима для жизни.
Лавуазье назвал этот газ кислородом, т. е. порождающим кислоты, так как полагал, что кислород — необходимый компонент всех кислот. В этом, как в дальнейшем выяснилось, он ошибался.
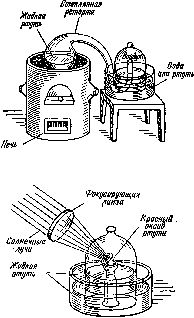
Рис. 7. Схемы опытов, проведенных Лавуазье, показанные в его книге «Элементарный курс химии» (рисунки сделаны женой Лавуазье).
Второй газ, составляющий четыре пятых воздуха («флогистированный воздух» Резерфорда), был признан совершенно самостоятельным веществом. Этот газ не поддерживал горения, мыши в нем гибли. Лавуазье назвал его азотом — безжизненным. Позднее азот был переименован в нитроген [32], что в переводе с латинского означает селитрообразующий, поскольку выяснилось, что азот является составной частью распространенного минерала селитры.
Лавуазье был убежден (и, надо сказать, совершенно справедливо), что жизнь поддерживается процессом, сходным с процессом горения: ибо мы вдыхаем воздух, богатый кислородом и бедный углекислым газом, а выдыхаем воздух, бедный кислородом и значительно обогащенный углекислым газом. Он и его коллега Пьер Симон де Лаплас (1749—1827), впоследствии известный астроном, попытались измерить количество вдыхаемого животным кислорода и выдыхаемого ими углекислого газа. Результаты оказались озадачивающими — часть вдыхаемого кислорода не превратилась в выдыхаемый углекислый газ.
Как мы отмечали выше, в 1783 г. Кавендиш все еще изучал «горючий газ». Он сжигал часть определенного объема этого газа и тщательно изучал образующиеся при этом продукты. Кавендиш выяснил, что образующиеся при горении газы конденсируются в жидкость, которая, как показали анализы, является всего-навсего водой.
Важность этого открытия трудно было переоценить. Теории элементов-стихий был нанесен еще один тяжелый удар, поскольку выяснилось, что вода не простое вещество, а продукт, образующийся при соединении двух газов.
Лавуазье, узнав об этом опыте, назвал газ Кавендиша водородом («образующим воду») и отметил, что водород горит, соединяясь с кислородом, и, следовательно, вода является соединением водорода и кислорода. Лавуазье также полагал, что пищевая субстанция и живая ткань представляют собой множество различных соединений углерода и водорода, поэтому при вдыхании воздуха кислород расходуется на образование не только углекислого газа из углерода, но и воды из водорода. Таким образом Лавуазье объяснил, куда расходуется та часть кислорода, которую он никак не мог учесть в своих первых опытах по изучению дыхания [33].
Новые теории Лавуазье повлекли за собой полную рационализацию химии. Было покончено со всеми таинственными «элементами». С того времени химики стали интересоваться только теми веществами, которые можно взвесить или измерить каким-либо другим способом.
Заложив таким образом фундамент химической науки, Лавуазье решил заняться надстройкой. В течение 80-х годов XVIII в. Лавуазье в сотрудничестве с тремя другими французскими химиками — Луи Бернаром Гитоном де Морво (1737—1816), Клодом Луи Бертолле (1748—1822) и Антуаном Франсуа де Фуркруа (1755—1809) — разработал логическую систему химической номенклатуры. Этот труд был опубликован в 1787 г.
Химия перестала быть мешаниной названий времен алхимии (см. гл. 2), когда каждый химик, используя собственную систему, мог поставить в тупик коллег. Была разработана система, основанная на логических принципах. По названиям соединений, предложенных этой номенклатурой, можно было определить те элементы, из которых оно состоит. Например, оксид кальция состоит из кальция и кислорода, хлорид натрия — из натрия и хлора, сульфид водорода — из водорода и серы и т. д. Четкая система приставок и суффиксов была разработана таким образом, что стало возможным судить о соотношении входящих в состав веществ элементов. Так, углекислый газ (диоксид углерода) богаче кислородом, чем угарный газ (монооксид углерода). В то же время хлорат калия содержит больше кислорода, чем хлорит калия, в перхлорате калия содержание кислорода еще выше, тогда как хлорид калия совсем не содержит кислорода.
В 1789 г. Лавуазье опубликовал книгу «Элементарный курс химии» («Traite elementaire de chimie»), в которой, основываясь на новых теориях и используя разработанную им номенклатуру, систематизировал накопленные к тому времени знания в области химии. Это был первый учебник по химии в современном понимании. В нем содержался, в частности, перечень всех известных в то время элементов или, вернее, всех веществ, которые Лавуазье, руководствуясь определением Бойля, считал элементами, т. е. веществами, которые нельзя разделить на более простые вещества (рис. 8). Лавуазье привел 33 элемента и, к его чести, только в двух случаях допустил несомненные ошибки. Это касалось «света» и «теплорода» (тепла), которые, как стало очевидно спустя несколько десятилетий, представляют собой вовсе не материальные субстанции, а формы энергии.
В октябре 1774 г. Париж посетил Пристли и рассказал Лавуазье о своем открытии «дефлогистированного воздуха». Лавуазье сразу же оценил значение этого открытия. В 1775 г. он выступил с докладом в Академии наук, а вскоре подготовил и статью, в которой утверждал, что воздух является не простым веществом, а смесью двух газов. Одну пятую воздуха, по мнению Лавуазье, составляет «дефлогистированный воздух» Пристли (Лавуазье, к сожалению, оспаривал у Пристли честь открытия кислорода). И именно эта часть воздуха соединяется с горящими или ржавеющими предметами, переходит из руд в древесный уголь и необходима для жизни.
Лавуазье назвал этот газ кислородом, т. е. порождающим кислоты, так как полагал, что кислород — необходимый компонент всех кислот. В этом, как в дальнейшем выяснилось, он ошибался.

Рис. 7. Схемы опытов, проведенных Лавуазье, показанные в его книге «Элементарный курс химии» (рисунки сделаны женой Лавуазье).
Второй газ, составляющий четыре пятых воздуха («флогистированный воздух» Резерфорда), был признан совершенно самостоятельным веществом. Этот газ не поддерживал горения, мыши в нем гибли. Лавуазье назвал его азотом — безжизненным. Позднее азот был переименован в нитроген [32], что в переводе с латинского означает селитрообразующий, поскольку выяснилось, что азот является составной частью распространенного минерала селитры.
Лавуазье был убежден (и, надо сказать, совершенно справедливо), что жизнь поддерживается процессом, сходным с процессом горения: ибо мы вдыхаем воздух, богатый кислородом и бедный углекислым газом, а выдыхаем воздух, бедный кислородом и значительно обогащенный углекислым газом. Он и его коллега Пьер Симон де Лаплас (1749—1827), впоследствии известный астроном, попытались измерить количество вдыхаемого животным кислорода и выдыхаемого ими углекислого газа. Результаты оказались озадачивающими — часть вдыхаемого кислорода не превратилась в выдыхаемый углекислый газ.
Как мы отмечали выше, в 1783 г. Кавендиш все еще изучал «горючий газ». Он сжигал часть определенного объема этого газа и тщательно изучал образующиеся при этом продукты. Кавендиш выяснил, что образующиеся при горении газы конденсируются в жидкость, которая, как показали анализы, является всего-навсего водой.
Важность этого открытия трудно было переоценить. Теории элементов-стихий был нанесен еще один тяжелый удар, поскольку выяснилось, что вода не простое вещество, а продукт, образующийся при соединении двух газов.
Лавуазье, узнав об этом опыте, назвал газ Кавендиша водородом («образующим воду») и отметил, что водород горит, соединяясь с кислородом, и, следовательно, вода является соединением водорода и кислорода. Лавуазье также полагал, что пищевая субстанция и живая ткань представляют собой множество различных соединений углерода и водорода, поэтому при вдыхании воздуха кислород расходуется на образование не только углекислого газа из углерода, но и воды из водорода. Таким образом Лавуазье объяснил, куда расходуется та часть кислорода, которую он никак не мог учесть в своих первых опытах по изучению дыхания [33].
Новые теории Лавуазье повлекли за собой полную рационализацию химии. Было покончено со всеми таинственными «элементами». С того времени химики стали интересоваться только теми веществами, которые можно взвесить или измерить каким-либо другим способом.
Заложив таким образом фундамент химической науки, Лавуазье решил заняться надстройкой. В течение 80-х годов XVIII в. Лавуазье в сотрудничестве с тремя другими французскими химиками — Луи Бернаром Гитоном де Морво (1737—1816), Клодом Луи Бертолле (1748—1822) и Антуаном Франсуа де Фуркруа (1755—1809) — разработал логическую систему химической номенклатуры. Этот труд был опубликован в 1787 г.
Химия перестала быть мешаниной названий времен алхимии (см. гл. 2), когда каждый химик, используя собственную систему, мог поставить в тупик коллег. Была разработана система, основанная на логических принципах. По названиям соединений, предложенных этой номенклатурой, можно было определить те элементы, из которых оно состоит. Например, оксид кальция состоит из кальция и кислорода, хлорид натрия — из натрия и хлора, сульфид водорода — из водорода и серы и т. д. Четкая система приставок и суффиксов была разработана таким образом, что стало возможным судить о соотношении входящих в состав веществ элементов. Так, углекислый газ (диоксид углерода) богаче кислородом, чем угарный газ (монооксид углерода). В то же время хлорат калия содержит больше кислорода, чем хлорит калия, в перхлорате калия содержание кислорода еще выше, тогда как хлорид калия совсем не содержит кислорода.
В 1789 г. Лавуазье опубликовал книгу «Элементарный курс химии» («Traite elementaire de chimie»), в которой, основываясь на новых теориях и используя разработанную им номенклатуру, систематизировал накопленные к тому времени знания в области химии. Это был первый учебник по химии в современном понимании. В нем содержался, в частности, перечень всех известных в то время элементов или, вернее, всех веществ, которые Лавуазье, руководствуясь определением Бойля, считал элементами, т. е. веществами, которые нельзя разделить на более простые вещества (рис. 8). Лавуазье привел 33 элемента и, к его чести, только в двух случаях допустил несомненные ошибки. Это касалось «света» и «теплорода» (тепла), которые, как стало очевидно спустя несколько десятилетий, представляют собой вовсе не материальные субстанции, а формы энергии.
