Страница:
4.3. Химическое равновесие
Система находится в равновесии, если ее состояние не изменяется во времени. Равенство скоростей прямой и обратной реакции – условие сохранения равновесия системы.
Примером обратимой реакции является реакция
N2 + 3H2 ↔ 2NH3.
Закон действия масс: отношение произведения концентраций продуктов реакции к произведению концентраций исходных веществ (все концентрации указывают в степенях, равных их стехиометрическим коэффициентам) есть постоянная, называемая константой равновесия.
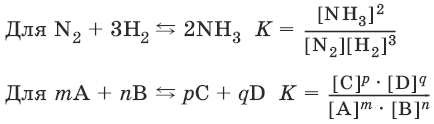 Константа равновесия – это мера протекания прямой реакции.
Константа равновесия – это мера протекания прямой реакции.
К = О – прямая реакция не идет;
К = ∞ – прямая реакция идет до конца;
К > 1 – равновесие сдвинуто вправо;
К < 1 – равновесие сдвинуто влево.
Константа равновесия реакции К связана с величиной изменения стандартной энергии Гиббса ΔG для этой же реакции:
ΔG = – RTlnK, или ΔG = -2,3RTlgK, или К= 10-0,435ΔG/RT
Если К > 1, то lgK > 0 и ΔG < 0, т. е. если равновесие сдвинуто вправо, то реакция – переход от исходного состояния к равновесному – идет самопроизвольно.
Если К < 1, то lgK < 0 и ΔG > 0, т. е. если равновесие сдвинуто влево, то реакция самопроизвольно вправо не идет.
Закон смещения равновесия: если на систему, находящуюся в равновесии, оказывается внешнее воздействие, в системе возникает процесс, который противодействует внешнему воздействию.
Примером обратимой реакции является реакция
N2 + 3H2 ↔ 2NH3.
Закон действия масс: отношение произведения концентраций продуктов реакции к произведению концентраций исходных веществ (все концентрации указывают в степенях, равных их стехиометрическим коэффициентам) есть постоянная, называемая константой равновесия.
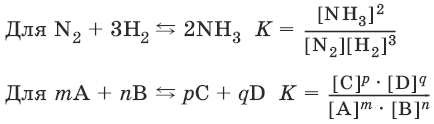
К = О – прямая реакция не идет;
К = ∞ – прямая реакция идет до конца;
К > 1 – равновесие сдвинуто вправо;
К < 1 – равновесие сдвинуто влево.
Константа равновесия реакции К связана с величиной изменения стандартной энергии Гиббса ΔG для этой же реакции:
ΔG = – RTlnK, или ΔG = -2,3RTlgK, или К= 10-0,435ΔG/RT
Если К > 1, то lgK > 0 и ΔG < 0, т. е. если равновесие сдвинуто вправо, то реакция – переход от исходного состояния к равновесному – идет самопроизвольно.
Если К < 1, то lgK < 0 и ΔG > 0, т. е. если равновесие сдвинуто влево, то реакция самопроизвольно вправо не идет.
Закон смещения равновесия: если на систему, находящуюся в равновесии, оказывается внешнее воздействие, в системе возникает процесс, который противодействует внешнему воздействию.
5. Окислительно-восстановительные реакции
Окислительно-восстановите льные реакции – реакции, которые идут с изменением степеней окисления элементов.
Окисление – процесс отдачи электронов.
Восстановление – процесс присоединения электронов.
Окислитель – атом, молекула или ион, который принимает электроны.
Восстановитель – атом, молекула или ион, который отдает электроны.
Окислители, принимая электроны, переходят в восстановленную форму:
F2 [ок. ] + 2ē → 2F¯ [восст.].
Восстановители, отдавая электроны, переходят в окисленную форму:
Na0 [восст. ] – 1ē → Na+ [ок.].
Равновесие между окисленной и восстановленной формами характеризуется с помощью уравнения Нернста для окислительно-восстановительного потенциала:
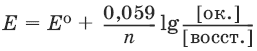 где Е0 – стандартное значение окислительно-восстановительного потенциала; n – число переданных электронов; [восст. ] и [ок. ] – молярные концентрации соединения в восстановленной и окисленной формах соответственно.
где Е0 – стандартное значение окислительно-восстановительного потенциала; n – число переданных электронов; [восст. ] и [ок. ] – молярные концентрации соединения в восстановленной и окисленной формах соответственно.
Величины стандартных электродных потенциалов Е0 приведены в таблицах и характеризуют окислительные и восстановительные свойства соединений: чем поло-жительнее величина Е0, тем сильнее окислительные свойства, и чем отрицательнее значение Е0, тем сильнее восстановительные свойства.
Например, для F2 + 2ē ↔ 2F¯Е0 = 2,87 вольт, а для Na+ + 1ē ↔ Na0Е0 = -2,71 вольт (процесс всегда записывается для реакций восстановления).
Окислительно-восстановительная реакция представляет собой совокупность двух полуреакций, окисления и восстановления, и характеризуется электродвижущей силой (э.д.с.) ΔЕ0: ΔЕ0 = ΔЕ0ок – ΔЕ0восст, где Е0ок и ΔЕ0восст – стандартные потенциалы окислителя и восстановителя для данной реакции.
Э.д.с. реакции ΔЕ0 связана с изменением свободной энергии Гиббса ΔG и константой равновесия реакции К:
ΔG = – nFΔЕ0 или ΔЕ = (RT/nF)lnK.
Э.д.с. реакции при нестандартных концентрациях ΔЕ равна: ΔЕ = ΔЕ0 – (RT/nF) × IgK или ΔЕ = ΔЕ0 – (0,059/n)lgK.
В случае равновесия ΔG = 0 и ΔЕ = 0, откуда ΔЕ = (0,059/n)lgK и К = 10nΔE/0,059.
Для самопроизвольного протекания реакции должны выполняться соотношения: ΔG < 0 или К >> 1, которым соответствует условие ΔЕ0 > 0. Поэтому для определения возможности протекания данной окислительно-восстановительной реакции необходимо вычислить значение ΔЕ0. Если ΔЕ0 > 0, реакция идет. Если ΔЕ0 < 0, реакция не идет.
Гальванический элемент Даниэля состоит из цинкового и медного электродов, погруженных в растворы ZnSO4 и CuSO4 соответственно. Растворы электролитов сообщаются через пористую перегородку. При этом на цинковом электроде идет окисление: Zn → Zn2+ + 2ē, а на медном электроде – восстановление: Cu2+ + 2ē → Cu. В целом идет реакция: Zn + CuSO4 = ZnSO4 + Cu.
Анод – электрод, на котором идет окисление. Катод – электрод, на котором идет восстановление. В гальванических элементах анод заряжен отрицательно, а катод – положительно. На схемах элементов металл и раствор отделены вертикальной чертой, а два раствора – двойной вертикальной чертой.
Так, для реакции Zn + CuSO4 = ZnSO4 + Cu схемой гальванического элемента является запись: (-)Zn | ZnSO4 || CuSO4 | Cu(+).
Электродвижущая сила (э.д.с.) реакции равна ΔЕ0 = Е0ок – Е0восст = Е0(Cu2+/Cu) – Е0(Zn2+/Zn) = 0,34 – (-0,76) = 1,10 В. Из-за потерь напряжение, создаваемое элементом, будет несколько меньше, чем ΔЕ0. Если концентрации растворов отличаются от стандартных, равных 1 моль/л, то Е0ок и Е0восст вычисляются по уравнению Нернста, а затем вычисляется э.д.с. соответствующего гальванического элемента.
Сухой элемент состоит их цинкового корпуса, пасты NH4Cl с крахмалом или мукой, смеси MnO2 с графитом и графитового электрода. В ходе его работы идет реакция: Zn + 2NH4Cl + 2MnO2 = [Zn(NH3)2]Cl + 2MnOOH.
Схема элемента: (-)Zn | NH4Cl | MnO2, C(+). Э.д.с. элемента – 1,5 В.
Аккумуляторы. Свинцовый аккумулятор представляет собой две свинцовые пластины, погруженные в 30%-ный раствор серной кислоты и покрытые слоем нерастворимого PbSO4. При заряде аккумулятора на электродах идут процессы:
PbSO4(тв) + 2ē → Рb(тв) + SO42-
PbSO4(тв) + 2H2O → РbO2(тв) + 4H+ + SO42- + 2ē
При разряде аккумулятора на электродах идут процессы:
РЬ(тв) + SO42- → PbSO4(тв) + 2ē
РbO2(тв) + 4H+ + SO42- + 2ē → PbSO4(тв) + 2Н2O
Суммарную реакцию можно записать в виде:
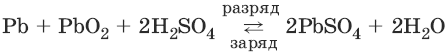 Для работы аккумулятор нуждается в регулярной зарядке и контроле концентрации серной кислоты, которая может несколько уменьшаться при работе аккумулятора.
Для работы аккумулятор нуждается в регулярной зарядке и контроле концентрации серной кислоты, которая может несколько уменьшаться при работе аккумулятора.
Окисление – процесс отдачи электронов.
Восстановление – процесс присоединения электронов.
Окислитель – атом, молекула или ион, который принимает электроны.
Восстановитель – атом, молекула или ион, который отдает электроны.
Окислители, принимая электроны, переходят в восстановленную форму:
F2 [ок. ] + 2ē → 2F¯ [восст.].
Восстановители, отдавая электроны, переходят в окисленную форму:
Na0 [восст. ] – 1ē → Na+ [ок.].
Равновесие между окисленной и восстановленной формами характеризуется с помощью уравнения Нернста для окислительно-восстановительного потенциала:
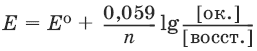
Величины стандартных электродных потенциалов Е0 приведены в таблицах и характеризуют окислительные и восстановительные свойства соединений: чем поло-жительнее величина Е0, тем сильнее окислительные свойства, и чем отрицательнее значение Е0, тем сильнее восстановительные свойства.
Например, для F2 + 2ē ↔ 2F¯Е0 = 2,87 вольт, а для Na+ + 1ē ↔ Na0Е0 = -2,71 вольт (процесс всегда записывается для реакций восстановления).
Окислительно-восстановительная реакция представляет собой совокупность двух полуреакций, окисления и восстановления, и характеризуется электродвижущей силой (э.д.с.) ΔЕ0: ΔЕ0 = ΔЕ0ок – ΔЕ0восст, где Е0ок и ΔЕ0восст – стандартные потенциалы окислителя и восстановителя для данной реакции.
Э.д.с. реакции ΔЕ0 связана с изменением свободной энергии Гиббса ΔG и константой равновесия реакции К:
ΔG = – nFΔЕ0 или ΔЕ = (RT/nF)lnK.
Э.д.с. реакции при нестандартных концентрациях ΔЕ равна: ΔЕ = ΔЕ0 – (RT/nF) × IgK или ΔЕ = ΔЕ0 – (0,059/n)lgK.
В случае равновесия ΔG = 0 и ΔЕ = 0, откуда ΔЕ = (0,059/n)lgK и К = 10nΔE/0,059.
Для самопроизвольного протекания реакции должны выполняться соотношения: ΔG < 0 или К >> 1, которым соответствует условие ΔЕ0 > 0. Поэтому для определения возможности протекания данной окислительно-восстановительной реакции необходимо вычислить значение ΔЕ0. Если ΔЕ0 > 0, реакция идет. Если ΔЕ0 < 0, реакция не идет.
Химические источники тока
Гальванические элементы – устройства, преобразующие энергию химической реакции в электрическую энергию.Гальванический элемент Даниэля состоит из цинкового и медного электродов, погруженных в растворы ZnSO4 и CuSO4 соответственно. Растворы электролитов сообщаются через пористую перегородку. При этом на цинковом электроде идет окисление: Zn → Zn2+ + 2ē, а на медном электроде – восстановление: Cu2+ + 2ē → Cu. В целом идет реакция: Zn + CuSO4 = ZnSO4 + Cu.
Анод – электрод, на котором идет окисление. Катод – электрод, на котором идет восстановление. В гальванических элементах анод заряжен отрицательно, а катод – положительно. На схемах элементов металл и раствор отделены вертикальной чертой, а два раствора – двойной вертикальной чертой.
Так, для реакции Zn + CuSO4 = ZnSO4 + Cu схемой гальванического элемента является запись: (-)Zn | ZnSO4 || CuSO4 | Cu(+).
Электродвижущая сила (э.д.с.) реакции равна ΔЕ0 = Е0ок – Е0восст = Е0(Cu2+/Cu) – Е0(Zn2+/Zn) = 0,34 – (-0,76) = 1,10 В. Из-за потерь напряжение, создаваемое элементом, будет несколько меньше, чем ΔЕ0. Если концентрации растворов отличаются от стандартных, равных 1 моль/л, то Е0ок и Е0восст вычисляются по уравнению Нернста, а затем вычисляется э.д.с. соответствующего гальванического элемента.
Сухой элемент состоит их цинкового корпуса, пасты NH4Cl с крахмалом или мукой, смеси MnO2 с графитом и графитового электрода. В ходе его работы идет реакция: Zn + 2NH4Cl + 2MnO2 = [Zn(NH3)2]Cl + 2MnOOH.
Схема элемента: (-)Zn | NH4Cl | MnO2, C(+). Э.д.с. элемента – 1,5 В.
Аккумуляторы. Свинцовый аккумулятор представляет собой две свинцовые пластины, погруженные в 30%-ный раствор серной кислоты и покрытые слоем нерастворимого PbSO4. При заряде аккумулятора на электродах идут процессы:
PbSO4(тв) + 2ē → Рb(тв) + SO42-
PbSO4(тв) + 2H2O → РbO2(тв) + 4H+ + SO42- + 2ē
При разряде аккумулятора на электродах идут процессы:
РЬ(тв) + SO42- → PbSO4(тв) + 2ē
РbO2(тв) + 4H+ + SO42- + 2ē → PbSO4(тв) + 2Н2O
Суммарную реакцию можно записать в виде:
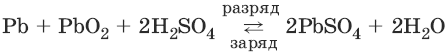
6. Растворы
6.1. Концентрация растворов
Массовая доля вещества в растворе w равна отношению массы растворенного вещества к массе раствора: w = mв-ва/mр-ра или w = mв-вa/(V × ρ), так как mр-ра = Vp-pa × ρр-ра.
Молярная концентрация с равна отношению числа молей растворенного вещества к объему раствора: с = n(моль)/V(л) или с = m/(М × V(л)).
Молярная концентрация эквивалентов (нормальная или эквивалентная концентрация) сэ равна отношению числа эквивалентов растворенного вещества к объему раствора: сэ = n(моль экв.)/V(л) или сэ = m/(Мэ × V(л)).
Молярная концентрация с равна отношению числа молей растворенного вещества к объему раствора: с = n(моль)/V(л) или с = m/(М × V(л)).
Молярная концентрация эквивалентов (нормальная или эквивалентная концентрация) сэ равна отношению числа эквивалентов растворенного вещества к объему раствора: сэ = n(моль экв.)/V(л) или сэ = m/(Мэ × V(л)).
6.2. Электролитическая диссоциация
Электролитическая диссоциация – распад электролита на катионы и анионы под действием полярных молекул растворителя.
Степень диссоциации α – отношение концентрации диссоциированных молекул (сдисс) к общей концентрации растворенных молекул (соб): α = сдисс/соб.
Электролиты можно разделить на сильные (α ~ 1) и слабые.
Сильные электролиты (для них α ~ 1) – соли и основания, растворимые в воде, а также некоторые кислоты: HNO3, HCl, H2SO4, HI, HBr, HClO4 и другие.
Слабые электролиты (для них α << 1) – Н2O, NH4OH, малорастворимые основания и соли и многие кислоты: HF, H2SO3, H2CO3, H2S, CH3COOH и другие.
Ионные уравнения реакций. В ионных уравнениях реакций сильные электролиты записываются в виде ионов, а слабые электролиты, малорастворимые вещества и газы – в виде молекул. Например:
CaCO3↓ + 2HCl = CaCl2 + Н2O + CO2↑
CaCO3↓ + 2H+ + 2Cl¯ = Са2+ + 2Cl¯ + Н2O + CO2↑
CaCO3↓ + 2Н+ = Са2+ + Н2O + CO2↑
Реакции между ионами идут в сторону образования вещества, дающего меньше ионов, т. е. в сторону более слабого электролита или менее растворимого вещества.
Степень диссоциации α – отношение концентрации диссоциированных молекул (сдисс) к общей концентрации растворенных молекул (соб): α = сдисс/соб.
Электролиты можно разделить на сильные (α ~ 1) и слабые.
Сильные электролиты (для них α ~ 1) – соли и основания, растворимые в воде, а также некоторые кислоты: HNO3, HCl, H2SO4, HI, HBr, HClO4 и другие.
Слабые электролиты (для них α << 1) – Н2O, NH4OH, малорастворимые основания и соли и многие кислоты: HF, H2SO3, H2CO3, H2S, CH3COOH и другие.
Ионные уравнения реакций. В ионных уравнениях реакций сильные электролиты записываются в виде ионов, а слабые электролиты, малорастворимые вещества и газы – в виде молекул. Например:
CaCO3↓ + 2HCl = CaCl2 + Н2O + CO2↑
CaCO3↓ + 2H+ + 2Cl¯ = Са2+ + 2Cl¯ + Н2O + CO2↑
CaCO3↓ + 2Н+ = Са2+ + Н2O + CO2↑
Реакции между ионами идут в сторону образования вещества, дающего меньше ионов, т. е. в сторону более слабого электролита или менее растворимого вещества.
6.3. Диссоциация слабых электролитов
Применим закон действия масс к равновесию между ионами и молекулами в растворе слабого электролита, например уксусной кислоты:
CH3COOH ↔ CH3COО¯ + Н+
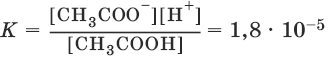 Константы равновесия реакций диссоциации называются константами диссоциации. Константы диссоциации характеризуют диссоциацию слабых электролитов: чем меньше константа, тем меньше диссоциирует слабый электролит, тем он слабее.
Константы равновесия реакций диссоциации называются константами диссоциации. Константы диссоциации характеризуют диссоциацию слабых электролитов: чем меньше константа, тем меньше диссоциирует слабый электролит, тем он слабее.
Многоосновные кислоты диссоциируют ступенчато:
Н3PO4 ↔ Н+ + Н2PO4¯
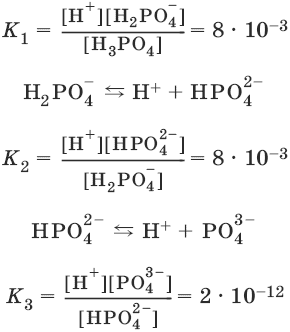 Константа равновесия суммарной реакции диссоциации равна произведению констант отдельных стадий диссоциации:
Константа равновесия суммарной реакции диссоциации равна произведению констант отдельных стадий диссоциации:
Н3PO4 ↔ ЗН+ + PO43-
 Закон разбавления Оствальда: степень диссоциации слабого электролита (а) увеличивается при уменьшении его концентрации, т. е. при разбавлении:
Закон разбавления Оствальда: степень диссоциации слабого электролита (а) увеличивается при уменьшении его концентрации, т. е. при разбавлении:
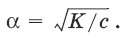 Влияние общего иона на диссоциацию слабого электролита: добавление общего иона уменьшает диссоциацию слабого электролита. Так, при добавлении к раствору слабого электролита CH3COOH
Влияние общего иона на диссоциацию слабого электролита: добавление общего иона уменьшает диссоциацию слабого электролита. Так, при добавлении к раствору слабого электролита CH3COOH
CH3COOH ↔ CH3COО¯ + Н+ α << 1
сильного электролита, содержащего общий с CH3COOH ион, т. е. ацетат-ион, например CH3COОNa
CH3COОNa ↔ CH3COО¯ + Na+ α = 1
концентрация ацетат-иона увеличивается, и равновесие диссоциации CH3COOH сдвигается влево, т. е. диссоциация кислоты уменьшается.
CH3COOH ↔ CH3COО¯ + Н+
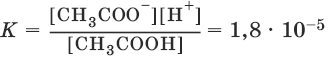
Многоосновные кислоты диссоциируют ступенчато:
Н3PO4 ↔ Н+ + Н2PO4¯

Н3PO4 ↔ ЗН+ + PO43-

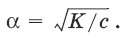
CH3COOH ↔ CH3COО¯ + Н+ α << 1
сильного электролита, содержащего общий с CH3COOH ион, т. е. ацетат-ион, например CH3COОNa
CH3COОNa ↔ CH3COО¯ + Na+ α = 1
концентрация ацетат-иона увеличивается, и равновесие диссоциации CH3COOH сдвигается влево, т. е. диссоциация кислоты уменьшается.
6.4. Диссоциация сильных электролитов
Активность иона а – концентрация иона, проявляющаяся в его свойствах.
Коэффициент активности f – отношение активности иона а к концентрации с: f = а/с или а = fc.
Если f = 1, то ионы свободны и не взаимодействуют между собой. Это имеет место в очень разбавленных растворах, в растворах слабых электролитов и т. д.
Если f < 1, то ионы взаимодействуют между собой. Чем меньше f, тем больше взаимодействие между ионами.
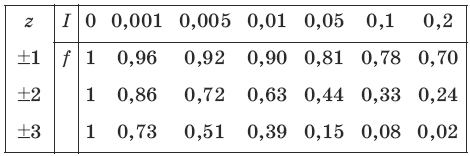
Коэффициент активности зависит от ионной силы раствора I: чем больше ионная сила, тем меньше коэффициент активности.
Ионная сила раствора I зависит от зарядов z и концентраций с ионов:
I = 0,52Σс • z2.
Коэффициент активности зависит от заряда иона: чем больше заряд иона, тем меньше коэффициент активности. Математически зависимость коэффициента активности f от ионной силы I и заряда иона z записывается с помощью формулы Дебая-Хюккеля:
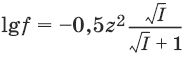 Коэффициенты активности ионов можно определить с помощью следующей таблицы:
Коэффициенты активности ионов можно определить с помощью следующей таблицы:
Коэффициент активности f – отношение активности иона а к концентрации с: f = а/с или а = fc.
Если f = 1, то ионы свободны и не взаимодействуют между собой. Это имеет место в очень разбавленных растворах, в растворах слабых электролитов и т. д.
Если f < 1, то ионы взаимодействуют между собой. Чем меньше f, тем больше взаимодействие между ионами.
Коэффициент активности зависит от ионной силы раствора I: чем больше ионная сила, тем меньше коэффициент активности.
Ионная сила раствора I зависит от зарядов z и концентраций с ионов:
I = 0,52Σс • z2.
Коэффициент активности зависит от заряда иона: чем больше заряд иона, тем меньше коэффициент активности. Математически зависимость коэффициента активности f от ионной силы I и заряда иона z записывается с помощью формулы Дебая-Хюккеля:
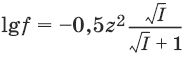

6.5 Ионное произведение воды. Водородный показатель
Вода – слабый электролит – диссоциирует, образуя ионы Н+ и OH¯. Эти ионы гидратированы, т. е. соединены с несколькими молекулами воды, но для простоты их записывают в негидратированной форме
Н2O ↔ Н+ + OH¯.
На основании закона действия масс, для этого равновесия:
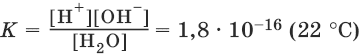 Концентрацию молекул воды [Н2O], т. е. число молей в 1 л воды, можно считать постоянной и равной [Н2O] = 1000 г/л : 18 г/моль = 55,6 моль/л. Отсюда:
Концентрацию молекул воды [Н2O], т. е. число молей в 1 л воды, можно считать постоянной и равной [Н2O] = 1000 г/л : 18 г/моль = 55,6 моль/л. Отсюда:
К • [Н2O] = К(Н2O) = [Н+] • [OH¯] = 10-14 (22°C).
Ионное произведение воды – произведение концентраций [Н+] и [OH¯] – есть величина постоянная при постоянной температуре и равная 10-14 при 22°C.
Ионное произведение воды увеличивается с увеличением температуры.
Водородный показатель рН – отрицательный логарифм концентрации ионов водорода: рН = – lg[H+]. Аналогично: pOH = – lg[OH¯].
Логарифмирование ионного произведения воды дает: рН + рOH = 14.
Величина рН характеризует реакцию среды.
Если рН = 7, то [Н+] = [OH¯] – нейтральная среда.
Если рН < 7, то [Н+] > [OH¯] – кислотная среда.
Если рН > 7, то [Н+] < [OH¯] – щелочная среда.
Н2O ↔ Н+ + OH¯.
На основании закона действия масс, для этого равновесия:
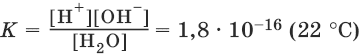
К • [Н2O] = К(Н2O) = [Н+] • [OH¯] = 10-14 (22°C).
Ионное произведение воды – произведение концентраций [Н+] и [OH¯] – есть величина постоянная при постоянной температуре и равная 10-14 при 22°C.
Ионное произведение воды увеличивается с увеличением температуры.
Водородный показатель рН – отрицательный логарифм концентрации ионов водорода: рН = – lg[H+]. Аналогично: pOH = – lg[OH¯].
Логарифмирование ионного произведения воды дает: рН + рOH = 14.
Величина рН характеризует реакцию среды.
Если рН = 7, то [Н+] = [OH¯] – нейтральная среда.
Если рН < 7, то [Н+] > [OH¯] – кислотная среда.
Если рН > 7, то [Н+] < [OH¯] – щелочная среда.
6.6. Буферные растворы
Буферные растворы – растворы, имеющие определенную концентрацию ионов водорода. рН этих растворов не меняется при разбавлении и мало меняется при добавлении небольших количеств кислот и щелочей.
I. Раствор слабой кислоты НА, концентрация – скисл, и ее соли с сильным основанием ВА, концентрация – ссоли. Например, ацетатный буфер – раствор уксусной кислоты и ацетата натрия: CH3COOH + CHgCOONa.
рН = рКкисл + lg(ссоли/скисл).
II. Раствор слабого основания ВOH, концентрация – сосн, и его соли с сильной кислотой ВА, концентрация – ссоли. Например, аммиачный буфер – раствор гидроксида аммония и хлорида аммония NH4OH + NH4Cl.
рН = 14 – рКосн – lg(ссоли/сосн).
I. Раствор слабой кислоты НА, концентрация – скисл, и ее соли с сильным основанием ВА, концентрация – ссоли. Например, ацетатный буфер – раствор уксусной кислоты и ацетата натрия: CH3COOH + CHgCOONa.
рН = рКкисл + lg(ссоли/скисл).
II. Раствор слабого основания ВOH, концентрация – сосн, и его соли с сильной кислотой ВА, концентрация – ссоли. Например, аммиачный буфер – раствор гидроксида аммония и хлорида аммония NH4OH + NH4Cl.
рН = 14 – рКосн – lg(ссоли/сосн).
6.7. Гидролиз солей
Гидролиз солей – взаимодействие ионов соли с водой с образованием слабого электролита.
Примеры уравнений реакций гидролиза.
I. Соль образована сильным основанием и слабой кислотой:
Na2CO3 + H2O ↔ NaHCO3 + NaOH
2Na+ + CO32- + H2O ↔ 2Na+ + HCO3¯ + OH¯
CO32- + H2O ↔ HCO3¯ + OH¯, pH > 7, щелочная среда.
По второй ступени гидролиз практически не идет.
II. Соль образована слабым основанием и сильной кислотой:
AlCl3 + H2O ↔ (AlOH)Cl2 + HCl
Al3+ + ЗCl¯ + H2O ↔ AlOH2+ + 2Cl¯ + Н+ + Cl¯
Al3+ + H2O ↔ AlOH2+ + Н+, рН < 7.
По второй ступени гидролиз идет меньше, а по третьей ступени практически не идет.
III. Соль образована сильным основанием и сильной кислотой:
KNO3 + H2O ≠
К+ + NO3¯ + Н2O ≠ нет гидролиза, рН ≈ 7.
IV. Соль образована слабым основанием и слабой кислотой:
CH3COONH4 + H2O ↔ CH3COOH + NH4OH
CH3COO¯ + NH4+ + H2O ↔ CH3COOH + NH4OH, рН = 7.
В ряде случаев, когда соль образована очень слабыми основаниями и кислотами, идет полный гидролиз. В таблице растворимости у таких солей символ – «разлагаются водой»:
Al2S3 + 6Н2O = 2Al(OH)3↓ + 3H2S↑
Возможность полного гидролиза следует учитывать в обменных реакциях:
Al2(SO4)3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 3Na2SO4 + 3CO2↑
Степень гидролиза h – отношение концентрации гидролизованных молекул к общей концентрации растворенных молекул.
Для солей, образованных сильным основанием и слабой кислотой:
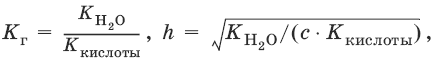 [OH¯] = ch, рOH = – lg[OH¯], рН = 14 – рOH.
[OH¯] = ch, рOH = – lg[OH¯], рН = 14 – рOH.
Из выражения следует, что степень гидролиза h (т. е. гидролиз) увеличивается:
а) с увеличением температуры, так как увеличивается K(H2O);
б) с уменьшением диссоциации кислоты, образующей соль: чем слабее кислота, тем больше гидролиз;
в) с разбавлением: чем меньше с, тем больше гидролиз.
Для солей, образованных слабым основанием и сильной кислотой
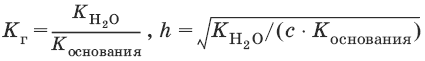 [Н+] = ch, рН = – lg[H+].
[Н+] = ch, рН = – lg[H+].
Для солей, образованных слабым основанием и слабой кислотой
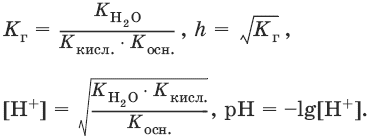
Примеры уравнений реакций гидролиза.
I. Соль образована сильным основанием и слабой кислотой:
Na2CO3 + H2O ↔ NaHCO3 + NaOH
2Na+ + CO32- + H2O ↔ 2Na+ + HCO3¯ + OH¯
CO32- + H2O ↔ HCO3¯ + OH¯, pH > 7, щелочная среда.
По второй ступени гидролиз практически не идет.
II. Соль образована слабым основанием и сильной кислотой:
AlCl3 + H2O ↔ (AlOH)Cl2 + HCl
Al3+ + ЗCl¯ + H2O ↔ AlOH2+ + 2Cl¯ + Н+ + Cl¯
Al3+ + H2O ↔ AlOH2+ + Н+, рН < 7.
По второй ступени гидролиз идет меньше, а по третьей ступени практически не идет.
III. Соль образована сильным основанием и сильной кислотой:
KNO3 + H2O ≠
К+ + NO3¯ + Н2O ≠ нет гидролиза, рН ≈ 7.
IV. Соль образована слабым основанием и слабой кислотой:
CH3COONH4 + H2O ↔ CH3COOH + NH4OH
CH3COO¯ + NH4+ + H2O ↔ CH3COOH + NH4OH, рН = 7.
В ряде случаев, когда соль образована очень слабыми основаниями и кислотами, идет полный гидролиз. В таблице растворимости у таких солей символ – «разлагаются водой»:
Al2S3 + 6Н2O = 2Al(OH)3↓ + 3H2S↑
Возможность полного гидролиза следует учитывать в обменных реакциях:
Al2(SO4)3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 3Na2SO4 + 3CO2↑
Степень гидролиза h – отношение концентрации гидролизованных молекул к общей концентрации растворенных молекул.
Для солей, образованных сильным основанием и слабой кислотой:
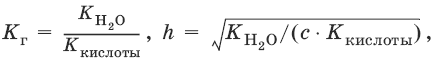
Из выражения следует, что степень гидролиза h (т. е. гидролиз) увеличивается:
а) с увеличением температуры, так как увеличивается K(H2O);
б) с уменьшением диссоциации кислоты, образующей соль: чем слабее кислота, тем больше гидролиз;
в) с разбавлением: чем меньше с, тем больше гидролиз.
Для солей, образованных слабым основанием и сильной кислотой
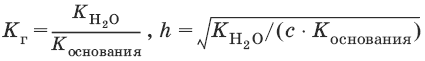
Для солей, образованных слабым основанием и слабой кислотой
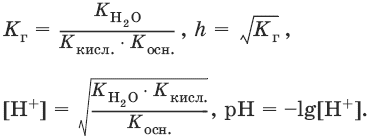
6.8. Протолитическая теория кислот и оснований
Протолиз – процесс передачи протона.
Протолиты – кислоты и основания, отдающие и принимающие протоны.
Кислота – молекула или ион, способные отдавать протон. Каждой кислоте соответствует сопряженное с нею основание. Сила кислот характеризуется константой кислоты Кк.
Н2CO3 + Н2O ↔ Н3O+ + HCO3¯
Кк = 4 × 10-7
[Al(Н2O)6]3+ + Н2O ↔ [Al(Н2O)5OH]2+ + Н3O+
Кк = 9 × 10-6
Основание – молекула или ион, способные принимать протон. Каждому основанию соответствует сопряженная с ним кислота. Сила оснований характеризуется константой основания К0.
NH3 × Н2O (Н2O) ↔ NH4+ + OH¯
К0= 1,8 ×10-5
Амфолиты – протолиты, способные к отдаче и к присоединению протона.
HCO3¯ + H2O ↔ Н3O+ + CO32-
HCO3¯ – кислота.
HCO3¯ + H2O ↔ Н2CO3 + OH¯
HCO3¯ – основание.
Для воды: Н2O+ Н2O ↔ Н3O+ + OH¯
K(H2O) = [Н3O+][OH¯] = 10-14 и рН = – lg[H3O+].
Константы Кк и К0 для сопряженных кислот и оснований связаны между собой.
НА + Н2O ↔ Н3O+ + А¯,
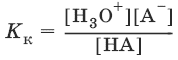 А¯ + Н2O ↔ НА + OH¯,
А¯ + Н2O ↔ НА + OH¯,
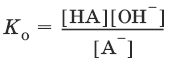 Отсюда
Отсюда
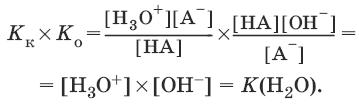
Протолиты – кислоты и основания, отдающие и принимающие протоны.
Кислота – молекула или ион, способные отдавать протон. Каждой кислоте соответствует сопряженное с нею основание. Сила кислот характеризуется константой кислоты Кк.
Н2CO3 + Н2O ↔ Н3O+ + HCO3¯
Кк = 4 × 10-7
[Al(Н2O)6]3+ + Н2O ↔ [Al(Н2O)5OH]2+ + Н3O+
Кк = 9 × 10-6
Основание – молекула или ион, способные принимать протон. Каждому основанию соответствует сопряженная с ним кислота. Сила оснований характеризуется константой основания К0.
NH3 × Н2O (Н2O) ↔ NH4+ + OH¯
К0= 1,8 ×10-5
Амфолиты – протолиты, способные к отдаче и к присоединению протона.
HCO3¯ + H2O ↔ Н3O+ + CO32-
HCO3¯ – кислота.
HCO3¯ + H2O ↔ Н2CO3 + OH¯
HCO3¯ – основание.
Для воды: Н2O+ Н2O ↔ Н3O+ + OH¯
K(H2O) = [Н3O+][OH¯] = 10-14 и рН = – lg[H3O+].
Константы Кк и К0 для сопряженных кислот и оснований связаны между собой.
НА + Н2O ↔ Н3O+ + А¯,
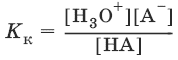
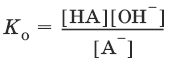
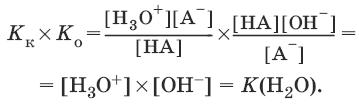
7. Константа растворимости. Растворимость
В системе, состоящей из раствора и осадка, идут два процесса – растворение осадка и осаждение. Равенство скоростей этих двух процессов является условием равновесия.
Насыщенный раствор – раствор, который находится в равновесии с осадком.
Закон действия масс в применении к равновесию между осадком и раствором дает:
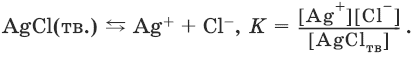 Поскольку [AgClтв] = const,
Поскольку [AgClтв] = const,
К • [AgClтв] = Ks(AgCl) = [Ag+] • [Cl¯].
В общем виде имеем:
АmBn(тв.) ↔ mA+n + nB-m
Ks(AmBn) = [А+n]m • [В-m]n.
Константа растворимости Ks (или произведение растворимости ПР) – произведение концентраций ионов в насыщенном растворе малорастворимого электролита – есть величина постоянная и зависит лишь от температуры.
Растворимость малорастворимого вещества s может быть выражена в молях на литр. В зависимости от величины s вещества могут быть разделены на малорастворимые – s < 10-4 моль/л, среднерастворимые – 10-4 моль/л ≤ s ≤ 10-2 моль/л и хорошо растворимые s >10-2 моль/л.
Растворимость соединений связана с их произведением растворимости.
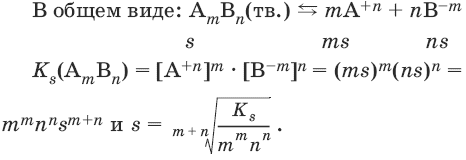
Ks = [Ag+] • [CI¯]:
а) условие равновесия между осадком и раствором: [Ag+] • [Cl¯] = Ks.
б) условие осаждения: [Ag+] • [Cl¯] > Ks; в ходе осаждения концентрации ионов уменьшаются до установления равновесия;
в) условие растворения осадка или существования насыщенного раствора: [Ag+] • [Cl¯] < Ks; в ходе растворения осадка концентрация ионов увеличивается до установления равновесия.
Насыщенный раствор – раствор, который находится в равновесии с осадком.
Закон действия масс в применении к равновесию между осадком и раствором дает:
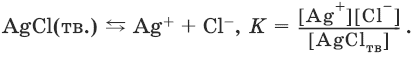
К • [AgClтв] = Ks(AgCl) = [Ag+] • [Cl¯].
В общем виде имеем:
АmBn(тв.) ↔ mA+n + nB-m
Ks(AmBn) = [А+n]m • [В-m]n.
Константа растворимости Ks (или произведение растворимости ПР) – произведение концентраций ионов в насыщенном растворе малорастворимого электролита – есть величина постоянная и зависит лишь от температуры.
Растворимость малорастворимого вещества s может быть выражена в молях на литр. В зависимости от величины s вещества могут быть разделены на малорастворимые – s < 10-4 моль/л, среднерастворимые – 10-4 моль/л ≤ s ≤ 10-2 моль/л и хорошо растворимые s >10-2 моль/л.
Растворимость соединений связана с их произведением растворимости.
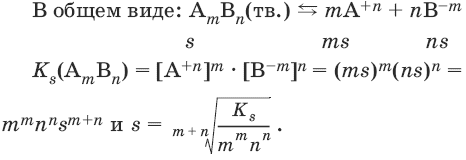
Условие осаждения и растворения осадка
В случае AgCl: AgCl ↔ Ag+ + Cl¯Ks = [Ag+] • [CI¯]:
а) условие равновесия между осадком и раствором: [Ag+] • [Cl¯] = Ks.
б) условие осаждения: [Ag+] • [Cl¯] > Ks; в ходе осаждения концентрации ионов уменьшаются до установления равновесия;
в) условие растворения осадка или существования насыщенного раствора: [Ag+] • [Cl¯] < Ks; в ходе растворения осадка концентрация ионов увеличивается до установления равновесия.
8. Координационные соединения
Координационные (комплексные) соединения – соединения с донорно-акцеп-торной связью.
Для K3[Fe(CN)6]:
ионы внешней сферы – 3К+,
ион внутренней сферы – [Fe(CN)6]3-,
комплексообразователь – Fe3+,
лиганды – 6CN¯, их дентатность – 1,
координационное число – 6.
Примеры комплексообразователей: Ag+, Cu2+, Hg2+, Zn2+, Ni2+, Fe3+, Pt4+ и др.
Примеры лигандов: полярные молекулы Н2O, NH3, CO и анионы CN¯, Cl¯, OH¯ и др.
Координационные числа: обычно 4 или 6, реже 2, 3 и др.
Номенклатура. Называют сначала анион (в именительном падеже), затем катион (в родительном падеже). Названия некоторых лигандов: NH3 – аммин, Н2O – акво, CN¯ – циано, Cl¯ – хлоро, OH¯ – гидроксо. Названия координационных чисел: 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса. Указывают степень окисления комплек-сообразователя:
[Ag(NH3)2]Cl – хлорид диамминсеребра(I);
[Cu(NH3)4]SO4 – сульфат тетрамминмеди(II);
K3[Fe(CN)6] – гексацианоферрат(III) калия.
Диамагнитный комплексный ион Fe(CN)64-.
Цианид-ион – донор
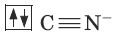 Ион железа Fe2+ – акцептор – имеет формулу 3d64s04p0. С учетом диамагнитности комплекса (все электроны спарены) и координационного числа (нужны 6 свободных орбиталей) имеем d2sp3-гибридизацию:
Ион железа Fe2+ – акцептор – имеет формулу 3d64s04p0. С учетом диамагнитности комплекса (все электроны спарены) и координационного числа (нужны 6 свободных орбиталей) имеем d2sp3-гибридизацию:
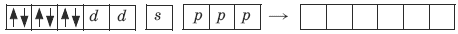 Комплекс диамагнитный, низкоспиновый, внутриорбитальный, стабильный (не используются внешние электроны), октаэд-рический (d2sp3-гибридизация).
Комплекс диамагнитный, низкоспиновый, внутриорбитальный, стабильный (не используются внешние электроны), октаэд-рический (d2sp3-гибридизация).
Парамагнитный комплексный ион FeF63-.
Фторид-ион – донор.
Ион железа Fe3+ – акцептор – имеет формулу 3d54s04p0. С учетом парамагнитности комплекса (электроны распарены) и координационного числа (нужны 6 свободных орбиталей) имеем sp3d2-гибридизацию:
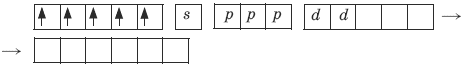 Комплекс парамагнитный, высокоспиновый, внешнеорбитальный, нестабильный (использованы внешние 4d-орбитали), октаэдрический (sp3d2-гибридизация).
Комплекс парамагнитный, высокоспиновый, внешнеорбитальный, нестабильный (использованы внешние 4d-орбитали), октаэдрический (sp3d2-гибридизация).
[Ag(NH3)2]NO3 → Ag(NH3)2+ + NO3¯, α = 1.
Ионы внутренней сферы, т. е. комплексные ионы, диссоциируют на ионы металла и лиганды, как слабые электролиты, по ступеням.
 где K1, К2, К1_2 называются константами нестойкости и характеризуют диссоциацию комплексов: чем меньше константа нестойкости, тем меньше диссоциирует комплекс, тем он устойчивее.
где K1, К2, К1_2 называются константами нестойкости и характеризуют диссоциацию комплексов: чем меньше константа нестойкости, тем меньше диссоциирует комплекс, тем он устойчивее.
Для K3[Fe(CN)6]:
ионы внешней сферы – 3К+,
ион внутренней сферы – [Fe(CN)6]3-,
комплексообразователь – Fe3+,
лиганды – 6CN¯, их дентатность – 1,
координационное число – 6.
Примеры комплексообразователей: Ag+, Cu2+, Hg2+, Zn2+, Ni2+, Fe3+, Pt4+ и др.
Примеры лигандов: полярные молекулы Н2O, NH3, CO и анионы CN¯, Cl¯, OH¯ и др.
Координационные числа: обычно 4 или 6, реже 2, 3 и др.
Номенклатура. Называют сначала анион (в именительном падеже), затем катион (в родительном падеже). Названия некоторых лигандов: NH3 – аммин, Н2O – акво, CN¯ – циано, Cl¯ – хлоро, OH¯ – гидроксо. Названия координационных чисел: 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса. Указывают степень окисления комплек-сообразователя:
[Ag(NH3)2]Cl – хлорид диамминсеребра(I);
[Cu(NH3)4]SO4 – сульфат тетрамминмеди(II);
K3[Fe(CN)6] – гексацианоферрат(III) калия.
Химическая связь.
Теория валентных связей предполагает гибридизацию орбиталей центрального атома. Расположение образующихся при этом гибридных орбиталей определяет геометрию комплексов.Диамагнитный комплексный ион Fe(CN)64-.
Цианид-ион – донор
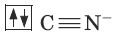
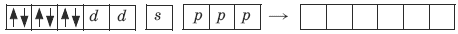
Парамагнитный комплексный ион FeF63-.
Фторид-ион – донор.
Ион железа Fe3+ – акцептор – имеет формулу 3d54s04p0. С учетом парамагнитности комплекса (электроны распарены) и координационного числа (нужны 6 свободных орбиталей) имеем sp3d2-гибридизацию:

Диссоциация координационных соединений.
Координационные соединения в растворе полностью диссоциируют на ионы внутренней и внешней сфер.[Ag(NH3)2]NO3 → Ag(NH3)2+ + NO3¯, α = 1.
Ионы внутренней сферы, т. е. комплексные ионы, диссоциируют на ионы металла и лиганды, как слабые электролиты, по ступеням.

II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
1. Основные классы неорганических соединений
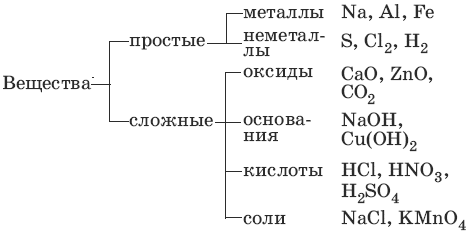
1.1. Оксиды
Оксиды – сложные вещества, состоящие из атомов кислорода в степени окисления -2 и атомов другого элемента.
Номенклатура: Fe2O3 – оксид железа(III), Cl2O – оксид хлора(I).
Солеобразующие оксиды:
основные – оксиды металлов в степени окисления +1, +2,
амфотерные – оксиды металлов в степени окисления +2, +3, +4,
кислотные – оксиды металлов в степени окисления +5, +6, +7 и
оксиды неметаллов в степени окисления +1 – +7.
С + O2 = CO2
2Са + O2 = 2СаО
Горение (обжиг) сложных веществ:
CH4 + 2O2 = CO2 + 2Н2O
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Разложение сложных веществ:
CaCO3 →t→ СаО + CO2
2Fe(OH)3 →t→ Fe2O3 + ЗН2O
СаО + Н2O = Са(OH)2 (растворимы оксиды металлов IA– и IIА-групп, кроме Be, Mg)
CuO + Н2O ≠ (оксиды остальных металлов нерастворимы)
СаО + CO2 = CaCO3
СаО + 2HCl = CaCl2 + Н2O
Кислотным оксидам (CO2, Р2O5, СrO3, Mn2O7) соответствуют кислоты.
SO2 + Н2O = H2SO3 (кислотные оксиды, кроме SiO2, растворимы в воде)
SO2 + СаО = CaSO3
SO2 + 2NaOH = Na2SO3 + Н2O
Амфотерным оксидам (ZnO, Al2O3, Cr2O3, ВеО, РЬО) соответствуют амфотерные гидроксиды.
ZnO + H2O ≠ (амфотерные оксиды нерастворимы в воде)
ZnO + 2HCl = ZnCl2 + Н2O
ZnO + 2NaOH →t→ Na2ZnO2 + Н2O (при нагревании или сплавлении)
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] (в разбавленном растворе)
Номенклатура: Fe2O3 – оксид железа(III), Cl2O – оксид хлора(I).
Классификация оксидов
Несолеобразующие (безразличные) оксиды: CO, SiO, NO, N2O.Солеобразующие оксиды:
основные – оксиды металлов в степени окисления +1, +2,
амфотерные – оксиды металлов в степени окисления +2, +3, +4,
кислотные – оксиды металлов в степени окисления +5, +6, +7 и
оксиды неметаллов в степени окисления +1 – +7.
Получение оксидов
Горение простых веществ:С + O2 = CO2
2Са + O2 = 2СаО
Горение (обжиг) сложных веществ:
CH4 + 2O2 = CO2 + 2Н2O
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Разложение сложных веществ:
CaCO3 →t→ СаО + CO2
2Fe(OH)3 →t→ Fe2O3 + ЗН2O
Химические свойства оксидов
Основным оксидам (Na2O, CaO, CuO, FeO) соответствуют основания.СаО + Н2O = Са(OH)2 (растворимы оксиды металлов IA– и IIА-групп, кроме Be, Mg)
CuO + Н2O ≠ (оксиды остальных металлов нерастворимы)
СаО + CO2 = CaCO3
СаО + 2HCl = CaCl2 + Н2O
Кислотным оксидам (CO2, Р2O5, СrO3, Mn2O7) соответствуют кислоты.
SO2 + Н2O = H2SO3 (кислотные оксиды, кроме SiO2, растворимы в воде)
SO2 + СаО = CaSO3
SO2 + 2NaOH = Na2SO3 + Н2O
Амфотерным оксидам (ZnO, Al2O3, Cr2O3, ВеО, РЬО) соответствуют амфотерные гидроксиды.
ZnO + H2O ≠ (амфотерные оксиды нерастворимы в воде)
ZnO + 2HCl = ZnCl2 + Н2O
ZnO + 2NaOH →t→ Na2ZnO2 + Н2O (при нагревании или сплавлении)
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] (в разбавленном растворе)
1.2. Основания
Основания – сложные вещества, состоящие из атомов металла и гидроксиль-ных групп; основания – электролиты, образующие при диссоциации в качестве анионов только анионы гидроксила.
Номенклатура: Fe(OH)3 – гидроксид железа(III).
– нерастворимые Fe(OH)2, Mg(OH)2;
– амфотерные Zn(OH)2, Al(OH)3, Ве(OH)2, Сr(OH)3;
– однокислотные NaOH, KOH;
– двухкислотные Ва(OH)2, Zn(OH)2;
– трехкислотные Al(OH)3, Сr(OH)3.
2Na + 2Н2O = 2NaOH + Н2
Na2O + Н2O = 2NaOH
Номенклатура: Fe(OH)3 – гидроксид железа(III).
Классификация оснований:
– растворимые (щелочи) NaOH, KOH;– нерастворимые Fe(OH)2, Mg(OH)2;
– амфотерные Zn(OH)2, Al(OH)3, Ве(OH)2, Сr(OH)3;
– однокислотные NaOH, KOH;
– двухкислотные Ва(OH)2, Zn(OH)2;
– трехкислотные Al(OH)3, Сr(OH)3.
Получение оснований
Получение щелочей:2Na + 2Н2O = 2NaOH + Н2
Na2O + Н2O = 2NaOH
Конец бесплатного ознакомительного фрагмента
