Страница:
Ирина Михайловна Спивак
Экология. Повреждение и репарация ДНК
Предисловие
Эта книга – специализированное учебное пособие, посвященное одной из особенностей ДНК-метаболизма – ее репарации.
Настоящее пособия написано по материалам курса лекций по физико-химической биологии, часть которого автор на протяжении последних 4 лет читает в СПбПГУ, являясь одним из его создателей.
Молекулярная биология и особенно та ее область, которая занимается изучением ДНК-метаболизма – одна из наиболее бурно развивающихся дисциплин в современном естествознании. В нее постоянно привносится множество новых фактов, и почти каждый год совершаются открытия. Объем настоящего учебного пособия слишком мал, чтобы вместить в себя огромный накопленный материал. Поэтому в каждой главе книги даны обобщенные и устоявшиеся представления о той или иной проблеме, проиллюстрированные примерами из современной литературы. Автор не мог не воспользоваться также и тем обстоятельством, что в последнее десятилетие в нашей стране было издано несколько ценных (отечественных и переводных) учебных пособий по молекулярной биологии и смежным дисциплинам. Это позволило ему в весьма кратком виде изложить в данном учебном пособии целый ряд вопросов и порекомендовать читателю ознакомиться с контекстом, внутри которого существуют все представленные в пособии данные по репарации ДНК.
Одновременно нужно отметить, что это учебное пособие не могло бы появиться в печати без активной поддержки сотрудников кафедры физико-химической биологии клетки факультета медицинской физики и биоинженерии СПбГПУ и уважаемых рецензентов, с которыми автор обсуждал состояние современной парадигмы молекулярной биологии.
Автор с признательностью примет от читателей критические замечания и советы по совершенствованию данного пособия.
Настоящее пособия написано по материалам курса лекций по физико-химической биологии, часть которого автор на протяжении последних 4 лет читает в СПбПГУ, являясь одним из его создателей.
Молекулярная биология и особенно та ее область, которая занимается изучением ДНК-метаболизма – одна из наиболее бурно развивающихся дисциплин в современном естествознании. В нее постоянно привносится множество новых фактов, и почти каждый год совершаются открытия. Объем настоящего учебного пособия слишком мал, чтобы вместить в себя огромный накопленный материал. Поэтому в каждой главе книги даны обобщенные и устоявшиеся представления о той или иной проблеме, проиллюстрированные примерами из современной литературы. Автор не мог не воспользоваться также и тем обстоятельством, что в последнее десятилетие в нашей стране было издано несколько ценных (отечественных и переводных) учебных пособий по молекулярной биологии и смежным дисциплинам. Это позволило ему в весьма кратком виде изложить в данном учебном пособии целый ряд вопросов и порекомендовать читателю ознакомиться с контекстом, внутри которого существуют все представленные в пособии данные по репарации ДНК.
Одновременно нужно отметить, что это учебное пособие не могло бы появиться в печати без активной поддержки сотрудников кафедры физико-химической биологии клетки факультета медицинской физики и биоинженерии СПбГПУ и уважаемых рецензентов, с которыми автор обсуждал состояние современной парадигмы молекулярной биологии.
Автор с признательностью примет от читателей критические замечания и советы по совершенствованию данного пособия.
Введение
Описание ДНК-метаболизма является неотъемлемой составной частью молекулярной и физико-химической биологии. Молекулярная биология как самостоятельная наука, изучающая молекулярные основы жизнедеятельности клетки, возникла на рубеже 1940–1950 гг., когда была установлена генетическая роль дезоксирибонуклеиновых кислот (ДНК), а расшифровка структуры ДНК позволила описать в простых физико-химических терминах принцип передачи наследуемых признаков от родительской клетки к дочерним.
К этому времени история изучения нуклеиновых кислот насчитывала уже около восьмидесяти лет. Честь их открытия принадлежит выдающемуся швейцарскому биохимику Фридриху Мишеру, который в 1868–1872 гг. выделил из ядер спермы лосося новое фосфорсодержащее вещество, названное им нуклеином (от греч. nucleus– ядро). Впервые нуклеиновую кислоту, свободную от белков, получил Р. Альтман в 1889 г., который и ввел этот термин в биохимию. В результате дальнейшего изучения химического состава нуклеиновых кислот удалось установить, что в природе их существует два типа, причем долгое время существовала уверенность в том, что ядра клеток животных содержат только ДНК, а ядра клеток растений – только РНК. И лишь к середине 1930-х годов было доказано, что ДНК и РНК содержатся в каждой живой клетке. Первостепенная роль в утверждении этого фундаментального положения принадлежит А. Н. Белозерскому, впервые выделившему ДНК из растений. С развитием методов цитохимии и гистохимии к концу 1940-х годов было установлено, что ДНК локализуется преимущественно в ядре, а РНК – в цитоплазме клеток,
К началу 1950-х годов работы по изучению химического строения нуклеиновых кислот были завершены. Было выяснено строение их мономеров – нуклеозидов и нуклеотидов, и доказано, что и в ДНК, и в РНК нуклеотидные остатки связаны между собой в полимер только 3'-О-фосфодиэфирной связью. Выдающейся вехой в изучении нуклеиновых кислот стало открытие О. Эйвери с сотрудниками, которые показали, что с помощью чистой ДНК наследуемый признак может быть перенесен из одной клетки в другую. Так было доказано, что ДНК является носителем генетической информации. В 1953 г. Дж. Уотсон и Ф. Крик сумели правильно интерпретировать данные рентгенеструктурного анализа ДНК, накопленные в лабораториях Р. Франклин и М. Уилкинса, и на их основе построить модель пространственной структуры ДНК. Они показали, что макромолекула ДНК – это регулярная двойная спираль, в которой две полинуклеотидные цепи строго комплементарны друг другу. Из анализа модели следовало, что после расплетания двойной спирали на каждой из полинуклеотидных нитей может быть построена комплементарная ей новая, в результате чего образуются две дочерние молекулы, неотличимые от материнской ДНК. Через пять лет М. Мезельсон и Ф. Сталь экспериментально подтвердили этот механизм, а несколько раньше (1956) А. Корнберг открыл фермент ДНК-полимеразу, который на расплетенных нитях, как на матрицах, синтезирует новые, комплементарные им цепи ДНК.
Открытие генетической роли ДНК потребовало решения другой фундаментальной задачи – поддержания стабильности молекулы ДНК и ее постоянства при передаче в ряду поколений.
Как ни странно это прозвучит, но созданию современных представлений о метаболизме ДНК и гармоничном взаимодействии процессов репликации, рекомбинации и репарации во время клеточного цикла препятствовала утвердившаяся к середине 50-х годов прошлого века парарадигма о безупречности и совершенстве – а, следовательно, и неизменности – двунитевой молекулы ДНК. Вторая половина XX века прошла под знаком изменения этой парадигмы и осознания динамического равновесия между постоянно возникающими повреждениями ДНК и восстановлением этих повреждений. В силу этого противоречия, во всех существующих учебниках при описании ДНК-метаболизма проблема репарации традиционно занимает место Золушки рядом со своими более удачливыми сестрами – репликацией и рекомбинацией. Репарации ДНК обычно посвящается несколько страниц с самыми общими представлениями о той сложной совокупности многообразных процессов, которые входят в это понятие. Таким образом, становится очевидным необходимость и востребованность специального учебного пособия, фокусирующегося именно на проблемах репарации и глобального клеточного ответа на повреждения ДНК.
В современную эпоху, когда на первый план в науках о земле и человеке выходит экология, знание механизмов, противостоящих накоплению мутационного груза и степени их надежности, представляется крайне актуальной. При получении образования по направлению «Техническая физика» необходимо создать у студентов, обучающихся на факультете медицинской физики и биоинженерии современные представления о ДНК-метаболизме, которые будут способствовать у них выработке строгого методического подхода к будущим научно-техническим исследованиям в области прикладной биологии и медицины.
К этому времени история изучения нуклеиновых кислот насчитывала уже около восьмидесяти лет. Честь их открытия принадлежит выдающемуся швейцарскому биохимику Фридриху Мишеру, который в 1868–1872 гг. выделил из ядер спермы лосося новое фосфорсодержащее вещество, названное им нуклеином (от греч. nucleus– ядро). Впервые нуклеиновую кислоту, свободную от белков, получил Р. Альтман в 1889 г., который и ввел этот термин в биохимию. В результате дальнейшего изучения химического состава нуклеиновых кислот удалось установить, что в природе их существует два типа, причем долгое время существовала уверенность в том, что ядра клеток животных содержат только ДНК, а ядра клеток растений – только РНК. И лишь к середине 1930-х годов было доказано, что ДНК и РНК содержатся в каждой живой клетке. Первостепенная роль в утверждении этого фундаментального положения принадлежит А. Н. Белозерскому, впервые выделившему ДНК из растений. С развитием методов цитохимии и гистохимии к концу 1940-х годов было установлено, что ДНК локализуется преимущественно в ядре, а РНК – в цитоплазме клеток,
К началу 1950-х годов работы по изучению химического строения нуклеиновых кислот были завершены. Было выяснено строение их мономеров – нуклеозидов и нуклеотидов, и доказано, что и в ДНК, и в РНК нуклеотидные остатки связаны между собой в полимер только 3'-О-фосфодиэфирной связью. Выдающейся вехой в изучении нуклеиновых кислот стало открытие О. Эйвери с сотрудниками, которые показали, что с помощью чистой ДНК наследуемый признак может быть перенесен из одной клетки в другую. Так было доказано, что ДНК является носителем генетической информации. В 1953 г. Дж. Уотсон и Ф. Крик сумели правильно интерпретировать данные рентгенеструктурного анализа ДНК, накопленные в лабораториях Р. Франклин и М. Уилкинса, и на их основе построить модель пространственной структуры ДНК. Они показали, что макромолекула ДНК – это регулярная двойная спираль, в которой две полинуклеотидные цепи строго комплементарны друг другу. Из анализа модели следовало, что после расплетания двойной спирали на каждой из полинуклеотидных нитей может быть построена комплементарная ей новая, в результате чего образуются две дочерние молекулы, неотличимые от материнской ДНК. Через пять лет М. Мезельсон и Ф. Сталь экспериментально подтвердили этот механизм, а несколько раньше (1956) А. Корнберг открыл фермент ДНК-полимеразу, который на расплетенных нитях, как на матрицах, синтезирует новые, комплементарные им цепи ДНК.
Открытие генетической роли ДНК потребовало решения другой фундаментальной задачи – поддержания стабильности молекулы ДНК и ее постоянства при передаче в ряду поколений.
Как ни странно это прозвучит, но созданию современных представлений о метаболизме ДНК и гармоничном взаимодействии процессов репликации, рекомбинации и репарации во время клеточного цикла препятствовала утвердившаяся к середине 50-х годов прошлого века парарадигма о безупречности и совершенстве – а, следовательно, и неизменности – двунитевой молекулы ДНК. Вторая половина XX века прошла под знаком изменения этой парадигмы и осознания динамического равновесия между постоянно возникающими повреждениями ДНК и восстановлением этих повреждений. В силу этого противоречия, во всех существующих учебниках при описании ДНК-метаболизма проблема репарации традиционно занимает место Золушки рядом со своими более удачливыми сестрами – репликацией и рекомбинацией. Репарации ДНК обычно посвящается несколько страниц с самыми общими представлениями о той сложной совокупности многообразных процессов, которые входят в это понятие. Таким образом, становится очевидным необходимость и востребованность специального учебного пособия, фокусирующегося именно на проблемах репарации и глобального клеточного ответа на повреждения ДНК.
В современную эпоху, когда на первый план в науках о земле и человеке выходит экология, знание механизмов, противостоящих накоплению мутационного груза и степени их надежности, представляется крайне актуальной. При получении образования по направлению «Техническая физика» необходимо создать у студентов, обучающихся на факультете медицинской физики и биоинженерии современные представления о ДНК-метаболизме, которые будут способствовать у них выработке строгого методического подхода к будущим научно-техническим исследованиям в области прикладной биологии и медицины.
1. Изучение ДНК-метаболизма
Заинтересовавшись историей изучения трех Р ДНК-метаболизма – репликации (копирование ДНК-предшественницы при каждом клеточном делении), рекомбинации (обмене между различными молекулами ДНК в клетке) и репарации (возвращение измененной ДНК к ее нормальному, «правильному» состоянию), с удивлением обнаруживаешь, что исследования репарации и мутагенеза (появления наследуемых изменений ДНК) резко, почти на 20 лет, отставали от изучения репликации и рекомбинации. Это в первую очередь связано с тем, что серьезные теоретические взгляды на мутационные повреждения ДНК и их репарацию идеологически противоречили изначально сложившейся в науке парадигме о физико-химическом, структурном и, если можно так выразиться, эстетическом совершенстве двойной спирали ДНК. Такое восторженное отношение к главной молекуле наследственности препятствовало развитию системы новых взглядов на динамическое состояние ДНК, которые в большинстве случаев даже не воспринимались всерьез. Фрэнк Сталь однажды заявил, что «возможность того, что гены являются субъектами суматохи, возникающей при одновременном действии оскорбления и неуклюжих усилий эти оскорбления загладить, неправдоподобна».
Только через два десятилетия после того, как он и Джеймс Уотсон представили структуру ДНК, Френсис Крик признался в своем письме в «Nature» от 26 апреля 1974 года: «Мы совершенно ошиблись в возможной роли ДНК-репарации, хотя позднее я пришел к пониманию того, что ДНК столь точна потому, что существует множество различных механизмов репарации». Это ретроспективное размышление одного из создателей модели двойной спирали ДНК дает намек на раннее понимание ДНК как крайне стабильного макромолекулярного образования. Именно это преобладающее в то время мнение задержало изучение таких биохимических процессов как мутагенез и репарация.
Здесь, впрочем, нужно сказать, что через короткий промежуток времени, после того как Уотсон и Крик сообщили о двойной спиральной структуре ДНК, они же приложили правила спаривания оснований к мутагенезу, формулируя его так: «Спонтанная мутация может быть результатом того, что основание случайно окажется в одной из его редких, но вероятных таутомерных форм».
Таутомеризация – это свойство вещества, позволяющее ему находиться в одном из взаимопереходящих химических состояний; в случае ДНК оснований – это кето– и энол-формы. Уотсон и Крик вначале внимательно изучили все возможности и сложности таутомеризации и неудачно попробовали сконструировать свою ДНК-модель из редких энольных форм оснований. Проблема стабильного спаривания оснований была разрешена ими только после того, как Джерри Донахью, бывший аспирант Лайнуса Полинга, указал Уотсону на более разумное использование обычной кето-формы.
При этом Уотсоном и Криком не было дано никакого объяснения тому факту, что химическая лабильность ДНК, проявляющая себя в виде той самой таутомеризации, может иметь широкое приложение к изучению проблемы стабильности генов. Действительно, эта область наблюдения указывает прямой подход к уточнению природы повреждения ДНК и его возможных биологических последствий. В науке создалась парадоксальная ситуация. Для исследования таких реальных проблем, как расшифровка генетического кода или понимание основных признаков репликации и рекомбинации ДНК, активно разрабатывались и создавались многочисленные системы in vitro. При их разработке как инструмент для определения функций генов и их полипептидных продуктов и уточнения генетического кода широко применялся мутагенез, который сам еще долго не являлся предметом независимых серьезных исследований. И все это несмотря на тот факт, что существование репарационного феномена фотореактивации было известно за несколько лет до описания самой структуры ДНК.
Так было до того момента, когда стало понятно, что ДНК все-таки постоянно подвергается повреждениям и что у клетки есть целый арсенал путей, чтобы реагировать на эти повреждения. При этом нарушение или врожденная недостаточность процессов репарации и возникающие в результате этого мутации могут иметь катастрофические последствия, приводя к целому ряду заболеваний человека. Одновременно с этим укреплялось понимание, что мутации тем не менее необходимы, так как являются основой жизни и эволюции.
Последующие работы подтвердили идею о динамическом состоянии ДНК, то есть серьезно изменили существующую парадигму. Это сделало почти в один миг очевидным, что ДНК всех живых организмов постоянно подвергаются мириадам типов повреждений, и что клетки изобрели остроумные механизмы, позволяющие им быть устойчивыми к этим повреждениям и/или репарировать их. Нарушение данных механизмов может привести к серьезным болезненным последствиям, что хорошо проиллюстрировано человеческим наследственным заболеванием пигментной ксеродермой (xeroderma pigmentosum, ХР), наследственным неполипозным раком кишечника (human nonpoliposys colon cancer, HNPCC) и семейными формами рака груди. ХР характеризуется более чем в 10 000 раз повышенным риском рака кожи, связанным с мутагенным воздействием солнечного света, люди с HNPCC демонстрируют повышенную наследственную предрасположенность к раку прямой кишки и другим онкологическим заболеваниям.
Только через два десятилетия после того, как он и Джеймс Уотсон представили структуру ДНК, Френсис Крик признался в своем письме в «Nature» от 26 апреля 1974 года: «Мы совершенно ошиблись в возможной роли ДНК-репарации, хотя позднее я пришел к пониманию того, что ДНК столь точна потому, что существует множество различных механизмов репарации». Это ретроспективное размышление одного из создателей модели двойной спирали ДНК дает намек на раннее понимание ДНК как крайне стабильного макромолекулярного образования. Именно это преобладающее в то время мнение задержало изучение таких биохимических процессов как мутагенез и репарация.
Здесь, впрочем, нужно сказать, что через короткий промежуток времени, после того как Уотсон и Крик сообщили о двойной спиральной структуре ДНК, они же приложили правила спаривания оснований к мутагенезу, формулируя его так: «Спонтанная мутация может быть результатом того, что основание случайно окажется в одной из его редких, но вероятных таутомерных форм».
Таутомеризация – это свойство вещества, позволяющее ему находиться в одном из взаимопереходящих химических состояний; в случае ДНК оснований – это кето– и энол-формы. Уотсон и Крик вначале внимательно изучили все возможности и сложности таутомеризации и неудачно попробовали сконструировать свою ДНК-модель из редких энольных форм оснований. Проблема стабильного спаривания оснований была разрешена ими только после того, как Джерри Донахью, бывший аспирант Лайнуса Полинга, указал Уотсону на более разумное использование обычной кето-формы.
При этом Уотсоном и Криком не было дано никакого объяснения тому факту, что химическая лабильность ДНК, проявляющая себя в виде той самой таутомеризации, может иметь широкое приложение к изучению проблемы стабильности генов. Действительно, эта область наблюдения указывает прямой подход к уточнению природы повреждения ДНК и его возможных биологических последствий. В науке создалась парадоксальная ситуация. Для исследования таких реальных проблем, как расшифровка генетического кода или понимание основных признаков репликации и рекомбинации ДНК, активно разрабатывались и создавались многочисленные системы in vitro. При их разработке как инструмент для определения функций генов и их полипептидных продуктов и уточнения генетического кода широко применялся мутагенез, который сам еще долго не являлся предметом независимых серьезных исследований. И все это несмотря на тот факт, что существование репарационного феномена фотореактивации было известно за несколько лет до описания самой структуры ДНК.
Так было до того момента, когда стало понятно, что ДНК все-таки постоянно подвергается повреждениям и что у клетки есть целый арсенал путей, чтобы реагировать на эти повреждения. При этом нарушение или врожденная недостаточность процессов репарации и возникающие в результате этого мутации могут иметь катастрофические последствия, приводя к целому ряду заболеваний человека. Одновременно с этим укреплялось понимание, что мутации тем не менее необходимы, так как являются основой жизни и эволюции.
Последующие работы подтвердили идею о динамическом состоянии ДНК, то есть серьезно изменили существующую парадигму. Это сделало почти в один миг очевидным, что ДНК всех живых организмов постоянно подвергаются мириадам типов повреждений, и что клетки изобрели остроумные механизмы, позволяющие им быть устойчивыми к этим повреждениям и/или репарировать их. Нарушение данных механизмов может привести к серьезным болезненным последствиям, что хорошо проиллюстрировано человеческим наследственным заболеванием пигментной ксеродермой (xeroderma pigmentosum, ХР), наследственным неполипозным раком кишечника (human nonpoliposys colon cancer, HNPCC) и семейными формами рака груди. ХР характеризуется более чем в 10 000 раз повышенным риском рака кожи, связанным с мутагенным воздействием солнечного света, люди с HNPCC демонстрируют повышенную наследственную предрасположенность к раку прямой кишки и другим онкологическим заболеваниям.
1.1. Начало исследования репарации
Самые ранние работы, посвященные мутациям и репарации ДНК были начаты еще в 1930-х годах по инициативе небольшой, но выдающейся группы ученых-физиков. Из воспоминаний генетика Гвидо Понтекорво нам известно, что «в годы, непосредственно предшествовавшие второй мировой войне, случилось нечто новое: введение идей (не технологий) из царства физики в царство генетики, в частности касающихся проблем размера, мутабильности и саморепликации генов». Достижением этого содружества физики и генетики в предвоенной Германии стало сотрудничество между немецкими физиками Карлом Циммером и Максом Дельбрюком и русским генетиком Николаем Владимировичем Тимофеевым-Ресовским. Это сотрудничество возникло после того, как Герман Меллер, генетик, работавший на плодовой мушке Drosophila, первым продемонстрировал, что внешние агенты, такие как ионизирующая радиация, могут являться причиной мутаций живых организмов.
Сначала Тимофеев-Ресовский и Циммер заинтересовались, каким образом столь небольшие количества энергии в форме ионизирующей радиации (формально эквивалентные тепловой энергии, получаемой не более чем при выпивании одной чашки чая) могут иметь столь глубокие биологические эффекты. С другой стороны, Дельбрюку и Меллеру было важно понять, каким именно образом каждая мутация может влиять на физическую природу гена, и – как следствие – помочь ученым в понимании этой природы (нужно помнить, что речь идет о 30-х годах ХХ века).
Ретроспективно представляется неизбежным, что использование физических (а позже – химических) инструментов, таких как ионизирующее или ультрафиолетовое излучение (УФ) и химические мутагены для изучения генов, привело к вопросу, каким образом эти агенты повреждают ДНК. И, однажды поняв, что эти вмешательства вызывают нарушение как структуры, так и функций генов, иногда прямо приводящие к утере организмом каких-либо из них, ученые поставили вопрос о том, как именно клетки способны существовать с этой поврежденной ДНК. Циммер писал: «Никто не может использовать излучения без понимания механизмов их действия, и также никто не может обнаружить какие-либо вызванные излучениями изменения, не заинтересовавшись нормальным состоянием исследуемого материала».
К сожалению, начало Второй мировой войны сказалось и на развитии фундаментальной науки в Германии, многие ученые вынуждены были эмигрировать, замечательное научное братство физиков и генетиков распалось.
Сначала Тимофеев-Ресовский и Циммер заинтересовались, каким образом столь небольшие количества энергии в форме ионизирующей радиации (формально эквивалентные тепловой энергии, получаемой не более чем при выпивании одной чашки чая) могут иметь столь глубокие биологические эффекты. С другой стороны, Дельбрюку и Меллеру было важно понять, каким именно образом каждая мутация может влиять на физическую природу гена, и – как следствие – помочь ученым в понимании этой природы (нужно помнить, что речь идет о 30-х годах ХХ века).
Ретроспективно представляется неизбежным, что использование физических (а позже – химических) инструментов, таких как ионизирующее или ультрафиолетовое излучение (УФ) и химические мутагены для изучения генов, привело к вопросу, каким образом эти агенты повреждают ДНК. И, однажды поняв, что эти вмешательства вызывают нарушение как структуры, так и функций генов, иногда прямо приводящие к утере организмом каких-либо из них, ученые поставили вопрос о том, как именно клетки способны существовать с этой поврежденной ДНК. Циммер писал: «Никто не может использовать излучения без понимания механизмов их действия, и также никто не может обнаружить какие-либо вызванные излучениями изменения, не заинтересовавшись нормальным состоянием исследуемого материала».
К сожалению, начало Второй мировой войны сказалось и на развитии фундаментальной науки в Германии, многие ученые вынуждены были эмигрировать, замечательное научное братство физиков и генетиков распалось.
1.2. Репликация ДНК
Для того чтобы начать серьезный разговор о репарации, необходимо вспомнить основные детали репликации ДНК. Важно понимать, что все процессы ДНК-метаболизма тесно связаны между собой и белки, вовлеченные в репликацию и рекомбинацию ДНК, способны принимать участие в различных процессах репарации. Для наглядности рассмотрим схему процесса репликации у прокариот, представленную на рис. 1.
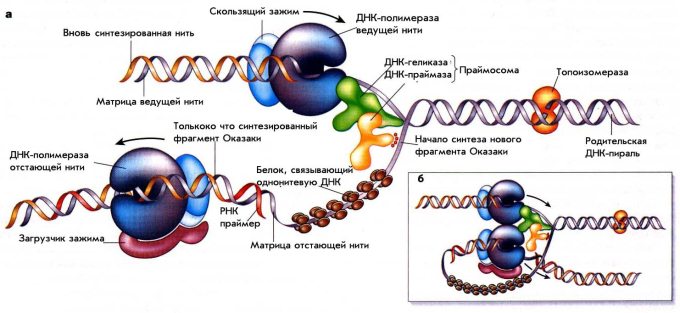
Рисунок 1. Схема репликации ДНК у E.coli. На панели а схематически показаны белки в Y– раскрученной вилке репликации ДНК, но в реальности вилка репликации свернута в трех измерениях и образует структуру, подобную той, что изображена на вставке б.
Сфокусируемся на схематическом изображении а. В репликативной вилке одновременно активны две молекулы ДНК-полимеразы. Одна движется постоянно, производя новую дочернюю молекулу ДНК на ведущей нити, тогда как другая производит длинную серию коротких фрагментов Оказаки на отстающей нити. Обе полимеразы «заякорены» на их матрице с помощью ассоциированных с ними белков в виде «скользящего зажима» (sliding clump) и «загрузчика зажима» (clump loader).
ДНК-геликаза, активированная энергией АТФ-гидролиза, быстро движется вдоль одной из матричных нитей (на рис. 1 – ведущая нить), раскрывая ДНК-спираль прямо перед репликативной вилкой. ДНК-геликаза предоставляет основания ДНК-спирали ДНК-полимеразе ведущей нити, чтобы та могла их копировать. Ферменты ДНК-топоизомеразы облегчают раскручивание спирали ДНК.
В дополнение к матрице, ДНК-полимераза нуждается в праймере, «затравке», существующей до начала собственно самого основного процесса синтеза ДНК, небольшой цепи ДНК или РНК с концом, к которому и присоединяется следующий нуклеотид. По этой причине ДНК-полимераза отстающей нити нуждается в действии фермента ДНК-праймазы перед тем, как она начнет синтез каждого нового фрагмента Оказаки. Праймаза производит очень короткую молекулу РНК (как РНК-праймер) в качестве 5’-конца каждого фрагмента Оказаки, к которому ДНК-полимераза и будет достраивать нуклеотиды. Наконец, однонитевые участки ДНК внутри вилки покрыты множеством копий SSB белка (связывающего однонитевую ДНК, single strand binding), занимая открытую область ДНК на нитях-матрицах с их подготовленными для копирования основаниями.
В представленной на вставке б схеме репликационной вилки показано, что ДНК-полимераза отстающей нити остается связанной с ДНК-полимеразой ведущей нити. Это позволяет ДНК-полимеразе отстающей нити оставаться внутри вилки после того, как завершен синтез очередного фрагмента Оказаки. В результате, одна и та же полимераза снова и снова участвует в синтезе большого числа фрагментов Оказаки, необходимых для образования новой цепи ДНК на отстающей нити.
В дополнение к перечисленной группе коровых (основных) белков, для репликации ДНК необходимы и другие белки, не представленные на рис. 1. Среди них можно описать группу белков – инициаторов репликации, необходимых для организации каждой новой репликативной вилки на ориджине репликации, белок РНКазу, удаляющий РНК-затравки фрагментов Оказаки, и ДНК-лигазу, сшивающая близлежащие фрагменты Оказаки друг с другом при формировании непрерывной нити ДНК.
RecQ-подобные геликазы вместе с топоизомеразой III также играют важную роль в репликации, а не только в других клеточных процессах, таких как гомологическая рекомбинация и контроль клеточного цикла.
Таким образом, мы видим, что процесс репликации очень сложен и может приводить к ошибкам в генетическом тексте, например, за счет подстановки неправильно спаренного или измененного основания. Одновременно процесс репликации является постоянным источником разрывов ДНК в клетке. Во-первых, всегда есть еще не соединившиеся фрагменты Оказаки. Во-вторых, при остановке движения репликативной вилки, чем бы она ни была вызвана, начинается процесс деградации ДНК и появляются ее свободные концы. В-третьих, топоизомераза I (ТорI) катализирует две основные реакции – разрезание и воссоединение однонитевой, нормально спаренной ДНК для релаксации ее суперскрученности при репликации или транскрипции. Множество эндогенных факторов действуют на эти две реакции разобщающее и приводят к образованию и накоплению ТорI-разрешающего комплекса, который является переходным к образованию двунитевых разрывов ДНК со всеми вытекающими последствиями. Таким образом, в течение процесса репликации структура ДНК может повреждаться и изменяться, а это уже само по себе является материалом для репарации.

Рисунок 1. Схема репликации ДНК у E.coli. На панели а схематически показаны белки в Y– раскрученной вилке репликации ДНК, но в реальности вилка репликации свернута в трех измерениях и образует структуру, подобную той, что изображена на вставке б.
Сфокусируемся на схематическом изображении а. В репликативной вилке одновременно активны две молекулы ДНК-полимеразы. Одна движется постоянно, производя новую дочернюю молекулу ДНК на ведущей нити, тогда как другая производит длинную серию коротких фрагментов Оказаки на отстающей нити. Обе полимеразы «заякорены» на их матрице с помощью ассоциированных с ними белков в виде «скользящего зажима» (sliding clump) и «загрузчика зажима» (clump loader).
ДНК-геликаза, активированная энергией АТФ-гидролиза, быстро движется вдоль одной из матричных нитей (на рис. 1 – ведущая нить), раскрывая ДНК-спираль прямо перед репликативной вилкой. ДНК-геликаза предоставляет основания ДНК-спирали ДНК-полимеразе ведущей нити, чтобы та могла их копировать. Ферменты ДНК-топоизомеразы облегчают раскручивание спирали ДНК.
В дополнение к матрице, ДНК-полимераза нуждается в праймере, «затравке», существующей до начала собственно самого основного процесса синтеза ДНК, небольшой цепи ДНК или РНК с концом, к которому и присоединяется следующий нуклеотид. По этой причине ДНК-полимераза отстающей нити нуждается в действии фермента ДНК-праймазы перед тем, как она начнет синтез каждого нового фрагмента Оказаки. Праймаза производит очень короткую молекулу РНК (как РНК-праймер) в качестве 5’-конца каждого фрагмента Оказаки, к которому ДНК-полимераза и будет достраивать нуклеотиды. Наконец, однонитевые участки ДНК внутри вилки покрыты множеством копий SSB белка (связывающего однонитевую ДНК, single strand binding), занимая открытую область ДНК на нитях-матрицах с их подготовленными для копирования основаниями.
В представленной на вставке б схеме репликационной вилки показано, что ДНК-полимераза отстающей нити остается связанной с ДНК-полимеразой ведущей нити. Это позволяет ДНК-полимеразе отстающей нити оставаться внутри вилки после того, как завершен синтез очередного фрагмента Оказаки. В результате, одна и та же полимераза снова и снова участвует в синтезе большого числа фрагментов Оказаки, необходимых для образования новой цепи ДНК на отстающей нити.
В дополнение к перечисленной группе коровых (основных) белков, для репликации ДНК необходимы и другие белки, не представленные на рис. 1. Среди них можно описать группу белков – инициаторов репликации, необходимых для организации каждой новой репликативной вилки на ориджине репликации, белок РНКазу, удаляющий РНК-затравки фрагментов Оказаки, и ДНК-лигазу, сшивающая близлежащие фрагменты Оказаки друг с другом при формировании непрерывной нити ДНК.
RecQ-подобные геликазы вместе с топоизомеразой III также играют важную роль в репликации, а не только в других клеточных процессах, таких как гомологическая рекомбинация и контроль клеточного цикла.
Таким образом, мы видим, что процесс репликации очень сложен и может приводить к ошибкам в генетическом тексте, например, за счет подстановки неправильно спаренного или измененного основания. Одновременно процесс репликации является постоянным источником разрывов ДНК в клетке. Во-первых, всегда есть еще не соединившиеся фрагменты Оказаки. Во-вторых, при остановке движения репликативной вилки, чем бы она ни была вызвана, начинается процесс деградации ДНК и появляются ее свободные концы. В-третьих, топоизомераза I (ТорI) катализирует две основные реакции – разрезание и воссоединение однонитевой, нормально спаренной ДНК для релаксации ее суперскрученности при репликации или транскрипции. Множество эндогенных факторов действуют на эти две реакции разобщающее и приводят к образованию и накоплению ТорI-разрешающего комплекса, который является переходным к образованию двунитевых разрывов ДНК со всеми вытекающими последствиями. Таким образом, в течение процесса репликации структура ДНК может повреждаться и изменяться, а это уже само по себе является материалом для репарации.
1.2.1. Репарация за счет проверки ДНК-полимеразой
Частота ошибочных встроек нуклеотидов в ходе репликации у бактерий составляет приблизительно 10-7-10-11. При этом известно, что ДНК-полимераза, синтезируя новую цепь, делает ошибки примерно в 100 раз чаще. Подобное увеличение точности репликации связано с тем, что одновременно ДНК-полимераза способна производить проверку встраивания. Большинство прокариотических, а также и эукариотических, полимераз в дополнение к полимеризующей активности в направлении 5'→3' имеет экзонуклеазную активность в направлении 3'→5'. При встраивании «неправильного» нуклеотида ошибка обычно (хотя и не всегда) распознается самой полимеразой, вероятно, из-за того, что в этом месте в двойной спирали образуется пузырь или впячивание, наличие которых не позволят полимеразе добавить следующий нуклеотид к растущему З'-ОН-концу. Процесс репликации не пойдет дальше до тех пор, пока «неправильный» нуклеотид не будет удален, а нужный не встанет на его место. У ДНК-полимеразы III E.coli эндонуклеазной активностью обладает субъединица ε (эпсилон), которая кодируется геном mutD, при инактивации которого возникают клетки с мутаторным фенотипом. Именно эта субъединица повышает точность ДНК-полимеразы III на 2–3 порядка. При мутациях гена mutD возникает дефект в системе проверки правильности встраивания нуклеотидов в направлении 3'→5'. В результате многие из неправильно встроенных нуклеотидов остаются во вновь синтезированной нити ДНК и с той или иной вероятностью приводят к возникновению мутаций.
Корректирующая 3'-5'-экзонуклеазная активность ДНК-полимеразы сама по себе является достаточно сложным и энергоемким процессом. При расчистке участка ДНК с неправильно спаренным основанием поисходит следующая цепь событий. Связывание dNTP с комплексом «ДНК-полимераза-матрица-З'-конец синтезируемой нити» протекает, как минимум, через два конформационных изменения ДНК-полимеразы. При попадании неправильного dNTP в реакцию оба эти конформационные изменения замедляются, что способствует перемещению неправильного конца в активный центр 3'-5'-экзонуклеазы (субъединицы ε) для расчистки участка ДНК вокруг неспаренного основания и его последующего ресинтеза. Так как биохимические реакции обладают некоторой инерционностью, в ходе расчистки удаляются не только неправильные, но и расположенные по соседству правильные нуклеотиды. Таким образом корректирующая активность ДНК-полимеразы не может превышать оптимальный предел, ведь в противном случае «сверхкорректная» полимеризация потребовала бы огромных затрат энергии, одновременно приводя к резкому снижению скорости синтеза ДНК. Этот предел и ограничивает повышение точности репликации примерной величиной 102.
Здесь нужно остановиться еще на двух моментах. Во-первых, на разных нитях ДНК корректирующая активность полимеразы проявляется в разной степени. Частота ошибок в отстающей нити всегда в 10–20 раз выше, чем в ведушей. Например, в клетке человека за раунд репликации образуется 2х106 фрагментов Оказаки. В начале синтеза каждого из них ДНК-полимераза α (ошибочность которой 10-4) присоединяет 30–40 dNМР к РНК-праймеру. В процессе объединения фрагментов Оказаки большая часть этих dNМР выщепляется. Если предположить, что в каждом фрагменте Оказаки остается хотя бы один dNМР, присоединенный с помощью ДНК-полимеразы α, то, учитывая, что лишь 3 % ДНК млекопитающих транскрибируется, в транскрибируемой ДНК за раунд репликации образуется примерно 60 ошибок, подлежащих коррекции. Это является логическим объяснением того, что у эукариот ошибочность отстающей нити на порядок превышает таковую величину для лидирующей нити, где ДНК-полимераза α участвует только в инициации синтеза на ориджине репликации; один раз на весь репликон.
Во-вторых, PolIII способна корректировать преимущественно трансверсии из-за того, что пара пурин-пурин и пиримидин-пиримидин легче распознаются корректирующей активностью ДНК-полимераз, чем некомплементарные пары пурин-пиримидин. В то же время транзиции и сдвиги рамки считывания преимущественно исправляются уже после завершения репликации системой репарации неспаренных оснований (MMR, missmatch repair).
Вследствие этого транзиции происходят чаще, чем трансверcии, хотя теоретически должно быть наоборот – ведь каждый пурин может быть заменен на один пурин или на три пиримидина, а каждый пиримидин – на один пиримидин или два пурина.
Что же играет главную роль в распознавании корректирующей активностью ДНК-полимеразы неправильно подставленного нуклеотида? Каким образом отделить в эксперименте фактор энергетический (необходимость образования водородных связей между двумя спаривающимися нуклеотидами) и фактор геометрический (необходимость правильной стереометрической формы образовавшейся пары)? Это в 1997 году удалось сделать Кулу с соавторами. Они использовали в качестве аналога тимина неполярный дифтортолуол (F) и соответствующий ему dFTP, который в полимеразной реакции подобен dTTP, но только стерически, так как совершенно не способен образовывать водородные связи. Удивительно, но частота ошибочного включения дифтортолуола напротив аденина оказалась на три порядка выше, чем частота такого же неправильного (вместо тимина) включения цитозина. То есть ДНК-полимераза предпочитает встраивать неспособный к образованию водородных связей, но более близкий к тимину стерически, фтортолуол, а не цитозин, способный к образованию водородных связей, но не столь идентичный тимину стерически. Таким образом, хотя это и выглядит почти фантастически, ДНК-полимеразы способны включать в синтезируемую нить любую органическую молекулу (представленную, естественно, в форме дезокситрифосфата), лишь бы она соответствовала структурным требованиям активного центра самого фермента и В-формы ДНК.
Корректирующая 3'-5'-экзонуклеазная активность ДНК-полимеразы сама по себе является достаточно сложным и энергоемким процессом. При расчистке участка ДНК с неправильно спаренным основанием поисходит следующая цепь событий. Связывание dNTP с комплексом «ДНК-полимераза-матрица-З'-конец синтезируемой нити» протекает, как минимум, через два конформационных изменения ДНК-полимеразы. При попадании неправильного dNTP в реакцию оба эти конформационные изменения замедляются, что способствует перемещению неправильного конца в активный центр 3'-5'-экзонуклеазы (субъединицы ε) для расчистки участка ДНК вокруг неспаренного основания и его последующего ресинтеза. Так как биохимические реакции обладают некоторой инерционностью, в ходе расчистки удаляются не только неправильные, но и расположенные по соседству правильные нуклеотиды. Таким образом корректирующая активность ДНК-полимеразы не может превышать оптимальный предел, ведь в противном случае «сверхкорректная» полимеризация потребовала бы огромных затрат энергии, одновременно приводя к резкому снижению скорости синтеза ДНК. Этот предел и ограничивает повышение точности репликации примерной величиной 102.
Здесь нужно остановиться еще на двух моментах. Во-первых, на разных нитях ДНК корректирующая активность полимеразы проявляется в разной степени. Частота ошибок в отстающей нити всегда в 10–20 раз выше, чем в ведушей. Например, в клетке человека за раунд репликации образуется 2х106 фрагментов Оказаки. В начале синтеза каждого из них ДНК-полимераза α (ошибочность которой 10-4) присоединяет 30–40 dNМР к РНК-праймеру. В процессе объединения фрагментов Оказаки большая часть этих dNМР выщепляется. Если предположить, что в каждом фрагменте Оказаки остается хотя бы один dNМР, присоединенный с помощью ДНК-полимеразы α, то, учитывая, что лишь 3 % ДНК млекопитающих транскрибируется, в транскрибируемой ДНК за раунд репликации образуется примерно 60 ошибок, подлежащих коррекции. Это является логическим объяснением того, что у эукариот ошибочность отстающей нити на порядок превышает таковую величину для лидирующей нити, где ДНК-полимераза α участвует только в инициации синтеза на ориджине репликации; один раз на весь репликон.
Во-вторых, PolIII способна корректировать преимущественно трансверсии из-за того, что пара пурин-пурин и пиримидин-пиримидин легче распознаются корректирующей активностью ДНК-полимераз, чем некомплементарные пары пурин-пиримидин. В то же время транзиции и сдвиги рамки считывания преимущественно исправляются уже после завершения репликации системой репарации неспаренных оснований (MMR, missmatch repair).
Вследствие этого транзиции происходят чаще, чем трансверcии, хотя теоретически должно быть наоборот – ведь каждый пурин может быть заменен на один пурин или на три пиримидина, а каждый пиримидин – на один пиримидин или два пурина.
Что же играет главную роль в распознавании корректирующей активностью ДНК-полимеразы неправильно подставленного нуклеотида? Каким образом отделить в эксперименте фактор энергетический (необходимость образования водородных связей между двумя спаривающимися нуклеотидами) и фактор геометрический (необходимость правильной стереометрической формы образовавшейся пары)? Это в 1997 году удалось сделать Кулу с соавторами. Они использовали в качестве аналога тимина неполярный дифтортолуол (F) и соответствующий ему dFTP, который в полимеразной реакции подобен dTTP, но только стерически, так как совершенно не способен образовывать водородные связи. Удивительно, но частота ошибочного включения дифтортолуола напротив аденина оказалась на три порядка выше, чем частота такого же неправильного (вместо тимина) включения цитозина. То есть ДНК-полимераза предпочитает встраивать неспособный к образованию водородных связей, но более близкий к тимину стерически, фтортолуол, а не цитозин, способный к образованию водородных связей, но не столь идентичный тимину стерически. Таким образом, хотя это и выглядит почти фантастически, ДНК-полимеразы способны включать в синтезируемую нить любую органическую молекулу (представленную, естественно, в форме дезокситрифосфата), лишь бы она соответствовала структурным требованиям активного центра самого фермента и В-формы ДНК.
1.2.2. Участие корректирующих автономных экзонуклеаз в репликации и репарации ДНК
Корректирующая экзонуклеазная активность не обязательно является частью процессивной ДНК-полимеразы. Достаточно часто в клетке для коррекции новосинтезированной ДНК привлекаются многочисленные автономные экзонуклеазы. Эти экзонуклеазы способны отщеплять неправильный нуклеотид, образуя (или не образуя) комплекс с ДНК-полимеразами.
