Страница:
Сложные вещества образованы атомами разных элементов. Делятся по составу и химическим свойствам:
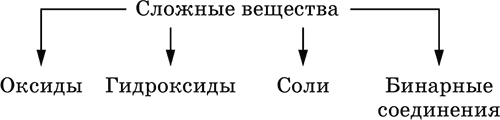
Оксиды – соединения элементов с кислородом, степень окисления кислорода в оксидах всегда равна (-II). Делятся по составу и химическим свойствам:
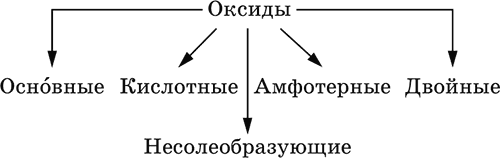
Элементы He, Ne и Ar соединений с кислородом не образуют. Соединения элементов с кислородом в других степенях окисления – это не оксиды, а бинарные соединения, например O+IIF2-I и H2+IO2-I. Не относятся к оксидам и смешанные бинарные соединения, например S+IVCl2-IO-II.
Оснóвные оксиды – продукты полной дегидратации (реальной или условной) основных гидроксидов, сохраняют химические свойства последних.
Из типичных металлов только Li, Mg, Ca и Sr образуют оксиды Li2O, MgO, СаО и SrO при сжигании на воздухе; оксиды Na2O, К2O, Rb2O, Cs2O и ВаО получают другими способами.
Оксиды CuO, Ag2O и NiO также относят к основным.
Кислотные оксиды – продукты полной дегидратации (реальной или условной) кислотных гидроксидов, сохраняют химические свойства последних.
Из типичных неметаллов только S, Se, Р, As, С и Si образуют оксиды SO2, SeO2, Р2O5, As2O3, СO2 и SiO2 при сжигании на воздухе; оксиды Cl2O, Cl2O7, I2O5, SO3, SeO3, N2O3, N2O5 и As2O5 получают другими способами.
Исключение: у оксидов NO2 и ClO2 нет соответствующих кислотных гидроксидов, но их считают кислотными, так как NO2 и ClO2 реагируют со щелочами, образуя соли двух кислот, а ClO2 и с водой, образуя две кислоты:
а) 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
б) 2ClO2 + Н2O (хол.) = НClO2 + НClO3
2ClO2 + 2NaOH (хол.) = NaClO2 + NaClO3 + H2O
Оксиды CrO3 и Mn2O7 (хром и марганец в высшей степени окисления) также являются кислотными.
Амфотерные оксиды – продукты полной дегидратации (реальной или условной) амфотерных гидроксидов, сохраняют химические свойства амфотерных гидроксидов.
Типичные амфигены (кроме Ga) при сжигании на воздухе образуют оксиды BeO, Cr2O3, ZnO, Al2O3, GeO2, SnO2 и РЬО; амфотерные оксиды Ga2O3, SnO и РЬO2 получают другими способами.
Двойные оксиды образованы либо атомами одного амфотерного элемента в разных степенях окисления, либо атомами двух разных (металлических, амфотерных) элементов, что и определяет их химические свойства. Примеры:
(FeIIFe2III)O4, (Рb2IIPbIV)O4, (MgAl2)O4, (CaTi)O3.
Оксид железа образуется при сгорании железа на воздухе, оксид свинца – при слабом нагревании свинца в кислороде; оксиды двух разных металлов получают другими способами.
Несолеобразующие оксиды – оксиды неметаллов, не имеющие кислотных гидроксидов и не вступающие в реакции солеобразования (отличие от основных, кислотных и амфотерных оксидов), например: СО, NO, N2O, SiO, S2O.
Гидроксиды – соединения элементов (кроме фтора и кислорода) с гидроксогруппами О-IIН, могут содержать также кислород O-II. В гидроксидах степень окисления элемента всегда положительная (от +I до +VIII). Число гидроксогрупп от 1 до 6. Делятся по химическим свойствам:
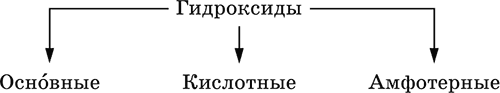
Оснóвные гидроксиды (основания) образованы элементами с металлическими свойствами.
Получаются по реакциям соответствующих основных оксидов с водой:
М2O + Н2O = 2МОН (М = Li, Na, К, Rb, Cs)
МО + Н2O = М(ОН)2 (М = Са, Sr, Ва)
Исключение: гидроксиды Mg(OH)2, Cu(OH)2 и Ni(OH)2 получают другими способами.
При нагревании реальная дегидратация (потеря воды) протекает для следующих гидроксидов:
2LiOH = Li2O + Н2O
М(ОН)2 = МО + Н2O (М = Mg, Са, Sr, Ва, Cu, Ni)
Основные гидроксиды замещают свои гидроксогруппы на кислотные остатки с образованием солей, металлические элементы сохраняют свою степень окисления в катионах солей.
Хорошо растворимые в воде основные гидроксиды (NaOH, КОН, Са(ОН)2, Ва(ОН)2 и др.) называют щелочами, так как именно с их помощью в растворе создается щелочная среда.
Кислотные гидроксиды (кислоты) образованы элементами с неметаллическими свойствами. Примеры:
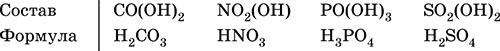
При диссоциации в разбавленном водном растворе образуются катионы Н+ (точнее, Н3O+) и следующие анионы, или кислотные остатки:
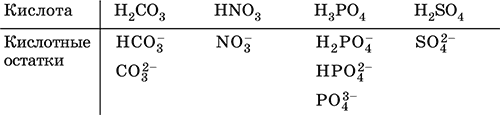
Кислоты можно получить по реакциям соответствующих кислотных оксидов с водой (ниже приведены реально протекающие реакции):
Cl2O + H2O = 2HClO
Е2O3 + Н2O = 2НЕO2 (Е = N, As)
As2O3 + 3H2O = 2H3AsO3
EO2 + H2O = H2EO3 (Е = С, Se)
E2O5 + H2O = 2HEO3 (Е = N, Р, I)
E2O5 + 3H2O = 2H3EO4 (E = P, As)
EO3 + H2O = H2EO4 (E = S, Se, Cr)
E2O7 + H2O = 2HEO4 (E = Cl, Mn)
Исключение: оксиду SO2 в качестве кислотного гидроксида соответствует полигидрат SO2 nН2O («сернистая кислота H2SO3» не существует, но кислотные остатки HSO3- и SO32- присутствуют в солях).
При нагревании некоторых кислот протекает реальная дегидратация и образуются соответствующие кислотные оксиды:
2HAsO2 = As2O3 + H2O
H2EO3 = EO2 + H2O (E = C, Si, Ge, Se)
2HIO3 = I2O5 + H2O
2H3AsO4 = As2O5 + H2O
H2SeO4 = SeO3 + H2O
При замене (реальной и формальной) водорода кислот на металлы и амфигены образуются соли, кислотные остатки сохраняют в солях свой состав и заряд. Кислоты H2SO4 и Н3РO4 в разбавленном водном растворе реагируют с металлами и амфигенами, стоящими в ряду напряжений левее водорода, при этом образуются соответствующие соли и выделяется водород (кислота HNO3 в такие реакции не вступает; ниже типичные металлы, кроме Mg, не указаны, так как они реагируют в подобных условиях с водой):
М + H2SO4(pasб.) = MSO4 + Н2↑ (М = Be, Mg, Cr, Mn, Zn, Fe, Ni)
2M + 3H2SO4(paзб.) = M2(SO4)3 + 3H2↑ (M = Al, Ga)
3M + 2Н3РO4(разб.) = M3(PO4)2↓ + 3H2↑ (M = Mg, Fe, Zn)
В отличие от бескислородных кислот кислотные гидроксиды называют кислородсодержащими кислотами или оксокислотами.
Амфотерные гидроксиды образованы элементами с амфотерными свойствами. Типичные амфотерные гидроксиды:
Be(OH)2 Sn(OH)2 Al(OH)3 AlO(OH)
Zn(OH)2 Pb(OH)2 Cr(OH)3 CrO(OH)
He образуются из амфотерных оксидов и воды, но подвергаются реальной дегидратации и образуют амфотерные оксиды:
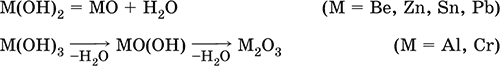
Исключение: для железа(III) известен только метагидроксид FeO(OH), «гидроксид железа(III) Fe(OH)3» не существует (не получен).
Амфотерные гидроксиды проявляют свойства основных и кислотных гидроксидов; образуют два вида солей, в которых амфотерный элемент входит в состав либо катионов солей, либо их анионов.
Для элементов, имеющих несколько степеней окисления, действует правило: чем выше степень окисления, тем более выражены кислотные свойства гидроксидов (и/или соответствующих оксидов).

Соли – соединения, состоящие из катионов основных или амфотерных (в роли основных) гидроксидов и анионов (остатков) кислотных или амфотерных (в роли кислотных) гидроксидов. В отличие от бескислородных солей, соли, рассматриваемые здесь, называются кислородсодержащими солями или оксосолями. Делятся по составу катионов и анионов:
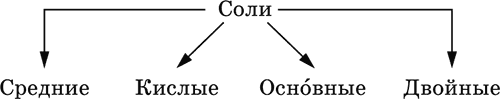
Средние соли содержат средние кислотные остатки СО32-, NO3-, РО43-, SO42- и др.; например: К2СO3, Mg(NO3)2, Cr2(SO4)3, Zn3(PO4)2.
Если средние соли получают по реакциям с участием гидроксидов, то реагенты берут в эквивалентных количествах. Например, соль К2СO3 можно получить, если взять реагенты в соотношениях:
2КОН и 1Н2СO3, 1К2O и 1Н2СO3, 2КОН и 1СO2.
Реакции образования средних солей:
1)
2NaOH + H2SO4 = Na2SO4 + 2Н2O
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
1б) амфотерный гидроксид + кислотный гидроксид →…
2Al(ОН)3 + 3H2SO4 = Al2(SO4)3 + 6Н2O
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2Н2O
1в) основный гидроксид + амфотерный гидроксид →…
NaOH + Al(ОН)3 = NaAlO2 + 2Н2O (в расплаве)
2NaOH + Zn(OH)2 = Na2ZnO2 + 2Н2O (в расплаве)
2)
Na2O + H2SO4 = Na2SO4 + Н2O
CuO + 2HNO3 = Cu(NO3)2 + H2O
2б) амфотерный оксид + кислотный гидроксид →…
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
ZnO + 2HNO3 = Zn(NO3)2 + H2O
2в) основный оксид + амфотерный гидроксид →…
Na2O + 2Al(ОН)3 = 2NaAlO2 + ЗН2O (в расплаве)
Na2O + Zn(OH)2 = Na2ZnO2 + Н2O (в расплаве)
3)
2NaOH + SO3 = Na2SO4 + Н2O
Ва(ОН)2 + СO2 = ВаСO3 + Н2O
3б) амфотерный гидроксид + кислотный оксид →…
2Al(ОН)3 + 3SO3 = Al2(SO4)3 + 3H2O
Zn(OH)2 + N2O5 = Zn(NO3)2 + H2O
Зв) основный гидроксид + амфотерный оксид →…
2NaOH + Al2O3 = 2NaAlO2 + Н2O (в расплаве)
2NaOH + ZnO = Na2ZnO2 + Н2O (в расплаве)
4)
Na2O + SO3 = Na2SO4, BaO + СO2 = ВаСO3
4б) амфотерный оксид + кислотный оксид →…
Al2O3 + 3SO3 = Al2(SO4)3, ZnO + N2O5 = Zn(NO3)2
4в) основный оксид + амфотерный оксид →…
Na2O + Al2O3 = 2NaAlO2, Na2O + ZnO = Na2ZnO2
Реакции 1в, если они протекают в растворе, сопровождаются образованием других продуктов — комплексных солей:
NaOH (конц.) + Al(OН)3 = Na[Al(OH)4]
КОН (конц.) + Cr(OH)3 = К3[Cr(ОН)6]
2NaOH (конц.) + M(OH)2 = Na2[M(OH)4] (М = Be, Zn)
КОН (конц.) + M(OH)2 = K[M(OH)3] (М = Sn, Pb)
Все средние соли в растворе – сильные электролиты (диссоциируют нацело).
Кислые соли содержат кислые кислотные остатки (с водородом) HCO3-, Н2РO42-, HPO42- и др., образуются при действии на основные и амфотерные гидроксиды или средние соли избытка кислотных гидроксидов, содержащих не менее двух атомов водорода в молекуле; аналогично действуют соответствующие кислотные оксиды:
NaOH + H2SO4 (конц.) = NaHSO4 + H2O
Ва(ОН)2 + 2Н3РO4 (конц.) = Ва(Н2РO4)2 + 2Н2O
Zn(OH)2 + Н3РO4 (конц.) = ZnHPO4↓ + 2Н2O
PbSO4 + H2SO4 (конц.) = Pb(HSO4)2
K2HPO4 + Н3РO4 (конц.) = 2КН2РO4
Са(ОН)2 + 2ЕO2 = Са(НЕO3)2 (Е = С, S)
Na2EO3 + ЕO2 + H2O = 2NaHEO3 (Е = С, S)
При добавлении гидроксида соответствующего металла или амфигена кислые соли переводятся в средние:
NaHSO4 + NaOH = Na2SO4 + Н2O
Pb(HSO4)2 + Pb(OH)2 = 2PbSO4↓ + 2H2O
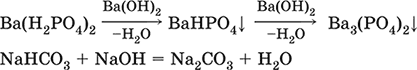
Почти все кислые соли хорошо растворимы в воде, диссоциируют нацело (КНСO3 = К+ + HCO3-).
Оснóвные соли содержат гидроксогруппы ОН, рассматриваемые как отдельные анионы, например FeNO3(OH), Ca2SO4(OH)2, Cu2CO3(OH)2, образуются при действии на кислотные гидроксиды избытка основного гидроксида, содержащего не менее двух гидроксогрупп в формульной единице:
Со(ОН)2 + HNO3 = CoNO3(OH)↓ + Н2O
2Ni(OH)2 + H2SO4 = Ni2SO4(OH)2↓ + 2H2O
2Cu(OH)2 + H2CO3 = Cu2CO3(OH)2↓ + 2H2O
Основные соли, образованные сильными кислотами, при добавлении соответствующего кислотного гидроксида переходят в средние:
CoNO3(OH) + HNO3 = Co(NO3)2 + Н2O
Ni2SO4(OH)2 + H2SO4 = 2NiSO4 + 2H2O
Большинство основных солей малорастворимы в воде; они осаждаются при совместном гидролизе, если образованы слабыми кислотами:
2MgCl2 + Н2O + 2Na2CO3 = Mg2CO3(OH)2↓ + СO2↑ + 4NaCl
Двойные соли содержат два химически разных катиона; например: CaMg(CO3)2, KAl(SO4)2, Fe(NH4)2(SO4)2, LiAl(SiO3)2. Многие двойные соли образуются (в виде кристаллогидратов) при совместной кристаллизации соответствующих средних солей из насыщенного раствора:
K2SO4 + MgSO4 + 6Н2O = K2Mg(SO4)2 6Н2O↓
Часто двойные соли менее растворимы в воде по сравнению с отдельными средними солями.
Бинарные соединения – это сложные вещества, не относящиеся к классам оксидов, гидроксидов и солей и состоящие из катионов и бескислородных анионов (реальных или условных).
Их химические свойства разнообразны и рассматриваются в неорганической химии отдельно для неметаллов разных групп Периодической системы; в этом случае классификация проводится по виду аниона.
Примеры:
а) галогениды: OF2, HF, KBr, PbI2, NH4Cl, BrF3, IF7
б) хальгогениды: H2S, Na2S, ZnS, As2S3, NH4HS, K2Se, NiSe
в) нитриды: NH3, NH3 H2O, Li3N, Mg3N2, AlN, Si3N4
г) карбиды: CH4, Be2C, Al4C3, Na2C2, CaC2, Fe3C, SiC
д) силициды: Li4Si, Mg2Si, ThSi2
е) гидриды: LiH, CaH2, AlH3, SiH4
ж) пероксидьг. H2O2, Na2O2, СаO2
з) надпероксиды: HO2, КO2, Ва(O2)2
По типу химической связи среди этих бинарных соединений различают:
ковалентные: OF2, IF7, H2S, P2S5, NH3, H2O2
ионные: Nal, K2Se, Mg3N2, CaC2, Na2O2, KO2
Встречаются двойные (с двумя разными катионами) и смешанные (с двумя разными анионами) бинарные соединения, например: KMgCl3, (FeCu)S2 и Pb(Cl)F, Bi(Cl)O, SCl2O2, As(O)F3.
Все ионные комплексные соли (кроме гидроксокомплексных) также относятся к этому классу сложных веществ (хотя обычно рассматриваются отдельно), например:
[Cu(NH3)4]SO4 K4[Fe(CN)6] Na3[AlF6]
[Ag(NH3)2]Cl K3[Fe(NCS)6] K2[SiF6]
К бинарным соединениям относятся ковалентные комплексные соединения без внешней сферы, например [Fe(CO)5] и [№(СО)4].
По аналогии со взаимосвязью гидроксидов и солей из всех бинарных соединений выделяют бескислородные кислоты и соли (остальные соединения классифицируют как прочие).
Бескислородные кислоты содержат (как и оксокислоты) подвижный водород Н+ и поэтому проявляют некоторые химические свойства кислотных гидроксидов (диссоциация в воде, участие в реакциях солеобразования в роли кислоты). Распространенные бескислородные кислоты – это HF, НCl, HBr, HI, HCN и H2S, из них HF, HCN и H2S – слабые кислоты, а остальные – сильные.
Примеры реакций солеобразования:
2HBr + ZnO = ZnBr2 + Н2O
2H2S + Ва(ОН)2 = Ba(HS)2 + 2Н2O
2HI + Pb(OH)2 = Pbl2↓ + 2Н2O
Металлы и амфигены, стоящие в ряду напряжений левее водорода и не реагирующие с водой, вступают во взаимодействие с сильными кислотами НCl, НВr и HI (в общем виде НГ) в разбавленном растворе и вытесняют из них водород (приведены реально протекающие реакции):
М + 2НГ = МГ2 + Н2↑ (М = Be, Mg, Zn, Cr, Mn, Fe, Co, Ni)
2M + 6НГ = 2МГ3 + H2↑ (M = Al, Ga)
Бескислородные соли образованы катионами металлов и амфигенов (а также катионом аммония NH4+) и анионами (остатками) бескислородных кислот; примеры: AgF, NaCl, KBr, PbI2, Na2S, Ba(HS)2, NaCN, NH4Cl. Проявляют некоторые химические свойства оксосолей.
Общий способ получения бескислородных солей с одноэлементными анионами – взаимодействие металлов и амфигенов с неметаллами F2, Cl2, Br2 и I2 (в общем виде Г2) и серой S (приведены реально протекающие реакции):
2М + Г2 = 2МГ (М = Li, Na, К, Rb, Cs, Ag)
M + Г2 = МГ2 (М = Be, Mg, Са, Sr, Ва, Zn, Mn, Со)
2М + ЗГ2 = 2МГ3 (М = Al, Ga, Cr)
2М + S = M2S (М = Li, Na, К, Rb, Cs, Ag)
M + S = MS (M = Be, Mg, Ca, Sr, Ba, Zn, Mn, Fe, Co, Ni)
2M + 3S = M2S3 (M = Al, Ga, Cr)
Исключения:
а) Cu и Ni реагируют только с галогенами Cl2 и Br2 (продукты МCl2, МBr2)
б) Cr и Mn реагируют с Cl2, Br2 и I2 (продукты CrCl3, CrBr3, CrI3 и MnCl2, MnBr2, MnI2)
в) Fe реагирует с F2 и Cl2 (продукты FeF3, FeCl3), с Br2 (смесь FeBr3 и FeBr2), с I2 (продукт FeI2)
г) Cu при реакции с S образует смесь продуктов Cu2S и CuS
Прочие бинарные соединения – все вещества этого класса, кроме выделенных в отдельные подклассы бескислородных кислот и солей.
Способы получения бинарных соединений этого подкласса разнообразны, самый простой – взаимодействие простых веществ (приведены реально протекающие реакции):
а) галогениды:
S + 3F2 = SF6, N2 + 3F2 = 2NF3
2P + 5Г2 = 2РГ5 (Г = F, CI, Br)
С + 2F2 = CF4
Si + 2Г2 = Sir4 (Г = F, CI, Br, I)
б) халькогениды:
2As + 3S = As2S3
2E + 5S = E2S5 (E = P, As)
E + 2S = ES2 (E = C, Si)
в) нитриды:
3H2 + N2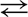 2NH3
2NH3
6M + N2 = 2M3N (M = Li, Na, K)
3M + N2 = M3N2 (M = Be, Mg, Ca)
2Al + N2 = 2AlN
3Si + 2N2 = Si3N4
г) карбиды:
2M + 2C = M2C2 (M = Li, Na)
2Be + С = Be2C
M + 2C = MC2 (M = Ca, Sr, Ba)
4Al + 3C = Al4C3
Si + С = SiC
д) силициды:
4Li + Si = Li4Si
2M + Si = M2Si (M = Mg, Ca)
е) гидриды:
2M + H2 = 2MH (M = Li, Na, K)
M + H2 = MH2 (M = Mg, Ca)
ж) пероксиды, надпероксиды:
2Na + O2 = Na2O2 (сгорание на воздухе)
M + O2 = МО2 (М = К, Rb, Cs; сгорание на воздухе)
Многие из этих веществ полностью реагируют с водой (чаще гидролизуются без изменения степеней окисления элементов, но гидриды выступают как восстановители, а надпероксиды вступают в реакции дисмутации):
РCl5 + 4Н2O = Н3РO4 + 5НCl
SiBr4 + 2Н2O = SiO2↓ + 4НBr
P2S5 + 8Н2O = 2Н3РO4 + 5H2S↑
SiS2 + 2Н2O = SiO2↓ + 2H2S
Mg3N2 + 8H2O = 3Mg(OH)2↓ + 2(NH3 H2O)
Na3N + 4H2O = 3NaOH + NH3 H2O
Be2C + 4H2O = 2Be(OH)2↓ + CH4↑
MC2 + 2H2O = M(OH)2 + C2H2↑ (M = Ca, Sr, Ba)
Al4C3 + 12H2O = 4Al(OH)3↓ + 3CH4↑
MH + H2O = MOH + H2↑ (M = Li, Na, K)
MgH2 + 2H2O = Mg(OH)2↓ + H2↑
CaH2 + 2H2O = Ca(OH)2 + H2↑
Na2O2 + 2H2O = 2NaOH + H2O2
2MO2 + 2H2O = 2MOH + H2O2 + O2↑ (M = K, Rb, Cs)
Другие вещества, наоборот, устойчивы по отношению к воде, среди них SF6, NF3, CF4, CS2, AlN, Si3N4, SiC, Li4Si, Mg2Si и Ca2Si.
1) фуллерен
2) этилен
3) ацетон
4) озон
2. В формульных единицах продуктов реакций
Si + CF12 →…, Si + O2 →…, Si + Mg →…
общая сумма числа атомов всех элементов равна
1) 8
2) 9
3) 10
4) 11
3. В металлсодержащих продуктах реакций
Na + Н2O →…, Са + Н2O →…, Al + НCl (р-р) →…
общая сумма числа атомов всех элементов равна
1) 6
2) 8
3) 10
4) 12
4. Оксид кальция может реагировать (по отдельности) со всеми веществами набора
1) СO2, NaOH, NO
2) HBr, SO3, NH4Cl
3) BaO, SO3, KMgCl3
4) O2, Al2O3, NH3
5. Будет протекать реакция между оксидом серы (IV) и
1) SiO2
2) КCl
3) LiOH
4) NaNO3
6. Соль МAlO2 образуется при сплавлении
1) Al и ZnO
2) Al2O3 и КОН
3) Al и Са(ОН)2
4) Al2O3 и Fe2O3
7. В молекулярном уравнении реакции
ZnO + HNO3 → Zn(NO3)2 +…
сумма коэффициентов равна
1) 4
2) 5
3) 6
4) 7
8. Продукты реакции N2O5 + NaOH →… – это
1) Na2O, HNO3
2) NaOH, NH3
3) NaNO3, H2O
4) NaNO2, N2, H2O
9. Набор оснований – это
1) NaOH, LiOH, ClOH
2) NaOH, Ba(OH)2, Cu(OH)2
3) Ca(OH)2, KOH, BrOH
4) Mg(OH)2, Be(OH)2, NO(OH)
10. Гидроксид калия реагирует в растворе (по отдельности) с веществами набора
1) СО, CuSO4
2) SO2, Ag
3) Al, Ba(OH)2
4) SO3, FeCl3
11–12. Остаток, отвечающий кислоте с названием
11. Серная
12. Азотная
имеет формулу
1) NO2-
2) SO42-
3) NO3-
4) SO32-
13. Из соляной и разбавленной серной кислот не выделяет газ только металл
1) ртуть
2) цинк
3) магний
4) хром
14. Амфотерный гидроксид – это
1) Ва(ОН)2
2) CsOH
3) Ni(OH)2
4) Cr(OH)3
15-16. По заданным формулам гидроксидов
15. H3PO4, РЬ(ОН)2
16. Cr(OH)3, HNO3
выводится формула средней соли
1) РЬ3(РO4)2
2) РЬ3РO4
3) Cr2NO3
4) Cr(NO3)3
17. После пропускания избытка H2S через раствор гидроксида бария в конечном растворе будет содержаться соль
1) Ba(HS)2
2) (BaOH)2S
3) BaS
4) BaSO3
18. Возможно протекание реакций:
1) CaSO3 + H2SO4 →…
2) Ca(NO3)2 + HNO3 →…
3) NaHCOg + K2SO4 →…
4) Al(HSO4)3 + NaOH →…
19. В уравнении реакции (СаOН)2СO3(т) + Н3РO4 → СаНРO4↓ +…
сумма коэффициентов равна
1) 6
2) 5
3) 9
4) 8
20. Установите соответствие между формулой вещества и группой, к которой оно относится.

21. Установите соответствие между исходными веществами и продуктами реакций.

22. В схеме превращений
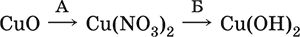
вещества А и Б указаны в наборе
1) NaNO3, Н2O
2) HNO3, КОН
3) N2O, NaOH
4) HNO3, Н2O
23. Составьте уравнения возможных реакций по схеме
FeS → H2S + PbS → PbSO4 → Pb(HSO4)2
24. Составьте уравнения четырех возможных реакций между веществами:
1) азотная кислота (конц.)
2) углерод (графит или кокс)
3) оксид кальция
4) оксид железа(II)
5. Металлы главных подгрупп I–III групп
5.1. Натрий

Оксиды – соединения элементов с кислородом, степень окисления кислорода в оксидах всегда равна (-II). Делятся по составу и химическим свойствам:

Элементы He, Ne и Ar соединений с кислородом не образуют. Соединения элементов с кислородом в других степенях окисления – это не оксиды, а бинарные соединения, например O+IIF2-I и H2+IO2-I. Не относятся к оксидам и смешанные бинарные соединения, например S+IVCl2-IO-II.
Оснóвные оксиды – продукты полной дегидратации (реальной или условной) основных гидроксидов, сохраняют химические свойства последних.
Из типичных металлов только Li, Mg, Ca и Sr образуют оксиды Li2O, MgO, СаО и SrO при сжигании на воздухе; оксиды Na2O, К2O, Rb2O, Cs2O и ВаО получают другими способами.
Оксиды CuO, Ag2O и NiO также относят к основным.
Кислотные оксиды – продукты полной дегидратации (реальной или условной) кислотных гидроксидов, сохраняют химические свойства последних.
Из типичных неметаллов только S, Se, Р, As, С и Si образуют оксиды SO2, SeO2, Р2O5, As2O3, СO2 и SiO2 при сжигании на воздухе; оксиды Cl2O, Cl2O7, I2O5, SO3, SeO3, N2O3, N2O5 и As2O5 получают другими способами.
Исключение: у оксидов NO2 и ClO2 нет соответствующих кислотных гидроксидов, но их считают кислотными, так как NO2 и ClO2 реагируют со щелочами, образуя соли двух кислот, а ClO2 и с водой, образуя две кислоты:
а) 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
б) 2ClO2 + Н2O (хол.) = НClO2 + НClO3
2ClO2 + 2NaOH (хол.) = NaClO2 + NaClO3 + H2O
Оксиды CrO3 и Mn2O7 (хром и марганец в высшей степени окисления) также являются кислотными.
Амфотерные оксиды – продукты полной дегидратации (реальной или условной) амфотерных гидроксидов, сохраняют химические свойства амфотерных гидроксидов.
Типичные амфигены (кроме Ga) при сжигании на воздухе образуют оксиды BeO, Cr2O3, ZnO, Al2O3, GeO2, SnO2 и РЬО; амфотерные оксиды Ga2O3, SnO и РЬO2 получают другими способами.
Двойные оксиды образованы либо атомами одного амфотерного элемента в разных степенях окисления, либо атомами двух разных (металлических, амфотерных) элементов, что и определяет их химические свойства. Примеры:
(FeIIFe2III)O4, (Рb2IIPbIV)O4, (MgAl2)O4, (CaTi)O3.
Оксид железа образуется при сгорании железа на воздухе, оксид свинца – при слабом нагревании свинца в кислороде; оксиды двух разных металлов получают другими способами.
Несолеобразующие оксиды – оксиды неметаллов, не имеющие кислотных гидроксидов и не вступающие в реакции солеобразования (отличие от основных, кислотных и амфотерных оксидов), например: СО, NO, N2O, SiO, S2O.
Гидроксиды – соединения элементов (кроме фтора и кислорода) с гидроксогруппами О-IIН, могут содержать также кислород O-II. В гидроксидах степень окисления элемента всегда положительная (от +I до +VIII). Число гидроксогрупп от 1 до 6. Делятся по химическим свойствам:

Оснóвные гидроксиды (основания) образованы элементами с металлическими свойствами.
Получаются по реакциям соответствующих основных оксидов с водой:
М2O + Н2O = 2МОН (М = Li, Na, К, Rb, Cs)
МО + Н2O = М(ОН)2 (М = Са, Sr, Ва)
Исключение: гидроксиды Mg(OH)2, Cu(OH)2 и Ni(OH)2 получают другими способами.
При нагревании реальная дегидратация (потеря воды) протекает для следующих гидроксидов:
2LiOH = Li2O + Н2O
М(ОН)2 = МО + Н2O (М = Mg, Са, Sr, Ва, Cu, Ni)
Основные гидроксиды замещают свои гидроксогруппы на кислотные остатки с образованием солей, металлические элементы сохраняют свою степень окисления в катионах солей.
Хорошо растворимые в воде основные гидроксиды (NaOH, КОН, Са(ОН)2, Ва(ОН)2 и др.) называют щелочами, так как именно с их помощью в растворе создается щелочная среда.
Кислотные гидроксиды (кислоты) образованы элементами с неметаллическими свойствами. Примеры:
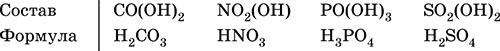
При диссоциации в разбавленном водном растворе образуются катионы Н+ (точнее, Н3O+) и следующие анионы, или кислотные остатки:

Кислоты можно получить по реакциям соответствующих кислотных оксидов с водой (ниже приведены реально протекающие реакции):
Cl2O + H2O = 2HClO
Е2O3 + Н2O = 2НЕO2 (Е = N, As)
As2O3 + 3H2O = 2H3AsO3
EO2 + H2O = H2EO3 (Е = С, Se)
E2O5 + H2O = 2HEO3 (Е = N, Р, I)
E2O5 + 3H2O = 2H3EO4 (E = P, As)
EO3 + H2O = H2EO4 (E = S, Se, Cr)
E2O7 + H2O = 2HEO4 (E = Cl, Mn)
Исключение: оксиду SO2 в качестве кислотного гидроксида соответствует полигидрат SO2 nН2O («сернистая кислота H2SO3» не существует, но кислотные остатки HSO3- и SO32- присутствуют в солях).
При нагревании некоторых кислот протекает реальная дегидратация и образуются соответствующие кислотные оксиды:
2HAsO2 = As2O3 + H2O
H2EO3 = EO2 + H2O (E = C, Si, Ge, Se)
2HIO3 = I2O5 + H2O
2H3AsO4 = As2O5 + H2O
H2SeO4 = SeO3 + H2O
При замене (реальной и формальной) водорода кислот на металлы и амфигены образуются соли, кислотные остатки сохраняют в солях свой состав и заряд. Кислоты H2SO4 и Н3РO4 в разбавленном водном растворе реагируют с металлами и амфигенами, стоящими в ряду напряжений левее водорода, при этом образуются соответствующие соли и выделяется водород (кислота HNO3 в такие реакции не вступает; ниже типичные металлы, кроме Mg, не указаны, так как они реагируют в подобных условиях с водой):
М + H2SO4(pasб.) = MSO4 + Н2↑ (М = Be, Mg, Cr, Mn, Zn, Fe, Ni)
2M + 3H2SO4(paзб.) = M2(SO4)3 + 3H2↑ (M = Al, Ga)
3M + 2Н3РO4(разб.) = M3(PO4)2↓ + 3H2↑ (M = Mg, Fe, Zn)
В отличие от бескислородных кислот кислотные гидроксиды называют кислородсодержащими кислотами или оксокислотами.
Амфотерные гидроксиды образованы элементами с амфотерными свойствами. Типичные амфотерные гидроксиды:
Be(OH)2 Sn(OH)2 Al(OH)3 AlO(OH)
Zn(OH)2 Pb(OH)2 Cr(OH)3 CrO(OH)
He образуются из амфотерных оксидов и воды, но подвергаются реальной дегидратации и образуют амфотерные оксиды:
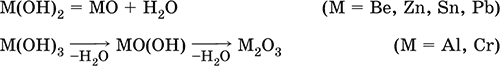
Исключение: для железа(III) известен только метагидроксид FeO(OH), «гидроксид железа(III) Fe(OH)3» не существует (не получен).
Амфотерные гидроксиды проявляют свойства основных и кислотных гидроксидов; образуют два вида солей, в которых амфотерный элемент входит в состав либо катионов солей, либо их анионов.
Для элементов, имеющих несколько степеней окисления, действует правило: чем выше степень окисления, тем более выражены кислотные свойства гидроксидов (и/или соответствующих оксидов).

Соли – соединения, состоящие из катионов основных или амфотерных (в роли основных) гидроксидов и анионов (остатков) кислотных или амфотерных (в роли кислотных) гидроксидов. В отличие от бескислородных солей, соли, рассматриваемые здесь, называются кислородсодержащими солями или оксосолями. Делятся по составу катионов и анионов:

Средние соли содержат средние кислотные остатки СО32-, NO3-, РО43-, SO42- и др.; например: К2СO3, Mg(NO3)2, Cr2(SO4)3, Zn3(PO4)2.
Если средние соли получают по реакциям с участием гидроксидов, то реагенты берут в эквивалентных количествах. Например, соль К2СO3 можно получить, если взять реагенты в соотношениях:
2КОН и 1Н2СO3, 1К2O и 1Н2СO3, 2КОН и 1СO2.
Реакции образования средних солей:
1)
1а) основный гидроксид + кислотный гидроксид →…Основание + Кислота → Соль + Вода
2NaOH + H2SO4 = Na2SO4 + 2Н2O
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
1б) амфотерный гидроксид + кислотный гидроксид →…
2Al(ОН)3 + 3H2SO4 = Al2(SO4)3 + 6Н2O
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2Н2O
1в) основный гидроксид + амфотерный гидроксид →…
NaOH + Al(ОН)3 = NaAlO2 + 2Н2O (в расплаве)
2NaOH + Zn(OH)2 = Na2ZnO2 + 2Н2O (в расплаве)
2)
2а) основный оксид + кислотный гидроксид →…Основной оксид + Кислота = Соль + Вода
Na2O + H2SO4 = Na2SO4 + Н2O
CuO + 2HNO3 = Cu(NO3)2 + H2O
2б) амфотерный оксид + кислотный гидроксид →…
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
ZnO + 2HNO3 = Zn(NO3)2 + H2O
2в) основный оксид + амфотерный гидроксид →…
Na2O + 2Al(ОН)3 = 2NaAlO2 + ЗН2O (в расплаве)
Na2O + Zn(OH)2 = Na2ZnO2 + Н2O (в расплаве)
3)
За) основный гидроксид + кислотный оксид →…Основание + Кислотный оксид → Соль + Вода
2NaOH + SO3 = Na2SO4 + Н2O
Ва(ОН)2 + СO2 = ВаСO3 + Н2O
3б) амфотерный гидроксид + кислотный оксид →…
2Al(ОН)3 + 3SO3 = Al2(SO4)3 + 3H2O
Zn(OH)2 + N2O5 = Zn(NO3)2 + H2O
Зв) основный гидроксид + амфотерный оксид →…
2NaOH + Al2O3 = 2NaAlO2 + Н2O (в расплаве)
2NaOH + ZnO = Na2ZnO2 + Н2O (в расплаве)
4)
4а) основный оксид + кислотный оксид →…Основной оксид + Кислотный оксид → Соль
Na2O + SO3 = Na2SO4, BaO + СO2 = ВаСO3
4б) амфотерный оксид + кислотный оксид →…
Al2O3 + 3SO3 = Al2(SO4)3, ZnO + N2O5 = Zn(NO3)2
4в) основный оксид + амфотерный оксид →…
Na2O + Al2O3 = 2NaAlO2, Na2O + ZnO = Na2ZnO2
Реакции 1в, если они протекают в растворе, сопровождаются образованием других продуктов — комплексных солей:
NaOH (конц.) + Al(OН)3 = Na[Al(OH)4]
КОН (конц.) + Cr(OH)3 = К3[Cr(ОН)6]
2NaOH (конц.) + M(OH)2 = Na2[M(OH)4] (М = Be, Zn)
КОН (конц.) + M(OH)2 = K[M(OH)3] (М = Sn, Pb)
Все средние соли в растворе – сильные электролиты (диссоциируют нацело).
Кислые соли содержат кислые кислотные остатки (с водородом) HCO3-, Н2РO42-, HPO42- и др., образуются при действии на основные и амфотерные гидроксиды или средние соли избытка кислотных гидроксидов, содержащих не менее двух атомов водорода в молекуле; аналогично действуют соответствующие кислотные оксиды:
NaOH + H2SO4 (конц.) = NaHSO4 + H2O
Ва(ОН)2 + 2Н3РO4 (конц.) = Ва(Н2РO4)2 + 2Н2O
Zn(OH)2 + Н3РO4 (конц.) = ZnHPO4↓ + 2Н2O
PbSO4 + H2SO4 (конц.) = Pb(HSO4)2
K2HPO4 + Н3РO4 (конц.) = 2КН2РO4
Са(ОН)2 + 2ЕO2 = Са(НЕO3)2 (Е = С, S)
Na2EO3 + ЕO2 + H2O = 2NaHEO3 (Е = С, S)
При добавлении гидроксида соответствующего металла или амфигена кислые соли переводятся в средние:
NaHSO4 + NaOH = Na2SO4 + Н2O
Pb(HSO4)2 + Pb(OH)2 = 2PbSO4↓ + 2H2O
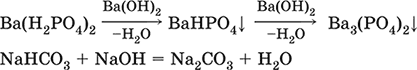
Почти все кислые соли хорошо растворимы в воде, диссоциируют нацело (КНСO3 = К+ + HCO3-).
Оснóвные соли содержат гидроксогруппы ОН, рассматриваемые как отдельные анионы, например FeNO3(OH), Ca2SO4(OH)2, Cu2CO3(OH)2, образуются при действии на кислотные гидроксиды избытка основного гидроксида, содержащего не менее двух гидроксогрупп в формульной единице:
Со(ОН)2 + HNO3 = CoNO3(OH)↓ + Н2O
2Ni(OH)2 + H2SO4 = Ni2SO4(OH)2↓ + 2H2O
2Cu(OH)2 + H2CO3 = Cu2CO3(OH)2↓ + 2H2O
Основные соли, образованные сильными кислотами, при добавлении соответствующего кислотного гидроксида переходят в средние:
CoNO3(OH) + HNO3 = Co(NO3)2 + Н2O
Ni2SO4(OH)2 + H2SO4 = 2NiSO4 + 2H2O
Большинство основных солей малорастворимы в воде; они осаждаются при совместном гидролизе, если образованы слабыми кислотами:
2MgCl2 + Н2O + 2Na2CO3 = Mg2CO3(OH)2↓ + СO2↑ + 4NaCl
Двойные соли содержат два химически разных катиона; например: CaMg(CO3)2, KAl(SO4)2, Fe(NH4)2(SO4)2, LiAl(SiO3)2. Многие двойные соли образуются (в виде кристаллогидратов) при совместной кристаллизации соответствующих средних солей из насыщенного раствора:
K2SO4 + MgSO4 + 6Н2O = K2Mg(SO4)2 6Н2O↓
Часто двойные соли менее растворимы в воде по сравнению с отдельными средними солями.
Бинарные соединения – это сложные вещества, не относящиеся к классам оксидов, гидроксидов и солей и состоящие из катионов и бескислородных анионов (реальных или условных).
Их химические свойства разнообразны и рассматриваются в неорганической химии отдельно для неметаллов разных групп Периодической системы; в этом случае классификация проводится по виду аниона.
Примеры:
а) галогениды: OF2, HF, KBr, PbI2, NH4Cl, BrF3, IF7
б) хальгогениды: H2S, Na2S, ZnS, As2S3, NH4HS, K2Se, NiSe
в) нитриды: NH3, NH3 H2O, Li3N, Mg3N2, AlN, Si3N4
г) карбиды: CH4, Be2C, Al4C3, Na2C2, CaC2, Fe3C, SiC
д) силициды: Li4Si, Mg2Si, ThSi2
е) гидриды: LiH, CaH2, AlH3, SiH4
ж) пероксидьг. H2O2, Na2O2, СаO2
з) надпероксиды: HO2, КO2, Ва(O2)2
По типу химической связи среди этих бинарных соединений различают:
ковалентные: OF2, IF7, H2S, P2S5, NH3, H2O2
ионные: Nal, K2Se, Mg3N2, CaC2, Na2O2, KO2
Встречаются двойные (с двумя разными катионами) и смешанные (с двумя разными анионами) бинарные соединения, например: KMgCl3, (FeCu)S2 и Pb(Cl)F, Bi(Cl)O, SCl2O2, As(O)F3.
Все ионные комплексные соли (кроме гидроксокомплексных) также относятся к этому классу сложных веществ (хотя обычно рассматриваются отдельно), например:
[Cu(NH3)4]SO4 K4[Fe(CN)6] Na3[AlF6]
[Ag(NH3)2]Cl K3[Fe(NCS)6] K2[SiF6]
К бинарным соединениям относятся ковалентные комплексные соединения без внешней сферы, например [Fe(CO)5] и [№(СО)4].
По аналогии со взаимосвязью гидроксидов и солей из всех бинарных соединений выделяют бескислородные кислоты и соли (остальные соединения классифицируют как прочие).
Бескислородные кислоты содержат (как и оксокислоты) подвижный водород Н+ и поэтому проявляют некоторые химические свойства кислотных гидроксидов (диссоциация в воде, участие в реакциях солеобразования в роли кислоты). Распространенные бескислородные кислоты – это HF, НCl, HBr, HI, HCN и H2S, из них HF, HCN и H2S – слабые кислоты, а остальные – сильные.
Примеры реакций солеобразования:
2HBr + ZnO = ZnBr2 + Н2O
2H2S + Ва(ОН)2 = Ba(HS)2 + 2Н2O
2HI + Pb(OH)2 = Pbl2↓ + 2Н2O
Металлы и амфигены, стоящие в ряду напряжений левее водорода и не реагирующие с водой, вступают во взаимодействие с сильными кислотами НCl, НВr и HI (в общем виде НГ) в разбавленном растворе и вытесняют из них водород (приведены реально протекающие реакции):
М + 2НГ = МГ2 + Н2↑ (М = Be, Mg, Zn, Cr, Mn, Fe, Co, Ni)
2M + 6НГ = 2МГ3 + H2↑ (M = Al, Ga)
Бескислородные соли образованы катионами металлов и амфигенов (а также катионом аммония NH4+) и анионами (остатками) бескислородных кислот; примеры: AgF, NaCl, KBr, PbI2, Na2S, Ba(HS)2, NaCN, NH4Cl. Проявляют некоторые химические свойства оксосолей.
Общий способ получения бескислородных солей с одноэлементными анионами – взаимодействие металлов и амфигенов с неметаллами F2, Cl2, Br2 и I2 (в общем виде Г2) и серой S (приведены реально протекающие реакции):
2М + Г2 = 2МГ (М = Li, Na, К, Rb, Cs, Ag)
M + Г2 = МГ2 (М = Be, Mg, Са, Sr, Ва, Zn, Mn, Со)
2М + ЗГ2 = 2МГ3 (М = Al, Ga, Cr)
2М + S = M2S (М = Li, Na, К, Rb, Cs, Ag)
M + S = MS (M = Be, Mg, Ca, Sr, Ba, Zn, Mn, Fe, Co, Ni)
2M + 3S = M2S3 (M = Al, Ga, Cr)
Исключения:
а) Cu и Ni реагируют только с галогенами Cl2 и Br2 (продукты МCl2, МBr2)
б) Cr и Mn реагируют с Cl2, Br2 и I2 (продукты CrCl3, CrBr3, CrI3 и MnCl2, MnBr2, MnI2)
в) Fe реагирует с F2 и Cl2 (продукты FeF3, FeCl3), с Br2 (смесь FeBr3 и FeBr2), с I2 (продукт FeI2)
г) Cu при реакции с S образует смесь продуктов Cu2S и CuS
Прочие бинарные соединения – все вещества этого класса, кроме выделенных в отдельные подклассы бескислородных кислот и солей.
Способы получения бинарных соединений этого подкласса разнообразны, самый простой – взаимодействие простых веществ (приведены реально протекающие реакции):
а) галогениды:
S + 3F2 = SF6, N2 + 3F2 = 2NF3
2P + 5Г2 = 2РГ5 (Г = F, CI, Br)
С + 2F2 = CF4
Si + 2Г2 = Sir4 (Г = F, CI, Br, I)
б) халькогениды:
2As + 3S = As2S3
2E + 5S = E2S5 (E = P, As)
E + 2S = ES2 (E = C, Si)
в) нитриды:
3H2 + N2
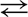 2NH3
2NH3 6M + N2 = 2M3N (M = Li, Na, K)
3M + N2 = M3N2 (M = Be, Mg, Ca)
2Al + N2 = 2AlN
3Si + 2N2 = Si3N4
г) карбиды:
2M + 2C = M2C2 (M = Li, Na)
2Be + С = Be2C
M + 2C = MC2 (M = Ca, Sr, Ba)
4Al + 3C = Al4C3
Si + С = SiC
д) силициды:
4Li + Si = Li4Si
2M + Si = M2Si (M = Mg, Ca)
е) гидриды:
2M + H2 = 2MH (M = Li, Na, K)
M + H2 = MH2 (M = Mg, Ca)
ж) пероксиды, надпероксиды:
2Na + O2 = Na2O2 (сгорание на воздухе)
M + O2 = МО2 (М = К, Rb, Cs; сгорание на воздухе)
Многие из этих веществ полностью реагируют с водой (чаще гидролизуются без изменения степеней окисления элементов, но гидриды выступают как восстановители, а надпероксиды вступают в реакции дисмутации):
РCl5 + 4Н2O = Н3РO4 + 5НCl
SiBr4 + 2Н2O = SiO2↓ + 4НBr
P2S5 + 8Н2O = 2Н3РO4 + 5H2S↑
SiS2 + 2Н2O = SiO2↓ + 2H2S
Mg3N2 + 8H2O = 3Mg(OH)2↓ + 2(NH3 H2O)
Na3N + 4H2O = 3NaOH + NH3 H2O
Be2C + 4H2O = 2Be(OH)2↓ + CH4↑
MC2 + 2H2O = M(OH)2 + C2H2↑ (M = Ca, Sr, Ba)
Al4C3 + 12H2O = 4Al(OH)3↓ + 3CH4↑
MH + H2O = MOH + H2↑ (M = Li, Na, K)
MgH2 + 2H2O = Mg(OH)2↓ + H2↑
CaH2 + 2H2O = Ca(OH)2 + H2↑
Na2O2 + 2H2O = 2NaOH + H2O2
2MO2 + 2H2O = 2MOH + H2O2 + O2↑ (M = K, Rb, Cs)
Другие вещества, наоборот, устойчивы по отношению к воде, среди них SF6, NF3, CF4, CS2, AlN, Si3N4, SiC, Li4Si, Mg2Si и Ca2Si.
Примеры заданий частей А, В, С
1. Простые вещества – это1) фуллерен
2) этилен
3) ацетон
4) озон
2. В формульных единицах продуктов реакций
Si + CF12 →…, Si + O2 →…, Si + Mg →…
общая сумма числа атомов всех элементов равна
1) 8
2) 9
3) 10
4) 11
3. В металлсодержащих продуктах реакций
Na + Н2O →…, Са + Н2O →…, Al + НCl (р-р) →…
общая сумма числа атомов всех элементов равна
1) 6
2) 8
3) 10
4) 12
4. Оксид кальция может реагировать (по отдельности) со всеми веществами набора
1) СO2, NaOH, NO
2) HBr, SO3, NH4Cl
3) BaO, SO3, KMgCl3
4) O2, Al2O3, NH3
5. Будет протекать реакция между оксидом серы (IV) и
1) SiO2
2) КCl
3) LiOH
4) NaNO3
6. Соль МAlO2 образуется при сплавлении
1) Al и ZnO
2) Al2O3 и КОН
3) Al и Са(ОН)2
4) Al2O3 и Fe2O3
7. В молекулярном уравнении реакции
ZnO + HNO3 → Zn(NO3)2 +…
сумма коэффициентов равна
1) 4
2) 5
3) 6
4) 7
8. Продукты реакции N2O5 + NaOH →… – это
1) Na2O, HNO3
2) NaOH, NH3
3) NaNO3, H2O
4) NaNO2, N2, H2O
9. Набор оснований – это
1) NaOH, LiOH, ClOH
2) NaOH, Ba(OH)2, Cu(OH)2
3) Ca(OH)2, KOH, BrOH
4) Mg(OH)2, Be(OH)2, NO(OH)
10. Гидроксид калия реагирует в растворе (по отдельности) с веществами набора
1) СО, CuSO4
2) SO2, Ag
3) Al, Ba(OH)2
4) SO3, FeCl3
11–12. Остаток, отвечающий кислоте с названием
11. Серная
12. Азотная
имеет формулу
1) NO2-
2) SO42-
3) NO3-
4) SO32-
13. Из соляной и разбавленной серной кислот не выделяет газ только металл
1) ртуть
2) цинк
3) магний
4) хром
14. Амфотерный гидроксид – это
1) Ва(ОН)2
2) CsOH
3) Ni(OH)2
4) Cr(OH)3
15-16. По заданным формулам гидроксидов
15. H3PO4, РЬ(ОН)2
16. Cr(OH)3, HNO3
выводится формула средней соли
1) РЬ3(РO4)2
2) РЬ3РO4
3) Cr2NO3
4) Cr(NO3)3
17. После пропускания избытка H2S через раствор гидроксида бария в конечном растворе будет содержаться соль
1) Ba(HS)2
2) (BaOH)2S
3) BaS
4) BaSO3
18. Возможно протекание реакций:
1) CaSO3 + H2SO4 →…
2) Ca(NO3)2 + HNO3 →…
3) NaHCOg + K2SO4 →…
4) Al(HSO4)3 + NaOH →…
19. В уравнении реакции (СаOН)2СO3(т) + Н3РO4 → СаНРO4↓ +…
сумма коэффициентов равна
1) 6
2) 5
3) 9
4) 8
20. Установите соответствие между формулой вещества и группой, к которой оно относится.

21. Установите соответствие между исходными веществами и продуктами реакций.

22. В схеме превращений
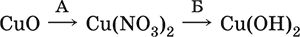
вещества А и Б указаны в наборе
1) NaNO3, Н2O
2) HNO3, КОН
3) N2O, NaOH
4) HNO3, Н2O
23. Составьте уравнения возможных реакций по схеме
FeS → H2S + PbS → PbSO4 → Pb(HSO4)2
24. Составьте уравнения четырех возможных реакций между веществами:
1) азотная кислота (конц.)
2) углерод (графит или кокс)
3) оксид кальция
4) оксид железа(II)
5. Металлы главных подгрупп I–III групп
5.1. Натрий
Натрий – элемент 3-го периода и IA-группы Периодической системы, порядковый номер 11. Электронная формула атома [10Ne]3s1, степени окисления +I и 0. Имеет малую электроотрицательность (0,93), проявляет только металлические (основные) свойства. Образует (как катион) многочисленные соли и бинарные соединения. Почти все соли натрия хорошо растворимы в воде.
В природе – пятый по химической распространенности элемент (второй среди металлов), встречается только в виде соединений. Жизненно важный элемент для всех организмов.
Натрий, катион натрия и его соединения окрашивают пламя газовой горелки в ярко-желтый цвет (качественное обнаружение).
Натрий Na. Серебристо-белый металл, легкий, мягкий (режется ножом), низкоплавкий. Хранят натрий в керосине. С ртутью образует жидкий сплав — амальгаму (до 0,2 % Na).
Весьма реакционноспособный, во влажном воздухе натрий медленно покрывается гидроксидной пленкой и теряет блеск (тускнеет):
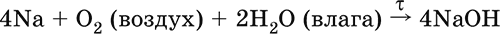
Натрий химически активен, сильный восстановитель. Воспламеняется на воздухе при умеренном нагревании (>250 °C), реагирует с неметаллами:
2Na + O2 = Na2O2 2Na + H2 = 2NaH
2Na + Cl2 = 2NaCl 2Na + S = Na2S
6Na + N2 = 2Na3N 2Na + 2C = Na2C2
Очень бурно и с большим экзо-эффектом натрий реагирует с водой:
2Na + 2H2O = 2NaOH + Н2↑ + 368 кДж
От теплоты реакции кусочки натрия расплавляются в шарики, которые начинают беспорядочно двигаться из-за выделения Н2. Реакция сопровождается резкими щелчками вследствие взрывов гремучего газа (Н2 + O2). Раствор окрашивается фенолфталеином в малиновый цвет (щелочная среда).
В ряду напряжений натрий стоит значительно левее водорода, из разбавленных кислот HCl и H2SO4 вытесняет водород (за счет Н2O и Н+).
В природе – пятый по химической распространенности элемент (второй среди металлов), встречается только в виде соединений. Жизненно важный элемент для всех организмов.
Натрий, катион натрия и его соединения окрашивают пламя газовой горелки в ярко-желтый цвет (качественное обнаружение).
Натрий Na. Серебристо-белый металл, легкий, мягкий (режется ножом), низкоплавкий. Хранят натрий в керосине. С ртутью образует жидкий сплав — амальгаму (до 0,2 % Na).
Весьма реакционноспособный, во влажном воздухе натрий медленно покрывается гидроксидной пленкой и теряет блеск (тускнеет):
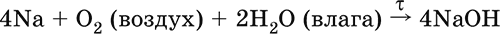
Натрий химически активен, сильный восстановитель. Воспламеняется на воздухе при умеренном нагревании (>250 °C), реагирует с неметаллами:
2Na + O2 = Na2O2 2Na + H2 = 2NaH
2Na + Cl2 = 2NaCl 2Na + S = Na2S
6Na + N2 = 2Na3N 2Na + 2C = Na2C2
Очень бурно и с большим экзо-эффектом натрий реагирует с водой:
2Na + 2H2O = 2NaOH + Н2↑ + 368 кДж
От теплоты реакции кусочки натрия расплавляются в шарики, которые начинают беспорядочно двигаться из-за выделения Н2. Реакция сопровождается резкими щелчками вследствие взрывов гремучего газа (Н2 + O2). Раствор окрашивается фенолфталеином в малиновый цвет (щелочная среда).
В ряду напряжений натрий стоит значительно левее водорода, из разбавленных кислот HCl и H2SO4 вытесняет водород (за счет Н2O и Н+).
