Страница:
Р. А. Лидин
Химия: Полный справочник для подготовки к ЕГЭ
Предисловие
Справочник включает весь теоретический материал школьного курса химии, необходимый для сдачи ЕГЭ, – итоговой аттестации учащихся. Этот материал распределен по 14 разделам, содержание которых соответствует темам, проверяемым на ЕГЭ, – четырем содержательным блокам: «Химический элемент», «Вещество», «Химическая реакция», «Познание и применение веществ и химических реакций». К каждому разделу даны тренировочные задания из частей А и В – с выбором ответа и кратким ответом. Раздел 15 полностью посвящен решению расчетных задач, включенных в экзаменационную часть С.
Тестовые задания составлены таким образом, что, отвечая на них, учащийся сможет более рационально повторить основные положения школьного курса химии.
В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Для удобства работы с данным справочником приведена таблица, где указано соответствие между тематикой экзамена и разделами книги.
Пособие адресовано старшим школьникам, абитуриентам и учителям.





Тестовые задания составлены таким образом, что, отвечая на них, учащийся сможет более рационально повторить основные положения школьного курса химии.
В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Для удобства работы с данным справочником приведена таблица, где указано соответствие между тематикой экзамена и разделами книги.
Пособие адресовано старшим школьникам, абитуриентам и учителям.







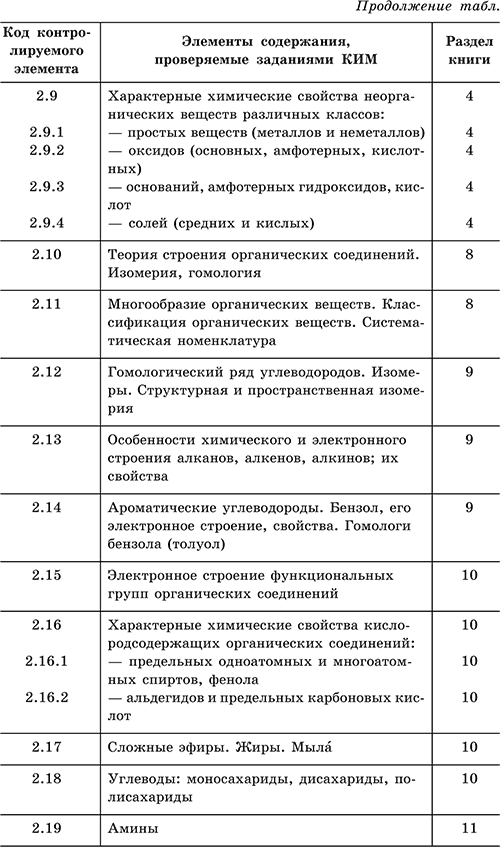
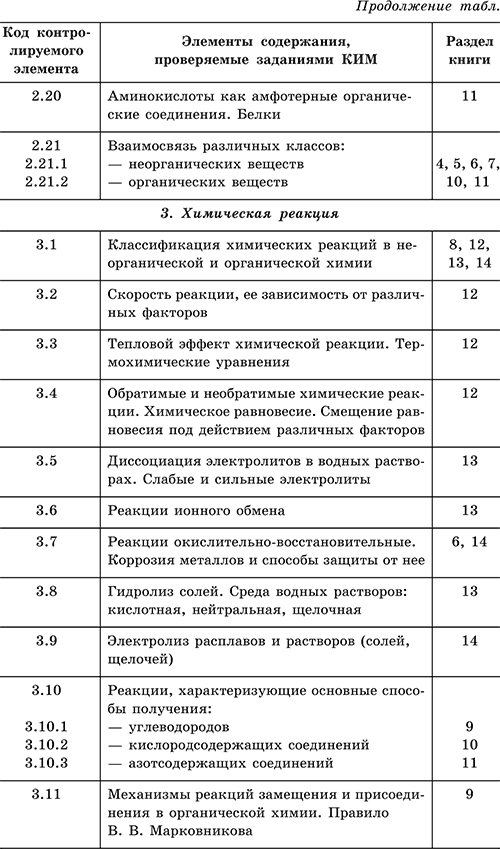
1. Распространенные элементы. строение атомов. Электронные оболочки. Орбитали
Химический элемент– определенный вид атомов, обозначаемый названием и символом и характеризуемый порядковым номером и относительной атомной массой.
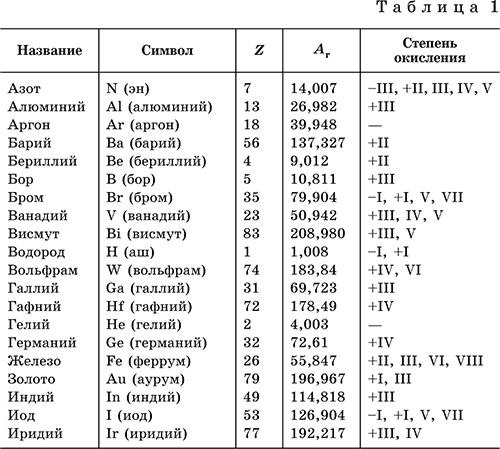
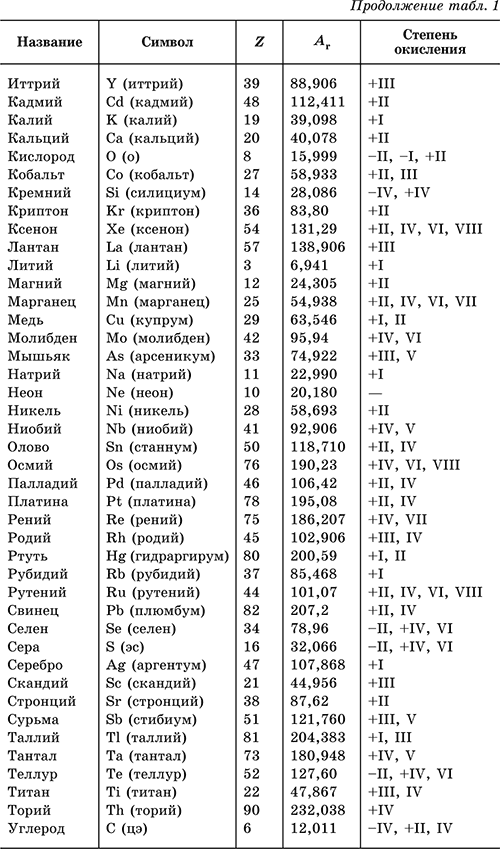
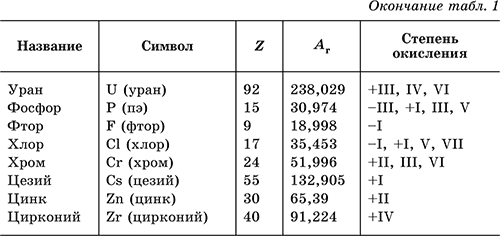
В табл. 1 перечислены распространенные химические элементы, приведены символы, которыми они обозначаются (в скобках – произношение), порядковые номера, относительные атомные массы, характерные степени окисления.
Нулевая степень окисления элемента в его простом веществе (веществах) в таблице не указана.
Все атомы одного элемента имеют одно и то же число протонов в ядре и число электронов в оболочке. Так, в атоме элемента водород Н находится 1р+ в ядре и на периферии 1е-; в атоме элемента кислород О находится 8р+ в ядре и 8е- в оболочке; атом элемента алюминий Аl содержит 13р+ в ядре и 13е- в оболочке.
Атомы одного элемента могут различаться числом нейтронов в ядре, такие атомы называются изотопами. Так, у элемента водород Н три изотопа: водород-1 (специальное название и символ протий 1H) с 1 р+ в ядре и 1е- в оболочке; водород-2 (дейтерий 2Н, или D) с 1р+ и 1п0 в ядре и 1е- в оболочке; водород-3 (тритий 3Н, или Т) с 1р+ и 2п0 в ядре и 1е- в оболочке. В символах 1Н, 2Н и 3Н верхний индекс указывает массовое число– сумму чисел протонов и нейтронов в ядре. Другие примеры:

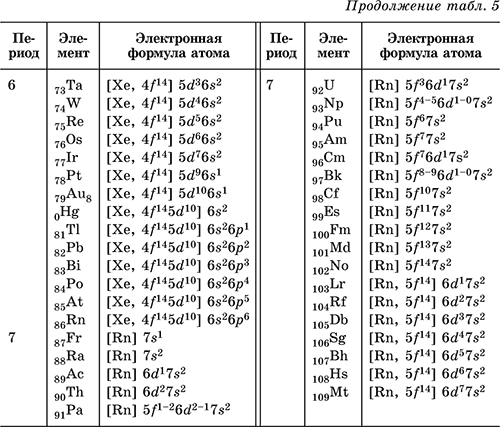
Электронную формулу атома любого химического элемента в соответствии с его расположением в Периодической системе элементов Д. И. Менделеева можно определить по табл. 2.

Электронная оболочка любого атома делится на энергетические уровни (1, 2, 3-й и т. д.), уровни делятся на подуровни (обозначаются буквами s, р, d, f). Подуровни состоят из атомных орбиталей – областей пространства, где вероятно пребывание электронов. Орбитали обозначаются как 1s (орбиталь 1-го уровня s-подуровня), 2s, 2р, 3s, 3р, 3d, 4s… Число орбиталей в подуровнях:

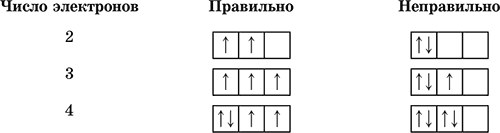
Заполнение атомных орбиталей электронами происходит в соответствии с тремя условиями:
1) принцип минимума энергии

3) принцип максимальной мультиплетности (правило Хунда)
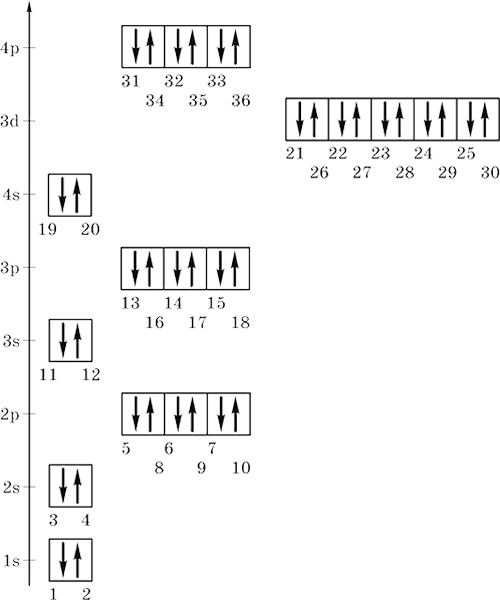
Заполнение электронами уровней, подуровней и орбиталей атомов элементов от Н (Z = 1) до Kr (Z = 36) показано на энергетической диаграмме (номера отвечают последовательности заполнения и совпадают с порядковыми номерами элементов):
Из заполненных энергетических диаграмм выводятся электронные формулы атомов элементов. Число электронов на орбиталях данного подуровня указывается в верхнем индексе справа от буквы (например, 3d5 – это 5 электронов на Зd-подуровне); вначале идут электроны 1-го уровня, затем 2-го, 3-го и т. д. Формулы могут быть полными и краткими, последние содержат в скобках символ соответствующего благородного газа, чем передается его формула, и, сверх того, начиная с Zn, заполненный внутренний d-подуровень. Примеры:
1H = 1s1
2Не = 1s2
3Li = 1s22s1 = [2He]2s1
8O = 1s22s22p4 = [2He]2s22p4
13Al = 1s22s22p63s23p1 = [10Ne]3s23p1
17Cl = 1s22s22p63s23p5 = [10Ne]3s23p5
2OСа = 1s22s22p63s23p4s2 = [18Ar]4s2
21Sc = 1s22s22p63s23p63d14s2 = [18Ar]3d14s2
25Mn = 1s22s22p63s23p63d54s2 = [18Ar]3d54s2
26Fe = 1s22s22p63s23p63d64s2 = [18Ar]3d64s2
3OZn = 1s22s22p63s23p63d104s2 = [18Ar, 3d10]4s2
33As = 1s22s22p63s23p63d104s24p3 = [18Ar, 3d10]4s24p3
36Kr = 1s22s22p63s23p63d104s24p6 = [18Ar, 3d10]4s24p6
Электроны, вынесенные за скобки, называются валентными. Именно они принимают участие в образовании химических связей.
Исключение составляют:
24Cr = 1s22s22p63s23p63d54s1 = [18Аr]Зd54s1 (а не 3d44s2!),
29Cu = 1s22s22p63s23p63d104s1 = [18Ar]3d104s1 (а не 3d94s2!).
1) дейтерий
2) оксоний
3) протий
4) тритий
2. Формула валентных подуровней атома металла – это
1) 4s24p4
2) 3d54s2
3) 2s22p1
4) 3s23p6
3. Число неспаренных электронов в основном состоянии атома железа равно
1) 2
2) 3
3) 4
4) 8
4. В возбужденном состоянии атома алюминия число неспаренных электронов равно
1) 1
2) 2
3) 3
4) 4
5. Электронная формула [Ar]3d94s0 отвечает катиону
1) Ti2+
2) Cu2+
3) Cr2+
4) Zn2+
6. Электронная формула аниона Э2- [Ne] 3s23p6 отвечает элементу
1) аргон
2) хлор
3) сера
4) фосфор
7. Суммарное число электронов в катионе Mg2+ и анионе F- равно
1) 9
2) 10
3) 20
4) 21
В табл. 1 перечислены распространенные химические элементы, приведены символы, которыми они обозначаются (в скобках – произношение), порядковые номера, относительные атомные массы, характерные степени окисления.
Нулевая степень окисления элемента в его простом веществе (веществах) в таблице не указана.



Все атомы одного элемента имеют одно и то же число протонов в ядре и число электронов в оболочке. Так, в атоме элемента водород Н находится 1р+ в ядре и на периферии 1е-; в атоме элемента кислород О находится 8р+ в ядре и 8е- в оболочке; атом элемента алюминий Аl содержит 13р+ в ядре и 13е- в оболочке.
Атомы одного элемента могут различаться числом нейтронов в ядре, такие атомы называются изотопами. Так, у элемента водород Н три изотопа: водород-1 (специальное название и символ протий 1H) с 1 р+ в ядре и 1е- в оболочке; водород-2 (дейтерий 2Н, или D) с 1р+ и 1п0 в ядре и 1е- в оболочке; водород-3 (тритий 3Н, или Т) с 1р+ и 2п0 в ядре и 1е- в оболочке. В символах 1Н, 2Н и 3Н верхний индекс указывает массовое число– сумму чисел протонов и нейтронов в ядре. Другие примеры:

Электронную формулу атома любого химического элемента в соответствии с его расположением в Периодической системе элементов Д. И. Менделеева можно определить по табл. 2.


Электронная оболочка любого атома делится на энергетические уровни (1, 2, 3-й и т. д.), уровни делятся на подуровни (обозначаются буквами s, р, d, f). Подуровни состоят из атомных орбиталей – областей пространства, где вероятно пребывание электронов. Орбитали обозначаются как 1s (орбиталь 1-го уровня s-подуровня), 2s, 2р, 3s, 3р, 3d, 4s… Число орбиталей в подуровнях:

Заполнение атомных орбиталей электронами происходит в соответствии с тремя условиями:
1) принцип минимума энергии
Последовательность нарастания энергии подуровней:Электроны заполняют орбитали, начиная с подуровня с меньшей энергией.
2) правило запрета (принцип Паули)1s < 2c < 2p < 3s < 3p < 4s ≤ 3d < 4p < 5s ≤ 4d < 5p < 6s…
Один электрон на орбитали называется неспаренным, два электрона — электронной парой:В каждой орбитали может разместиться не более двух электронов.

3) принцип максимальной мультиплетности (правило Хунда)
Каждый электрон имеет свою собственную характеристику – спин (условно изображается стрелкой вверх или вниз). Спины электронов складываются как вектора, сумма спинов данного числа электронов на подуровне должна быть максимальной (мультиплетность):В пределах подуровня электроны сначала заполняют все орбитали наполовину, а затем – полностью.

Заполнение электронами уровней, подуровней и орбиталей атомов элементов от Н (Z = 1) до Kr (Z = 36) показано на энергетической диаграмме (номера отвечают последовательности заполнения и совпадают с порядковыми номерами элементов):

Из заполненных энергетических диаграмм выводятся электронные формулы атомов элементов. Число электронов на орбиталях данного подуровня указывается в верхнем индексе справа от буквы (например, 3d5 – это 5 электронов на Зd-подуровне); вначале идут электроны 1-го уровня, затем 2-го, 3-го и т. д. Формулы могут быть полными и краткими, последние содержат в скобках символ соответствующего благородного газа, чем передается его формула, и, сверх того, начиная с Zn, заполненный внутренний d-подуровень. Примеры:
1H = 1s1
2Не = 1s2
3Li = 1s22s1 = [2He]2s1
8O = 1s22s22p4 = [2He]2s22p4
13Al = 1s22s22p63s23p1 = [10Ne]3s23p1
17Cl = 1s22s22p63s23p5 = [10Ne]3s23p5
2OСа = 1s22s22p63s23p4s2 = [18Ar]4s2
21Sc = 1s22s22p63s23p63d14s2 = [18Ar]3d14s2
25Mn = 1s22s22p63s23p63d54s2 = [18Ar]3d54s2
26Fe = 1s22s22p63s23p63d64s2 = [18Ar]3d64s2
3OZn = 1s22s22p63s23p63d104s2 = [18Ar, 3d10]4s2
33As = 1s22s22p63s23p63d104s24p3 = [18Ar, 3d10]4s24p3
36Kr = 1s22s22p63s23p63d104s24p6 = [18Ar, 3d10]4s24p6
Электроны, вынесенные за скобки, называются валентными. Именно они принимают участие в образовании химических связей.
Исключение составляют:
24Cr = 1s22s22p63s23p63d54s1 = [18Аr]Зd54s1 (а не 3d44s2!),
29Cu = 1s22s22p63s23p63d104s1 = [18Ar]3d104s1 (а не 3d94s2!).
Примеры заданий части А
1. Название, не относящееся к изотопам водорода, – это1) дейтерий
2) оксоний
3) протий
4) тритий
2. Формула валентных подуровней атома металла – это
1) 4s24p4
2) 3d54s2
3) 2s22p1
4) 3s23p6
3. Число неспаренных электронов в основном состоянии атома железа равно
1) 2
2) 3
3) 4
4) 8
4. В возбужденном состоянии атома алюминия число неспаренных электронов равно
1) 1
2) 2
3) 3
4) 4
5. Электронная формула [Ar]3d94s0 отвечает катиону
1) Ti2+
2) Cu2+
3) Cr2+
4) Zn2+
6. Электронная формула аниона Э2- [Ne] 3s23p6 отвечает элементу
1) аргон
2) хлор
3) сера
4) фосфор
7. Суммарное число электронов в катионе Mg2+ и анионе F- равно
1) 9
2) 10
3) 20
4) 21
2. Периодический закон. Периодическая система. Электроотрицательность. Степени окисления
Современная формулировка Периодического закона, открытого Д. И. Менделеевым в 1869 г.:

Проследим, например, изменение высших и низших степеней окисления у элементов IA – VIIA-групп во втором – четвертом периодах по табл. 3.
Положительные степени окисления проявляют все элементы, за исключением фтора. Их значения увеличиваются с ростом заряда ядер и совпадают с числом электронов на последнем энергетическом уровне (за исключением кислорода). Эти степени окисления называют высшими степенями окисления. Например, высшая степень окисления фосфора Р равна +V.

Отрицательные степени окисления проявляют элементы, начиная с углерода С, кремния Si и германия Ge. Значения их равны числу электронов, недостающих до восьми. Эти степени окисления называют низшими степенями окисления. Например, у атома фосфора Р на последнем энергетическом уровне недостает трех электронов до восьми, значит, низшая степень окисления фосфора Р равна – III.
Значения высших и низших степеней окисления повторяются периодически, совпадая по группам; например, в IVA-группе углерод С, кремний Si и германий Ge имеют высшую степень окисления +IV, а низшую степень окисления – IV.
Эта периодичность изменения степеней окисления отражается на периодическом изменении состава и свойств химических соединений элементов.
Аналогично прослеживается периодическое изменение электроотрицательности элементов в 1—6-м периодах IA– VIIA-групп (табл. 4).
В каждом периоде Периодической системы электроотрицательность элементов увеличивается при возрастании порядкового номера (слева направо).
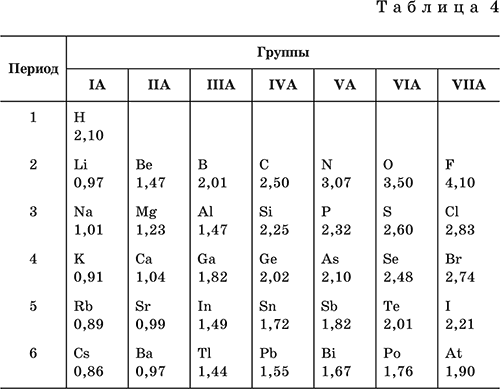
В каждой группе Периодической системы электроотрицательность уменьшается при возрастании порядкового номера (сверху вниз). Фтор F обладает наивысшей, а цезий Cs – наинизшей электроотрицательностью среди элементов 1—6-го периодов.
У типичных неметаллов – высокая электроотрицательность, а у типичных металлов – низкая.
1) 2
2) 8
3) 18
4) 32
2. Металлические свойства элементов 3-го периода от Na до Сl
1) силиваются
2) ослабевают
3) не изменяются
4) не знаю
3. Неметаллические свойства галогенов с увеличением порядкового номера
1) возрастают
2) понижаются
3) остаются без изменений
4) не знаю
4. В ряду элементов Zn – Hg – Со – Cd один элемент, не входящий в группу, – это
1) Са
2) Cs
3) Cd
4) Со
5. Металлические свойства элементов повышаются по ряду
1) In – Ga – Al
2) К – Rb – Sr
3) Ge – Ga – Tl
4) Li – Be – Mg
6. Неметаллические свойства в ряду элементов Аl – Si – С – N
1) увеличиваются
2) уменьшаются
3) не изменяются
4) не знаю
7. В ряду элементов О – S – Se – Те размеры (радиусы) атома
1) уменьшаются
2) увеличиваются
3) не изменяются
4) не знаю
8. В ряду элементов Р – Si – Аl – Mg размеры (радиусы) атома
1) уменьшаются
2) увеличиваются
3) не изменяются
4) не знаю
9. Для фосфора элемент с меньшей электроотрицательностью – это
1) N
2) S
3) Сl
4) Mg
10. Молекула, в которой электронная плотность смещена к атому фосфора, – это
1) PF3
2) РН3
3) P2S3
4) Р2O3
11. Высшая степень окисления элементов проявляется в наборе оксидов и фторидов
1) СlO2, РСl5, SeCl4, SO3
2) PCl, Аl2O3, КСl, СО
3) SeO3, ВСl3, N2O5, СаСl2
4) AsCl5, SeO2, SCl2, Cl2O7
12. Низшая степень окисления элементов – в их водородных соединениях и фторидах набора
1) ClF3, NH3, NaH, OF2
2) H3S+, NH+, SiH4, H2Se
3) CH4, BF4, H3O+, PF3
4) PH3, NF+, HF2, CF4
13. Валентность для многовалентного атома одинакова в ряду соединений
1) SiH4 – AsH3 – CF4
2) РН3 – BF3 – ClF3
3) AsF3 – SiCl4 – IF7
4) H2O – BClg – NF3
14. Укажите соответствие между формулой вещества или иона и степенью окисления углерода в них

Периодически повторяющийся характер изменения состава электронной оболочки атомов элементов объясняет периодическое изменение свойств элементов при движении по периодам и группам Периодической системы.Свойства элементов находятся в периодической зависимости от порядкового номера.

Проследим, например, изменение высших и низших степеней окисления у элементов IA – VIIA-групп во втором – четвертом периодах по табл. 3.
Положительные степени окисления проявляют все элементы, за исключением фтора. Их значения увеличиваются с ростом заряда ядер и совпадают с числом электронов на последнем энергетическом уровне (за исключением кислорода). Эти степени окисления называют высшими степенями окисления. Например, высшая степень окисления фосфора Р равна +V.

Отрицательные степени окисления проявляют элементы, начиная с углерода С, кремния Si и германия Ge. Значения их равны числу электронов, недостающих до восьми. Эти степени окисления называют низшими степенями окисления. Например, у атома фосфора Р на последнем энергетическом уровне недостает трех электронов до восьми, значит, низшая степень окисления фосфора Р равна – III.
Значения высших и низших степеней окисления повторяются периодически, совпадая по группам; например, в IVA-группе углерод С, кремний Si и германий Ge имеют высшую степень окисления +IV, а низшую степень окисления – IV.
Эта периодичность изменения степеней окисления отражается на периодическом изменении состава и свойств химических соединений элементов.
Аналогично прослеживается периодическое изменение электроотрицательности элементов в 1—6-м периодах IA– VIIA-групп (табл. 4).
В каждом периоде Периодической системы электроотрицательность элементов увеличивается при возрастании порядкового номера (слева направо).

В каждой группе Периодической системы электроотрицательность уменьшается при возрастании порядкового номера (сверху вниз). Фтор F обладает наивысшей, а цезий Cs – наинизшей электроотрицательностью среди элементов 1—6-го периодов.
У типичных неметаллов – высокая электроотрицательность, а у типичных металлов – низкая.
Примеры заданий частей А, В
1. В 4-м периоде число элементов равно1) 2
2) 8
3) 18
4) 32
2. Металлические свойства элементов 3-го периода от Na до Сl
1) силиваются
2) ослабевают
3) не изменяются
4) не знаю
3. Неметаллические свойства галогенов с увеличением порядкового номера
1) возрастают
2) понижаются
3) остаются без изменений
4) не знаю
4. В ряду элементов Zn – Hg – Со – Cd один элемент, не входящий в группу, – это
1) Са
2) Cs
3) Cd
4) Со
5. Металлические свойства элементов повышаются по ряду
1) In – Ga – Al
2) К – Rb – Sr
3) Ge – Ga – Tl
4) Li – Be – Mg
6. Неметаллические свойства в ряду элементов Аl – Si – С – N
1) увеличиваются
2) уменьшаются
3) не изменяются
4) не знаю
7. В ряду элементов О – S – Se – Те размеры (радиусы) атома
1) уменьшаются
2) увеличиваются
3) не изменяются
4) не знаю
8. В ряду элементов Р – Si – Аl – Mg размеры (радиусы) атома
1) уменьшаются
2) увеличиваются
3) не изменяются
4) не знаю
9. Для фосфора элемент с меньшей электроотрицательностью – это
1) N
2) S
3) Сl
4) Mg
10. Молекула, в которой электронная плотность смещена к атому фосфора, – это
1) PF3
2) РН3
3) P2S3
4) Р2O3
11. Высшая степень окисления элементов проявляется в наборе оксидов и фторидов
1) СlO2, РСl5, SeCl4, SO3
2) PCl, Аl2O3, КСl, СО
3) SeO3, ВСl3, N2O5, СаСl2
4) AsCl5, SeO2, SCl2, Cl2O7
12. Низшая степень окисления элементов – в их водородных соединениях и фторидах набора
1) ClF3, NH3, NaH, OF2
2) H3S+, NH+, SiH4, H2Se
3) CH4, BF4, H3O+, PF3
4) PH3, NF+, HF2, CF4
13. Валентность для многовалентного атома одинакова в ряду соединений
1) SiH4 – AsH3 – CF4
2) РН3 – BF3 – ClF3
3) AsF3 – SiCl4 – IF7
4) H2O – BClg – NF3
14. Укажите соответствие между формулой вещества или иона и степенью окисления углерода в них

3. Молекулы. Химическая связь. Строение веществ
Химические частицы, образованные из двух или нескольких атомов, называются молекулами (реальными или условными формульными единицами многоатомных веществ). Атомы в молекулах химически связаны.
Под химической связью понимают электрические силы притяжения, удерживающие частицы друг около друга. Каждая химическая связь в структурных формулах представляется валентной чертой, например:
H – H (связь между двумя атомами водорода);
H3N – Н+ (связь между атомом азота молекулы аммиака и катионом водорода);
(К+) – (I-) (связь между катионом калия и иодид-ионом).
Химическая связь образуется парой электронов (•), которая в электронных формулах сложных частиц (молекул, сложных ионов) обычно заменяется валентной чертой, в отличие от собственных, неподеленных электронных пар атомов, например:
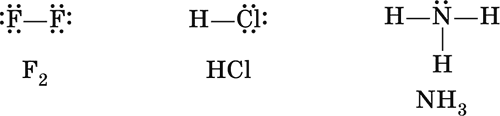
Химическая связь называется ковалентной, если она образована путем обобществления пары электронов обоими атомами.
В молекуле F2 оба атома фтора имеют одинаковую электроотрицательность, следовательно, обладание электронной парой для них одинаково. Такую химическую связь называют неполярной, так как у каждого атома фтора электронная плотность одинакова и в электронной формуле молекулы может быть условно разделена между ними поровну:
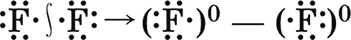
В молекуле хлороводорода НСl химическая связь уже полярная, так как электронная плотность на атоме хлора (элемента с большей электроотрицательностью) значительно выше, чем на атоме водорода:
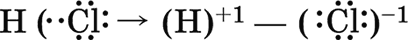
Ковалентная связь, например Н – Н, может быть образована путем обобществления электронов двух нейтральных атомов:
По другому механизму та же ковалентная связь H – H возникает при обобществлении электронной пары гидрид-иона H катионом водорода Н+:
Одинарные связи (Н – Н, F – F, Н – CI, Н – N) называются а-связями, они определяют геометрическую форму молекул.
Двойные и тройные связи (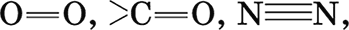
 ) содержат одну σ-составляющую и одну или две π-составляющие; σ-составляющая, являющаяся основной и условно образующаяся первой, всегда прочнее π-составляющих.
) содержат одну σ-составляющую и одну или две π-составляющие; σ-составляющая, являющаяся основной и условно образующаяся первой, всегда прочнее π-составляющих.
Физическими (реально измеряемыми) характеристиками химической связи являются ее энергия, длина и полярность.
Энергия химической связи (Есв) – это теплота, которая выделяется при образовании данной связи и затрачивается на ее разрыв. Для одних и тех же атомов одинарная связь всегда слабее, чем кратная (двойная, тройная).
Длина химической связи (lсв) – межъядерное расстояние. Для одних и тех же атомов одинарная связь всегда длиннее, чем кратная.
Полярность связи измеряется электрическим дипольным моментом р – произведением реального электрического заряда (на атомах данной связи) на длину диполя (т. е. длину связи). Чем больше дипольный момент, тем выше полярность связи. Реальные электрические заряды на атомах в ковалентной связи всегда меньше по значению, чем степени окисления элементов, но совпадают по знаку; например, для связи H+I—Cl-I реальные заряды равны Н+0'17—Сl-0'17 (двухполюсная частица, или диполь).
Полярность молекул определяется их составом и геометрической формой.
Неполярными (р = O) будут:
а) молекулы простых веществ, так как они содержат только неполярные ковалентные связи;
б) многоатомные молекулы сложных веществ, если их геометрическая форма симметрична.
Например, молекулы СО2, BF3 и СН4 имеют следующие направления равных (по длине) векторов связей:
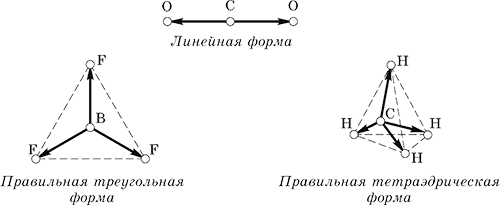
При сложении векторов связей их сумма всегда обращается в нуль, и молекулы в целом неполярны, хотя и содержат полярные связи.
Полярными (р > O) будут:
а) двухатомные молекулы сложных веществ, так как они содержат только полярные связи;
б) многоатомные молекулы сложных веществ, если их строение асимметрично, т. е. их геометрическая форма либо незавершенная, либо искаженная, что приводит к появлению суммарного электрического диполя, например у молекул NH3, Н2О, HNО3 и HCN.
Сложные ионы, например NH4+, SO42- и NO3-, не могут быть диполями в принципе, они несут только один (положительный или отрицательный) заряд.
Ионная связь возникает при электростатическом притяжении катионов и анионов почти без обобществления пары электронов, например между К+ и I-. У атома калия – недостаток электронной плотности, у атома иода – избыток. Такую связь считают предельным случаем ковалентной связи, поскольку пара электронов находится практически во владении у аниона. Такая связь наиболее характерна для соединений типичных металлов и неметаллов (CsF, NaBr, CaO, K2S, Li3N) и веществ класса солей (NaNО3, K2SО4, СаСО3). Все эти соединения при комнатных условиях представляют собой кристаллические вещества, которые объединяют общим названием ионные кристаллы (кристаллы, построенные из катионов и анионов).
Известен еще один вид связи, называемой металлической связью, в которой валентные электроны так непрочно удерживаются атомами металлов, что фактически не принадлежат конкретным атомам.
Атомы металлов, оставшиеся без четко принадлежащих им внешних электронов, становятся как бы положительными ионами. Они образуют металлическую кристаллическую решетку. Совокупность обобществленных валентных электронов (электронный газ) удерживает положительные ионы металла вместе и в определенных узлах решетки.
Помимо ионных и металлических кристаллов существуют еще атомные и молекулярные кристаллические вещества, в узлах решеток которых находятся атомы или молекулы соответственно. Примеры: алмаз и графит – кристаллы с атомной решеткой, иод I2 и диоксид углерода СO2 (сухой лед) – кристаллы с молекулярной решеткой.
Химические связи существуют не только внутри молекул веществ, но могут образовываться и между молекулами, например для жидкого HF, воды Н2O и смеси H2O + NH3:
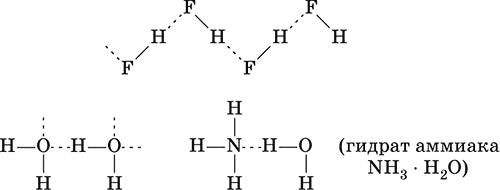
Водородная связь образуется за счет сил электростатического притяжения полярных молекул, содержащих атомы самых электроотрицательных элементов – F, О, N. Например, водородные связи имеются в HF, Н2O и NH3, но их нет в HCl, H2S и РН3.
Водородные связи малоустойчивы и разрываются довольно легко, например при плавлении льда и кипении воды. Однако на разрыв этих связей затрачивается некоторая дополнительная энергия, и поэтому температуры плавления (табл. 5) и кипения веществ с водородными связями

(например, HF и Н2O) оказываются значительно выше, чем у подобных веществ, но без водородных связей (например, HCl и H2S соответственно).
Многие органические соединения также образуют водородные связи; важную роль водородная связь играет в биологических процессах.
1) SiH4, Сl2O, СаВr2
2) NF3, NH4Cl, P2O5
3) CH4, HNO3, Na(CH3O)
4) CCl2O, I2, N2O
2–4. Ковалентная связь
2. одинарная
3. двойная
4. тройная
присутствует в веществе
1) КСl
2) N2
3) S2
4) H2S
5. Кратные связи имеются в молекулах
1) HCOOH
2) ССl4
3) С3Н8
4) С3Н4
6. Частицы, называемые радикалами, – это
1) SO2
2) СlO2
3) С2Н6
4) С2Н5
7. Одна из связей образована по донорно-акцепторному механизму в наборе ионов
1) SO42-, NH4+
2) H3O+, NH4+
3) PO43-, NO3-
4) PH4+, SO32-
8. Наиболее прочная и короткая связь – в молекуле
1) Н2O
2) H2S
3) HF
4) PH3
9. Вещества только с ионными связями – в наборе
1) HCl, КСl
2) NH4Cl, SiCl4
3) NaF, CsCl
4) Nal, P2O5
10–13. Кристаллическая решетка вещества
10. Si
11. H2SO4
12. Cr
13. Ва(ОН)2
1) металлическая
2) ионная
3) атомная
4) молекулярная
Под химической связью понимают электрические силы притяжения, удерживающие частицы друг около друга. Каждая химическая связь в структурных формулах представляется валентной чертой, например:
H – H (связь между двумя атомами водорода);
H3N – Н+ (связь между атомом азота молекулы аммиака и катионом водорода);
(К+) – (I-) (связь между катионом калия и иодид-ионом).
Химическая связь образуется парой электронов (•), которая в электронных формулах сложных частиц (молекул, сложных ионов) обычно заменяется валентной чертой, в отличие от собственных, неподеленных электронных пар атомов, например:
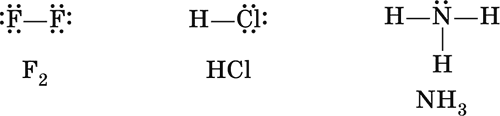
Химическая связь называется ковалентной, если она образована путем обобществления пары электронов обоими атомами.
В молекуле F2 оба атома фтора имеют одинаковую электроотрицательность, следовательно, обладание электронной парой для них одинаково. Такую химическую связь называют неполярной, так как у каждого атома фтора электронная плотность одинакова и в электронной формуле молекулы может быть условно разделена между ними поровну:
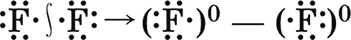
В молекуле хлороводорода НСl химическая связь уже полярная, так как электронная плотность на атоме хлора (элемента с большей электроотрицательностью) значительно выше, чем на атоме водорода:
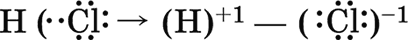
Ковалентная связь, например Н – Н, может быть образована путем обобществления электронов двух нейтральных атомов:
илиH · + · H → H – H
Такой механизм образования связи называется обменным или равноценным.H ∙ ∙ H
По другому механизму та же ковалентная связь H – H возникает при обобществлении электронной пары гидрид-иона H катионом водорода Н+:
илиH+ + (:H)- → H – H
Катион Н+ в этом случае называют акцептором, а анион Н – донором электронной пары. Механизм образования ковалентной связи при этом будет донорно-акцепторным, или координационным.H ∙ ∙ H
Одинарные связи (Н – Н, F – F, Н – CI, Н – N) называются а-связями, они определяют геометрическую форму молекул.
Двойные и тройные связи (
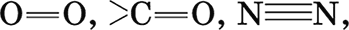
 ) содержат одну σ-составляющую и одну или две π-составляющие; σ-составляющая, являющаяся основной и условно образующаяся первой, всегда прочнее π-составляющих.
) содержат одну σ-составляющую и одну или две π-составляющие; σ-составляющая, являющаяся основной и условно образующаяся первой, всегда прочнее π-составляющих.Физическими (реально измеряемыми) характеристиками химической связи являются ее энергия, длина и полярность.
Энергия химической связи (Есв) – это теплота, которая выделяется при образовании данной связи и затрачивается на ее разрыв. Для одних и тех же атомов одинарная связь всегда слабее, чем кратная (двойная, тройная).
Длина химической связи (lсв) – межъядерное расстояние. Для одних и тех же атомов одинарная связь всегда длиннее, чем кратная.
Полярность связи измеряется электрическим дипольным моментом р – произведением реального электрического заряда (на атомах данной связи) на длину диполя (т. е. длину связи). Чем больше дипольный момент, тем выше полярность связи. Реальные электрические заряды на атомах в ковалентной связи всегда меньше по значению, чем степени окисления элементов, но совпадают по знаку; например, для связи H+I—Cl-I реальные заряды равны Н+0'17—Сl-0'17 (двухполюсная частица, или диполь).
Полярность молекул определяется их составом и геометрической формой.
Неполярными (р = O) будут:
а) молекулы простых веществ, так как они содержат только неполярные ковалентные связи;
б) многоатомные молекулы сложных веществ, если их геометрическая форма симметрична.
Например, молекулы СО2, BF3 и СН4 имеют следующие направления равных (по длине) векторов связей:

При сложении векторов связей их сумма всегда обращается в нуль, и молекулы в целом неполярны, хотя и содержат полярные связи.
Полярными (р > O) будут:
а) двухатомные молекулы сложных веществ, так как они содержат только полярные связи;
б) многоатомные молекулы сложных веществ, если их строение асимметрично, т. е. их геометрическая форма либо незавершенная, либо искаженная, что приводит к появлению суммарного электрического диполя, например у молекул NH3, Н2О, HNО3 и HCN.
Сложные ионы, например NH4+, SO42- и NO3-, не могут быть диполями в принципе, они несут только один (положительный или отрицательный) заряд.
Ионная связь возникает при электростатическом притяжении катионов и анионов почти без обобществления пары электронов, например между К+ и I-. У атома калия – недостаток электронной плотности, у атома иода – избыток. Такую связь считают предельным случаем ковалентной связи, поскольку пара электронов находится практически во владении у аниона. Такая связь наиболее характерна для соединений типичных металлов и неметаллов (CsF, NaBr, CaO, K2S, Li3N) и веществ класса солей (NaNО3, K2SО4, СаСО3). Все эти соединения при комнатных условиях представляют собой кристаллические вещества, которые объединяют общим названием ионные кристаллы (кристаллы, построенные из катионов и анионов).
Известен еще один вид связи, называемой металлической связью, в которой валентные электроны так непрочно удерживаются атомами металлов, что фактически не принадлежат конкретным атомам.
Атомы металлов, оставшиеся без четко принадлежащих им внешних электронов, становятся как бы положительными ионами. Они образуют металлическую кристаллическую решетку. Совокупность обобществленных валентных электронов (электронный газ) удерживает положительные ионы металла вместе и в определенных узлах решетки.
Помимо ионных и металлических кристаллов существуют еще атомные и молекулярные кристаллические вещества, в узлах решеток которых находятся атомы или молекулы соответственно. Примеры: алмаз и графит – кристаллы с атомной решеткой, иод I2 и диоксид углерода СO2 (сухой лед) – кристаллы с молекулярной решеткой.
Химические связи существуют не только внутри молекул веществ, но могут образовываться и между молекулами, например для жидкого HF, воды Н2O и смеси H2O + NH3:

Водородная связь образуется за счет сил электростатического притяжения полярных молекул, содержащих атомы самых электроотрицательных элементов – F, О, N. Например, водородные связи имеются в HF, Н2O и NH3, но их нет в HCl, H2S и РН3.
Водородные связи малоустойчивы и разрываются довольно легко, например при плавлении льда и кипении воды. Однако на разрыв этих связей затрачивается некоторая дополнительная энергия, и поэтому температуры плавления (табл. 5) и кипения веществ с водородными связями

(например, HF и Н2O) оказываются значительно выше, чем у подобных веществ, но без водородных связей (например, HCl и H2S соответственно).
Многие органические соединения также образуют водородные связи; важную роль водородная связь играет в биологических процессах.
Примеры заданий части А
1. Вещества только с ковалентными связями – это1) SiH4, Сl2O, СаВr2
2) NF3, NH4Cl, P2O5
3) CH4, HNO3, Na(CH3O)
4) CCl2O, I2, N2O
2–4. Ковалентная связь
2. одинарная
3. двойная
4. тройная
присутствует в веществе
1) КСl
2) N2
3) S2
4) H2S
5. Кратные связи имеются в молекулах
1) HCOOH
2) ССl4
3) С3Н8
4) С3Н4
6. Частицы, называемые радикалами, – это
1) SO2
2) СlO2
3) С2Н6
4) С2Н5
7. Одна из связей образована по донорно-акцепторному механизму в наборе ионов
1) SO42-, NH4+
2) H3O+, NH4+
3) PO43-, NO3-
4) PH4+, SO32-
8. Наиболее прочная и короткая связь – в молекуле
1) Н2O
2) H2S
3) HF
4) PH3
9. Вещества только с ионными связями – в наборе
1) HCl, КСl
2) NH4Cl, SiCl4
3) NaF, CsCl
4) Nal, P2O5
10–13. Кристаллическая решетка вещества
10. Si
11. H2SO4
12. Cr
13. Ва(ОН)2
1) металлическая
2) ионная
3) атомная
4) молекулярная
4. Классификация и взаимосвязь неорганических веществ
Классификация неорганических веществ базируется на химическом составе – наиболее простой и постоянной во времени характеристике. Химический состав вещества показывает, какие элементы присутствуют в нем и в каком числовом отношении для их атомов.
Элементы условно делятся на элементы с металлическими и неметаллическими свойствами. Первые из них всегда входят в состав катионов многоэлементных веществ (металлические свойства), вторые – в состав анионов (неметаллические свойства). В соответствии с Периодическим законом в периодах и группах между этими элементами находятся амфотерные элементы, проявляющие одновременно в той или иной мере металлические и неметаллические (амфотерные, двойственные) свойства. Элементы VIIIA-группы продолжают рассматривать отдельно (благородные газы), хотя для Kr, Хе и Rn обнаружены явно неметаллические свойства (элементы Не, Ne, Ar химически инертны).
Классификация простых и сложных неорганических веществ приведена в табл. 6.
Ниже приводятся определения (дефиниции) классов неорганических веществ, их важнейшие химические свойства и способы получения.
Неорганические вещества – соединения, образуемые всеми химическими элементами (кроме большинства органических соединений углерода). Делятся по химическому составу:
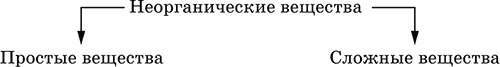
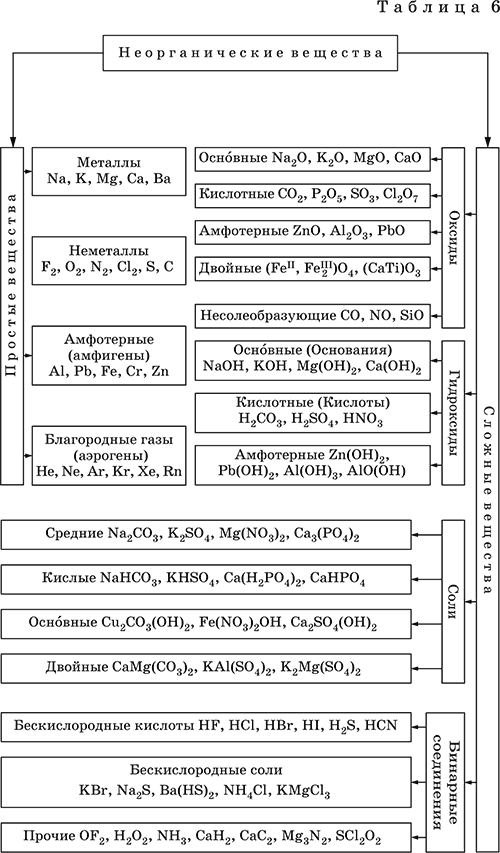
Простые вещества образованы атомами одного элемента. Делятся по химическим свойствам:

Металлы – простые вещества элементов с металлическими свойствами (низкая электроотрицательность). Типичные металлы:
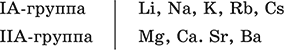
Металлы обладают высокой восстановительной способностью по сравнению с типичными неметаллами. В электрохимическом ряду напряжений они стоят значительно левее водорода, вытесняют водород из воды (магний – при кипячении):
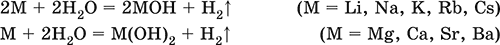
Простые вещества элементов Cu, Ag и Ni также относят к металлам, так как у их оксидов CuO, Ag2O, NiO и гидроксидов Cu(OH)2, Ni(OH)2 преобладают основные свойства.
Неметаллы – простые вещества элементов с неметаллическими свойствами (высокая электроотрицательность). Типичные неметаллы: F2, Cl2, Br2, I2, O2, S, N2, Р, С, Si.
Неметаллы обладают высокой окислительной способностью по сравнению с типичными металлами.
Амфигены – амфотерные простые вещества, образованные элементами с амфотерными (двойственными) свойствами (электроотрицательность промежуточная между металлами и неметаллами). Типичные амфигены: Be, Cr, Zn, Аl, Sn, Pb.
Амфигены обладают более низкой восстановительной способностью по сравнению с типичными металлами. В электрохимическом ряду напряжений они примыкают слева к водороду или стоят за ним справа.
Аэрогены – благородные газы, одноатомные простые вещества элементов VIIIA-группы: Не, Ne, Ar, Kr, Xe, Rn. Из них He, Ne и Ar химически пассивны (соединения с другими элементами не получены), а Kr, Хе и Rn проявляют некоторые свойства неметаллов с высокой электроотрицательностью.
Элементы условно делятся на элементы с металлическими и неметаллическими свойствами. Первые из них всегда входят в состав катионов многоэлементных веществ (металлические свойства), вторые – в состав анионов (неметаллические свойства). В соответствии с Периодическим законом в периодах и группах между этими элементами находятся амфотерные элементы, проявляющие одновременно в той или иной мере металлические и неметаллические (амфотерные, двойственные) свойства. Элементы VIIIA-группы продолжают рассматривать отдельно (благородные газы), хотя для Kr, Хе и Rn обнаружены явно неметаллические свойства (элементы Не, Ne, Ar химически инертны).
Классификация простых и сложных неорганических веществ приведена в табл. 6.
Ниже приводятся определения (дефиниции) классов неорганических веществ, их важнейшие химические свойства и способы получения.
Неорганические вещества – соединения, образуемые всеми химическими элементами (кроме большинства органических соединений углерода). Делятся по химическому составу:

Простые вещества образованы атомами одного элемента. Делятся по химическим свойствам:

Металлы – простые вещества элементов с металлическими свойствами (низкая электроотрицательность). Типичные металлы:
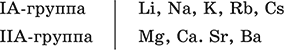
Металлы обладают высокой восстановительной способностью по сравнению с типичными неметаллами. В электрохимическом ряду напряжений они стоят значительно левее водорода, вытесняют водород из воды (магний – при кипячении):
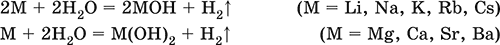
Простые вещества элементов Cu, Ag и Ni также относят к металлам, так как у их оксидов CuO, Ag2O, NiO и гидроксидов Cu(OH)2, Ni(OH)2 преобладают основные свойства.
Неметаллы – простые вещества элементов с неметаллическими свойствами (высокая электроотрицательность). Типичные неметаллы: F2, Cl2, Br2, I2, O2, S, N2, Р, С, Si.
Неметаллы обладают высокой окислительной способностью по сравнению с типичными металлами.
Амфигены – амфотерные простые вещества, образованные элементами с амфотерными (двойственными) свойствами (электроотрицательность промежуточная между металлами и неметаллами). Типичные амфигены: Be, Cr, Zn, Аl, Sn, Pb.
Амфигены обладают более низкой восстановительной способностью по сравнению с типичными металлами. В электрохимическом ряду напряжений они примыкают слева к водороду или стоят за ним справа.
Аэрогены – благородные газы, одноатомные простые вещества элементов VIIIA-группы: Не, Ne, Ar, Kr, Xe, Rn. Из них He, Ne и Ar химически пассивны (соединения с другими элементами не получены), а Kr, Хе и Rn проявляют некоторые свойства неметаллов с высокой электроотрицательностью.
