При малоиммунном гломерулонефрите в интерстиции отмечается интенсивная инфильтрация лейкоцитами, в том числе перигломерулярная с сопутствующим разрывом капсулы Боумена. В отдельных случаях перигломерулярные инфильтраты очень массивны и напоминают гранулематозную реакцию с накоплением эпителиоидных клеток. По данным U. Eisenberger и F. Fakhouri, при ANCA-негативном малоиммунном гломерулонефрите в 95 % случаев (биопсий) в почечном тубуло-интерстиции отмечается интенсивная лимфоцитарно-макрофагальная инфильтрация с примесью лейкоцитов, в 80 % случаев – тубуло-интерстициальный фиброз. При малоиммунном гломерулонефрите макрофаги, обильно инфильтрирующие почечные клубочки, продуцируют большое количество тканевого фактора, усиливающего формирование полулуний.
При иммунофлюоресцентном исследовании иммунные депозиты в почечных клубочках чаще всего не выявляются, иногда бывают обнаружены небольшие очаговые отложения С3. Фибриноген накапливается в полулуниях или участках некроза почечных клубочков. При электронно-микроскопическом исследовании выявляют разрывы базальной мембраны клубочков и отложения фибрина. Иммунные комплексы отсутствуют. В исходе гломерулонефрита с полулуниями развивается вторично сморщенная почка с очень быстро формирующейся почечной недостаточностью.
Клиническая картина
Клиническая картина быстропрогрессирующего гломерулонефрита складывается из сочетания 3 «больших» нефрологических синдромов (табл. 3.3), каждый из которых может на определенном этапе приобретать ведущее значение. Жалобы пациента и тяжесть его состояния во многом обусловлены развитием соответствующих осложнений – острой левожелудочковой недостаточности с отеком легких, отека мозга и острых нарушений мозгового кровообращения при злокачественной артериальной гипертензии, нефротического криза (см. «Нефротический криз»). Необходимо также иметь в виду, что определенная часть угрожающих жизни осложнений быстропрогрессирующего гломерулонефрита, например гиперкалиемия, выраженность которой может стать первоочередным показанием к проведению острого гемодиализа, нередко остаются почти бессимптомными, или их признаки, в частности тенденция к брадикардии, могут быть своевременно не замеченными. Названное обстоятельство подчеркивает необходимость тщательного клинико-лабораторного мониторинга состояния пациентов с быстропрогрессирующим гломерулонефритом, который зачастую может быть осуществлен только в условиях отделения интенсивной терапии.
Таблица 3.3
Клиническая картина быстропрогрессирующего гломерулонефрита
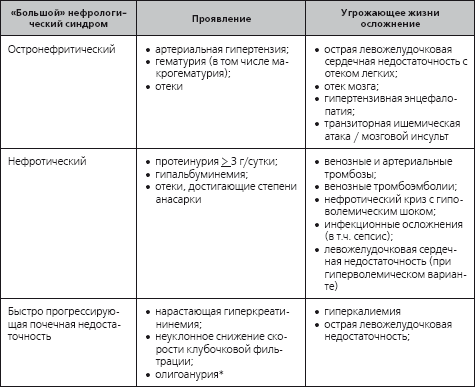 * Может отсутствовать на первых этапах формирования быстропрогрессирующего гломерулонефрита.
* Может отсутствовать на первых этапах формирования быстропрогрессирующего гломерулонефрита.
Необходимо также иметь в виду, что значительную роль в клинической картине быстропрогрессирующего гломерулонефрита наряду с проявлениями собственно почечного процесса и его осложнений, нередко приобретают признаки поражения других органов. Выраженность этих симптомов зависит от особенностей системного заболевания: так, при гранулематозе Вегенера могут наблюдаться геморрагический и/или фиброзирующий альвеолит, поражение ЛОР-органов с перфорацией носовой перегородки, стенозом трахеи или гранулематозным расплавлением костей глазницы и основания черепа, при HCV-ассоциированной смешанной криоглобулинемии – триада Мельтцера (кожная пурпура, артралгии, слабость) и ишемические некрозы дистальных фаланг пальцев рук и ног, а при системной красной волчанке – волчаночные кардит и цереброваскулит.
Диагноз
Быстропрогрессирующий гломерулонефрит диагностируют на основании оценки скорости ухудшения фильтрационной функции почек и выделения ведущего на момент обследования нефрологического синдрома (остронефритического и/или нефротического).
Наряду с динамикой биохимических параметров крови (в том числе креатининемии с последующии расчетом скорости клубочковой фильтрации и калиемии) и показателей периферической крови (сывороточного содержания гемоглобина, количества эритроцитов, лейкоцитов и тромбоцитов) необходимо также оценить сывороточный уровень иммуноглобулинов A, M и G, комплемента, ANCA (c типированием их по фракциям: антитела к миелопероксидазе, антитела к протеинкиназе-3), анти-БМК-антител, а также антител к кардиолипину.
Всем больным быстропрогрессирующим гломерулонефритом показана биопсия почки. Проведение ее необходимо в первую очередь с целью определения прогноза и выбора оптимального метода лечения: своевременно примененная агрессивная схема иммуносупрессивной терапии иногда позволяет добиться улучшения или даже восстановления почечной функции даже в ситуации, когда степень ее ухудшения достигла терминальной почечной недостаточности. В связи с этим при быстропрогрессирующем гломерулонефрите биопсию почки необходимо выполнять и при выраженной, требующей проведения гемодиализа почечной недостаточности.
Быстропрогрессирующий гломерулонефрит следует дифференцировать с состояниями, воспроизводящими его клинически (табл. 3.4), при которых тактика лечения может радикально отличаться. Следует тем не менее иметь в виду, что ни одно из хронических заболеваний почек не исключает возможности присоединения быстропрогрессирующего гломерулонефрита.
Таблица 3.4
Состояния, воспроизводящие клиническую картину быстропрогрессирующего гломерулонефрита

 * В редких случаях приводит к развитию быстропрогрессирующего гломерулонефрита, в том числе ANCA-ассоциированного.
* В редких случаях приводит к развитию быстропрогрессирующего гломерулонефрита, в том числе ANCA-ассоциированного.
Лечение
Основной принцип лечения быстропрогрессирующего гломерулонефрита – максимально активная иммуносупрессивная терапия даже при выраженном ухудшении почечной функции. При быстропрогрессирующем гломерулонефрите риск нежелательных явлений, обусловленных агрессивной иммуносупрессивной терапией, всегда меньше, чем не устранимая другими способами вероятность необратимого ухудшения функции почек и связанного с этим фатального исхода.
Пульс-терапию необходимо начать до получения биопсийных результатов морфологического исследования ткани почки, метилпреднизолоном. Циклофосфамид в сверхвысоких дозах присоединяют в первую очередь при III типе быстропрогрессирующего гломерулонефрита и наличии ANCA в сыворотке крови.
Эффективность иммуносупрессивной терапии существенно повышается при одновременном проведении плазмафереза. Плазмаферез абсолютно показан всем больным синдромом Гудпасчера (антительный (I) тип быстропрогрессирующего гломерулонефрита). Плазмаферез желательно проводить перед очередной инфузией циклофосфамида. При II (иммунокомплексном) типе быстропрогрессирующего гломерулонефрита плазмаферез менее обоснован, за исключением HCV-индуцированной смешанной криоглобулинемии, при которой также целесообразна противовирусная терапия (интерфероном-a в сочетании с рибавирином). Больные гранулематозом Вегенера, как правило, нуждаются в длительном приеме циклофосфамида; при микроскопическом полиангиите возможен прием азатиоприна.
Выраженность почечной недостаточности, как правило, ограничивает применение при быстропрогрессирующем гломерулонефрите метотрексата. Положительный опыт применения циклоспорина исчерпывается пока отдельными наблюдениями. Для достижения ремиссии быстропрогрессирующего гломерулонефрита III типа (в рамках гранулематоза Вегенера и микроскопического полиангиита) с успехом применяли внутривенный иммуноглобулин, не позволивший тем не менее полностью отказаться от стандартных схем иммуносупрессивной терапии. Для индукции ремиссии быстропрогрессирующего гломерулонефрита при гранулематозе Вегенера у пациентов, не переносивших циклофосфамида, возможно применение микофенолата мофетила, хотя обоснованность этого требует уточнения в специально планируемых контролируемых клинических исследованиях. Продолжаются контролируемые исследования, посвященные оценке эффективности ритуксимаба – моноклональных антител к CD20 – при гранулематозе Вегенера; показано, что этот препарат способен уменьшать сывороточный титр ANCA. Следует тем не менее подчеркнуть, что обоснование применения того или иного иммунодепрессанта при быстропрогрессирующем гломерулонефрите требует включения в контролируемые исследования пациентов с соответствующими исходными характеристиками. Без предварительного изучения на быстропрогрессирующий гломерулонефрит, очевидно, нельзя полностью экстраполировать лечебные тактики, оказавшиеся эффективными при других органных поражениях.
С учетом установленной на экспериментальных моделях роли происходящих из костного мозга клеток в репарации костной ткани можно предполагать высокую эффективность этого лечебного подхода при быстропрогрессирующем гломерулонефрите. При экспериментальном гломерулонефрите инъекции костномозговых клеток приводили к уменьшению инфильтрации почечной ткани макрофагами, снижению распространенности гломерулосклероза, улучшению функции почек и увеличению выживаемости животных. Показано также, что инъекции происходящих из костного мозга клеток-предшественников эндотелиоцитов при экспериментальном гломерулонефрите сопровождаются уменьшением повреждения клубочковых эндотелиоцитов и активации мезангиоцитов. В ближайшем будущем целесообразна попытка применения этого лечебного подхода и в клинических исследованиях.
Прогноз
Вероятность терминальной почечной недостаточности возрастает по мере увеличения числа почечных клубочков с полулуниями. Показано, что при поражении 30 % и более почечных клубочков у всех пациентов в течение 2 лет возникает потребность в программном гемодиализе. Потребность в гемодиализе в дебюте болезни и пожилой возраст также ухудшают прогноз. При малоиммунном (pauci, III тип) быстропрогрессирующем гломерулонефрите риск необратимого ухудшения функции почек возрастает в 1,8 раза при увеличении числа полностью склерозированных клубочков на 10 % и в 1,5 раза – при увеличении количества клубочков с полулуниями на 10 %. Выраженное поражение почечного тубуло-интерстиция, экспрессия его структурами трансформирующего фактора роста-b и мембранатакующего комплекса комплемента (фракции С5b—C9) свидетельствуют в пользу высокой вероятности отсутствия ответа на лечение.
До применения активной иммунодепрессивной терапии почти у 100 % больных в течение года развивалась терминальная почечная недостаточность. В настоящее время более чем у 80 % пациентов удается добиться ремиссии. Прогноз при системных заболеваниях может определяться также поражением других органов (сердечно-сосудистой системы, легких).
Выживаемость почечного трансплантата у больных быстропрогрессирующим гломерулонефритом в течение 1 года достигает 90 %. Риск рецидива заболевания в почечном трансплантате может быть несколько выше при некоторых системных заболеваниях (некротизирующих ANCA-ассоциированных васкулитах, системной красной волчанке).
Перспективы
Эффективность лечения быстропрогрессирующего гломерулонефрита может быть существенно повышена с помощью активно разрабатываемых в настоящее время суперселективных терапевтических стратегий (с использованием антител к трансформирующему фактору роста-b и его рецепторам, блокаторов гремлина), тормозящих почечный фиброгенез, пролиферацию составляющих клубочковые полулуния клеток и, возможно, индуцирующих их контролируемый апоптоз.
Для первичной и вторичной профилактики быстропрогрессирующего гломерулонефрита первоочередное значение приобретает формирование регистров, включающих значительное число пациентов и обеспечивающих возможность длительного наблюдения за ними, благодаря чему можно рассчитывать на выделение достоверных и потенциально устранимых факторов риска.
Глава 4
При иммунофлюоресцентном исследовании иммунные депозиты в почечных клубочках чаще всего не выявляются, иногда бывают обнаружены небольшие очаговые отложения С3. Фибриноген накапливается в полулуниях или участках некроза почечных клубочков. При электронно-микроскопическом исследовании выявляют разрывы базальной мембраны клубочков и отложения фибрина. Иммунные комплексы отсутствуют. В исходе гломерулонефрита с полулуниями развивается вторично сморщенная почка с очень быстро формирующейся почечной недостаточностью.
Клиническая картина
Клиническая картина быстропрогрессирующего гломерулонефрита складывается из сочетания 3 «больших» нефрологических синдромов (табл. 3.3), каждый из которых может на определенном этапе приобретать ведущее значение. Жалобы пациента и тяжесть его состояния во многом обусловлены развитием соответствующих осложнений – острой левожелудочковой недостаточности с отеком легких, отека мозга и острых нарушений мозгового кровообращения при злокачественной артериальной гипертензии, нефротического криза (см. «Нефротический криз»). Необходимо также иметь в виду, что определенная часть угрожающих жизни осложнений быстропрогрессирующего гломерулонефрита, например гиперкалиемия, выраженность которой может стать первоочередным показанием к проведению острого гемодиализа, нередко остаются почти бессимптомными, или их признаки, в частности тенденция к брадикардии, могут быть своевременно не замеченными. Названное обстоятельство подчеркивает необходимость тщательного клинико-лабораторного мониторинга состояния пациентов с быстропрогрессирующим гломерулонефритом, который зачастую может быть осуществлен только в условиях отделения интенсивной терапии.
Таблица 3.3
Клиническая картина быстропрогрессирующего гломерулонефрита

Необходимо также иметь в виду, что значительную роль в клинической картине быстропрогрессирующего гломерулонефрита наряду с проявлениями собственно почечного процесса и его осложнений, нередко приобретают признаки поражения других органов. Выраженность этих симптомов зависит от особенностей системного заболевания: так, при гранулематозе Вегенера могут наблюдаться геморрагический и/или фиброзирующий альвеолит, поражение ЛОР-органов с перфорацией носовой перегородки, стенозом трахеи или гранулематозным расплавлением костей глазницы и основания черепа, при HCV-ассоциированной смешанной криоглобулинемии – триада Мельтцера (кожная пурпура, артралгии, слабость) и ишемические некрозы дистальных фаланг пальцев рук и ног, а при системной красной волчанке – волчаночные кардит и цереброваскулит.
Диагноз
Быстропрогрессирующий гломерулонефрит диагностируют на основании оценки скорости ухудшения фильтрационной функции почек и выделения ведущего на момент обследования нефрологического синдрома (остронефритического и/или нефротического).
Наряду с динамикой биохимических параметров крови (в том числе креатининемии с последующии расчетом скорости клубочковой фильтрации и калиемии) и показателей периферической крови (сывороточного содержания гемоглобина, количества эритроцитов, лейкоцитов и тромбоцитов) необходимо также оценить сывороточный уровень иммуноглобулинов A, M и G, комплемента, ANCA (c типированием их по фракциям: антитела к миелопероксидазе, антитела к протеинкиназе-3), анти-БМК-антител, а также антител к кардиолипину.
Всем больным быстропрогрессирующим гломерулонефритом показана биопсия почки. Проведение ее необходимо в первую очередь с целью определения прогноза и выбора оптимального метода лечения: своевременно примененная агрессивная схема иммуносупрессивной терапии иногда позволяет добиться улучшения или даже восстановления почечной функции даже в ситуации, когда степень ее ухудшения достигла терминальной почечной недостаточности. В связи с этим при быстропрогрессирующем гломерулонефрите биопсию почки необходимо выполнять и при выраженной, требующей проведения гемодиализа почечной недостаточности.
Быстропрогрессирующий гломерулонефрит следует дифференцировать с состояниями, воспроизводящими его клинически (табл. 3.4), при которых тактика лечения может радикально отличаться. Следует тем не менее иметь в виду, что ни одно из хронических заболеваний почек не исключает возможности присоединения быстропрогрессирующего гломерулонефрита.
Таблица 3.4
Состояния, воспроизводящие клиническую картину быстропрогрессирующего гломерулонефрита


Лечение
Основной принцип лечения быстропрогрессирующего гломерулонефрита – максимально активная иммуносупрессивная терапия даже при выраженном ухудшении почечной функции. При быстропрогрессирующем гломерулонефрите риск нежелательных явлений, обусловленных агрессивной иммуносупрессивной терапией, всегда меньше, чем не устранимая другими способами вероятность необратимого ухудшения функции почек и связанного с этим фатального исхода.
Пульс-терапию необходимо начать до получения биопсийных результатов морфологического исследования ткани почки, метилпреднизолоном. Циклофосфамид в сверхвысоких дозах присоединяют в первую очередь при III типе быстропрогрессирующего гломерулонефрита и наличии ANCA в сыворотке крови.
Эффективность иммуносупрессивной терапии существенно повышается при одновременном проведении плазмафереза. Плазмаферез абсолютно показан всем больным синдромом Гудпасчера (антительный (I) тип быстропрогрессирующего гломерулонефрита). Плазмаферез желательно проводить перед очередной инфузией циклофосфамида. При II (иммунокомплексном) типе быстропрогрессирующего гломерулонефрита плазмаферез менее обоснован, за исключением HCV-индуцированной смешанной криоглобулинемии, при которой также целесообразна противовирусная терапия (интерфероном-a в сочетании с рибавирином). Больные гранулематозом Вегенера, как правило, нуждаются в длительном приеме циклофосфамида; при микроскопическом полиангиите возможен прием азатиоприна.
Выраженность почечной недостаточности, как правило, ограничивает применение при быстропрогрессирующем гломерулонефрите метотрексата. Положительный опыт применения циклоспорина исчерпывается пока отдельными наблюдениями. Для достижения ремиссии быстропрогрессирующего гломерулонефрита III типа (в рамках гранулематоза Вегенера и микроскопического полиангиита) с успехом применяли внутривенный иммуноглобулин, не позволивший тем не менее полностью отказаться от стандартных схем иммуносупрессивной терапии. Для индукции ремиссии быстропрогрессирующего гломерулонефрита при гранулематозе Вегенера у пациентов, не переносивших циклофосфамида, возможно применение микофенолата мофетила, хотя обоснованность этого требует уточнения в специально планируемых контролируемых клинических исследованиях. Продолжаются контролируемые исследования, посвященные оценке эффективности ритуксимаба – моноклональных антител к CD20 – при гранулематозе Вегенера; показано, что этот препарат способен уменьшать сывороточный титр ANCA. Следует тем не менее подчеркнуть, что обоснование применения того или иного иммунодепрессанта при быстропрогрессирующем гломерулонефрите требует включения в контролируемые исследования пациентов с соответствующими исходными характеристиками. Без предварительного изучения на быстропрогрессирующий гломерулонефрит, очевидно, нельзя полностью экстраполировать лечебные тактики, оказавшиеся эффективными при других органных поражениях.
С учетом установленной на экспериментальных моделях роли происходящих из костного мозга клеток в репарации костной ткани можно предполагать высокую эффективность этого лечебного подхода при быстропрогрессирующем гломерулонефрите. При экспериментальном гломерулонефрите инъекции костномозговых клеток приводили к уменьшению инфильтрации почечной ткани макрофагами, снижению распространенности гломерулосклероза, улучшению функции почек и увеличению выживаемости животных. Показано также, что инъекции происходящих из костного мозга клеток-предшественников эндотелиоцитов при экспериментальном гломерулонефрите сопровождаются уменьшением повреждения клубочковых эндотелиоцитов и активации мезангиоцитов. В ближайшем будущем целесообразна попытка применения этого лечебного подхода и в клинических исследованиях.
Прогноз
Вероятность терминальной почечной недостаточности возрастает по мере увеличения числа почечных клубочков с полулуниями. Показано, что при поражении 30 % и более почечных клубочков у всех пациентов в течение 2 лет возникает потребность в программном гемодиализе. Потребность в гемодиализе в дебюте болезни и пожилой возраст также ухудшают прогноз. При малоиммунном (pauci, III тип) быстропрогрессирующем гломерулонефрите риск необратимого ухудшения функции почек возрастает в 1,8 раза при увеличении числа полностью склерозированных клубочков на 10 % и в 1,5 раза – при увеличении количества клубочков с полулуниями на 10 %. Выраженное поражение почечного тубуло-интерстиция, экспрессия его структурами трансформирующего фактора роста-b и мембранатакующего комплекса комплемента (фракции С5b—C9) свидетельствуют в пользу высокой вероятности отсутствия ответа на лечение.
До применения активной иммунодепрессивной терапии почти у 100 % больных в течение года развивалась терминальная почечная недостаточность. В настоящее время более чем у 80 % пациентов удается добиться ремиссии. Прогноз при системных заболеваниях может определяться также поражением других органов (сердечно-сосудистой системы, легких).
Выживаемость почечного трансплантата у больных быстропрогрессирующим гломерулонефритом в течение 1 года достигает 90 %. Риск рецидива заболевания в почечном трансплантате может быть несколько выше при некоторых системных заболеваниях (некротизирующих ANCA-ассоциированных васкулитах, системной красной волчанке).
Перспективы
Эффективность лечения быстропрогрессирующего гломерулонефрита может быть существенно повышена с помощью активно разрабатываемых в настоящее время суперселективных терапевтических стратегий (с использованием антител к трансформирующему фактору роста-b и его рецепторам, блокаторов гремлина), тормозящих почечный фиброгенез, пролиферацию составляющих клубочковые полулуния клеток и, возможно, индуцирующих их контролируемый апоптоз.
Для первичной и вторичной профилактики быстропрогрессирующего гломерулонефрита первоочередное значение приобретает формирование регистров, включающих значительное число пациентов и обеспечивающих возможность длительного наблюдения за ними, благодаря чему можно рассчитывать на выделение достоверных и потенциально устранимых факторов риска.
Глава 4
Злокачественная артериальная гипертензия
Представления о злокачественной артериальной гипертензии начали формироваться еще в первой половине ХХ века во многом благодаря работам F. Volhard и T. Fahr, в которых впервые была четко описана связь стойкого повышения АД с быстро появляющимися признаками поражения органов-мишеней – слепотой, неврологической симптоматикой, нарастающей левожелудочковой сердечной недостаточностью, но особенно – с неуклонным ухудшением фильтрационной функции почек, обусловленным обнаруженным при аутопсии глобальным нефросклерозом, сопровождаемым генерализованным гиалинозом мелких внутрипочечных артерий и артериол («злокачественным нефроангиосклерозом»). В связи с отсутствием в то время эффективных способов лекарственного снижения АД приоритетным направлением в научных исследованиях, посвященных проблеме злокачественной артериальной гипертензии, оставался поиск возможных причин и механизмов ее озлокачествления. Работы Е.М. Тареева, обобщенные в широко известной монографии «Гипертоническая болезнь», наиболее полно охарактеризовали клинические проявления и патогенез злокачественной артериальной гипертензии, в них также были приведены некоторые подходы к ее лечению, сохраняющие актуальность и в настоящее время (например, резкое ограничение потребления поваренной соли). Более того, именно в исследованиях Е.М. Тареева и его учеников акцент в терапевтической тактике впервые был смещен с использования заведомо неэффективных симптоматических средств к применению мер, непосредственно направленных на снижение АД. Например, результатами оригинального клинического анализа была доказана неэффективность использовавшегося при лечении характерной для злокачественной артериальной гипертензии головной боли калия родоната, не влиявшего на тонус сосудов, объем циркулирующей крови и натриевый гомеостаз и, таким образом, не способного оказывать антигипертензивное действие.
Кроме того, в публикациях Е.М. Тареева были заложены основы следующего этапа изучения злокачественной артериальной гипертензии, реализация которого стала возможной только благодаря существенному расширению с начала 1950-х годов возможностей методов обследования. Этот этап характеризуется интенсивной разработкой принципов, позволяющих отличать злокачественный вариант эссенциальной артериальной гипертензии (гипертонической болезни) от вторичной артериальнй гипертензии, также нередко обладающей чертами злокачественности (Г.Г. Арабидзе и соавт.). Одновременно были уточнены детали патогенеза отдельных потенциально злокачественных форм вторичной артериальной гипертензии, в первую очередь нефрогенных (М.А. Пальцев и соавт.).
В настоящее время выяснение возможных причин озлокачествления артериальной гипертензии остается приоритетной задачей при обследовании пациентов, и для ее решения могут быть применены современные визуализирующие и молекулярно-генетические методы. Эволюция представлений о злокачественной артериальной гипертензии, таким образом, всегда была подчинена потребностям оптимизации тактики ведения подобных больных (табл. 4.1).
Таблица 4.1
Этапы изучения злокачественной артериальной гипертензии
 Понятие «злокачественная артериальная гипертензия» может быть интерпретировано как:
Понятие «злокачественная артериальная гипертензия» может быть интерпретировано как:
• вариант эссенциальной артериальной гипертензии (по Е.М. Тарееву, 1948), характеризующийся очень быстрым, часто необратимым, поражением органов-мишеней и в связи с этим – неблагоприятным прогнозом;
• форма вторичной артериальной гипертензии, которая, если ее причину не выявили или не устраняют, приобретает злокачественное течение.
Очевидно, что к признакам озлокачествления артериальной гипертензии не следует относить только непосредственно повышение АД. Быстропрогрессирующее поражение органов-мишеней возможно и тогда, когда рост АД не достигает III степени артериальной гипертензии (> 180/110 мм рт. ст.) по классификации European Society of Hypertension / Российского Медицинского Общества Артериальной Гипертензии. По-видимому, в диагностике злокачественной артериальной гипертензии мало применим «критериальный» подход; ее выявление должно основываться на тщательной оценке динамики клинических, лабораторных и инструментальных показателей, отражающих как состояние центральной и органной гемодинамики, так и степень поражения органов-мишеней (головной мозг, миокард, сосудистая стенка, почки).
Признаками злокачественной артериальной гипертензии следует считать:
• выраженный подъем АД (систоло-диастолическая или изолированная систолическая артериальная гипертензия), > 180/110 мм рт. ст.;
• резистентность к комбинированной антигипертензивной терапии (при злокачественной артериальной гипертензии всегда возникает потребность в повторном парентеральном применении короткодействующих антигипертензивных препаратов);
• быстро прогрессирующее и потенциально фатальное поражение органов-мишеней.
Подъем АД при злокачественной артериальной гипертензии может возникать de novo при исходно нормальном АД, что особенно типично для злокачественного (по Е.М. Тарееву, 1948) варианта эссенциальной артериальной гипертензии. В процессе его формирования в течение первых часов с момента начала роста АД поражение органов-мишеней становится клинически очевидным (например, ухудшение зрения вплоть до полной слепоты, левожелудочковая сердечная недостаточность с отеком легких, гипертоническая энцефалопатия с нарушением сознания и/или острое нарушение мозгового кровообращения, острая почечная недостаточность с олигоанурией). Наибольшую опасность с прогностической точки зрения представляет рост систолического АД (особенно при остающемся нормальным или почти нормальным диастолическом АД), сопровождающийся одновременным увеличением пульсового АД и характеризующийся очень высоким риском органных осложнений, развивающихся за счет повреждения сосудистой стенки, в том числе эндотелиоцитов, и гемодинамического удара, складывающегося из суммирующихся систолической и отраженной пульсовых волн.
Резистентную артериальную гипертензию диагностируют при невозможности снижения АД с использованием сочетания из представителей 3 классов антигипертензивных препаратов в адекватных дозах (обязательно включая диуретик) и немедикаментозных методов лечения. Резистентность к антигипертензивной терапии – обязательный признак злокачественной артериальной гипертензии, хотя резистентная артериальная гипертензия далеко не всегда исходно обладает чертами злокачественной (см. ниже).
При злокачественной артериальной гипертензии клинически ведущим может стать вовлечение одного из органов-мишеней, однако на определенном этапе поражение всегда становится полиорганным (табл. 4.2). Поражение каждого из органов-мишеней при злокачественной артериальной гипертензии является потенциально фатальным.
Таблица 4.2
Органы-мишени и варианты их поражения при злокачественной артериальной гипертензии
 С клинической точки зрения представляется целесообразным выделение 5 аспектов проблемы злокачественной артериальной гипертензии в нефрологической практике:
С клинической точки зрения представляется целесообразным выделение 5 аспектов проблемы злокачественной артериальной гипертензии в нефрологической практике:
• злокачественный вариант эссенциальной артериальной гипертензии как причина почечного поражения;
• злокачественная артериальная гипертензия как маркер активности и/или быстрого прогрессирования почечного поражения при хронических заболеваниях почек;
• злокачественная артериальная гипертензия как признак терминальной почечной недостаточности;
• резистентная артериальная гипертензия, потенциально озлокачествляющаяся;
• злокачественная артериальная гипертензия, обусловленная причинами, непосредственно не связанными с хронической болезнью почек.
Эпидемиология
Считают, что распространенность злокачественного варианта эссенциальной артериальной гипертензии была особенно велика во время Первой и Второй мировых войн и значительно снизилась в 1950—1960-е годы прошлого века. Высокую частоту злокачественной эссенциальной артериальной гипертензии в указанные периоды объясняют в первую очередь продолжительным действием на крупные группы взрослого населения необычного по силе психоэмоционального стресса, а также особенностями питания. Яркий пример последнему – жители блокадного Ленинграда, привычный рацион которых содержал количество поваренной соли, более чем в 10 раз превышавшее общепринятые нормы. В блокадном Ленинграде злокачественная артериальная гипертензия носила как типичный – «кризовый» – характер, так и приводила (при относительно невысоком АД) к тяжелым дистрофическим изменениям в органах-мишенях и их последующему фатальному поражению.
В целом рост заболеваемости злокачественной эссенциальной артериальной гипертензией, отмеченный в первой половине ХХ века, можно связать именно с последствиями Второй мировой войны. Так, по данным Е.М. Тареева (1948), частота возникновения злокачественной эссенциальной артериальной гипертензии, составлявшая в 1936-м году 7,5 %, к 1946-м году увеличилась более чем в три раза.
С другой стороны, отмеченное в последующем снижение заболеваемости злокачественным вариантом эссенциальной артериальной гипертензии в определенной степени связано с расширением возможностей прижизненной диагностики вторичных форм артериальной гипертензии, способных к озлокачествлению. Так, уже в начале 1950-х годов ХХ века из числа случаев злокачественной артериальной гипертензии, исходно интерпретируемой как эссенциальная, стали выделять наблюдения, связанные с атеросклеротическим стенозом почечных артерий. В последующем стало возможным своевременное распознавание феохромоцитомы и катехоламин-продуцирующих опухолей вненадпочечниковой локализации, а также выявление первичного антифосфолипидного синдрома и других тромботических микроангиопатий, среди клинических проявлений которых ведущим оказывается именно синдром злокачественной артериальной гипертензии. Таким образом, ранее стереотипно интерпретируемая как эссенциальная, злокачественная артериальная гипертензия стала «разделяться» на отдельные формы в зависимости от конкретной причины, обусловливающей ее возникновение.
В когортном исследовании, выполнявшемся в течение 12 лет в Амстердаме, были собраны сведения о 122 больных злокачественной эссенциальной артериальной гипертензией, средний возраст которых составлял 44+12 лет. Среди этих пациентов преобладали мужчины (66 %), 47 % больных относились к черной расе, 58 – исходно страдали эссенциальной артериальной гипертензией, в дальнейшем озлокачествившейся, 37 – получали антигипертензивную терапию, а 23 – самостоятельно ее прекратили. Ориентируясь на результаты данного исследования, можно сказать, что заболеваемость злокачественной эссенциальной артериальной гипертензией составляет 2,7+0,9 случаев на 100 000 представителей популяции.
По-видимому, основными эпидемиологическими характеристиками злокачественного варианта эссенциальной артериальной гипертензии следует считать:
• возникновение ее у лиц молодого и среднего возраста (то есть меньшего, чем типичного для дебюта эссенциальной артериальной гипертензии);
• преобладание мужчин среди заболевших;
• большую частоту заболеваемости среди представителей черной расы, особенно афроамериканцев, являющих собой «естественную» модель злокачественного течения эссенциальной артериальной гипертензии, поражения почек и органа зрения.
До конца не определена и истинная распространенность потенциально злокачественной резистентной артериальной гипертензии. Изучение ее эпидемиологии затруднено в первую очередь тем, что далеко не все пациенты исходно получают антигипертензивную терапию, соответствующую общепринятым стандартам. Выявление феномена резистентности артериальной гипертензии, исходя из его формальных критериев, зачастую невозможно и тогда, когда величины АД остаются очень высокими, несмотря на использование сочетания препаратов, которое само по себе (например, назначение b-адреноблокатора и недигидропиридинового антагониста кальция) нередко является необоснованным. Кроме того, до конца не установлены и сроки, которые должны пройти от начала систематического лечения артериальной гипертензии и до того времени, когда можно было бы утверждать, что артериальная гипертензия действительно не уступает комбинации из антигипертензивных препаратов, обязательно включающей диуретик.
J.P. Garg и соавт. (2005) проанализировали базу данных, содержащую информацию о 1281 больном, обратившемся в специализированное отделение артериальных гипертензий в течение 8 лет. Только у 141 пациента (11,0 %) была констатирована истинно резистентная артериальная гипертензия. M.A. Brown и соавт. (2001) среди 611 лиц, направленных на 24-часовой амбулаторный мониторинг АД в связи с отмеченным при амбулаторном наблюдении отсутствием его контроля, выделили группу из 118 больных (19,3 %), страдавших именно резистентной формой артериальной гипертензии. Пациенты с резистентной артериальной гипертензией были старше и отличались достоверно более высоким систолическим (но не диастолическим) АД. У 38 % из них был констатирован феномен «белого халата», более выраженный при измерении АД врачом, а не медицинской сестрой.
Распространенность злокачественной артериальной гипертензии, очевидно, зависит также от особенностей обследуемой группы лиц. Cравнительно редко встречающаяся в настоящее время в популяции злокачественная артериальная гипертензия значительно чаще обнаруживается у пациентов, госпитализированных в отделения нефрологии и/или артериальной гипертензии, особенно у демонстрирующих стойкое снижение СКФ и гиперкреатининемию. Очевидна значительная частота развития злокачественной артериальной гипертензии при некоторых заболеваниях, сопровождающихся тяжелым поражением почек – системной красной волчанке, первичном антифосфолипидном синдроме, системной склеродермии, а также системных васкулитах, например узелковом полиартериите.
Этиология
Этиологические факторы, обусловливающие озлокачествление артериальной гипертензии, разнообразны (табл. 4.3), но попытка их выявления всегда оправдана, так как во многих случаях дает возможность их устранения, направленного если не на нормализацию, то по крайней мере на снижение АД. Среди возможных причин развития злокачественного варианта эссенциальной артериальной гипертензии называют избыточное психоэмоциональное напряжение, травмы и ожоги. Известно, что в короткий срок после начала действия необычного по силе психотравмирующего фактора возможен резкий подъем АД с поражением органов-мишеней. Так, описан случай тяжелого гипертонического криза, сформировавшегося при исходно нормальном АД у молодого врача, работавшего в блокадном Ленинграде и проводившего обход в палате в момент попадания в нее артиллерийского снаряда.
Генетические детерминанты злокачественной эссенциальной гипертензии установить не удается как в силу относительно редкого выявления этой формы болезни, так и в связи с тем, что даже в периоды, когда частота заболеваний возрастала, семейные случаи практически не наблюдались. Тем не менее, у части пациентов приобретение артериальной гипертензией злокачественного течения, в том числе за счет поражения почечного микроциркуляторного русла по типу тромботической микроангиопатии, может быть связано с носительством определенных генетических маркеров. Реализуя свое протромбогенное действие, генетические детерминанты тромбофилий могут непосредственно модулировать формирование почечного артериолосклероза – одной из ключевых составляющих морфогенеза злокачественной артериальной гипертензии. Так, анализ биопсий почки, выполненных в госпитале университета штата Айова (США), выявил, что в группе больных, у которых был констатирован артериолосклероз неустановленного происхождения, не менее 10 % пациентов демонстрировали носительство мутации фактора V (Leiden) или 20210А варианта гена протромбина, а почти 30 % – ТТ-вариант гена метилентетрагидрофолат-редуктазы. Частота обнаружения генетических детерминант первичной тромбофилии у лиц, у которых при морфологическом исследовании ткани почки были выявлены изменения, расцененные как артериолосклероз неясного генеза, оказалась достоверно выше, чем у больных с другими морфологическими вариантами почечного поражения.
Кроме того, в публикациях Е.М. Тареева были заложены основы следующего этапа изучения злокачественной артериальной гипертензии, реализация которого стала возможной только благодаря существенному расширению с начала 1950-х годов возможностей методов обследования. Этот этап характеризуется интенсивной разработкой принципов, позволяющих отличать злокачественный вариант эссенциальной артериальной гипертензии (гипертонической болезни) от вторичной артериальнй гипертензии, также нередко обладающей чертами злокачественности (Г.Г. Арабидзе и соавт.). Одновременно были уточнены детали патогенеза отдельных потенциально злокачественных форм вторичной артериальной гипертензии, в первую очередь нефрогенных (М.А. Пальцев и соавт.).
В настоящее время выяснение возможных причин озлокачествления артериальной гипертензии остается приоритетной задачей при обследовании пациентов, и для ее решения могут быть применены современные визуализирующие и молекулярно-генетические методы. Эволюция представлений о злокачественной артериальной гипертензии, таким образом, всегда была подчинена потребностям оптимизации тактики ведения подобных больных (табл. 4.1).
Таблица 4.1
Этапы изучения злокачественной артериальной гипертензии

• вариант эссенциальной артериальной гипертензии (по Е.М. Тарееву, 1948), характеризующийся очень быстрым, часто необратимым, поражением органов-мишеней и в связи с этим – неблагоприятным прогнозом;
• форма вторичной артериальной гипертензии, которая, если ее причину не выявили или не устраняют, приобретает злокачественное течение.
Очевидно, что к признакам озлокачествления артериальной гипертензии не следует относить только непосредственно повышение АД. Быстропрогрессирующее поражение органов-мишеней возможно и тогда, когда рост АД не достигает III степени артериальной гипертензии (> 180/110 мм рт. ст.) по классификации European Society of Hypertension / Российского Медицинского Общества Артериальной Гипертензии. По-видимому, в диагностике злокачественной артериальной гипертензии мало применим «критериальный» подход; ее выявление должно основываться на тщательной оценке динамики клинических, лабораторных и инструментальных показателей, отражающих как состояние центральной и органной гемодинамики, так и степень поражения органов-мишеней (головной мозг, миокард, сосудистая стенка, почки).
Признаками злокачественной артериальной гипертензии следует считать:
• выраженный подъем АД (систоло-диастолическая или изолированная систолическая артериальная гипертензия), > 180/110 мм рт. ст.;
• резистентность к комбинированной антигипертензивной терапии (при злокачественной артериальной гипертензии всегда возникает потребность в повторном парентеральном применении короткодействующих антигипертензивных препаратов);
• быстро прогрессирующее и потенциально фатальное поражение органов-мишеней.
Подъем АД при злокачественной артериальной гипертензии может возникать de novo при исходно нормальном АД, что особенно типично для злокачественного (по Е.М. Тарееву, 1948) варианта эссенциальной артериальной гипертензии. В процессе его формирования в течение первых часов с момента начала роста АД поражение органов-мишеней становится клинически очевидным (например, ухудшение зрения вплоть до полной слепоты, левожелудочковая сердечная недостаточность с отеком легких, гипертоническая энцефалопатия с нарушением сознания и/или острое нарушение мозгового кровообращения, острая почечная недостаточность с олигоанурией). Наибольшую опасность с прогностической точки зрения представляет рост систолического АД (особенно при остающемся нормальным или почти нормальным диастолическом АД), сопровождающийся одновременным увеличением пульсового АД и характеризующийся очень высоким риском органных осложнений, развивающихся за счет повреждения сосудистой стенки, в том числе эндотелиоцитов, и гемодинамического удара, складывающегося из суммирующихся систолической и отраженной пульсовых волн.
Резистентную артериальную гипертензию диагностируют при невозможности снижения АД с использованием сочетания из представителей 3 классов антигипертензивных препаратов в адекватных дозах (обязательно включая диуретик) и немедикаментозных методов лечения. Резистентность к антигипертензивной терапии – обязательный признак злокачественной артериальной гипертензии, хотя резистентная артериальная гипертензия далеко не всегда исходно обладает чертами злокачественной (см. ниже).
При злокачественной артериальной гипертензии клинически ведущим может стать вовлечение одного из органов-мишеней, однако на определенном этапе поражение всегда становится полиорганным (табл. 4.2). Поражение каждого из органов-мишеней при злокачественной артериальной гипертензии является потенциально фатальным.
Таблица 4.2
Органы-мишени и варианты их поражения при злокачественной артериальной гипертензии

• злокачественный вариант эссенциальной артериальной гипертензии как причина почечного поражения;
• злокачественная артериальная гипертензия как маркер активности и/или быстрого прогрессирования почечного поражения при хронических заболеваниях почек;
• злокачественная артериальная гипертензия как признак терминальной почечной недостаточности;
• резистентная артериальная гипертензия, потенциально озлокачествляющаяся;
• злокачественная артериальная гипертензия, обусловленная причинами, непосредственно не связанными с хронической болезнью почек.
Эпидемиология
Считают, что распространенность злокачественного варианта эссенциальной артериальной гипертензии была особенно велика во время Первой и Второй мировых войн и значительно снизилась в 1950—1960-е годы прошлого века. Высокую частоту злокачественной эссенциальной артериальной гипертензии в указанные периоды объясняют в первую очередь продолжительным действием на крупные группы взрослого населения необычного по силе психоэмоционального стресса, а также особенностями питания. Яркий пример последнему – жители блокадного Ленинграда, привычный рацион которых содержал количество поваренной соли, более чем в 10 раз превышавшее общепринятые нормы. В блокадном Ленинграде злокачественная артериальная гипертензия носила как типичный – «кризовый» – характер, так и приводила (при относительно невысоком АД) к тяжелым дистрофическим изменениям в органах-мишенях и их последующему фатальному поражению.
В целом рост заболеваемости злокачественной эссенциальной артериальной гипертензией, отмеченный в первой половине ХХ века, можно связать именно с последствиями Второй мировой войны. Так, по данным Е.М. Тареева (1948), частота возникновения злокачественной эссенциальной артериальной гипертензии, составлявшая в 1936-м году 7,5 %, к 1946-м году увеличилась более чем в три раза.
С другой стороны, отмеченное в последующем снижение заболеваемости злокачественным вариантом эссенциальной артериальной гипертензии в определенной степени связано с расширением возможностей прижизненной диагностики вторичных форм артериальной гипертензии, способных к озлокачествлению. Так, уже в начале 1950-х годов ХХ века из числа случаев злокачественной артериальной гипертензии, исходно интерпретируемой как эссенциальная, стали выделять наблюдения, связанные с атеросклеротическим стенозом почечных артерий. В последующем стало возможным своевременное распознавание феохромоцитомы и катехоламин-продуцирующих опухолей вненадпочечниковой локализации, а также выявление первичного антифосфолипидного синдрома и других тромботических микроангиопатий, среди клинических проявлений которых ведущим оказывается именно синдром злокачественной артериальной гипертензии. Таким образом, ранее стереотипно интерпретируемая как эссенциальная, злокачественная артериальная гипертензия стала «разделяться» на отдельные формы в зависимости от конкретной причины, обусловливающей ее возникновение.
В когортном исследовании, выполнявшемся в течение 12 лет в Амстердаме, были собраны сведения о 122 больных злокачественной эссенциальной артериальной гипертензией, средний возраст которых составлял 44+12 лет. Среди этих пациентов преобладали мужчины (66 %), 47 % больных относились к черной расе, 58 – исходно страдали эссенциальной артериальной гипертензией, в дальнейшем озлокачествившейся, 37 – получали антигипертензивную терапию, а 23 – самостоятельно ее прекратили. Ориентируясь на результаты данного исследования, можно сказать, что заболеваемость злокачественной эссенциальной артериальной гипертензией составляет 2,7+0,9 случаев на 100 000 представителей популяции.
По-видимому, основными эпидемиологическими характеристиками злокачественного варианта эссенциальной артериальной гипертензии следует считать:
• возникновение ее у лиц молодого и среднего возраста (то есть меньшего, чем типичного для дебюта эссенциальной артериальной гипертензии);
• преобладание мужчин среди заболевших;
• большую частоту заболеваемости среди представителей черной расы, особенно афроамериканцев, являющих собой «естественную» модель злокачественного течения эссенциальной артериальной гипертензии, поражения почек и органа зрения.
До конца не определена и истинная распространенность потенциально злокачественной резистентной артериальной гипертензии. Изучение ее эпидемиологии затруднено в первую очередь тем, что далеко не все пациенты исходно получают антигипертензивную терапию, соответствующую общепринятым стандартам. Выявление феномена резистентности артериальной гипертензии, исходя из его формальных критериев, зачастую невозможно и тогда, когда величины АД остаются очень высокими, несмотря на использование сочетания препаратов, которое само по себе (например, назначение b-адреноблокатора и недигидропиридинового антагониста кальция) нередко является необоснованным. Кроме того, до конца не установлены и сроки, которые должны пройти от начала систематического лечения артериальной гипертензии и до того времени, когда можно было бы утверждать, что артериальная гипертензия действительно не уступает комбинации из антигипертензивных препаратов, обязательно включающей диуретик.
J.P. Garg и соавт. (2005) проанализировали базу данных, содержащую информацию о 1281 больном, обратившемся в специализированное отделение артериальных гипертензий в течение 8 лет. Только у 141 пациента (11,0 %) была констатирована истинно резистентная артериальная гипертензия. M.A. Brown и соавт. (2001) среди 611 лиц, направленных на 24-часовой амбулаторный мониторинг АД в связи с отмеченным при амбулаторном наблюдении отсутствием его контроля, выделили группу из 118 больных (19,3 %), страдавших именно резистентной формой артериальной гипертензии. Пациенты с резистентной артериальной гипертензией были старше и отличались достоверно более высоким систолическим (но не диастолическим) АД. У 38 % из них был констатирован феномен «белого халата», более выраженный при измерении АД врачом, а не медицинской сестрой.
Распространенность злокачественной артериальной гипертензии, очевидно, зависит также от особенностей обследуемой группы лиц. Cравнительно редко встречающаяся в настоящее время в популяции злокачественная артериальная гипертензия значительно чаще обнаруживается у пациентов, госпитализированных в отделения нефрологии и/или артериальной гипертензии, особенно у демонстрирующих стойкое снижение СКФ и гиперкреатининемию. Очевидна значительная частота развития злокачественной артериальной гипертензии при некоторых заболеваниях, сопровождающихся тяжелым поражением почек – системной красной волчанке, первичном антифосфолипидном синдроме, системной склеродермии, а также системных васкулитах, например узелковом полиартериите.
Этиология
Этиологические факторы, обусловливающие озлокачествление артериальной гипертензии, разнообразны (табл. 4.3), но попытка их выявления всегда оправдана, так как во многих случаях дает возможность их устранения, направленного если не на нормализацию, то по крайней мере на снижение АД. Среди возможных причин развития злокачественного варианта эссенциальной артериальной гипертензии называют избыточное психоэмоциональное напряжение, травмы и ожоги. Известно, что в короткий срок после начала действия необычного по силе психотравмирующего фактора возможен резкий подъем АД с поражением органов-мишеней. Так, описан случай тяжелого гипертонического криза, сформировавшегося при исходно нормальном АД у молодого врача, работавшего в блокадном Ленинграде и проводившего обход в палате в момент попадания в нее артиллерийского снаряда.
Генетические детерминанты злокачественной эссенциальной гипертензии установить не удается как в силу относительно редкого выявления этой формы болезни, так и в связи с тем, что даже в периоды, когда частота заболеваний возрастала, семейные случаи практически не наблюдались. Тем не менее, у части пациентов приобретение артериальной гипертензией злокачественного течения, в том числе за счет поражения почечного микроциркуляторного русла по типу тромботической микроангиопатии, может быть связано с носительством определенных генетических маркеров. Реализуя свое протромбогенное действие, генетические детерминанты тромбофилий могут непосредственно модулировать формирование почечного артериолосклероза – одной из ключевых составляющих морфогенеза злокачественной артериальной гипертензии. Так, анализ биопсий почки, выполненных в госпитале университета штата Айова (США), выявил, что в группе больных, у которых был констатирован артериолосклероз неустановленного происхождения, не менее 10 % пациентов демонстрировали носительство мутации фактора V (Leiden) или 20210А варианта гена протромбина, а почти 30 % – ТТ-вариант гена метилентетрагидрофолат-редуктазы. Частота обнаружения генетических детерминант первичной тромбофилии у лиц, у которых при морфологическом исследовании ткани почки были выявлены изменения, расцененные как артериолосклероз неясного генеза, оказалась достоверно выше, чем у больных с другими морфологическими вариантами почечного поражения.
Конец бесплатного ознакомительного фрагмента
