Страница:
При секвенировании простейших организмов, у которых геном относительно невелик, обычно используют процедуру, называемую условно «сверху вниз». Всю ДНК «разрезают» на кусочки с помощью уже упоминавшихся выше ферментов рестриктаз, затем секвенируют эти кусочки по отдельности, а после «склеивают» из них полный геном. «Склеивание» оригинала осуществляется за счет того, что нукле–отидные последовательности разных кусочков перекрываются друг с другом, т. е. одинаковы по концам. Эта методология получила название «дробовика». Суть данной процедуры отражена на рис. 16.
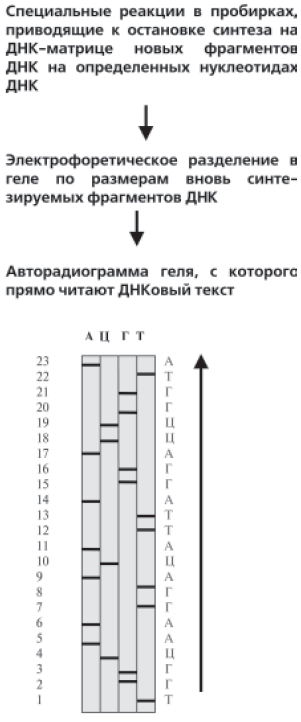
Рис. 15. Схема, поясняющая процесс подготовки и прочтения ДНКового текста
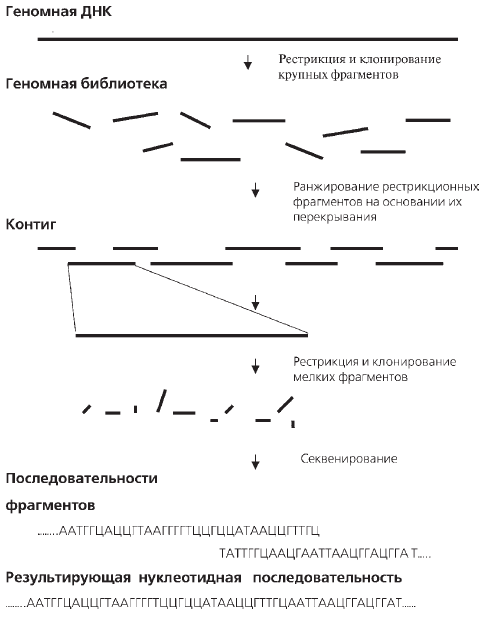
Рис. 16. Схема стратегии «дробовика», используемая для сек–венирования больших молекул ДНК
Однако в случае такого очень сложного генома, как геном человека, начали с другого, а именно с определения положения известных генов и других генетических маркеров на отдельных хромосомах, то есть с генетического картирования генома. Подобную задачу генетическими экспериментами на более простых объектах пытался решить еще Т. Морган, который за свои работы получил Нобелевскую премию в 1933 году. Теперь появились более эффективные методы. Один из них, называемый методом «радиационных гибридов», заключается в следующем. Клетки человека, растущие вне организма в питательной среде, облучают рентгеном, что приводит к гибели клеток в результате разрыва хромосомной ДНК на куски, содержащие от 2,5 до 25 млн. п. н. Но прежде, чем убитые облучением клетки распадутся, их сливают с клетками хомяка, в результате чего в разные клетки хомячка попадают разные наборы фрагментов ДНК человека. Затем «гибридные» клетки размножают в культуре, при этом в них наряду с собственной ДНК реплицируются и фрагменты чужеродной ДНК. Затем определяют состав известных генов и других генетических маркеров в каждой клеточной линии и, статистически обработав полученные данные, выводят наиболее вероятное их взаимное расположение в хромосомах. В качестве генетических маркеров использовали как гены, так и фрагменты ДНК с неизвестной функцией. Для картирования хромосом важным свойством маркеров являлся их полиморфизм, т. е. существование разных форм среди индивидуумов.
Так были построены первые генетические карты генома человека, на которых первоначально были отмечены различные генетические маркеры, отстоящие друг от друга на расстоянии не более 2 миллионов нуклеотидных пар (млн. н. п.).
Затем были составлены физические карты хромосом: первоначально с разрешением 0,1 млн. н. п., а затем 0,001 млн. н. п. Для этой цели на первом этапе применяли методы окрашивания хромосом и гибридизации с хромосомами in situ. И лишь позднее использовали рес–триктазы. С помощью этих удивительно точно работающих ферментов «дробили» ДНК по строго определенным участкам на миллионы перекрывающихся между собой по нуклеотидной последовательности фрагментов, «разбирали» каждый из них по отдельности, после чего из них «склеивали» оригинал. «Склеивание» проводили на основании перекрывания фрагментов по нуклеотидной последовательности. Так постепенно шли все выше и выше. Поэтому данная стратегия получила название «снизу вверх». Со всей очевидностью можно сказать, что решалась грандиозная по масштабам и сложности задача. И решить ее ученые смогли только с помощью суперкомпьютеров. В результате были созданы физические карты разных областей ДНК и целых хромосом, состоящие из последовательно перекрывающихся друг с другом фрагментов. Набор таких «родственных» фрагментов получил название контиг (рис. 16).
А далее наступила очередь секвенирования отдельных рестрик–ционных фрагментов. Это привело в конечном итоге к построению секвенсовых карт, на которых степень разрешения была доведена до своего максимального значения. Если 20 лет назад расшифровка нуклеотидной последовательности ДНК длиной 1000 п. н. считалась большим научным достижением (за это можно было сразу получить степень доктора наук), то уже к 1990 году секвенирование ДНК стало массовой технологией. А сейчас квалифицированный лаборант проделывает такую работу всего за несколько часов.
После появления эффективных методов секвенирования ДНК и нескольких стратегий использования этого метода стал стремительно нарастать вал расшифрованных нуклеотидных последовательностей, в первую очередь таких простых организмов, как вирусы, а также отдельных клонированных фрагментов ДНК различных видов высших организмов. Так, еще в конце 1970–х годов была расшифрована структура первого живого объекта – вируса бактерий – бактериофага, обозначаемого как φΧ 174, имеющего длину 5386 п. н. Затем последовала очередь других.
В конце 80–х гг. были начаты крупные международные проекты, целью которых было полное секвенирование геномов бактерий, грибов, дрожжей, дрозофилы, мыши, пшеницы, человека и др. Первоначально была определена первичная структура ДНК микроорганизмов с размерами генома до 20 млн. п. н., к концу 1998 г. их число составило уже 18 (см. табл. 2). Наименьший размер генома у свободно живущих организмов (например, у бактерии Mycoplasma genitalium) составляет лишь около 600 000 п. н. У этой бактерии содержится всего 500 генов, причем 150 из них (если их удалять по одиночке) никак не влияют на её жизнеспособность. Так возникло предположение, что элементарная «машина жизни» теоретически должна работать при наличии всего лишь 350 генов.
Первые объекты для секвенирования были выбраны неслучайно. Большинство из этих микроорганизмов (архебактерии, спирохеты, хламидобактерии, кишечная палочка, возбудители пневмоний, сифилиса, гемофилии, метанобразующие бактерии, микоплазмы, риккетсии, цианобактерии) способны вызывать различные патологии у человека. В настоящее время многие из этих проектов уже завершены; исследовано свыше 800 полных клеточных геномов микоплазм, архебактерий, кишечной палочки, возбудителей ряда болезней человека, а также пекарских дрожжей, маленького червя–нематоды, дрозофилы и весьма интересного в практическом плане растения арабидопсиса. Весьма вероятно, что истинное число сек–венированных к настоящему времени геномов гораздо больше, потому что многие фармацевтические фирмы засекречивают свои результаты, не публикуя их в открытой печати.
Таблица 2. Некоторые микроорганизмы, геномы которых полностью секвенированы к настоящему времени

ТАЙНА ТАЙН ЗА 6 МИЛЛИАРДОВ ДОЛЛАРОВ
И вот дошла очередь до расшифровки сокровеннейшей тайны человека – ДНКового текста его генома, который некоторые называют Книгой жизни или Энциклопедией человека.
Напомним еще раз, как все это начиналось и происходило. В 1988 году был создан проект «Геном человека» Национального института здоровья США. Главой работ по полному секвенированию генома человека стал нобелевский лауреат Джеймс Уотсон. Одновременно в России с этой же идеей выступил академик А. А. Баев. Государственная программа «Геном человека» была принята в этом же году в Советском Союзе. Позднее к программе подключились другие страны, и широкомасштабные координированные исследования стали проводиться под эгидой международной организации Human Genom Organisation (HUGO). На работу по секвенированию генома человека, осуществленную этим мировым консорциумом, было потрачено в сумме более 3 миллиардов долларов. В России членами этой организации являются сегодня около 80 российских ученых (председатель Российского совета по геному человека – академик Л. Л. Киселев). Из 24–х хромосом генома человека ученые России в основном концентрировались на 3–й, 13–й и 19–й хромосомах. При этом непосредственно секвенированием ДНК они занимались очень мало, основное внимание было обращено на структурно–функциональные исследования генома. В материальном отношении наш вклад был настолько скромен, что сейчас при общих подсчетах его вообще не учитывают.
Первоначально огромный объем предстоящей работы очень пугал многих исследователей. И действительно ситуация на первых этапах не была слишком обнадеживающей. В первые 2 года работы проекта «Геном человека» скорости секвенирования были еще очень низкими. Для полного завершения работы такими темпами потребовалось бы около 100 лет. Это удручало одних исследователей, но не останавливало других. Последним стало очевидно, что решение данной задачи невыполнимо традиционными методами и необходим поиск новых подходов и технологий расшифровки нуклеотид–ных последовательностей фрагментов ДНК, а также создание новой вычислительной техники и оригинальных компьютерных программ. Все это, конечно, было невыполнимо в рамках отдельно взятого государства. По этой причине к проекту были привлечены около 20 различных стран, организован международный банк данных, куда поставлялась вся информация, полученная в процессе решения данной задачи. В результате технических новаций постепенно возрастала производительность аппаратуры, стали использовать промышленные роботы, многие процессы были автоматизированы. И вскоре скорость секвенирования достигла 10 млн. нуклеотидных пар в сутки! Теперь уже выполнение проекта стало реальностью. За 1995 г. длина участков ДНК человека с установленной последовательностью нуклеотидов увеличилась почти в 10 раз, но это составляло еще менее 0,001% от всего генома человека. К началу 1998 г. было секве–нировано всего около 3% генома.
Примерно в это время к работе по секвенированию ДНК человека неожиданно присоединилась частная американская компания из штата Мериленд «Celera Genomics» под руководством Крега Венте–ра, которая объявила, что закончит свою работу на 4 года раньше международного консорциума. Это сильно подхлестнуло всех участников.
Следует отметить, что два конкурирующих коллектива – HUGO и Celera – использовали в своей работе разные подходы к секвени–рованию ДНК. Эту разницу можно сравнить с процессом создания подробной маршрутной карты. Можно описать подробнейшим образом каждую горку, каждую канавку, каждый бугорок. А можно описать весь путь, но при этом отметить только наиболее важные участки. Международный консорциум применил в своей работе традиционный метод, который заключался в том, что «кусочки» молекул ДНК выстраивали друг за другом: сначала делали карты хромосом, а потом по ним «прогуливались». Таким образом, ученые теряли время на подготовке материала, картировании, но выигрывали в секвени–ровании – не нужно было помногу раз делать одно и то же. Руководитель компании «Селера» Крег Вентер предложил ускоренный вариант, так называемый «шрапнельный» метод расшифровки структуры целого генома. Этот метод предусматривает разделение всего генома на небольшие фрагменты ДНК без предварительного их картирования, а затем расшифровку последовательностей с использованием высокопроизводительных автоматов и «сборку» фрагментов в нужном порядке с помощью суперкомпьютера с учетом соответствия перекрывающихся нуклеотидных последовательностей на концах фрагментов. Все это напоминает сборку гигантского неизвестного паззла по отдельным совершенно абстрактным его фрагментам. Метод, конечно, казался очень простым, но при этом одни и те же «кусочки» неизбежно попадали в аппарат–секвенатор по 10, а то и по 20 раз. «Celera», конечно же, теряла на том, что по многу раз сек–венировала одни и те же фрагменты, поскольку до начала их секве–нирования ничего о них не знала. Это казалось многим непроизводительной тратой средств и времени. Но в конечном итоге в результате использования своего подхода «Селера» сильно сэкономила время и деньги на предварительной подготовке материала, так как нужно было только раздробить ДНК на фрагменты и не заниматься трудоемким процессом их предварительного картирования. Кроме того, «Селера» почти с самого начала использовала специальный робот, который способен автоматически расшифровывать ДНК. Этот робот обладал способностью метить разные «буквы» ДНКово–го текста различными флюоресцирующими красками, а затем с помощью лазера считывать последовательности цветов, как последовательность букв. Огромный объем информации обрабатывался с помощью уникального суперкомпьютера. Celera по–латински обозначает «быстрая». И компания оправдала свое название. Еще в 1995–м году на основе предложенного Вентером подхода было осуществлено секвенирование генома бактерии Haemophilus influenzae. А когда «Селера» приступила к секвенированию генома человека, то и здесь добилась большого успеха, быстро встав по числу секвенированных нуклеотидных последовательностей генома человека вровень с международным консорциумом.
Началась беспримерная в науке гонка. Два коллектива работали независимо, не жалея сил, чтобы придти к финишу первыми. Технология все время совершенствовалась. В результате жесткой конкуренции была создана, можно сказать, новая индустрия по секвени–рованию ДНК. В Англии, США, Франции, Германии, Японии появились гигантские автоматизированные фабрики – геномотроны, – секвенирующие по несколько миллионов нуклеотидов в неделю.
И вот произошло долгожданное событие: в декабрьском номере журнала Nature за 1999 год появилась статья под названием «Нукле–отидные последовательности первой хромосомы человека». В этой статье коллектив, состоящий из более чем двухсот авторов, сообщил о полном секвенировании одной из самых малых хромосом человека – хромосомы под номером 22. Выход этой статьи окончательно подтвердил тот факт, что проект «Геном человека» будет выполнен. Произошедшее событие некоторые ученые сравнили с первым взглядом на ландшафт новой планеты.
Между разными участниками гонки, призом в которой была полная последовательность нуклеотидов генома человека, с самого начала возникло еще одно существенное противоречие. Суть его заключалась в том, что Вентер и его компания «Селера» настаивали на праве индивидуального владения всеми данными, полученными при установлении последовательности нуклеотидов, и возможности получать коммерческую выгоду от всех видов использования этих материалов. Руководители международного проекта считали, что результаты расшифровки генома должны быть доступны всем ученым и использоваться ими без всяких ограничений. Спор достиг такого накала, что в это вынуждены были вмешаться даже главы разных правительств. Весной 2000 года президент США Билл Клинтон и британский премьер–министр Тони Блэр выступили с совместным заявлением, в котором поддержали позицию руководителей международного проекта «Геном человека». В конечном итоге консенсус был достигнут, и в июне 2000 года два конкурирующих коллектива – «Celera Genomics» и международный консорциум, – объединив свои данные, официально объявили о том, что их совместными усилиями в целом завершено секвенирование генома человека, создан его черновой вариант.
Проект «Геном человека» оказался одним из наиболее дерзновенных, дорогостоящих и потенциально важных проектов в истории науки. Согласно первоначальным расчетам, работа по расшифровке генома человека должна была окончиться в 2005–м году и стоить в общей сложности 3 миллиарда долларов. Но жизнь внесла свои существенные поправки, и в конечном итоге проект реализовался на 5 лет быстрее, но на его реализацию потребовалось уже примерно 6 миллиардов долларов, т. е. чуть меньше чем по 2 доллара за каждую пару нуклеотидов. Дополнительные 3 миллиарда долларов были добавлены частным капиталом присоединившейся позднее компании Celera Genomics. Научные публикации чернового варианта структуры генома человека появились в феврале 2001 года. Качество секвенирования достаточно высокое и предполагает в среднем наличие только одного ошибочно определенного нуклеотида на протяжении более 50 тыс. п. н.
Итак, на сегодняшний день в основном геном человека секвени–рован, т. е. определен порядок расположения нуклеотидов во всех молекулах ДНК на всех хромосомах. Текст этот огромен. По последним данным он состоит из 3,2 миллиардов «букв». Вся эта информация теперь содержится в сверхмощных компьютерах (книга с этим текстом не издана и едва ли будет издана когда–либо). Вокруг этого события сразу же поднялся невероятный шум и ажиотаж. Но только специалисты понимали до конца и тот огромный успех, который был достигнут в результате реализации первого этапа программы, и сверхтрудность тех задач, которые еще предстоит решить человечеству до достижения конечной цели. Важно понимать, что все произошедшее не означает автоматически, что геном человека расшифрован, что мы можем уже этот текст читать как любую другую книгу без всяких проблем. Секвенирование (определение последовательностей нуклеотидов) не приводит автоматически к пониманию того, что написано (т. е. собственно говоря, к расшифровке). С имеющимся текстом предстоит еще очень долго разбираться, в частности, правильно расставить знаки пунктуации, выверить опечатки и др. Где–то они уже намечены, а где–то еще предстоит их проставить. Расшифровать нуклеотидную последовательность – это все равно, что читать книгу, просто произнося названия букв подряд. Найти ген значит понять, как буквы складываются в слова. Но нужно еще понять и смысл фразы. И это теперь основная проблема. Кроме того, следует еще добавить, что ДНКовый текст написан на «мертвом» языке, в расшифровке которого науке помочь попросту некому – надеяться нужно только на себя. Как воображение кошки во дворце английской королевы не поднялось выше мышки, так, вероятно, обстоит дело и с нашим сегодняшним пониманием генома. Все богатство этой Энциклопедии нам еще предстоит осознать.
У читателя может возникнуть вполне естественный вопрос: геном какого же человека определен в результате этих титанических усилий, кто этот конкретный человек? Четкого ответа пока нет, но ясно, что это не один человек, а, по крайней мере, 7—10 различных людей. Согласно имеющимся данным, фирма Celera в основном ориентировалась на геном одного человека, о котором известно лишь, что это белый мужчина среднего возраста. Скорее всего, это был сам глава корпорации Крег Вентер, хотя другие источники утверждают, что Celera использовала 5 человек (3 мужчин и 2 женщины), относящихся к разным расам – афро–американской, монголоидной и европеоидной. Международный консорциум использовал в своей работе материал не менее семи различных людей. В любом случае каждый из двух соперничавших коллективов брал для анализа ДНК из своего источника. А в результате опубликована усредненная нуклеотид–ная последовательность одного человеческого генома.
На основании полученных данных мы сегодня имеем общую характеристику нуклеотидных последовательностей ДНК, образующих геном человека, которая не будет существенно пересмотрена в дальнейшем. Можно ожидать, что множество деталей еще будет уточняться и меняться, но общая характеристика безусловно останется неизменной. Это сродни догмату папской непогрешимости: Roma locuta res finita est (Рим сказал свое слово, дело окончено).
Теперь вспомним основные этапы, по которым двигалась наука на пути к достижению полного секвенирования генома человека.
ОСНОВНЫЕ ВЕХИ ГЕНЕТИКИ И ГЕНОМИКИ
1865 год
Открытие Г. Менделем (1822—1884) факторов наследственности и разработка гибридологического метода, т. е. правил скрещивания организмов и учета признаков у их потомства.
1868 год
Ф. Мишер из спермы лосося выделил фосфорсодержащее вещество, происходящее из клеточных ядер, которое он назвал нуклеином (теперь его называют дезоксирибонуклеиновой кислотой).
1871 год
Ч. Дарвин публикует свою книгу «Происхождение человека и половой отбор».
1875 год
Ф. Гальтон демонстрирует возможность использования близнецов для изучения относительного влияния на организм наследственности и окружающей среды.
1900 год
Формальное рождение генетики как науки. Независимая публикация статей Г. де Фриза, К. Корренса и Э. Чермака с изложением основных законов наследования. «Переоткрыты» и стали известны широкой научной общественности исследования Г. Менделя.
1902 год
В. Саттон и Т. Бовери независимо создают хромосомную теорию наследственности.
1905 год
У. Бэтсон предлагает слово «генетика» (от греч. γιγνομαι – порождать) для нового направления науки.
1910 год
Т. Г. Морганом установлено, что гены расположены в хромосомах в линейном порядке, образуя группы сцепления. Морган установил также закономерности наследования признаков, сцепленных с полом (Нобелевская премия 1933 г. по физиологии и медицине за экспериментальное обоснование хромосомной теории наследственности).
А. Кёссель получил Нобелевскую премию по химии за установление того, что в состав ДНК входят четыре азотистых основания: аде–нин, гуанин, цитозин и тимин.
1922 год
Н. И. Вавилов сформулировал «закон гомологических рядов» – о параллелизме в изменчивости родственных групп растений, то есть о генетической близости этих групп. Закон Вавилова установил определенные правила формообразования и позволил предсказывать у данного вида еще не открытые, но возможные признаки (аналогия с системой Менделеева).
1925 год
Г. А. Надсон, Г. С. Филиппов, Г. Мюллер проводят первый цикл работ по радиационным методам индукции мутаций.
1926 год
С. С. Четвериков написал статью, заложившую основы популяци–онной генетики и синтеза генетики и теории эволюции.
1927 год
Г. Мюллер доказал мутационный эффект рентгеновских лучей, за что в 1946 г. получил Нобелевскую премию в области физиологии и медицины.
Н. К. Кольцов выдвинул идею матричного синтеза, которая и сегодня отвечает современным представлениям биологов: «В основе каждой хромосомы лежит тончайшая нить, которая представляет собой спиральный ряд огромных органических молекул – генов. Возможно, вся эта спираль является одной гигантской длины молекулой».
1928 год
Открытие явления трансформации у бактерий (Ф. Гриффит).
1929—1930 годы
А. С. Серебровский и Н. П. Дубинин впервые продемонстрировали сложную природу организации гена; первые реальные шаги на пути создания современного представления о тонкой структуре гена.
1931 год
Барбара Мак–Клинток продемонстрировала наличие кроссинго–вера.
1934 год
Н. П. Дубинин и Б. Н. Сидоров открыли особый тип эффекта положения.
Б. Л. Астауров осуществил успешные опыты по получению у шелкопряда потомства из неоплодотворенных яиц (одно из самых интересных достижений в прикладной генетике того времени).
1935 год
Н. В. Тимофеев–Ресовский, К. Г. Циммер, М. Дельбрюк осуществили экспериментальное определение размеров гена. Ими дана трактовка гена с позиций квантовой механики, тем самым был создан фундамент для открытия структуры ДНК.
1940 год
Дж. Бидл и Э. Татум сформулировали теорию «один ген – один фермент». (Нобелевская премия по физиологии и медицине за 1958 г.).
1943 год
И. А. Рапопорт, Ш. Ауэрбах и Дж. Г. Робсон впервые показали индукцию мутаций химическими веществами.
1944 год
О. Эвери, К. Маклеод и М. Маккарти установили, что «веществом гена» служит ДНК. Начало «эры ДНК».
М. Дельбрюк, С. Лурия, А. Херши произвели пионерские исследования по генетике кишечной палочки и ее фагов, после чего эти объекты стали модельными для генетических исследований на многие десятилетия. (Нобелевская премия по физиологии и медицине за 1969 год за открытие цикла репродукции вирусов и развитие генетики бактерий и вирусов).
Л. А. Зильбер сформулировал вирусно–генетическую теорию рака.
1950 год
Э. Чаргафф сформулировал знаменитое «правило Чаргаффа», которое гласит: в ДНК число нуклеотидов А равно числу Т, а число Г – числу Ц.
Б. Мак–Клинток показала существование перемещающихся генетических элементов. С большим опозданием (только в 1983 г.) она получила за это Нобелевскую премию в области физиологии и медицины.
1951 год
Р. Франклин и М. Уилкинсон получили первую рентгеннограмму молекулы ДНК.
1953 год
Ф. Крик и Дж. Уотсон, опираясь на результаты опытов генетиков и биохимиков и на данные рентгеноструктурного анализа, создали структурную модель ДНК в форме двойной спирали. В 1962 году им совместно с М. X. Ф. Уилкинсом присуждена Нобелевская премия по физиологии и медицине.
1956 год
Ю. Тио и A. Леван установили, что диплоидный набор хромосом у человека равен 46.
А. Корнберн обнаружил первый фермент, способный синтезировать ДНК в пробирке – ДНК–полимеразу I. В 1959 году он совместно с С. Очоа получил Нобелевскую премию по физиологии и медицине за исследование механизма биологического синтеза РНК и ДНК.
1958 год
М. Мезельсон и Ф. Сталь доказали полуконсервативный механизм репликации ДНК.

Рис. 15. Схема, поясняющая процесс подготовки и прочтения ДНКового текста

Рис. 16. Схема стратегии «дробовика», используемая для сек–венирования больших молекул ДНК
Однако в случае такого очень сложного генома, как геном человека, начали с другого, а именно с определения положения известных генов и других генетических маркеров на отдельных хромосомах, то есть с генетического картирования генома. Подобную задачу генетическими экспериментами на более простых объектах пытался решить еще Т. Морган, который за свои работы получил Нобелевскую премию в 1933 году. Теперь появились более эффективные методы. Один из них, называемый методом «радиационных гибридов», заключается в следующем. Клетки человека, растущие вне организма в питательной среде, облучают рентгеном, что приводит к гибели клеток в результате разрыва хромосомной ДНК на куски, содержащие от 2,5 до 25 млн. п. н. Но прежде, чем убитые облучением клетки распадутся, их сливают с клетками хомяка, в результате чего в разные клетки хомячка попадают разные наборы фрагментов ДНК человека. Затем «гибридные» клетки размножают в культуре, при этом в них наряду с собственной ДНК реплицируются и фрагменты чужеродной ДНК. Затем определяют состав известных генов и других генетических маркеров в каждой клеточной линии и, статистически обработав полученные данные, выводят наиболее вероятное их взаимное расположение в хромосомах. В качестве генетических маркеров использовали как гены, так и фрагменты ДНК с неизвестной функцией. Для картирования хромосом важным свойством маркеров являлся их полиморфизм, т. е. существование разных форм среди индивидуумов.
Так были построены первые генетические карты генома человека, на которых первоначально были отмечены различные генетические маркеры, отстоящие друг от друга на расстоянии не более 2 миллионов нуклеотидных пар (млн. н. п.).
Затем были составлены физические карты хромосом: первоначально с разрешением 0,1 млн. н. п., а затем 0,001 млн. н. п. Для этой цели на первом этапе применяли методы окрашивания хромосом и гибридизации с хромосомами in situ. И лишь позднее использовали рес–триктазы. С помощью этих удивительно точно работающих ферментов «дробили» ДНК по строго определенным участкам на миллионы перекрывающихся между собой по нуклеотидной последовательности фрагментов, «разбирали» каждый из них по отдельности, после чего из них «склеивали» оригинал. «Склеивание» проводили на основании перекрывания фрагментов по нуклеотидной последовательности. Так постепенно шли все выше и выше. Поэтому данная стратегия получила название «снизу вверх». Со всей очевидностью можно сказать, что решалась грандиозная по масштабам и сложности задача. И решить ее ученые смогли только с помощью суперкомпьютеров. В результате были созданы физические карты разных областей ДНК и целых хромосом, состоящие из последовательно перекрывающихся друг с другом фрагментов. Набор таких «родственных» фрагментов получил название контиг (рис. 16).
А далее наступила очередь секвенирования отдельных рестрик–ционных фрагментов. Это привело в конечном итоге к построению секвенсовых карт, на которых степень разрешения была доведена до своего максимального значения. Если 20 лет назад расшифровка нуклеотидной последовательности ДНК длиной 1000 п. н. считалась большим научным достижением (за это можно было сразу получить степень доктора наук), то уже к 1990 году секвенирование ДНК стало массовой технологией. А сейчас квалифицированный лаборант проделывает такую работу всего за несколько часов.
После появления эффективных методов секвенирования ДНК и нескольких стратегий использования этого метода стал стремительно нарастать вал расшифрованных нуклеотидных последовательностей, в первую очередь таких простых организмов, как вирусы, а также отдельных клонированных фрагментов ДНК различных видов высших организмов. Так, еще в конце 1970–х годов была расшифрована структура первого живого объекта – вируса бактерий – бактериофага, обозначаемого как φΧ 174, имеющего длину 5386 п. н. Затем последовала очередь других.
В конце 80–х гг. были начаты крупные международные проекты, целью которых было полное секвенирование геномов бактерий, грибов, дрожжей, дрозофилы, мыши, пшеницы, человека и др. Первоначально была определена первичная структура ДНК микроорганизмов с размерами генома до 20 млн. п. н., к концу 1998 г. их число составило уже 18 (см. табл. 2). Наименьший размер генома у свободно живущих организмов (например, у бактерии Mycoplasma genitalium) составляет лишь около 600 000 п. н. У этой бактерии содержится всего 500 генов, причем 150 из них (если их удалять по одиночке) никак не влияют на её жизнеспособность. Так возникло предположение, что элементарная «машина жизни» теоретически должна работать при наличии всего лишь 350 генов.
Первые объекты для секвенирования были выбраны неслучайно. Большинство из этих микроорганизмов (архебактерии, спирохеты, хламидобактерии, кишечная палочка, возбудители пневмоний, сифилиса, гемофилии, метанобразующие бактерии, микоплазмы, риккетсии, цианобактерии) способны вызывать различные патологии у человека. В настоящее время многие из этих проектов уже завершены; исследовано свыше 800 полных клеточных геномов микоплазм, архебактерий, кишечной палочки, возбудителей ряда болезней человека, а также пекарских дрожжей, маленького червя–нематоды, дрозофилы и весьма интересного в практическом плане растения арабидопсиса. Весьма вероятно, что истинное число сек–венированных к настоящему времени геномов гораздо больше, потому что многие фармацевтические фирмы засекречивают свои результаты, не публикуя их в открытой печати.
Таблица 2. Некоторые микроорганизмы, геномы которых полностью секвенированы к настоящему времени

ТАЙНА ТАЙН ЗА 6 МИЛЛИАРДОВ ДОЛЛАРОВ
Лучше изучить лишнее, чем ничего не изучить.
Сенека Старший
Кто хочет много знать,
тому надо мало спать.
Русская пословица
И вот дошла очередь до расшифровки сокровеннейшей тайны человека – ДНКового текста его генома, который некоторые называют Книгой жизни или Энциклопедией человека.
Напомним еще раз, как все это начиналось и происходило. В 1988 году был создан проект «Геном человека» Национального института здоровья США. Главой работ по полному секвенированию генома человека стал нобелевский лауреат Джеймс Уотсон. Одновременно в России с этой же идеей выступил академик А. А. Баев. Государственная программа «Геном человека» была принята в этом же году в Советском Союзе. Позднее к программе подключились другие страны, и широкомасштабные координированные исследования стали проводиться под эгидой международной организации Human Genom Organisation (HUGO). На работу по секвенированию генома человека, осуществленную этим мировым консорциумом, было потрачено в сумме более 3 миллиардов долларов. В России членами этой организации являются сегодня около 80 российских ученых (председатель Российского совета по геному человека – академик Л. Л. Киселев). Из 24–х хромосом генома человека ученые России в основном концентрировались на 3–й, 13–й и 19–й хромосомах. При этом непосредственно секвенированием ДНК они занимались очень мало, основное внимание было обращено на структурно–функциональные исследования генома. В материальном отношении наш вклад был настолько скромен, что сейчас при общих подсчетах его вообще не учитывают.
Первоначально огромный объем предстоящей работы очень пугал многих исследователей. И действительно ситуация на первых этапах не была слишком обнадеживающей. В первые 2 года работы проекта «Геном человека» скорости секвенирования были еще очень низкими. Для полного завершения работы такими темпами потребовалось бы около 100 лет. Это удручало одних исследователей, но не останавливало других. Последним стало очевидно, что решение данной задачи невыполнимо традиционными методами и необходим поиск новых подходов и технологий расшифровки нуклеотид–ных последовательностей фрагментов ДНК, а также создание новой вычислительной техники и оригинальных компьютерных программ. Все это, конечно, было невыполнимо в рамках отдельно взятого государства. По этой причине к проекту были привлечены около 20 различных стран, организован международный банк данных, куда поставлялась вся информация, полученная в процессе решения данной задачи. В результате технических новаций постепенно возрастала производительность аппаратуры, стали использовать промышленные роботы, многие процессы были автоматизированы. И вскоре скорость секвенирования достигла 10 млн. нуклеотидных пар в сутки! Теперь уже выполнение проекта стало реальностью. За 1995 г. длина участков ДНК человека с установленной последовательностью нуклеотидов увеличилась почти в 10 раз, но это составляло еще менее 0,001% от всего генома человека. К началу 1998 г. было секве–нировано всего около 3% генома.
Примерно в это время к работе по секвенированию ДНК человека неожиданно присоединилась частная американская компания из штата Мериленд «Celera Genomics» под руководством Крега Венте–ра, которая объявила, что закончит свою работу на 4 года раньше международного консорциума. Это сильно подхлестнуло всех участников.
Следует отметить, что два конкурирующих коллектива – HUGO и Celera – использовали в своей работе разные подходы к секвени–рованию ДНК. Эту разницу можно сравнить с процессом создания подробной маршрутной карты. Можно описать подробнейшим образом каждую горку, каждую канавку, каждый бугорок. А можно описать весь путь, но при этом отметить только наиболее важные участки. Международный консорциум применил в своей работе традиционный метод, который заключался в том, что «кусочки» молекул ДНК выстраивали друг за другом: сначала делали карты хромосом, а потом по ним «прогуливались». Таким образом, ученые теряли время на подготовке материала, картировании, но выигрывали в секвени–ровании – не нужно было помногу раз делать одно и то же. Руководитель компании «Селера» Крег Вентер предложил ускоренный вариант, так называемый «шрапнельный» метод расшифровки структуры целого генома. Этот метод предусматривает разделение всего генома на небольшие фрагменты ДНК без предварительного их картирования, а затем расшифровку последовательностей с использованием высокопроизводительных автоматов и «сборку» фрагментов в нужном порядке с помощью суперкомпьютера с учетом соответствия перекрывающихся нуклеотидных последовательностей на концах фрагментов. Все это напоминает сборку гигантского неизвестного паззла по отдельным совершенно абстрактным его фрагментам. Метод, конечно, казался очень простым, но при этом одни и те же «кусочки» неизбежно попадали в аппарат–секвенатор по 10, а то и по 20 раз. «Celera», конечно же, теряла на том, что по многу раз сек–венировала одни и те же фрагменты, поскольку до начала их секве–нирования ничего о них не знала. Это казалось многим непроизводительной тратой средств и времени. Но в конечном итоге в результате использования своего подхода «Селера» сильно сэкономила время и деньги на предварительной подготовке материала, так как нужно было только раздробить ДНК на фрагменты и не заниматься трудоемким процессом их предварительного картирования. Кроме того, «Селера» почти с самого начала использовала специальный робот, который способен автоматически расшифровывать ДНК. Этот робот обладал способностью метить разные «буквы» ДНКово–го текста различными флюоресцирующими красками, а затем с помощью лазера считывать последовательности цветов, как последовательность букв. Огромный объем информации обрабатывался с помощью уникального суперкомпьютера. Celera по–латински обозначает «быстрая». И компания оправдала свое название. Еще в 1995–м году на основе предложенного Вентером подхода было осуществлено секвенирование генома бактерии Haemophilus influenzae. А когда «Селера» приступила к секвенированию генома человека, то и здесь добилась большого успеха, быстро встав по числу секвенированных нуклеотидных последовательностей генома человека вровень с международным консорциумом.
Началась беспримерная в науке гонка. Два коллектива работали независимо, не жалея сил, чтобы придти к финишу первыми. Технология все время совершенствовалась. В результате жесткой конкуренции была создана, можно сказать, новая индустрия по секвени–рованию ДНК. В Англии, США, Франции, Германии, Японии появились гигантские автоматизированные фабрики – геномотроны, – секвенирующие по несколько миллионов нуклеотидов в неделю.
И вот произошло долгожданное событие: в декабрьском номере журнала Nature за 1999 год появилась статья под названием «Нукле–отидные последовательности первой хромосомы человека». В этой статье коллектив, состоящий из более чем двухсот авторов, сообщил о полном секвенировании одной из самых малых хромосом человека – хромосомы под номером 22. Выход этой статьи окончательно подтвердил тот факт, что проект «Геном человека» будет выполнен. Произошедшее событие некоторые ученые сравнили с первым взглядом на ландшафт новой планеты.
Между разными участниками гонки, призом в которой была полная последовательность нуклеотидов генома человека, с самого начала возникло еще одно существенное противоречие. Суть его заключалась в том, что Вентер и его компания «Селера» настаивали на праве индивидуального владения всеми данными, полученными при установлении последовательности нуклеотидов, и возможности получать коммерческую выгоду от всех видов использования этих материалов. Руководители международного проекта считали, что результаты расшифровки генома должны быть доступны всем ученым и использоваться ими без всяких ограничений. Спор достиг такого накала, что в это вынуждены были вмешаться даже главы разных правительств. Весной 2000 года президент США Билл Клинтон и британский премьер–министр Тони Блэр выступили с совместным заявлением, в котором поддержали позицию руководителей международного проекта «Геном человека». В конечном итоге консенсус был достигнут, и в июне 2000 года два конкурирующих коллектива – «Celera Genomics» и международный консорциум, – объединив свои данные, официально объявили о том, что их совместными усилиями в целом завершено секвенирование генома человека, создан его черновой вариант.
Проект «Геном человека» оказался одним из наиболее дерзновенных, дорогостоящих и потенциально важных проектов в истории науки. Согласно первоначальным расчетам, работа по расшифровке генома человека должна была окончиться в 2005–м году и стоить в общей сложности 3 миллиарда долларов. Но жизнь внесла свои существенные поправки, и в конечном итоге проект реализовался на 5 лет быстрее, но на его реализацию потребовалось уже примерно 6 миллиардов долларов, т. е. чуть меньше чем по 2 доллара за каждую пару нуклеотидов. Дополнительные 3 миллиарда долларов были добавлены частным капиталом присоединившейся позднее компании Celera Genomics. Научные публикации чернового варианта структуры генома человека появились в феврале 2001 года. Качество секвенирования достаточно высокое и предполагает в среднем наличие только одного ошибочно определенного нуклеотида на протяжении более 50 тыс. п. н.
Итак, на сегодняшний день в основном геном человека секвени–рован, т. е. определен порядок расположения нуклеотидов во всех молекулах ДНК на всех хромосомах. Текст этот огромен. По последним данным он состоит из 3,2 миллиардов «букв». Вся эта информация теперь содержится в сверхмощных компьютерах (книга с этим текстом не издана и едва ли будет издана когда–либо). Вокруг этого события сразу же поднялся невероятный шум и ажиотаж. Но только специалисты понимали до конца и тот огромный успех, который был достигнут в результате реализации первого этапа программы, и сверхтрудность тех задач, которые еще предстоит решить человечеству до достижения конечной цели. Важно понимать, что все произошедшее не означает автоматически, что геном человека расшифрован, что мы можем уже этот текст читать как любую другую книгу без всяких проблем. Секвенирование (определение последовательностей нуклеотидов) не приводит автоматически к пониманию того, что написано (т. е. собственно говоря, к расшифровке). С имеющимся текстом предстоит еще очень долго разбираться, в частности, правильно расставить знаки пунктуации, выверить опечатки и др. Где–то они уже намечены, а где–то еще предстоит их проставить. Расшифровать нуклеотидную последовательность – это все равно, что читать книгу, просто произнося названия букв подряд. Найти ген значит понять, как буквы складываются в слова. Но нужно еще понять и смысл фразы. И это теперь основная проблема. Кроме того, следует еще добавить, что ДНКовый текст написан на «мертвом» языке, в расшифровке которого науке помочь попросту некому – надеяться нужно только на себя. Как воображение кошки во дворце английской королевы не поднялось выше мышки, так, вероятно, обстоит дело и с нашим сегодняшним пониманием генома. Все богатство этой Энциклопедии нам еще предстоит осознать.
У читателя может возникнуть вполне естественный вопрос: геном какого же человека определен в результате этих титанических усилий, кто этот конкретный человек? Четкого ответа пока нет, но ясно, что это не один человек, а, по крайней мере, 7—10 различных людей. Согласно имеющимся данным, фирма Celera в основном ориентировалась на геном одного человека, о котором известно лишь, что это белый мужчина среднего возраста. Скорее всего, это был сам глава корпорации Крег Вентер, хотя другие источники утверждают, что Celera использовала 5 человек (3 мужчин и 2 женщины), относящихся к разным расам – афро–американской, монголоидной и европеоидной. Международный консорциум использовал в своей работе материал не менее семи различных людей. В любом случае каждый из двух соперничавших коллективов брал для анализа ДНК из своего источника. А в результате опубликована усредненная нуклеотид–ная последовательность одного человеческого генома.
На основании полученных данных мы сегодня имеем общую характеристику нуклеотидных последовательностей ДНК, образующих геном человека, которая не будет существенно пересмотрена в дальнейшем. Можно ожидать, что множество деталей еще будет уточняться и меняться, но общая характеристика безусловно останется неизменной. Это сродни догмату папской непогрешимости: Roma locuta res finita est (Рим сказал свое слово, дело окончено).
Теперь вспомним основные этапы, по которым двигалась наука на пути к достижению полного секвенирования генома человека.
ОСНОВНЫЕ ВЕХИ ГЕНЕТИКИ И ГЕНОМИКИ
Inventas vitamjuvat excoluisse per artes.
Изобретения улучшают жизнь, искусство украшает ее.
Надпись на нобелевской медали, фраза из «Энеиды» Вергилия
1865 год
Открытие Г. Менделем (1822—1884) факторов наследственности и разработка гибридологического метода, т. е. правил скрещивания организмов и учета признаков у их потомства.
1868 год
Ф. Мишер из спермы лосося выделил фосфорсодержащее вещество, происходящее из клеточных ядер, которое он назвал нуклеином (теперь его называют дезоксирибонуклеиновой кислотой).
1871 год
Ч. Дарвин публикует свою книгу «Происхождение человека и половой отбор».
1875 год
Ф. Гальтон демонстрирует возможность использования близнецов для изучения относительного влияния на организм наследственности и окружающей среды.
1900 год
Формальное рождение генетики как науки. Независимая публикация статей Г. де Фриза, К. Корренса и Э. Чермака с изложением основных законов наследования. «Переоткрыты» и стали известны широкой научной общественности исследования Г. Менделя.
1902 год
В. Саттон и Т. Бовери независимо создают хромосомную теорию наследственности.
1905 год
У. Бэтсон предлагает слово «генетика» (от греч. γιγνομαι – порождать) для нового направления науки.
1910 год
Т. Г. Морганом установлено, что гены расположены в хромосомах в линейном порядке, образуя группы сцепления. Морган установил также закономерности наследования признаков, сцепленных с полом (Нобелевская премия 1933 г. по физиологии и медицине за экспериментальное обоснование хромосомной теории наследственности).
А. Кёссель получил Нобелевскую премию по химии за установление того, что в состав ДНК входят четыре азотистых основания: аде–нин, гуанин, цитозин и тимин.
1922 год
Н. И. Вавилов сформулировал «закон гомологических рядов» – о параллелизме в изменчивости родственных групп растений, то есть о генетической близости этих групп. Закон Вавилова установил определенные правила формообразования и позволил предсказывать у данного вида еще не открытые, но возможные признаки (аналогия с системой Менделеева).
1925 год
Г. А. Надсон, Г. С. Филиппов, Г. Мюллер проводят первый цикл работ по радиационным методам индукции мутаций.
1926 год
С. С. Четвериков написал статью, заложившую основы популяци–онной генетики и синтеза генетики и теории эволюции.
1927 год
Г. Мюллер доказал мутационный эффект рентгеновских лучей, за что в 1946 г. получил Нобелевскую премию в области физиологии и медицины.
Н. К. Кольцов выдвинул идею матричного синтеза, которая и сегодня отвечает современным представлениям биологов: «В основе каждой хромосомы лежит тончайшая нить, которая представляет собой спиральный ряд огромных органических молекул – генов. Возможно, вся эта спираль является одной гигантской длины молекулой».
1928 год
Открытие явления трансформации у бактерий (Ф. Гриффит).
1929—1930 годы
А. С. Серебровский и Н. П. Дубинин впервые продемонстрировали сложную природу организации гена; первые реальные шаги на пути создания современного представления о тонкой структуре гена.
1931 год
Барбара Мак–Клинток продемонстрировала наличие кроссинго–вера.
1934 год
Н. П. Дубинин и Б. Н. Сидоров открыли особый тип эффекта положения.
Б. Л. Астауров осуществил успешные опыты по получению у шелкопряда потомства из неоплодотворенных яиц (одно из самых интересных достижений в прикладной генетике того времени).
1935 год
Н. В. Тимофеев–Ресовский, К. Г. Циммер, М. Дельбрюк осуществили экспериментальное определение размеров гена. Ими дана трактовка гена с позиций квантовой механики, тем самым был создан фундамент для открытия структуры ДНК.
1940 год
Дж. Бидл и Э. Татум сформулировали теорию «один ген – один фермент». (Нобелевская премия по физиологии и медицине за 1958 г.).
1943 год
И. А. Рапопорт, Ш. Ауэрбах и Дж. Г. Робсон впервые показали индукцию мутаций химическими веществами.
1944 год
О. Эвери, К. Маклеод и М. Маккарти установили, что «веществом гена» служит ДНК. Начало «эры ДНК».
М. Дельбрюк, С. Лурия, А. Херши произвели пионерские исследования по генетике кишечной палочки и ее фагов, после чего эти объекты стали модельными для генетических исследований на многие десятилетия. (Нобелевская премия по физиологии и медицине за 1969 год за открытие цикла репродукции вирусов и развитие генетики бактерий и вирусов).
Л. А. Зильбер сформулировал вирусно–генетическую теорию рака.
1950 год
Э. Чаргафф сформулировал знаменитое «правило Чаргаффа», которое гласит: в ДНК число нуклеотидов А равно числу Т, а число Г – числу Ц.
Б. Мак–Клинток показала существование перемещающихся генетических элементов. С большим опозданием (только в 1983 г.) она получила за это Нобелевскую премию в области физиологии и медицины.
1951 год
Р. Франклин и М. Уилкинсон получили первую рентгеннограмму молекулы ДНК.
1953 год
Ф. Крик и Дж. Уотсон, опираясь на результаты опытов генетиков и биохимиков и на данные рентгеноструктурного анализа, создали структурную модель ДНК в форме двойной спирали. В 1962 году им совместно с М. X. Ф. Уилкинсом присуждена Нобелевская премия по физиологии и медицине.
1956 год
Ю. Тио и A. Леван установили, что диплоидный набор хромосом у человека равен 46.
А. Корнберн обнаружил первый фермент, способный синтезировать ДНК в пробирке – ДНК–полимеразу I. В 1959 году он совместно с С. Очоа получил Нобелевскую премию по физиологии и медицине за исследование механизма биологического синтеза РНК и ДНК.
1958 год
М. Мезельсон и Ф. Сталь доказали полуконсервативный механизм репликации ДНК.
