Страница:
Важное значение имеют клинический и серологический контроль за донорами крови, применение шприцов разового использования и др.
Наряду с внутриутробным инфицированием заражение детей может произойти в семьях высокого риска (больные СПИДом, наркоманы, работники секс-бизнеса).
В конечном итоге следует учитывать, что при работе с инфицированными детьми заражение возможно в основном только при попадании крови этих детей (порезы, ушибы, укусы и др.) на поврежденную кожу, слизистые. Следовательно, при таких ситуациях обработку необходимо осуществлять в перчатках одноразового применения, а использованный перевязочный материал соответственным образом обрабатывать и ликвидировать.
Активная профилактика находится в стадии разработки. Ожидается, что в ближайшие 5-10 лет будут получены эффективные и безвредные вакцины против ВИЧ-инфекции. Однако высокая степень изменчивости вируса иммунодефицита вносит большие сомнения в эти оптимистические ожидания.
В итоге назначение современных препаратов ВИЧ-инфицированной беременной и в усиленном режиме – в родах, а также ребенку в первые дни жизни позволяет снизить риск передачи ВИЧ с 25–50 до 0,5 % (И. Шамов). Благодаря этим средствам в середине 90-х годов XX столетия удалось снизить темпы распространения ВИЧ-инфекции в Европейском регионе и Северной Америке, так как они обеспечивают и определенный противоэпидемический эффект.
Предлагается наряду с антивирусной терапией проводить кесарево сечение при ВИЧ-инфицированности, чтобы исключить возможность заражения плода при его прохождении через родовые пути.
Грудное вскармливание все же рискованно, особенно если заражение женщины произошло после родов. По последним данным, немало детей, родившихся от ВИЧ-инфицированных матерей, оказываются свободными от заражения. Однако после рождения в их крови могут содержаться материнские тела против ВИЧ. С другой стороны, иногда у ВИЧ-инфицированной матери могут и отсутствовать антитела – в зависимости от сроков ее заражения, а следовательно, они могут отсутствовать и у ее ребенка.
Таким образом, в том и другом случае необходимо повторное обследование малыша. Его следует проводить в 6 месяцев, когда материнские антитела уже отсутствуют. С другой стороны, к этому сроку, а иногда и позже, если все же заражение ребенка состоялось, могут появиться «собственные» антитела. Поэтому для окончательного решения вопроса об инфицированности обследование необходимо провести в годовалом возрасте и далее – в 1 год 6 месяцев.
В конечном итоге дети, не зараженные от ВИЧ-инфицированных матерей, снимаются с диспансерного учета только в 3 года.
Сразу после рождения такие дети оказываются в инфекционной больнице, в структуре которой находится центр по профилактике и борьбе со СПИДом. Однако их годичное пребывание в этих условиях невозможно. Вопросы дальнейшего пребывания таких детей в подобных центрах сейчас активно обсуждаются медицинской общественностью. Возникают предложения о создании для «отказных» инфицированных детей специализированных учреждений типа домов ребенка.
Вместе с тем пребывание ребенка в подобном учреждении является нарушением его прав по сохранению врачебной тайны о его заболевании, это записано в федеральном законе «О предупреждении распространения в Российской Федерации ВИЧ-инфекции».
Таким образом, эти дети с первых месяцев жизни оказываются в доме ребенка, и наряду с другими проблемами приходится решать вопрос и по их активной специфической защите от других инфекций, т. е. о вакцинопрофилактике.
Причем в подобной защите ВИЧ-инфицированные дети крайне нуждаются с учетом их особой восприимчивости из-за снижения иммунологических возможностей. Поэтому именно эти дети должны получить прививки против HIВ-инфекции (после 6 месяцев), менингита, гепатита А и особенно против пневмококковой инфекции (в 2 года), так как пневмококк – самый частый возбудитель осложнений и обострений у ВИЧ-инфицированных детей.
Что касается обязательных, т. е. календарных, вакцин, то здесь установки следующие:
• вакцину против гепатита В должны получать все дети по утвержденной схеме;
• ADC как «неживая» вакцина вместе с полиомиелитной инактивированной (ИПВ) вводится в принятые сроки на первом году, когда диагноз инфицированности еще неясен. Наблюдения свидетельствуют, что и AKDC также в соответствующие сроки может вводиться, с предварительным назначением (за 1–2 недели) поливитаминов;
• против кори, краснухи, паротита, как известно, применяются «живые» вакцины с годовалого возраста, когда уже имеется ясность в отношении ВИЧ-инфицированности. К последней группе вакцин отношение неоднозначное. С одной стороны, из-за разрушения иммунной системы при ВИЧ возможны тяжелые реакции на эти («живые») вакцины, с другой – заражение корью, причем летальность у этих детей – 100 %. Очевидно, следует руководствоваться эпидемиологической обстановкой по кори в регионе. Так, в Москве она весьма неустойчивая, что позволяет идти на эту рискованную вакцинацию.
Эта «живая» вакцина, представленная ослабленным возбудителем туберкулеза рогатого скота (М. Bovis), позволяет снизить заболеваемость у детей в 10–15 раз, поэтому всем здоровым новорожденным на 3-7-й день жизни вводится эта вакцина. Однако дети, рожденные от ВИЧ-инфицированных матерей, не прививаются в роддоме. Связано это с тем, что ВИЧ разрушает популяцию СБ4-лимфоцитов, которая играет ключевую роль в формировании противотуберкулезного иммунитета, поэтому введение даже ослабленного туберкулезного возбудителя вызывает тяжелые последствия у этих детей. Так, описаны отдельные случаи диссеминированной БЦЖ-инфекции, когда сведения о ВИЧ-инфицированности были получены после введения вакцины. Поэтому все дети, рожденные от ВИЧ-инфицированных матерей, не прививаются на протяжении первых 1,5 лет жизни. В дальнейшем ВИЧ-инфицированным детям эта вакцинация не проводится.
Что касается другой группы детей, у которых заражение не произошло, то решение зависит от обстановки и условий проживания. Так, если в окружении сохраняется опасность ВИЧ-инфицирования, вакцинация не проводится и в последующие периоды жизни ребенка. При устранении этой опасности прививки БЦЖ проводятся при неблагополучной эпидемиологической ситуации по туберкулезу.
ГЛАВА 3. Антибактериальная терапия в условиях интернатного учреждения
Вопросы рациональной антибиотикотерапии в интернатных условиях
Наряду с внутриутробным инфицированием заражение детей может произойти в семьях высокого риска (больные СПИДом, наркоманы, работники секс-бизнеса).
В конечном итоге следует учитывать, что при работе с инфицированными детьми заражение возможно в основном только при попадании крови этих детей (порезы, ушибы, укусы и др.) на поврежденную кожу, слизистые. Следовательно, при таких ситуациях обработку необходимо осуществлять в перчатках одноразового применения, а использованный перевязочный материал соответственным образом обрабатывать и ликвидировать.
Активная профилактика находится в стадии разработки. Ожидается, что в ближайшие 5-10 лет будут получены эффективные и безвредные вакцины против ВИЧ-инфекции. Однако высокая степень изменчивости вируса иммунодефицита вносит большие сомнения в эти оптимистические ожидания.
Беременность и ВИЧ
С каждым годом сокращается разница в частоте инфицированности ВИЧ между мужчинами и женщинами. Так, если в 1982 г. это соотношение составляло 15:1, то в 1990-м – 9:1, в 1995-м – 4:1. На первых этапах этого процесса заражение чаще всего происходило через инъекционные наркотики, в настоящее время резко возрастает процент половой передачи. Естественно, что наибольшая часть инфицированных женщин – это женщины детородного возраста, поэтому растет число детей, рожденных от ВИЧ-инфицированных матерей. Так, в 2000 г. в РФ родилось почти 2 тыс. таких детей, в 2003 г. – уже 4 тыс. В целом за последние 6 лет число ВИЧ-инфицированных беременных выросло в 450 раз. Следовательно, появились новые сложные, ранее не известные проблемы, которые приходится решать в повседневной практике. Так, в настоящее время ВИЧ-инфицированным беременным рекомендуется вводить азидотимидин (АЗТ) или его новую разновидность – ретровир, что снижает риск заражения плода в 3–4 раза. Есть отечественный аналог – тимазид. К сожалению, спустя несколько месяцев к АЗТ и его производным формируется привыкание не только у женщин, но и у их детей. Поэтому разрабатываются и другие препараты. Так, фосфазид (или зидофудин) снижает внутриутробное инфицирование почти в 3 раза.В итоге назначение современных препаратов ВИЧ-инфицированной беременной и в усиленном режиме – в родах, а также ребенку в первые дни жизни позволяет снизить риск передачи ВИЧ с 25–50 до 0,5 % (И. Шамов). Благодаря этим средствам в середине 90-х годов XX столетия удалось снизить темпы распространения ВИЧ-инфекции в Европейском регионе и Северной Америке, так как они обеспечивают и определенный противоэпидемический эффект.
Предлагается наряду с антивирусной терапией проводить кесарево сечение при ВИЧ-инфицированности, чтобы исключить возможность заражения плода при его прохождении через родовые пути.
Грудное вскармливание все же рискованно, особенно если заражение женщины произошло после родов. По последним данным, немало детей, родившихся от ВИЧ-инфицированных матерей, оказываются свободными от заражения. Однако после рождения в их крови могут содержаться материнские тела против ВИЧ. С другой стороны, иногда у ВИЧ-инфицированной матери могут и отсутствовать антитела – в зависимости от сроков ее заражения, а следовательно, они могут отсутствовать и у ее ребенка.
Таким образом, в том и другом случае необходимо повторное обследование малыша. Его следует проводить в 6 месяцев, когда материнские антитела уже отсутствуют. С другой стороны, к этому сроку, а иногда и позже, если все же заражение ребенка состоялось, могут появиться «собственные» антитела. Поэтому для окончательного решения вопроса об инфицированности обследование необходимо провести в годовалом возрасте и далее – в 1 год 6 месяцев.
В конечном итоге дети, не зараженные от ВИЧ-инфицированных матерей, снимаются с диспансерного учета только в 3 года.
Проблемы «отказных» детей
Среди ВИЧ-инфицированных детей основная их часть, как известно, это дети, от которых отказываются матери. Как уже подчеркивалось, только в возрасте года-полутора лет ребенка можно определить, инфицирован он или нет.Сразу после рождения такие дети оказываются в инфекционной больнице, в структуре которой находится центр по профилактике и борьбе со СПИДом. Однако их годичное пребывание в этих условиях невозможно. Вопросы дальнейшего пребывания таких детей в подобных центрах сейчас активно обсуждаются медицинской общественностью. Возникают предложения о создании для «отказных» инфицированных детей специализированных учреждений типа домов ребенка.
Вместе с тем пребывание ребенка в подобном учреждении является нарушением его прав по сохранению врачебной тайны о его заболевании, это записано в федеральном законе «О предупреждении распространения в Российской Федерации ВИЧ-инфекции».
Таким образом, эти дети с первых месяцев жизни оказываются в доме ребенка, и наряду с другими проблемами приходится решать вопрос и по их активной специфической защите от других инфекций, т. е. о вакцинопрофилактике.
Причем в подобной защите ВИЧ-инфицированные дети крайне нуждаются с учетом их особой восприимчивости из-за снижения иммунологических возможностей. Поэтому именно эти дети должны получить прививки против HIВ-инфекции (после 6 месяцев), менингита, гепатита А и особенно против пневмококковой инфекции (в 2 года), так как пневмококк – самый частый возбудитель осложнений и обострений у ВИЧ-инфицированных детей.
Что касается обязательных, т. е. календарных, вакцин, то здесь установки следующие:
• вакцину против гепатита В должны получать все дети по утвержденной схеме;
• ADC как «неживая» вакцина вместе с полиомиелитной инактивированной (ИПВ) вводится в принятые сроки на первом году, когда диагноз инфицированности еще неясен. Наблюдения свидетельствуют, что и AKDC также в соответствующие сроки может вводиться, с предварительным назначением (за 1–2 недели) поливитаминов;
• против кори, краснухи, паротита, как известно, применяются «живые» вакцины с годовалого возраста, когда уже имеется ясность в отношении ВИЧ-инфицированности. К последней группе вакцин отношение неоднозначное. С одной стороны, из-за разрушения иммунной системы при ВИЧ возможны тяжелые реакции на эти («живые») вакцины, с другой – заражение корью, причем летальность у этих детей – 100 %. Очевидно, следует руководствоваться эпидемиологической обстановкой по кори в регионе. Так, в Москве она весьма неустойчивая, что позволяет идти на эту рискованную вакцинацию.
ВИЧ и туберкулез
Особо следует сказать о прививках против туберкулеза вакциной БЦЖ.Эта «живая» вакцина, представленная ослабленным возбудителем туберкулеза рогатого скота (М. Bovis), позволяет снизить заболеваемость у детей в 10–15 раз, поэтому всем здоровым новорожденным на 3-7-й день жизни вводится эта вакцина. Однако дети, рожденные от ВИЧ-инфицированных матерей, не прививаются в роддоме. Связано это с тем, что ВИЧ разрушает популяцию СБ4-лимфоцитов, которая играет ключевую роль в формировании противотуберкулезного иммунитета, поэтому введение даже ослабленного туберкулезного возбудителя вызывает тяжелые последствия у этих детей. Так, описаны отдельные случаи диссеминированной БЦЖ-инфекции, когда сведения о ВИЧ-инфицированности были получены после введения вакцины. Поэтому все дети, рожденные от ВИЧ-инфицированных матерей, не прививаются на протяжении первых 1,5 лет жизни. В дальнейшем ВИЧ-инфицированным детям эта вакцинация не проводится.
Что касается другой группы детей, у которых заражение не произошло, то решение зависит от обстановки и условий проживания. Так, если в окружении сохраняется опасность ВИЧ-инфицирования, вакцинация не проводится и в последующие периоды жизни ребенка. При устранении этой опасности прививки БЦЖ проводятся при неблагополучной эпидемиологической ситуации по туберкулезу.
ГЛАВА 3. Антибактериальная терапия в условиях интернатного учреждения
Антимикробная химиотерапия ведет свое начало с 1936 г. – времени появления в клинической практике первого сульфаниламидного препарата; спустя 5 лет был впервые применен в клинике антибиотик пенициллин. Сегодня известно более 6 тыс. природных антимикробных препаратов и десятки тысяч полусинтетических производных. Но наибольшее практическое значение имеют около 50 антибиотиков, выпускаемых в разнообразных лекарственных формах.
Антимикробная химиотерапия рассматривает взаимодействие трех основных компонентов: микроорганизм, лекарственное средство, макроорганизм. Особенности каждого из компонентов влияют на выбор антимикробного средства при лечении.
К основным характеристикам микроорганизмов относят: патогенность, вирулентность, метаболическую активность, инвазивность.
Патогенность – способность микроорганизмов вызывать инфекционное заболевание у человека. Выделяют патогенные бактерии (Shigella dysenteriae – дизентерия, Yersinia pestis – чума) и условно-патогенные бактерии (Staphylococcus aureus, Streptococcus pneumoniae, Escherichia coli и др.). Вирулентность – степень патогенности. Метаболическая активность – продуцирование бактериями биологически активных веществ (например, экзотоксинов, ферментов, бета-лактамаз и др.). Инвазивность – способность микроорганизмов преодолевать защитные барьеры и диссеминировать (распространяться) в макроорганизме.
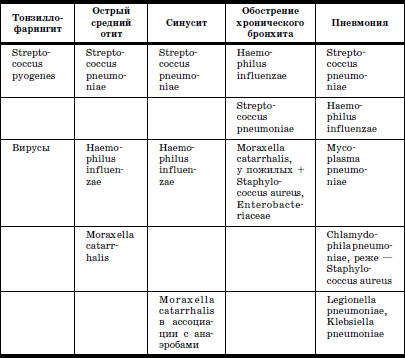
Сегодня хорошо изучены возбудители, вызывающие вне-больничные заболевания дыхательных путей (табл. 10).
Таблица 10
По степени чувствительности к антибактериальным препаратам бактерии разделяются на чувствительные, умеренно чувствительные и резистентные. К чувствительным относят возбудителей, рост которых прекращается при терапевтических концентрациях лекарств в крови. Для умеренно чувствительных микроорганизмов требуются максимальные дозы лекарственного препарата, чтобы добиться угнетения их роста. Устойчивые (резистентные) бактерии характеризуются бактериостатическим эффектом, который может быть достигнут только in vitro при высоких концентрациях лекарственного препарата, являющихся токсичными для человека.
Резистентность (устойчивость) бывает природной и приобретенной. У некоторых микроорганизмов генетически отсутствует чувствительность к антимикробному средству (вирусы устойчивы к антибиотикам, грамотрицательные бактерии к бензилпенициллину или ванкомицину, микоплазма – к бета-лактамным антибиотикам), в этом случае имеет место природная резистентность. Приобретенная резистентность возникает в результате мутации отдельных штаммов бактерий и селекции устойчивых клонов или в результате внехромосомного (плазмидного) обмена генетической информацией между отдельными бактериальными клетками. Выделяют два типа приобретенной резистентности:
• первичная резистентность бактерий имеет место до начала лечения антибиотиком (устойчивость некоторых штаммов золотистого стафилоккока или пневмококка к бензилпенициллину, гемофильной палочки – к ампициллину);
• вторичная резистентность бактерий возникает или возрастает в процессе применения антибактериальных препаратов.
• Снижение чувствительности к бета-лактамам; устойчивость в пенициллину в России менее 10 %.
• Бета-лактамы сохраняют клиническую эффективность в отношении пенициллинрезистентных пневмококков.
• Низкая природная активность пероральных цефалоспоринов III поколения.
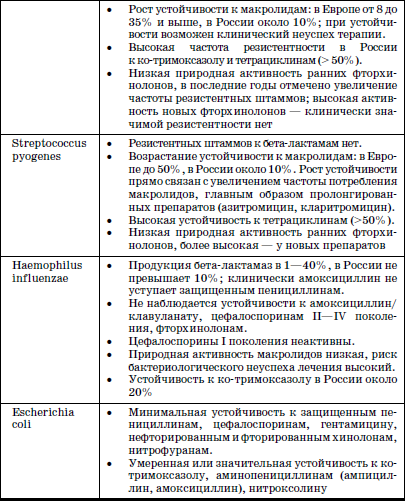
В настоящее время известно несколько механизмов взаимодействия приобретенной резистентности бактерий и антибактериальных средств, среди которых наиболее важными являются: изменение проницаемости клеточной стенки бактерий (модификация пориновых каналов) для антибактериальных препаратов; модификация клеточных структур – мишеней действия антибиотиков (например, пенициллинсвязывающих белков, SOS-субъединицы рибосом); продукция бактериями ферментов – бета-лактамаз, разрушающих бета-лактамное кольцо пенициллинов, цефалоспоринов, карбапенемов; активное выведение антибиотика (efflux) из бактериальной клетки. Резистентность некоторых наиболее значимых возбудителей внебольничных бактериальных инфекций представлена в табл. 11.
Таблица 11

К основным характеристикам антибактериальных препаратов относят их классификацию, вопросы фармакокинетики и фармакодинамики.
Понятие «антибактериальный препарат» – собирательное, оно объединяет: собственно антибиотики – соединения биологического происхождения, полу синтетические антибиотики – продукты химической модификации природных соединений и химиотерапевтические препараты – продукты полного химического синтеза, до сих пор в природе не обнаруженные. Это условная классификация по происхождению антибиотиков. В настоящее время такое деление не актуально, так как ряд природных антибиотиков получают путем синтеза (хлорамфеникол), другие являются синтетическими соединениями, а называются природными (фторхинолоны).
Антибактериальные препараты (АБП) составляют весьма многочисленных группу разнородных по химической структуре и механизму действия на микробный агент лекарственных средств, а также по спектру действия на различные группы микроорганизмов.
Отличительной характеристикой АБП любой химической структуры является их способность связываться с высокой степенью избирательности и аффинности с соответствующей мишенью – той или иной структурной молекулой бактериальной клетки либо ее ферментом, катализирующим ту или иную физиологически значимую функцию.
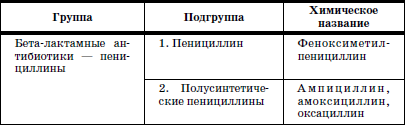
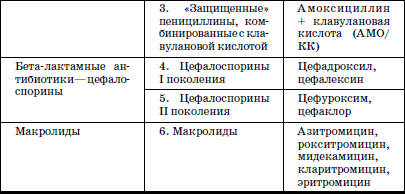
Каждый АБП характеризуется определенным (избирательным) спектром своего действия, и широта такого спектра варьирует для различных АБП в весьма широких пределах – от одного бактериального рода до обширных групп, включающих многие семейства грамположительных и грамотрицательных бактерий. Выбор группы АБП обусловливается видом возбудителя и локализацией воспалительного процесса. В амбулаторной педиатрической практике при лечении респираторной инфекции используют в основном 6 подгрупп АБП (табл. 12).
Таблица 12
Различают АБП узкого спектра антимикробного действия, активные преимущественно в отношении грамположительных (природные или некоторые полусинтетические пенициллины, макролиды, фузидин, линкомицин и др.) или грамотрицательных(полимиксины) микроорганизмов; широкого спектра, активные в отношении как грамположительных, так и грамотрицательных микроорганизмов (тетрациклины, аминогликозиды, левомицетин, некоторые полусинтетические пенициллины, цефалоспорины, рифампицин); противотуберкулезные (стрептомицин, канамицин, рифампицин, флоримицин, циклосерин); противогрибковые (нистатин, амфотерицин В, гризеофульвин и др.); действующие на простейших (мономицин); противоопухолевые (актиномицины, антрациклины, блеомицины и др.).
Антибактериальные препараты делятся, как и другие лекарственные средства, на группы и классы, что определяется не только спектром активности, но и фармакокинетическими особенностями и характером нежелательных реакций. Но при этом нельзя рассматривать все препараты одной группы как взаимозаменяемые. Даже препараты одного поколения имеют различную клиническую эффективность. Например: цефтазидим и цефоперазон эффективны против синегнойной палочки, а цефотаксим и цефтриаксон не обладают такой активностью, хотя все эти препараты из одной группы цефалоспоринов III поколения.
В клинической практике при терапии заболеваний имеет значение деление АБП на системные и местные (табл. 13).
Таблица 13
По основным механизмам противомикробного действия выделяют АБП, угнетающие синтез клеточной стенки бактерий (пенициллины, цефалоспорины, АБП из группы ванкомицина); нарушающие функции рибосом и процессы синтеза белков в микробных клетках (макролиды, аминогликозиды, тетрациклины, левомицетин, линкомицин); изменяющие проницаемость цитоплазматической мембраны микроорганизмов и обладающие детергентным действием на них (полимиксины, нистатин, леворин, амфотерицин В и др.); нарушающие синтез РНК бактерий (рифампицин).
По характеру противомикробного действия АБП разделяют на бактерицидные (быстро вызывающие гибель микробных клеток) и бактериостатические (задерживающие рост и размножение микробных клеток). Бактерицидным действием обладают в основном АБП, угнетающие синтез клеточной стенки, нарушающие проницаемость цитоплазматической мембраны микроорганизмов или блокирующие в них синтез РНК. Для подавляющего большинства АБП, нарушающих внутриклеточный синтез белка и функции рибосом, характерно бактериостатическое действие на микроорганизмы. Исключением являются АБП из группы аминогликозидов, которые отличаются тем, что не только нарушают функции рибосом и внутриклеточный синтез белка, но и, вероятно, вторично (непрямым путем) угнетают синтез клеточной стенки микроорганизмов.
Выделение бактерицидных и бактериостатических антибиотиков имеет основное практическое значение при лечении тяжелых инфекций. Обычно для достижения терапевтического эффекта используют антибиотики с бактериостатическим действием. Пациентам с нарушениями иммунитета следует назначать бактерицидные препараты. При необходимости назначения нескольких АМБ-препаратов следует избегать сочетаний лекарственных средств бактерицидного типа действия с препаратами бактериостатического действия. Это связано со значительным ослаблением противомикробного эффекта бактерицидно действующих препаратов бактериостатическими лекарствами.
Из фармакокинетических характеристик наиболее важными при выборе препарата являются период полувыведения и биодоступность (для препаратов, принимаемых внутрь).
В процессе антибиотикотерапии важное значение имеет назначение оптимальных доз и способов введения препаратов с учетом их фармакокинетики в организме больного. Оптимальными являются такие дозы АБП, при которых концентрация АБП в крови в 2–3 раза превышает величину его минимальной подавляющей концентрации в отношении выделенного возбудителя. Для больных с сопутствующей почечной недостаточностью при выборе антибиотиков и определении их доз необходимо принимать во внимание особенности фармакокинетики отдельных препаратов. Так, среди АБП имеются препараты (гентамицин, карбенициллин, цефалоридин, цефалексин и др.), выделение которых значительно уменьшается при почечной недостаточности, что способствует усилению их токсичности при данной патологии. Дозы таких АБП уменьшают в соответствии со степенью нарушения выделительной функции почек (по клиренсу креатинина). Коррекцию доз некоторых АБП (препаратов бензилпенициллина, ампициллина, оксациллина, линкомицина и цефалотина) проводят только при клиренсе креатинина менее 30 мл/мин. Выделение эритромицина, доксициклина, левомицетина, рифампицина и фузидина из организма при попечечной недостаточности не изменяется, поэтому данные АБП при нарушениях выделительной функции почек назначают в обычных дозах.
Немаловажным является вопрос длительности антибактериальной терапии. Рекомендуемая длительность антибактериальной терапии при лечении бактериальных респираторных инфекций в амбулаторной практике представлена в табл. 14.
Таблица 14
При назначении АБП следует учитывать особенности каждого лекарственного средства и особенно результаты их клинического применения, полученные в хорошо контролируемых клинических испытаниях.
Антимикробная химиотерапия рассматривает взаимодействие трех основных компонентов: микроорганизм, лекарственное средство, макроорганизм. Особенности каждого из компонентов влияют на выбор антимикробного средства при лечении.
К основным характеристикам микроорганизмов относят: патогенность, вирулентность, метаболическую активность, инвазивность.
Патогенность – способность микроорганизмов вызывать инфекционное заболевание у человека. Выделяют патогенные бактерии (Shigella dysenteriae – дизентерия, Yersinia pestis – чума) и условно-патогенные бактерии (Staphylococcus aureus, Streptococcus pneumoniae, Escherichia coli и др.). Вирулентность – степень патогенности. Метаболическая активность – продуцирование бактериями биологически активных веществ (например, экзотоксинов, ферментов, бета-лактамаз и др.). Инвазивность – способность микроорганизмов преодолевать защитные барьеры и диссеминировать (распространяться) в макроорганизме.
Сегодня хорошо изучены возбудители, вызывающие вне-больничные заболевания дыхательных путей (табл. 10).
Таблица 10
Наиболее значимые возбудители внебольничных инфекций дыхательных путей

По степени чувствительности к антибактериальным препаратам бактерии разделяются на чувствительные, умеренно чувствительные и резистентные. К чувствительным относят возбудителей, рост которых прекращается при терапевтических концентрациях лекарств в крови. Для умеренно чувствительных микроорганизмов требуются максимальные дозы лекарственного препарата, чтобы добиться угнетения их роста. Устойчивые (резистентные) бактерии характеризуются бактериостатическим эффектом, который может быть достигнут только in vitro при высоких концентрациях лекарственного препарата, являющихся токсичными для человека.
Резистентность (устойчивость) бывает природной и приобретенной. У некоторых микроорганизмов генетически отсутствует чувствительность к антимикробному средству (вирусы устойчивы к антибиотикам, грамотрицательные бактерии к бензилпенициллину или ванкомицину, микоплазма – к бета-лактамным антибиотикам), в этом случае имеет место природная резистентность. Приобретенная резистентность возникает в результате мутации отдельных штаммов бактерий и селекции устойчивых клонов или в результате внехромосомного (плазмидного) обмена генетической информацией между отдельными бактериальными клетками. Выделяют два типа приобретенной резистентности:
• первичная резистентность бактерий имеет место до начала лечения антибиотиком (устойчивость некоторых штаммов золотистого стафилоккока или пневмококка к бензилпенициллину, гемофильной палочки – к ампициллину);
• вторичная резистентность бактерий возникает или возрастает в процессе применения антибактериальных препаратов.
• Снижение чувствительности к бета-лактамам; устойчивость в пенициллину в России менее 10 %.
• Бета-лактамы сохраняют клиническую эффективность в отношении пенициллинрезистентных пневмококков.
• Низкая природная активность пероральных цефалоспоринов III поколения.
В настоящее время известно несколько механизмов взаимодействия приобретенной резистентности бактерий и антибактериальных средств, среди которых наиболее важными являются: изменение проницаемости клеточной стенки бактерий (модификация пориновых каналов) для антибактериальных препаратов; модификация клеточных структур – мишеней действия антибиотиков (например, пенициллинсвязывающих белков, SOS-субъединицы рибосом); продукция бактериями ферментов – бета-лактамаз, разрушающих бета-лактамное кольцо пенициллинов, цефалоспоринов, карбапенемов; активное выведение антибиотика (efflux) из бактериальной клетки. Резистентность некоторых наиболее значимых возбудителей внебольничных бактериальных инфекций представлена в табл. 11.
Таблица 11
Резистентность некоторых наиболее значимых возбудителей внебольничных бактериальных инфекций (СВ. Сидоренко, 2002)


К основным характеристикам антибактериальных препаратов относят их классификацию, вопросы фармакокинетики и фармакодинамики.
Понятие «антибактериальный препарат» – собирательное, оно объединяет: собственно антибиотики – соединения биологического происхождения, полу синтетические антибиотики – продукты химической модификации природных соединений и химиотерапевтические препараты – продукты полного химического синтеза, до сих пор в природе не обнаруженные. Это условная классификация по происхождению антибиотиков. В настоящее время такое деление не актуально, так как ряд природных антибиотиков получают путем синтеза (хлорамфеникол), другие являются синтетическими соединениями, а называются природными (фторхинолоны).
Антибактериальные препараты (АБП) составляют весьма многочисленных группу разнородных по химической структуре и механизму действия на микробный агент лекарственных средств, а также по спектру действия на различные группы микроорганизмов.
Отличительной характеристикой АБП любой химической структуры является их способность связываться с высокой степенью избирательности и аффинности с соответствующей мишенью – той или иной структурной молекулой бактериальной клетки либо ее ферментом, катализирующим ту или иную физиологически значимую функцию.
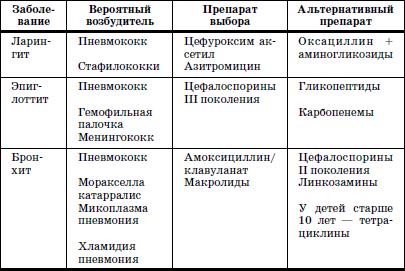
Каждый АБП характеризуется определенным (избирательным) спектром своего действия, и широта такого спектра варьирует для различных АБП в весьма широких пределах – от одного бактериального рода до обширных групп, включающих многие семейства грамположительных и грамотрицательных бактерий. Выбор группы АБП обусловливается видом возбудителя и локализацией воспалительного процесса. В амбулаторной педиатрической практике при лечении респираторной инфекции используют в основном 6 подгрупп АБП (табл. 12).
Таблица 12
Современные пероральные антибиотики для амбулаторной терапии респираторных инфекций у детей


Различают АБП узкого спектра антимикробного действия, активные преимущественно в отношении грамположительных (природные или некоторые полусинтетические пенициллины, макролиды, фузидин, линкомицин и др.) или грамотрицательных(полимиксины) микроорганизмов; широкого спектра, активные в отношении как грамположительных, так и грамотрицательных микроорганизмов (тетрациклины, аминогликозиды, левомицетин, некоторые полусинтетические пенициллины, цефалоспорины, рифампицин); противотуберкулезные (стрептомицин, канамицин, рифампицин, флоримицин, циклосерин); противогрибковые (нистатин, амфотерицин В, гризеофульвин и др.); действующие на простейших (мономицин); противоопухолевые (актиномицины, антрациклины, блеомицины и др.).
Антибактериальные препараты делятся, как и другие лекарственные средства, на группы и классы, что определяется не только спектром активности, но и фармакокинетическими особенностями и характером нежелательных реакций. Но при этом нельзя рассматривать все препараты одной группы как взаимозаменяемые. Даже препараты одного поколения имеют различную клиническую эффективность. Например: цефтазидим и цефоперазон эффективны против синегнойной палочки, а цефотаксим и цефтриаксон не обладают такой активностью, хотя все эти препараты из одной группы цефалоспоринов III поколения.
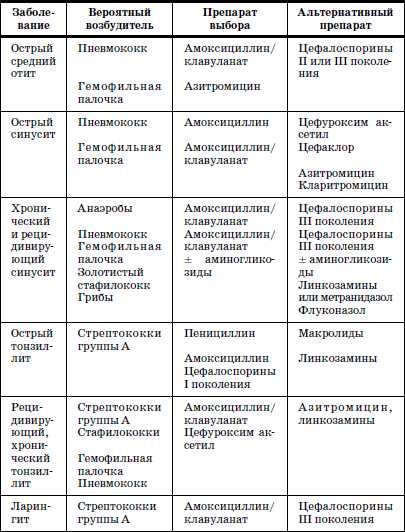
В клинической практике при терапии заболеваний имеет значение деление АБП на системные и местные (табл. 13).
Таблица 13
Выбор системных антибиотиков при бактериальных инфекциях дыхательных путей у детей


По основным механизмам противомикробного действия выделяют АБП, угнетающие синтез клеточной стенки бактерий (пенициллины, цефалоспорины, АБП из группы ванкомицина); нарушающие функции рибосом и процессы синтеза белков в микробных клетках (макролиды, аминогликозиды, тетрациклины, левомицетин, линкомицин); изменяющие проницаемость цитоплазматической мембраны микроорганизмов и обладающие детергентным действием на них (полимиксины, нистатин, леворин, амфотерицин В и др.); нарушающие синтез РНК бактерий (рифампицин).
По характеру противомикробного действия АБП разделяют на бактерицидные (быстро вызывающие гибель микробных клеток) и бактериостатические (задерживающие рост и размножение микробных клеток). Бактерицидным действием обладают в основном АБП, угнетающие синтез клеточной стенки, нарушающие проницаемость цитоплазматической мембраны микроорганизмов или блокирующие в них синтез РНК. Для подавляющего большинства АБП, нарушающих внутриклеточный синтез белка и функции рибосом, характерно бактериостатическое действие на микроорганизмы. Исключением являются АБП из группы аминогликозидов, которые отличаются тем, что не только нарушают функции рибосом и внутриклеточный синтез белка, но и, вероятно, вторично (непрямым путем) угнетают синтез клеточной стенки микроорганизмов.
Выделение бактерицидных и бактериостатических антибиотиков имеет основное практическое значение при лечении тяжелых инфекций. Обычно для достижения терапевтического эффекта используют антибиотики с бактериостатическим действием. Пациентам с нарушениями иммунитета следует назначать бактерицидные препараты. При необходимости назначения нескольких АМБ-препаратов следует избегать сочетаний лекарственных средств бактерицидного типа действия с препаратами бактериостатического действия. Это связано со значительным ослаблением противомикробного эффекта бактерицидно действующих препаратов бактериостатическими лекарствами.
Из фармакокинетических характеристик наиболее важными при выборе препарата являются период полувыведения и биодоступность (для препаратов, принимаемых внутрь).
В процессе антибиотикотерапии важное значение имеет назначение оптимальных доз и способов введения препаратов с учетом их фармакокинетики в организме больного. Оптимальными являются такие дозы АБП, при которых концентрация АБП в крови в 2–3 раза превышает величину его минимальной подавляющей концентрации в отношении выделенного возбудителя. Для больных с сопутствующей почечной недостаточностью при выборе антибиотиков и определении их доз необходимо принимать во внимание особенности фармакокинетики отдельных препаратов. Так, среди АБП имеются препараты (гентамицин, карбенициллин, цефалоридин, цефалексин и др.), выделение которых значительно уменьшается при почечной недостаточности, что способствует усилению их токсичности при данной патологии. Дозы таких АБП уменьшают в соответствии со степенью нарушения выделительной функции почек (по клиренсу креатинина). Коррекцию доз некоторых АБП (препаратов бензилпенициллина, ампициллина, оксациллина, линкомицина и цефалотина) проводят только при клиренсе креатинина менее 30 мл/мин. Выделение эритромицина, доксициклина, левомицетина, рифампицина и фузидина из организма при попечечной недостаточности не изменяется, поэтому данные АБП при нарушениях выделительной функции почек назначают в обычных дозах.
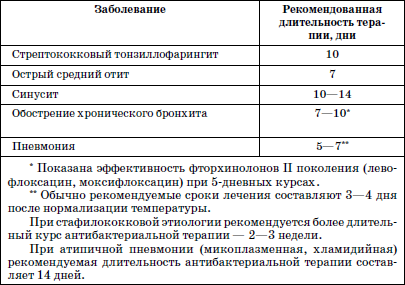
Немаловажным является вопрос длительности антибактериальной терапии. Рекомендуемая длительность антибактериальной терапии при лечении бактериальных респираторных инфекций в амбулаторной практике представлена в табл. 14.
Таблица 14
Рекомендуемая длительность антибактериальной терапии бактериальных респираторных инфекций в амбулаторной практике

При назначении АБП следует учитывать особенности каждого лекарственного средства и особенно результаты их клинического применения, полученные в хорошо контролируемых клинических испытаниях.
Вопросы рациональной антибиотикотерапии в интернатных условиях
Проблема рациональной и своевременной антимикробной химиотерапии является на сегодняшний день одной из наиболее актуальных в амбулаторных условиях.
Принимая решение о назначении лечения, врач должен ответить на многие вопросы:
• Данные нарушения вызваны инфекцией или симптоматическим проявлением других состояний (аллергия, неинфекционное воспаление, заболевания других органов и систем и т. д.)?
• Если это инфекция, то какие микроорганизмы ее вызвали: вирусы, бактерии, грибы? Если это вирусная инфекция, нет необходимости в назначении антибиотиков, так как они не оказывают противовирусного действия и не предотвращают развитие бактериальных осложнений.
• Если это бактериальная инфекция, надо решить, нужен ли антибиотик в данном случае ил и можно ограничиться симптоматической терапией? Ряд бактериальных инфекций (например, легкие формы острого синусита или острого среднего отита у лиц с нормальным иммунитетом) не требуют назначения антибиотиков, так как частота выздоровления у пациентов, получавших антибиотики и плацебо, одинакова. После принятия решения о применении антибактериальной терапии необходимо выбрать конкретный препарат. Область применения антибактериальных препаратов при вне-больничных респираторных инфекциях в амбулаторной практике представлена в табл. 15.
Таблица 15

• трактовка лихорадки как проявления инфекции; стремление к обязательному назначению лекарственного лечения в каждой клинической ситуации;
• трактовка предполагаемой инфекции как бактериальной;
• назначение АП без верификации бактериальной инфекции;
• назначение АП больным вирусной инфекцией с целью «профилактики» бактериальной инфекции;
• неадекватно длительная антибактериальная терапия в ожидании эффекта;
• недооценка или невыявление дополнительных признаков (анамнестических, клинических, лабораторных и т. д.);
• недооценка риска развития лекарственной устойчивости, нежелательных эффектов;
• желание врача перестраховаться.
Эффект лечения в интернатных условиях во многом зависит от адекватной оценки состояния ребенка врачом, преморбидного фона, вида инфекции, квалификации врача и т. д.
Современные тенденции оптимизации антибактериальной терапии затрагивают несколько ключевых позиций:
• повышение эффективности лечения путем внедрения современных протоколов эмпирической антибиотикотерапии;
• разработка алгоритмов антибиотикотерапии;
• применение современных антибиотиков с относительно высокой безопасностью с целью снижения частоты побочных реакций, осложнений суперинфекций;
• применение адекватных доз препаратов;
• внедрение щадящих режимов антибиотикотерапии для детей – отказ от инъекционных препаратов в амбулаторной практике, переход на однократный режим дозирования аминогликозидов и др.
Множество новых разработок в области антимикробной химиотерапии делают лечение инфекций более эффективным. Но, с другой стороны, огромное количество препаратов с различными микробиологическими и фармакологическими свойствами затрудняет выбор подходящего лекарственного средства и нередко представляет большие трудности для врача в выборе лечебного средства при назначении больным с инфекцией или подозрением на инфекцию. Достичь высокой эффективности антибиотикотерапии можно лишь при использовании современных протоколов эмпирической антибиотикотерапии по основным нозологическим формам заболеваний.
Ведущие специалисты в области педиатрии при разработке таких протоколов учитывают общие принципы выбора антибиотика, анатомо-физиологические особенности детского организма, а также особенности применения препарата в педиатрической практике во внебольничных условиях.
Общие особенности антибиотиков хорошо известны, они связаны с особым местом среди других групп лекарственных средств. Имеются объективные проблемы, связанные с применением антимикробных препаратов, так как, во-первых, это самая обширная группа лекарственных средств (только антибактериальных препаратов насчитывается более 20 классов, в России зарегистрировано более 200 антибиотиков); во-вторых, это самая трудная для применения группа лекарств (требуются знания не только препаратов и механизмов их действия, но и основ клинической микробиологии).
Принимая решение о назначении лечения, врач должен ответить на многие вопросы:
• Данные нарушения вызваны инфекцией или симптоматическим проявлением других состояний (аллергия, неинфекционное воспаление, заболевания других органов и систем и т. д.)?
• Если это инфекция, то какие микроорганизмы ее вызвали: вирусы, бактерии, грибы? Если это вирусная инфекция, нет необходимости в назначении антибиотиков, так как они не оказывают противовирусного действия и не предотвращают развитие бактериальных осложнений.
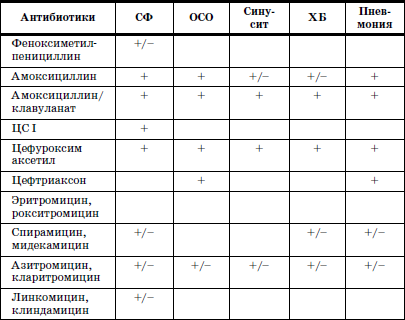
• Если это бактериальная инфекция, надо решить, нужен ли антибиотик в данном случае ил и можно ограничиться симптоматической терапией? Ряд бактериальных инфекций (например, легкие формы острого синусита или острого среднего отита у лиц с нормальным иммунитетом) не требуют назначения антибиотиков, так как частота выздоровления у пациентов, получавших антибиотики и плацебо, одинакова. После принятия решения о применении антибактериальной терапии необходимо выбрать конкретный препарат. Область применения антибактериальных препаратов при вне-больничных респираторных инфекциях в амбулаторной практике представлена в табл. 15.
Таблица 15
Область применения антибактериальных препаратов при внебольничных респираторных инфекциях в амбулаторной практике


Примечание. СФ – стрептококковый фарингит;Основные ошибки назначения АБП лихорадящим больным в интернатных условиях:
ОСО – острый средний отит;
ХБ – хронический бронхит;
ЦС I – пероральные цефалоспорины I поколения (цефалексин, це-фадроксил, цефаклор);
ФХ I – фторхинолоны I поколения (ципрофлоксацин, офлоксацин, пефлоксацин);
ФХ II – фторхинолоны II поколения (левофлоксацин, моксифлоксацин);
«+» – препарат высокоэффективен, рекомендуется в качестве средства выбора;
«+/—» – препарат применяется, но рекомендуется как альтернативное средство.
• трактовка лихорадки как проявления инфекции; стремление к обязательному назначению лекарственного лечения в каждой клинической ситуации;
• трактовка предполагаемой инфекции как бактериальной;
• назначение АП без верификации бактериальной инфекции;
• назначение АП больным вирусной инфекцией с целью «профилактики» бактериальной инфекции;
• неадекватно длительная антибактериальная терапия в ожидании эффекта;
• недооценка или невыявление дополнительных признаков (анамнестических, клинических, лабораторных и т. д.);
• недооценка риска развития лекарственной устойчивости, нежелательных эффектов;
• желание врача перестраховаться.
Эффект лечения в интернатных условиях во многом зависит от адекватной оценки состояния ребенка врачом, преморбидного фона, вида инфекции, квалификации врача и т. д.
Современные тенденции оптимизации антибактериальной терапии затрагивают несколько ключевых позиций:
• повышение эффективности лечения путем внедрения современных протоколов эмпирической антибиотикотерапии;
• разработка алгоритмов антибиотикотерапии;
• применение современных антибиотиков с относительно высокой безопасностью с целью снижения частоты побочных реакций, осложнений суперинфекций;
• применение адекватных доз препаратов;
• внедрение щадящих режимов антибиотикотерапии для детей – отказ от инъекционных препаратов в амбулаторной практике, переход на однократный режим дозирования аминогликозидов и др.
Множество новых разработок в области антимикробной химиотерапии делают лечение инфекций более эффективным. Но, с другой стороны, огромное количество препаратов с различными микробиологическими и фармакологическими свойствами затрудняет выбор подходящего лекарственного средства и нередко представляет большие трудности для врача в выборе лечебного средства при назначении больным с инфекцией или подозрением на инфекцию. Достичь высокой эффективности антибиотикотерапии можно лишь при использовании современных протоколов эмпирической антибиотикотерапии по основным нозологическим формам заболеваний.
Ведущие специалисты в области педиатрии при разработке таких протоколов учитывают общие принципы выбора антибиотика, анатомо-физиологические особенности детского организма, а также особенности применения препарата в педиатрической практике во внебольничных условиях.
Общие особенности антибиотиков хорошо известны, они связаны с особым местом среди других групп лекарственных средств. Имеются объективные проблемы, связанные с применением антимикробных препаратов, так как, во-первых, это самая обширная группа лекарственных средств (только антибактериальных препаратов насчитывается более 20 классов, в России зарегистрировано более 200 антибиотиков); во-вторых, это самая трудная для применения группа лекарств (требуются знания не только препаратов и механизмов их действия, но и основ клинической микробиологии).
