Страница:
В связи с тем, что в пременопаузном периоде яичники являются основным источником эстрогенов, подавление синтеза эстрогенов у менструирующих женщин может быть достигнуто путем выполнения овариоэктомии. Впервые данные об успешном лечении трех женщин, больных распространенным РМЖ, которым была произведена двусторонняя овариоэктомия, были опубликованы хирургом из Глазго Jeoral Beatsou в 1896 г. В связи с тем, что надпочечники также являются источником стероидных гормонов, в том числе эстрогенов, продолжая продуцировать их и с наступлением менопаузы, в середине XX века для лечения больных РМЖ было предложено выполнение билатеральной адреналэктомии, а также гипофизэктомии (для подавления выработки рилизинг-гормонов, стимулирующих выработку лютеинизирующего и фолликулостимулирующего гормонов).
В настоящее время хирургические методы гормонотерапии при РМЖ практически не применяются и представляют только исторический интерес. В качестве альтернативы методам хирургической эндокринологии в последние годы хорошо себя зарекомендовало применение эндокринных лекарственных препаратов системного действия. Пациенткам, находящимся в периоде пременопаузы, с целью медикаментозной кастрации назначают синтетический аналог природного гонадотропин-рилизинг гормона (гозерелин, золадекс). Применение гозерелина – это новые современные возможности выключения эстрогенной функции яичников у женщин в репродуктивном периоде и в пременопаузе. При постоянном применении гозерелин ингибирует выделение гипофизом лютеинизирующего гормона, что ведет к снижению концентрации эстрадиола в сыворотке крови у женщин. Результаты клинических испытаний показали, что частота объективного эффекта при лечении этим препаратом сходна с таковой при хирургической овариоэктомии.
У неменструирующих больных с положительными рецепторами эстрогенов наиболее эффективным методом гормонотерапии является назначение антиэстрогенов (тамоксифен, торемифен). Тамоксифен до настоящего времени остается «золотым стандартом» гормонотерапии. Механизм действия его следующий: препарат обладает большим сродством к рецепторам эстрогенов, чем сами эстрогены, поэтому происходит блокада рецепторов и нейтрализация влияния эстрогенов как на нормальные, так и на опухолевые клетки молочной железы. Тамоксифен эффективен при всех стадиях РМЖ. У больных с устойчивостью к тамоксифену, развившейся после начального положительного ответа, часто наблюдают положительную реакцию и на применение эндокринных препаратов второй линии – ингибиторов ароматазы, которые заменили адреналэктомию. У женщин в постменопаузальном периоде основным механизмом продукции эстрогенов является превращение с помощью фермента ароматазы адренального стероида андростендиона в эстрон, а затем в эстрадиол. Кроме того, имеются данные, что у женщин в глубокой менопаузе андростендион может вырабатываться не только надпочечниками, но и яичниками. При этом также происходит превращение андрогена андростендиона в эстрогены под действием фермента ароматазы. Сейчас появилось новое поколение этих препаратов (форместан, анэстрозол), которые избирательно блокируют реакцию ароматизации, и поэтому их применение не требует параллельного проведения заместительной терапии минералокортикоидами.
Несмотря на различные механизмы действия, роль гормонотерапии сводится, в конечном счете, к уменьшению влияния эстрогенов на раковые клетки, что в случае гормонально-зависимого рака приводит к замедлению роста опухоли, а у некоторых больных – к уменьшению уже существующих опухолевых масс, вплоть до их полного исчезновения.
Экспериментальные методы лечения
Активная или пассивная иммунизация. В отличие от иммунизации при инфекциях, эти методы при онкологических заболеваниях малоэффективны. В ряде случаев при применении пассивной иммунизации может развиваться опухолестимулирующий эффект, природа которого не очень понятна. Несмотря на это, в настоящее время изучаются перспективы использования высокоспецифичных моноклональных антител в качестве «транспорта» для доставки химиопрепаратов, радиоизотопов, противоопухолевых антибиотиков непосредственно в зону роста злокачественных клеток.
Применение цитокинов и иммуномодуляторов. В последние годы ведутся интенсивные клинические испытания иммуномодуляторов – препаратов, изменяющих биологическую реакцию организма на опухоль, оказывающих неспецифическое стимулирующее влияние на различные звенья иммунного ответа. В настоящее время применяют следующие препараты: тималин и тимоген (применяются в сочетании с полихимиотерапией, усиливая дифференцировку лимфоцитов вилочковой железы), левамизол или декарис (увеличивают количество Т-лимфоцитов), лейкинферон (лейкоцитарный интерферон человека, стимулирующий дифференцировку Т-лимфоцитов-киллеров).
Однако в клинической онкологии не найдены методы активной иммунотерапии, вызывающие стойкий и напряженный специфический иммунитет к опухолевым клеткам. Наблюдаемое улучшение состояния пациентов при всех изученных методах, к сожалению, носит временный и непродолжительный характер.
Молекулярно-генетические методы
Ведется поиск генно-инженерных подходов к лечению злокачественных опухолей. Например, перенос генов, кодирующих цитокины (фактор некроза опухолей, интерлейкин-2), в опухолевые клетки позволяет повысить противоопухолевый иммунитет. Введение в инфильтрирующие опухоль лимфоциты гена, кодирующего фактор некроза опухоли, приводит к увеличению концентрации этого цитокина в опухоли без системного токсического эффекта. Введение генов химерных противоопухолевых антител в Т-лимфоциты помогает добиться направленной цитотоксической активности. Возможно, что в перспективе с помощью переноса нормальных генов в опухолевые клетки удастся скорректировать генетические нарушения, ответственные за бесконтрольный рост опухоли.
Эти методы пока находятся в стадии разработки и не имеют существенного практического воплощения.
Рак грудной железы у мужчин
Прогноз
Тестовые задания для самоконтроля
Рекомендуемая литература
Неопухолевые заболевания пищевода
Кардиоспазм
Этиология и патогенез
Классификация
Клиническая картина и данные объективного исследования
В настоящее время хирургические методы гормонотерапии при РМЖ практически не применяются и представляют только исторический интерес. В качестве альтернативы методам хирургической эндокринологии в последние годы хорошо себя зарекомендовало применение эндокринных лекарственных препаратов системного действия. Пациенткам, находящимся в периоде пременопаузы, с целью медикаментозной кастрации назначают синтетический аналог природного гонадотропин-рилизинг гормона (гозерелин, золадекс). Применение гозерелина – это новые современные возможности выключения эстрогенной функции яичников у женщин в репродуктивном периоде и в пременопаузе. При постоянном применении гозерелин ингибирует выделение гипофизом лютеинизирующего гормона, что ведет к снижению концентрации эстрадиола в сыворотке крови у женщин. Результаты клинических испытаний показали, что частота объективного эффекта при лечении этим препаратом сходна с таковой при хирургической овариоэктомии.
У неменструирующих больных с положительными рецепторами эстрогенов наиболее эффективным методом гормонотерапии является назначение антиэстрогенов (тамоксифен, торемифен). Тамоксифен до настоящего времени остается «золотым стандартом» гормонотерапии. Механизм действия его следующий: препарат обладает большим сродством к рецепторам эстрогенов, чем сами эстрогены, поэтому происходит блокада рецепторов и нейтрализация влияния эстрогенов как на нормальные, так и на опухолевые клетки молочной железы. Тамоксифен эффективен при всех стадиях РМЖ. У больных с устойчивостью к тамоксифену, развившейся после начального положительного ответа, часто наблюдают положительную реакцию и на применение эндокринных препаратов второй линии – ингибиторов ароматазы, которые заменили адреналэктомию. У женщин в постменопаузальном периоде основным механизмом продукции эстрогенов является превращение с помощью фермента ароматазы адренального стероида андростендиона в эстрон, а затем в эстрадиол. Кроме того, имеются данные, что у женщин в глубокой менопаузе андростендион может вырабатываться не только надпочечниками, но и яичниками. При этом также происходит превращение андрогена андростендиона в эстрогены под действием фермента ароматазы. Сейчас появилось новое поколение этих препаратов (форместан, анэстрозол), которые избирательно блокируют реакцию ароматизации, и поэтому их применение не требует параллельного проведения заместительной терапии минералокортикоидами.
Несмотря на различные механизмы действия, роль гормонотерапии сводится, в конечном счете, к уменьшению влияния эстрогенов на раковые клетки, что в случае гормонально-зависимого рака приводит к замедлению роста опухоли, а у некоторых больных – к уменьшению уже существующих опухолевых масс, вплоть до их полного исчезновения.
Экспериментальные методы лечения
Активная или пассивная иммунизация. В отличие от иммунизации при инфекциях, эти методы при онкологических заболеваниях малоэффективны. В ряде случаев при применении пассивной иммунизации может развиваться опухолестимулирующий эффект, природа которого не очень понятна. Несмотря на это, в настоящее время изучаются перспективы использования высокоспецифичных моноклональных антител в качестве «транспорта» для доставки химиопрепаратов, радиоизотопов, противоопухолевых антибиотиков непосредственно в зону роста злокачественных клеток.
Применение цитокинов и иммуномодуляторов. В последние годы ведутся интенсивные клинические испытания иммуномодуляторов – препаратов, изменяющих биологическую реакцию организма на опухоль, оказывающих неспецифическое стимулирующее влияние на различные звенья иммунного ответа. В настоящее время применяют следующие препараты: тималин и тимоген (применяются в сочетании с полихимиотерапией, усиливая дифференцировку лимфоцитов вилочковой железы), левамизол или декарис (увеличивают количество Т-лимфоцитов), лейкинферон (лейкоцитарный интерферон человека, стимулирующий дифференцировку Т-лимфоцитов-киллеров).
Однако в клинической онкологии не найдены методы активной иммунотерапии, вызывающие стойкий и напряженный специфический иммунитет к опухолевым клеткам. Наблюдаемое улучшение состояния пациентов при всех изученных методах, к сожалению, носит временный и непродолжительный характер.
Молекулярно-генетические методы
Ведется поиск генно-инженерных подходов к лечению злокачественных опухолей. Например, перенос генов, кодирующих цитокины (фактор некроза опухолей, интерлейкин-2), в опухолевые клетки позволяет повысить противоопухолевый иммунитет. Введение в инфильтрирующие опухоль лимфоциты гена, кодирующего фактор некроза опухоли, приводит к увеличению концентрации этого цитокина в опухоли без системного токсического эффекта. Введение генов химерных противоопухолевых антител в Т-лимфоциты помогает добиться направленной цитотоксической активности. Возможно, что в перспективе с помощью переноса нормальных генов в опухолевые клетки удастся скорректировать генетические нарушения, ответственные за бесконтрольный рост опухоли.
Эти методы пока находятся в стадии разработки и не имеют существенного практического воплощения.
Рак грудной железы у мужчин
Рак грудной железы у мужчин встречается редко и составляет только 1 % от всех случаев рака этого органа и менее 1 % от всех злокачественных опухолей у мужчин. Гистологические типы аналогичны наблюдаемым у женщин, за исключением того, что дольковый рак in situ у мужчин не встречается. В 40 % случаев мужчины, болеющие РМЖ, поступают уже в неоперабельной стадии, что объясняется малыми размерами самой железы, вследствие чего опухоль быстро выходит за ее пределы. Диагностика и лечение РМЖ у мужчин проводится по тем же принципам, что и у женщин.
Прогноз
Около 30 % больных при выявлении первичной опухоли в молочной железе имеют уже клинически определяемые отдаленные метастазы. Из оставшихся 70 % пациенток не более половины их могут быть излечены только локальными методами. Остальные больные (30–35 %) уже имеют оккультные микрометастазы (не определяемые даже самыми современными инструментальными методами), которые в дальнейшем манифестируются клинически. Таким образом, более 60 % больных имеют либо клинически определимые, либо доклинические микрометастазы уже в начале первичного лечения. Эти данные убедительно подтверждают предположение В. Fisher о том, что РМЖ на стадии клинической манифестации более чем у половины больных является уже системным заболеванием, и проведения только локального лечения (операция, лучевая терапия) недостаточно, необходимо дополнять его системной терапией.
В зависимости от степени распространения опухоли, т. е. стадии заболевания, при которой начато лечение, для составления клинического прогноза результатов и степени выраженности последствий радикального лечения можно выделить следующие три группы пациентов.
1-я группа – больные с локализованными формами РМЖ без регионарных метастазов: преинвазивные стадии рака (рак in situ), «минимальные» (менее 1 см) опухоли I и IIA стадии (T1-2N0M0).
У этих больных отмечается наиболее благоприятный прогноз и наиболее высока вероятность многолетнего безрецидивного течения заболевания после выполнения органосохраняющих и функционально-щадящих операций. Показатели безрецидивной 5– и 10-летней выживаемости в этой группе составляют 91–82 % и 81–72 %, соответственно.
2-я группа – больные с первичным очагом большого размера (более 5 см) без регионарных метастазов (T3NOMO) или с опухолями размером менее 5 см, но при наличии метастазов в смещаемых подмышечных лимфатических узлах (T1-2N1M0). Эти пациенты нуждаются в сравнительно длительных (6-12 месяцев) сроках дополнительного лечения (лучевая терапия, полихимиотерапия, гормонотерапия). К этой же группе можно отнести больных, имеющих осложнения после лечения, а также больных с тяжелыми сопутствующими заболеваниями. Прогноз заболевания сомнительный, показатели безрецидивной 5-и 10-летней выживаемости составляют 67 % и 59 %, соответственно.
3-я группа – больные РМЖ с неблагоприятным прогнозом (Т1-2N2M0, T3N1-2M0, T4N0-2M0), нуждающиеся в длительной дополнительной полихимиотерапии и гормонотерапии. В этой группе больных наиболее высоки показатели возврата болезни в первые 2–3 года после проведенного лечения – показатели безрецидивной 5-и 10-летней выживаемости составляют 48 % и 30 % соответственно.
Подобное деление в определенной мере условно, ибо в любой из групп могут быть исключения, обусловленные целым рядом семейных, трудовых и социальных факторов.
В зависимости от степени распространения опухоли, т. е. стадии заболевания, при которой начато лечение, для составления клинического прогноза результатов и степени выраженности последствий радикального лечения можно выделить следующие три группы пациентов.
1-я группа – больные с локализованными формами РМЖ без регионарных метастазов: преинвазивные стадии рака (рак in situ), «минимальные» (менее 1 см) опухоли I и IIA стадии (T1-2N0M0).
У этих больных отмечается наиболее благоприятный прогноз и наиболее высока вероятность многолетнего безрецидивного течения заболевания после выполнения органосохраняющих и функционально-щадящих операций. Показатели безрецидивной 5– и 10-летней выживаемости в этой группе составляют 91–82 % и 81–72 %, соответственно.
2-я группа – больные с первичным очагом большого размера (более 5 см) без регионарных метастазов (T3NOMO) или с опухолями размером менее 5 см, но при наличии метастазов в смещаемых подмышечных лимфатических узлах (T1-2N1M0). Эти пациенты нуждаются в сравнительно длительных (6-12 месяцев) сроках дополнительного лечения (лучевая терапия, полихимиотерапия, гормонотерапия). К этой же группе можно отнести больных, имеющих осложнения после лечения, а также больных с тяжелыми сопутствующими заболеваниями. Прогноз заболевания сомнительный, показатели безрецидивной 5-и 10-летней выживаемости составляют 67 % и 59 %, соответственно.
3-я группа – больные РМЖ с неблагоприятным прогнозом (Т1-2N2M0, T3N1-2M0, T4N0-2M0), нуждающиеся в длительной дополнительной полихимиотерапии и гормонотерапии. В этой группе больных наиболее высоки показатели возврата болезни в первые 2–3 года после проведенного лечения – показатели безрецидивной 5-и 10-летней выживаемости составляют 48 % и 30 % соответственно.
Подобное деление в определенной мере условно, ибо в любой из групп могут быть исключения, обусловленные целым рядом семейных, трудовых и социальных факторов.
Тестовые задания для самоконтроля
Выберите один или несколько правильных ответов.
1. Развитие дисгормональных дисплазий молочной железы обусловливают следующие этиологические факторы:
1) гиперэстрогенемия;
2) нарушение лактации;
3) заболевания щитовидной железы;
4) частые аборты;
5) дисфункция яичников.
2. Мастодиния имеет следующие особенности:
1) редко встречается, причина – большая молочная железа;
2) может быть односторонней;
3) боли возникают перед менструацией;
4) это один из видов фиброзно-кистозной мастопатии.
3. У больной 32 лет диагностирована диффузная фиброзно-кистозная мастопатия, больной нужно назначить следующе лечение:
1) прием эстрогенных препаратов;
2) физиотерапию (УВЧ);
3) длительный прием йодида калия;
4) показана секторальная резекция молочной железы.
4. Рак молочной железы метастазирует в следующие группы лимфоузлов:
1) апикальные подмышечные;
2) внутренние грудные;
3) внутрибрюшные;
4) подключичные;
5) ретростернальные.
5. У женщины пальпируется небольшое новообразование в молочной железе, есть кровянистые выделения из соска. Это говорит о:
1) раке Педжета;
2) внутрипротоковой папилломе;
3) галактоцеле;
4) фиброзно-кистозной мастопатии;
5) мастодинии.
6. Факторы риска возникновения рака молочной железы:
1) поздняя первая беременность (после 35 лет);
2) отсутствие кормления грудью;
3) кистозная мастопатия;
4) рак молочной железы в семейном анамнезе;
5) курение.
7. Рак молочной железы чаще всего метастазирует в:
1) позвоночник;
2) легкие;
3) кожу;
4) печень;
5) надпочечники.
8. У больной 50 лет правая молочная железа инфильтрирована, отечна, резко уплотнена и увеличена в объеме, кожа ее покрыта красными пятнами с неровными, языкообразными краями, сосок втянут и деформирован. Ваш диагноз:
1) острый мастит;
2) рак Педжета;
3) рожеподобный рак;
4) солидный рак;
5) панцирный рак.
9. Симптом Кенинга патогномоничен для:
1) острого мастита;
2) фиброзно-кистозной мастопатии;
3) рака молочной железы;
4) галактоцеле;
5) внутрипротоковой папилломы.
10. При радикальной мастэктомии по Холстеду удаляют:
1) большую и малую грудные мышцы вместе с молочной железой;
2) парастернальные лимфоузлы;
3) подключичные лимфоузлы;
4) подмышечные лимфоузлы;
5) подлопаточные лимфоузлы.
11. Наиболее часто рак молочной железы локализуется в:
1) верхневнутреннем квадранте;
2) верхненаружном квадранте;
3) нижневнутреннем квадранте;
4) нижненаружном квадранте;
5) околососковой зоне.
12. Метастазирование по лимфатическому пути Героты – распространение опухоли в:
1) подмышечные лимфоузлы;
2) надключичные лимфоузлы;
3) печень;
4) противоположную молочную железу;
5) лимфоузлы забрюшинного пространства и малого таза;
13. У больной 28 лет месяц назад появилось мокнутие соска и ареолы правой молочной железы, затем отдельные участки ареолы стали изъязвляться и покрываться корочками. При осмотре эти участки напоминают экзему. В подмышечной впадине пльпируются увеличенные лимфоузлы, можно думать о следующем заболевании:
1) внутрипротоковая папиллома;
2) маститоподобный рак;
3) рак Педжета;
4) панцирный рак;
5) мастит.
14. У 46-летней больной раком молочной железы должна быть выполнена мастэктомия по Пэйти, при этом удаляются следующие структуры:
1) большая грудная мышца;
2) молочная железа с опухолью;
3) все подмышечные лимфоузлы пораженной стороны;
4) малая грудная мышца;
5) надключичные лимфоузлы.
15. Обследование молочных желез нужно проводить в следующее время менструального цикла:
1) во время menses;
2) накануне menses;
3) сразу по окончании menses;
4) в любое время;
5) через неделю после menses.
16. Рак Педжета – это:
1) изъязвление опухоли на коже молочных желез;
2) внутрипротоковое поражение мелких протоков;
3) рак эпителия устьев молочных протоков;
4) поражение обеих молочных желез;
5) рак молочных желез с поражением яичников.
17. У женщины 36 лет при пальпации правой молочной железы появляются кровянистые выделения из соска. Опухолевидных образований и увеличения подмышечных лимфоузлов не выявлено, можно заподозрить следующее заболевание:
1) рак Педжета;
2) галактоцеле;
3) листовидная фиброаденома;
4) внутрипротоковая папиллома;
5) диффузная фиброзно-кистозная мастопатия.
18. Маммография показана в следующих случаях:
1) при массовом обследовании;
2) при наблюдении за оставшейся молочной железой у перенесших мастэктомию;
3) при множественных кистах в молочной железе;
4) при большой молочной железе, опухоль в которой трудно обнаружить путем пальпации;
5) при сецернирующей молочной железе.
19. 30-летняя больная жалуется на боли и распирание в молочных железах перед menses. В молочных железах пальпируются различной плотности узелки размерами 2–3 мм, подмышечные лимфоузлы не пальпируются. Ваш предварительный диагноз:
1) двусторонний рак молочных желез;
2) филлоидная цистосаркома;
3) фиброзно-кистозная мастопатия;
4) рак Педжета;
5) меноррагия при кистозном раке молочной железы.
20. У больной раком молочной железы и развивающимся отеком верхней конечности следует избрать следующую операцию:
1) радикальную мастэктомию по Холстеду;
2) мастэктомию по Пэйти;
3) простую мастэктомию;
4) расширенную мастэктомию;
5) не выполнять операцию.
21. При послеродовом мастите в стадии серозного воспаления целесообразно назначить:
1) возвышенное положение молочной железы;
2) антибактериальную терапию;
3) сцеживание молока;
4) обработка сосков антисептиками;
5) новокаиновую блокаду.
22. При фиброаденоме молочной железы отмечается следующая симптоматика:
1) положительный симптом «умбиликации»;
2) положительный симптом Кенига;
3) выделения из соска;
4) изменяется форма соска;
5) положительный симптом Пайра.
23. В возникновении мастопатии имеют значение следующие факторы:
1) нарушение менструального цикла;
2) заболевания эндокринных органов;
3) нервно-психические нарушения;
4) ранее перенесенные маститы;
5) тип конституции.
24. При фиброаденоме молочной железы показана операция:
1) простая мастэктомия;
2) ампутация молочной железы;
3) секторальная резекция молочной железы;
4) операция Пэйти-Дайсона:
5) операция Холстеда.
25. Больная 30 лет жалуется на боли в молочных железах перед menses. При пальпации в молочных железах определяются множественные мелкие болезненные уплотнения. Подмышечные лимфоузлы не увеличены. Ваш предварительный диагноз:
1) двусторонний рак молочных желез I ст.;
2) внутрипротоковые папилломы;
3) фиброаденома;
4) фиброзно-кистозная мастопатщя
5) двусторонний мастит.
1. Развитие дисгормональных дисплазий молочной железы обусловливают следующие этиологические факторы:
1) гиперэстрогенемия;
2) нарушение лактации;
3) заболевания щитовидной железы;
4) частые аборты;
5) дисфункция яичников.
2. Мастодиния имеет следующие особенности:
1) редко встречается, причина – большая молочная железа;
2) может быть односторонней;
3) боли возникают перед менструацией;
4) это один из видов фиброзно-кистозной мастопатии.
3. У больной 32 лет диагностирована диффузная фиброзно-кистозная мастопатия, больной нужно назначить следующе лечение:
1) прием эстрогенных препаратов;
2) физиотерапию (УВЧ);
3) длительный прием йодида калия;
4) показана секторальная резекция молочной железы.
4. Рак молочной железы метастазирует в следующие группы лимфоузлов:
1) апикальные подмышечные;
2) внутренние грудные;
3) внутрибрюшные;
4) подключичные;
5) ретростернальные.
5. У женщины пальпируется небольшое новообразование в молочной железе, есть кровянистые выделения из соска. Это говорит о:
1) раке Педжета;
2) внутрипротоковой папилломе;
3) галактоцеле;
4) фиброзно-кистозной мастопатии;
5) мастодинии.
6. Факторы риска возникновения рака молочной железы:
1) поздняя первая беременность (после 35 лет);
2) отсутствие кормления грудью;
3) кистозная мастопатия;
4) рак молочной железы в семейном анамнезе;
5) курение.
7. Рак молочной железы чаще всего метастазирует в:
1) позвоночник;
2) легкие;
3) кожу;
4) печень;
5) надпочечники.
8. У больной 50 лет правая молочная железа инфильтрирована, отечна, резко уплотнена и увеличена в объеме, кожа ее покрыта красными пятнами с неровными, языкообразными краями, сосок втянут и деформирован. Ваш диагноз:
1) острый мастит;
2) рак Педжета;
3) рожеподобный рак;
4) солидный рак;
5) панцирный рак.
9. Симптом Кенинга патогномоничен для:
1) острого мастита;
2) фиброзно-кистозной мастопатии;
3) рака молочной железы;
4) галактоцеле;
5) внутрипротоковой папилломы.
10. При радикальной мастэктомии по Холстеду удаляют:
1) большую и малую грудные мышцы вместе с молочной железой;
2) парастернальные лимфоузлы;
3) подключичные лимфоузлы;
4) подмышечные лимфоузлы;
5) подлопаточные лимфоузлы.
11. Наиболее часто рак молочной железы локализуется в:
1) верхневнутреннем квадранте;
2) верхненаружном квадранте;
3) нижневнутреннем квадранте;
4) нижненаружном квадранте;
5) околососковой зоне.
12. Метастазирование по лимфатическому пути Героты – распространение опухоли в:
1) подмышечные лимфоузлы;
2) надключичные лимфоузлы;
3) печень;
4) противоположную молочную железу;
5) лимфоузлы забрюшинного пространства и малого таза;
13. У больной 28 лет месяц назад появилось мокнутие соска и ареолы правой молочной железы, затем отдельные участки ареолы стали изъязвляться и покрываться корочками. При осмотре эти участки напоминают экзему. В подмышечной впадине пльпируются увеличенные лимфоузлы, можно думать о следующем заболевании:
1) внутрипротоковая папиллома;
2) маститоподобный рак;
3) рак Педжета;
4) панцирный рак;
5) мастит.
14. У 46-летней больной раком молочной железы должна быть выполнена мастэктомия по Пэйти, при этом удаляются следующие структуры:
1) большая грудная мышца;
2) молочная железа с опухолью;
3) все подмышечные лимфоузлы пораженной стороны;
4) малая грудная мышца;
5) надключичные лимфоузлы.
15. Обследование молочных желез нужно проводить в следующее время менструального цикла:
1) во время menses;
2) накануне menses;
3) сразу по окончании menses;
4) в любое время;
5) через неделю после menses.
16. Рак Педжета – это:
1) изъязвление опухоли на коже молочных желез;
2) внутрипротоковое поражение мелких протоков;
3) рак эпителия устьев молочных протоков;
4) поражение обеих молочных желез;
5) рак молочных желез с поражением яичников.
17. У женщины 36 лет при пальпации правой молочной железы появляются кровянистые выделения из соска. Опухолевидных образований и увеличения подмышечных лимфоузлов не выявлено, можно заподозрить следующее заболевание:
1) рак Педжета;
2) галактоцеле;
3) листовидная фиброаденома;
4) внутрипротоковая папиллома;
5) диффузная фиброзно-кистозная мастопатия.
18. Маммография показана в следующих случаях:
1) при массовом обследовании;
2) при наблюдении за оставшейся молочной железой у перенесших мастэктомию;
3) при множественных кистах в молочной железе;
4) при большой молочной железе, опухоль в которой трудно обнаружить путем пальпации;
5) при сецернирующей молочной железе.
19. 30-летняя больная жалуется на боли и распирание в молочных железах перед menses. В молочных железах пальпируются различной плотности узелки размерами 2–3 мм, подмышечные лимфоузлы не пальпируются. Ваш предварительный диагноз:
1) двусторонний рак молочных желез;
2) филлоидная цистосаркома;
3) фиброзно-кистозная мастопатия;
4) рак Педжета;
5) меноррагия при кистозном раке молочной железы.
20. У больной раком молочной железы и развивающимся отеком верхней конечности следует избрать следующую операцию:
1) радикальную мастэктомию по Холстеду;
2) мастэктомию по Пэйти;
3) простую мастэктомию;
4) расширенную мастэктомию;
5) не выполнять операцию.
21. При послеродовом мастите в стадии серозного воспаления целесообразно назначить:
1) возвышенное положение молочной железы;
2) антибактериальную терапию;
3) сцеживание молока;
4) обработка сосков антисептиками;
5) новокаиновую блокаду.
22. При фиброаденоме молочной железы отмечается следующая симптоматика:
1) положительный симптом «умбиликации»;
2) положительный симптом Кенига;
3) выделения из соска;
4) изменяется форма соска;
5) положительный симптом Пайра.
23. В возникновении мастопатии имеют значение следующие факторы:
1) нарушение менструального цикла;
2) заболевания эндокринных органов;
3) нервно-психические нарушения;
4) ранее перенесенные маститы;
5) тип конституции.
24. При фиброаденоме молочной железы показана операция:
1) простая мастэктомия;
2) ампутация молочной железы;
3) секторальная резекция молочной железы;
4) операция Пэйти-Дайсона:
5) операция Холстеда.
25. Больная 30 лет жалуется на боли в молочных железах перед menses. При пальпации в молочных железах определяются множественные мелкие болезненные уплотнения. Подмышечные лимфоузлы не увеличены. Ваш предварительный диагноз:
1) двусторонний рак молочных желез I ст.;
2) внутрипротоковые папилломы;
3) фиброаденома;
4) фиброзно-кистозная мастопатщя
5) двусторонний мастит.
Рекомендуемая литература
Основная
Хирургические болезни / ред. Кузин М.И. 3-е изд., перераб. и доп. М.: Медицина, 2002.
Дополнительная
Дымарский П.Ю. Рак молочной железы. М.: Медицина, 1980. 192 с. Онкология / Под ред. Под редакцией В. И. Чиссова, С. Л. Дарьяловой. М.: ГЭОТАР-Медиа, 2009. 560 с.
Семиглазов В. Ф., Нургазиев К. Ш., Арзуманов А. С. Опухоли молочной железы (лечение и профилактика). Алматы, 2001. 345 с.
Сидоренко Л. Н. Мастопатия. – Л.: Медицина, 1991. – 264 с.
Хирургические болезни / ред. Кузин М.И. 3-е изд., перераб. и доп. М.: Медицина, 2002.
Дополнительная
Дымарский П.Ю. Рак молочной железы. М.: Медицина, 1980. 192 с. Онкология / Под ред. Под редакцией В. И. Чиссова, С. Л. Дарьяловой. М.: ГЭОТАР-Медиа, 2009. 560 с.
Семиглазов В. Ф., Нургазиев К. Ш., Арзуманов А. С. Опухоли молочной железы (лечение и профилактика). Алматы, 2001. 345 с.
Сидоренко Л. Н. Мастопатия. – Л.: Медицина, 1991. – 264 с.
Неопухолевые заболевания пищевода
Быстрому развитию клинической гастроэнтерологии в последние десятилетия способствовали достижения хирургии, терапии, рентгенологии и других медицинских дисциплин. Однако прогресс гастроэнтерологии мало коснулся клинической эзофагологии. Многие вопросы физиологии и патологии, морфологии и функции, диагностики, профилактики и лечения болезней пищевода недостаточно известны широкому кругу врачей и пищевод остается для них, по образному выражению 3. Маржатки (1967), «золушкой» в гастроэнтерологии.
Наибольшее внимание уделено клинической, рентгенологической, а также эндоскопической диагностике и дифференцировке болезней пищевода и кардии.
Наибольшее внимание уделено клинической, рентгенологической, а также эндоскопической диагностике и дифференцировке болезней пищевода и кардии.
Кардиоспазм
Считается, что кардиоспазм и ахалазия пищевода это синонимы одного заболевания, но есть и другая точка зрения. В настоящее время ряд авторов рассматривают кардиоспазм и ахалазию как два различных заболевания.
Кардиоспазм – стойкое спастическое сужение терминального отдела пищевода, проявляющееся дисфагией и в далеко зашедших стадиях сопровождающееся органическими изменениями его вышележащих отделов.
При ахалазии кардии отмечается отсутствие расслабления нижнего пищеводного сфинктера (НПС) во время акта глотания. Отсутствие этого рефлекса приводит к нарушению тонуса и моторики пищевода, что вызывает задержку прохождения пищевого комка.
Кардиоспазм – стойкое спастическое сужение терминального отдела пищевода, проявляющееся дисфагией и в далеко зашедших стадиях сопровождающееся органическими изменениями его вышележащих отделов.
При ахалазии кардии отмечается отсутствие расслабления нижнего пищеводного сфинктера (НПС) во время акта глотания. Отсутствие этого рефлекса приводит к нарушению тонуса и моторики пищевода, что вызывает задержку прохождения пищевого комка.
Этиология и патогенез
Причины и механизмы возникновения кардиоспазма окончательно не выяснены. Существует теория врожденного спазма, инфекционная, рефлекторная, психогенная и другие. В настоящее время принято считать, что ключевую роль в патогенезе кардиоспазма играет повреждение межмышечного нервного сплетения пищевода. При гистологическом и иммуногистохимическом исследованиях удаленных препаратов показано, что при кардиоспазме в стенке пищевода определяется значительное уменьшение и даже исчезновение ганглиозных клеток; имеются признаки хронического воспаления. Гибель постганглионарных тормозных нейронов, иннервирующих область НПС, приводит к преобладанию стимулирующих импульсов, которые проводятся волокнами блуждающего нерва. В результате тонус НПС резко возрастает, а его расслабление во время глотания затрудняется.
Следует отметить, что биохимические аспекты моторики НПС до сих пор не расшифрованы окончательно. Исследования последнего времени указывают на важную роль окиси азота и, возможно, вазоактивного интестинального пептида (ВИП) как медиаторов нейро-мышечной передачи.
К сожалению, причина повреждения интрамурального нервного сплетения (этиологический фактор кардиоспазма) остается неясной. В прошлом большое значение придавалось в данном аспекте тяжелым психическим травмам. Современные авторы активно обсуждают роль вирусной инфекции (в частности, герпетической) в генезе повреждения нервных структур пищеводной стенки.
В Южной Америке, особенно в Бразилии, встречается так называемая «вторичная» ахалазия кардии. В отличие от «первичной», идиопатической, этиология этой формы заболевания известна – она вызывается трипаносомой Круса и является одним из проявлений болезни Чагаса (американского трипаносомоза). Гибель ганглионарных клеток, локализующихся в клетках полых органов, приводит к развитию их патологического расширения (мегаколон, мегауретер, мегаэзофагус) и нарушению функции. Клиническая симптоматика первичной и вторичной ахалазии очень похожи, как и подходы к диагностике и лечению.
Некоторые авторы большое значение придают снижению содержания оксида азота, что приводит к нарушениям обмена кальция и передачи нервно-мышечного импульса. При кардиоспазме наблюдается повышенное давление в зоне НПС, градиент пищеводножелудочного давления может достигать 200 мм рт. ст. и более, при норме 10 + 3 мм рт. ст. Для начальных стадий кардиоспазма характерна усиленная непропульсивная моторика пищевода. Морфологически находят дегенеративно-дистрофические изменения в преганглионарных нейронах дорсальных ядер блуждающих нервов и в меньшей степени в постганглионарных нейронах ауэрбахова сплетения пищевода. В связи с нарушением центральной иннервации при кардиоспазме гладкая мускулатура НПС становится более чувствительной к своему физиологическому регулятору – эндогенному гастрину, вследствие чего наблюдается истинный спазм кардии.
При ахалазии кардии, напротив, поражаются преимущественно постганглионарные нейроны, в результате выпадает рефлекс раскрытия кардии на глоток. Манометрически находят нормальный или даже сниженный градиент пищеводно-желудочного давления, наблюдается значительное ослабление моторики пищевода. При ахалазии нет условий для возникновения повышенной чувствительности гладкой мускулатуры НПС к гастрину – сохраняется центральная иннервация.
Но, как правило, нарушение рефлекса раскрытия кардии и моторики пищевода – два параллельных процесса, идущих одновременно, и многие авторы термины «кардиоспазм» и «ахалазия кардии» считают синонимами.
Следует отметить, что биохимические аспекты моторики НПС до сих пор не расшифрованы окончательно. Исследования последнего времени указывают на важную роль окиси азота и, возможно, вазоактивного интестинального пептида (ВИП) как медиаторов нейро-мышечной передачи.
К сожалению, причина повреждения интрамурального нервного сплетения (этиологический фактор кардиоспазма) остается неясной. В прошлом большое значение придавалось в данном аспекте тяжелым психическим травмам. Современные авторы активно обсуждают роль вирусной инфекции (в частности, герпетической) в генезе повреждения нервных структур пищеводной стенки.
В Южной Америке, особенно в Бразилии, встречается так называемая «вторичная» ахалазия кардии. В отличие от «первичной», идиопатической, этиология этой формы заболевания известна – она вызывается трипаносомой Круса и является одним из проявлений болезни Чагаса (американского трипаносомоза). Гибель ганглионарных клеток, локализующихся в клетках полых органов, приводит к развитию их патологического расширения (мегаколон, мегауретер, мегаэзофагус) и нарушению функции. Клиническая симптоматика первичной и вторичной ахалазии очень похожи, как и подходы к диагностике и лечению.
Некоторые авторы большое значение придают снижению содержания оксида азота, что приводит к нарушениям обмена кальция и передачи нервно-мышечного импульса. При кардиоспазме наблюдается повышенное давление в зоне НПС, градиент пищеводножелудочного давления может достигать 200 мм рт. ст. и более, при норме 10 + 3 мм рт. ст. Для начальных стадий кардиоспазма характерна усиленная непропульсивная моторика пищевода. Морфологически находят дегенеративно-дистрофические изменения в преганглионарных нейронах дорсальных ядер блуждающих нервов и в меньшей степени в постганглионарных нейронах ауэрбахова сплетения пищевода. В связи с нарушением центральной иннервации при кардиоспазме гладкая мускулатура НПС становится более чувствительной к своему физиологическому регулятору – эндогенному гастрину, вследствие чего наблюдается истинный спазм кардии.
При ахалазии кардии, напротив, поражаются преимущественно постганглионарные нейроны, в результате выпадает рефлекс раскрытия кардии на глоток. Манометрически находят нормальный или даже сниженный градиент пищеводно-желудочного давления, наблюдается значительное ослабление моторики пищевода. При ахалазии нет условий для возникновения повышенной чувствительности гладкой мускулатуры НПС к гастрину – сохраняется центральная иннервация.
Но, как правило, нарушение рефлекса раскрытия кардии и моторики пищевода – два параллельных процесса, идущих одновременно, и многие авторы термины «кардиоспазм» и «ахалазия кардии» считают синонимами.
Классификация
В России наиболее распространена классификация кардиоспазма по стадиям, предложенная академиком Б. В. Петровским еще в 1957 году. В соответствии с этой классификацией выделяют четыре стадии заболевания: I – функциональный спазм непостоянного характера без расширения пищевода; II – стабильный спазм кардии с нерезким расширением пищевода (до 4–5 см); III – рубцовые изменения мышечных слоев кардии с выраженным расширением пищевода (до 6–8 см); IV – резко выраженный стеноз кардии со значительной дилатацией пищевода (более 8 см, иногда до 15–18 см), часто S-образным его искривлением и эзофагитом. Схематически эти изменения представлены на рисунке 17.
Некоторые авторы выделяют 2 типа заболевания по характеру расширения пищевода. При первом типе, помимо стойкого нарушения проходимости терминального отдела пищевода, наблюдается его умеренное расширение выше суженного участка, и пищевод имеет цилиндрическую или веретенообразную форму. При втором типе – отмечается значительное удлинение и мешковидное расширение пищевода, нередко с S-образным его искривлением (рис. 18).
Некоторые исследователи обозначают эти два типа болезни соответственно как кардиоспазм и ахалазию кардии.
Некоторые авторы выделяют 2 типа заболевания по характеру расширения пищевода. При первом типе, помимо стойкого нарушения проходимости терминального отдела пищевода, наблюдается его умеренное расширение выше суженного участка, и пищевод имеет цилиндрическую или веретенообразную форму. При втором типе – отмечается значительное удлинение и мешковидное расширение пищевода, нередко с S-образным его искривлением (рис. 18).
Некоторые исследователи обозначают эти два типа болезни соответственно как кардиоспазм и ахалазию кардии.
Клиническая картина и данные объективного исследования
Для кардиоспазма характерна триада симптомов: дисфагия, боли и регургитация. Основной признак заболевания – дисфагия, то есть затруднение прохождения пищи по пищеводу во время глотания.
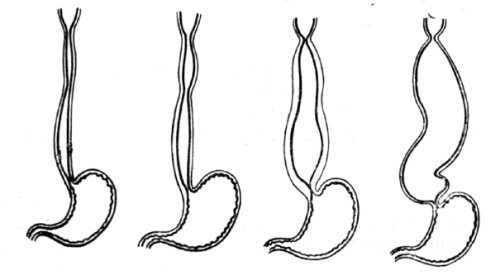
Рис. 17. Схема макроскопических изменений при I–IV стадиях кардиоспазма.
(Приводится по: О. Д. Федорова. Кардиоспазм. М., 1973)
 Рис. 18.
Рис. 18.
Рентгенологическая картина кардиоспазма:
А – при I типе заболевания; Б – при II типе заболевания. (Приводится по: В.Х. Василенко и соавт. Ахалазия кардии. М., 1976)
Чаще она развивается постепенно, но у ряда больных дебютирует остро, среди полного здоровья. В таких случаях «пусковым фактором» заболевания является негативный психоэмоциональный фон или внезапный стресс. И в дальнейшем эмоциональное состояние больного существенно влияет на выраженность дисфагии: волнения, отрицательные эмоции усиливают затруднение глотания. Спешка, усталость, проглатывание плохо пережеванных кусков пищи, питье холодной воды тоже вызывают усиление дисфагии. Запивание теплой водой и прием теплой полужидкой пищи ведут к облегчению глотания. Однако у некоторых пациентов наблюдается парадоксальная дисфагия – плотная пища проходит в желудок лучше, чем жидкая.
Выделяют 4 степени дисфагии: I – затруднения, возникающие при прохождении по пищеводу плотной пищи (хлеб, мясо); II – затруднения, возникающие при приеме полужидкой пищи (каши, пюре); III – затруднения при приеме жидкостей; IV – полная непроходимость пищевода, когда больные не в состоянии проглотить и глоток воды, не проходит даже слюна.

Рис. 17. Схема макроскопических изменений при I–IV стадиях кардиоспазма.
(Приводится по: О. Д. Федорова. Кардиоспазм. М., 1973)

Рентгенологическая картина кардиоспазма:
А – при I типе заболевания; Б – при II типе заболевания. (Приводится по: В.Х. Василенко и соавт. Ахалазия кардии. М., 1976)
Чаще она развивается постепенно, но у ряда больных дебютирует остро, среди полного здоровья. В таких случаях «пусковым фактором» заболевания является негативный психоэмоциональный фон или внезапный стресс. И в дальнейшем эмоциональное состояние больного существенно влияет на выраженность дисфагии: волнения, отрицательные эмоции усиливают затруднение глотания. Спешка, усталость, проглатывание плохо пережеванных кусков пищи, питье холодной воды тоже вызывают усиление дисфагии. Запивание теплой водой и прием теплой полужидкой пищи ведут к облегчению глотания. Однако у некоторых пациентов наблюдается парадоксальная дисфагия – плотная пища проходит в желудок лучше, чем жидкая.
Выделяют 4 степени дисфагии: I – затруднения, возникающие при прохождении по пищеводу плотной пищи (хлеб, мясо); II – затруднения, возникающие при приеме полужидкой пищи (каши, пюре); III – затруднения при приеме жидкостей; IV – полная непроходимость пищевода, когда больные не в состоянии проглотить и глоток воды, не проходит даже слюна.
