Страница:
Рубцовые стриктуры пищеводных анастомозов классифицируются по виду анастомоза (пищеводно-желудочный, пищеводнотолстокишечный, пищеводно-тонкокишечный), уровню его расположения (высокие – шейного и верхнегрудного отделов пищевода, низкие – средне– и нижнегрудного отделов), протяженности (короткие – до 1 см, протяженные – более 1 см) и степени стеноза. Так, сотрудники отделения эндоскопической хирургии РНЦХ РАМН выделяют 4 степени сужения пищеводных анастомозов: I – диаметр соустья 9-11 мм; II – 6–8 мм; III – 3–5 мм; IV – 0–2 мм (Ю.И. Галлингер, Э. А. Годжелло, 1999, Э. А. Годжелло, Ю.И. Галлингер, 2006). Такое деление определяет характер инструментария, который можно использовать для эндоскопического лечения стриктуры, и, кроме того, коррелирует со шкалой дисфагии (см. раздел «Рак пищевода»).
Клиническая картина и данные объективного исследования
Лабораторная и инструментальная диагностика
Дифференциальная диагностика
Лечение
Дивертикулы пищевода
Классификация
Этиология и патогенез
Клиническая картина и данные объективного исследования
Клиническая картина и данные объективного исследования
В клинической картине РСП ведущим является симптомокомплекс нарушения проходимости пищевода, который составляют дисфагия, пищеводная рвота, потеря массы тела. Появление и прогрессирование этой симптоматики различаются при разных по происхождению типах РСП.
При послеожоговой рубцовой стриктуре через неделю после химической травмы глотание становится менее болезненным и более свободным, это связано с уменьшением отека. Постепенно болезненность проходит, дисфагия уменьшается. Однако с шестой недели по мере замещения грануляций фиброзной тканью вновь усиливается дисфагия, которая носит прогрессивно нарастающий характер. Приспосабливаясь к своему страданию, больные долго и тщательно пережевывают пищу, запивают ее жидкостью. Прием пищи существенно растягивается во времени. Затем, по мере ретракции рубцов, проходимость пищевода ухудшается. Возникает пищеводная рвота – сразу после проглатывания пищи. Далее пациент перестает глотать даже воду. Тяжелая обструкция пищевода, характеризующаяся III и IV степенями дисфагии, обычно сопровождается слюнотечением. Больные с трудом проглатывают слюну и вынуждены ее выплевывать, поэтому возникает ложное ощущение, что слюны стало выделяться существенно больше, чем раньше.
При длительном течении РСП пациенты довольно резко теряют в весе, вплоть до развития кахексии. При наличии выраженной дисфагии масса тела снижается весьма быстро.
Пептические стриктуры пищевода характеризуются несколько иной картиной. Длительное время у больных присутствуют жалобы, типичные для рефлюкс-эзофагита: изжога, отрыжка кислым желудочным содержимым или воздухом, боли за грудиной. Изжога усиливается после еды и в наклонном положении туловища, а также при физической нагрузке. По мере формирования стриктуры появляется дисфагия, а изжога уменьшается и даже исчезает. Нередки боли за грудиной как при глотании, так и вне его, и боли в проекции мечевидного отростка грудины. Эрозии и язвы пищевода, сопутствующие пептической стриктуре, могут являться источником кровотечения, иногда довольно массивного.
В случаях развития послеоперационных РСП дисфагия появляется в сроки от 3–4 недель до 2–3 месяцев после хирургического вмешательства с наложением пищеводного анастомоза. Симптоматика таких стриктур напоминает таковую при сужениях пищевода другой природы, о которых упоминалось ранее.
Объективное исследование при РСП выявляет симптомы недостаточного питания: похудание, снижение тургора и эластичности кожи, истончение подкожного жирового слоя, атрофию скелетных мышц. Иногда при тяжелом сужении пищевода ощущается дурной запах изо рта вследствие застоя и гниения слизи и пищевых масс в супрастенотическом сегменте.
При послеожоговой рубцовой стриктуре через неделю после химической травмы глотание становится менее болезненным и более свободным, это связано с уменьшением отека. Постепенно болезненность проходит, дисфагия уменьшается. Однако с шестой недели по мере замещения грануляций фиброзной тканью вновь усиливается дисфагия, которая носит прогрессивно нарастающий характер. Приспосабливаясь к своему страданию, больные долго и тщательно пережевывают пищу, запивают ее жидкостью. Прием пищи существенно растягивается во времени. Затем, по мере ретракции рубцов, проходимость пищевода ухудшается. Возникает пищеводная рвота – сразу после проглатывания пищи. Далее пациент перестает глотать даже воду. Тяжелая обструкция пищевода, характеризующаяся III и IV степенями дисфагии, обычно сопровождается слюнотечением. Больные с трудом проглатывают слюну и вынуждены ее выплевывать, поэтому возникает ложное ощущение, что слюны стало выделяться существенно больше, чем раньше.
При длительном течении РСП пациенты довольно резко теряют в весе, вплоть до развития кахексии. При наличии выраженной дисфагии масса тела снижается весьма быстро.
Пептические стриктуры пищевода характеризуются несколько иной картиной. Длительное время у больных присутствуют жалобы, типичные для рефлюкс-эзофагита: изжога, отрыжка кислым желудочным содержимым или воздухом, боли за грудиной. Изжога усиливается после еды и в наклонном положении туловища, а также при физической нагрузке. По мере формирования стриктуры появляется дисфагия, а изжога уменьшается и даже исчезает. Нередки боли за грудиной как при глотании, так и вне его, и боли в проекции мечевидного отростка грудины. Эрозии и язвы пищевода, сопутствующие пептической стриктуре, могут являться источником кровотечения, иногда довольно массивного.
В случаях развития послеоперационных РСП дисфагия появляется в сроки от 3–4 недель до 2–3 месяцев после хирургического вмешательства с наложением пищеводного анастомоза. Симптоматика таких стриктур напоминает таковую при сужениях пищевода другой природы, о которых упоминалось ранее.
Объективное исследование при РСП выявляет симптомы недостаточного питания: похудание, снижение тургора и эластичности кожи, истончение подкожного жирового слоя, атрофию скелетных мышц. Иногда при тяжелом сужении пищевода ощущается дурной запах изо рта вследствие застоя и гниения слизи и пищевых масс в супрастенотическом сегменте.
Лабораторная и инструментальная диагностика
В анализах крови наблюдаются неспецифические изменения. Могут быть выявлены анемия, электролитные нарушения. Объективным показателем расстройства водного баланса служит появление признаков «сгущения» крови: повышение содержания гемоглобина, гематокрита, эритроцитов и общего белка. В процессе проведения инфузионной терапии и парентерального питания эти показатели изменяются, приближаясь к «истинным» значениям, не замаскированным процессом тяжелой дегидратации. В ряде случаев – при выраженном эзофагите и аспирационных легочных осложнениях – имеет место лейкоцитоз.
Инструментальная диагностика РСП базируется на рентгенологическом и эндоскопическом исследованиях.
Для рентгеноскопии пищевода применяют жидкую взвесь сульфата бария. При выраженных его сужениях эффективно использование водорастворимого контраста (урографин, триомбраст, омнипак).
Послеожоговые стриктуры обычно циркулярные – трубчатые или кольцевидные, реже мембранозные, клапанные. Просвет органа в области стриктуры резко сужен вплоть до полной облитерации, при этом определяется супрастенотическое расширение в виде конуса или чаши (рис. 27).
Контуры сужения бывают довольно гладкими, рельеф слизистой отсутствует, перистальтика обычно не выявляется. При наличии множественных стриктур вышележащая диагностируется легко, но мешает обнаружению нижележащих.
Пептические РСП могут быть различной протяженности и почти всегда сочетаются с ГПОД. Короткая стриктура имеет вид симметричного сужения с ровными контурами длиной 1–2 см (рис. 28).
Протяженная пептическая стриктура цилиндрической формы, расположена в дистальной части пищевода. Длина ее может превышать 3–5 см. Стенки стриктуры ригидны, складки слизистой утолщены, извилисты. В ряде случаев в зоне сужения можно обнаружить язвенную нишу.
Эндоскопическое исследование в случае послеожоговой РСП выше стриктуры выявляет картину хронического эзофагита. В пищеводе при этом задерживаются слизь, слюна, остатки пищи. Могут быть видны рубцы в виде перемычек, гребней, клапанов.
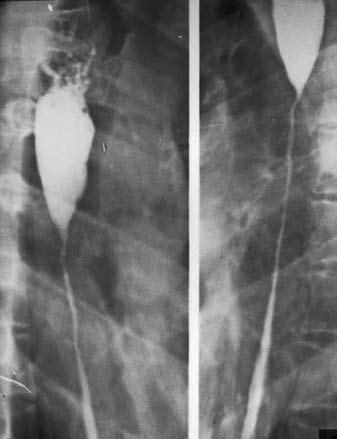
Рис. 27. Рентгенограмма пищевода при его послеожоговом рубцовом сужении. На снимке видны супрастенотическое расширение конической формы и протяженная стриктура средне– и нижнегрудного отделов пищевода.
Вход в стриктуру может располагаться как по центру, так и эксцентрично. Важной задачей эндоскопии является диагностика ожогового поражения глотки, что серьезно влияет на планирование объема операции. Участки рубцовых изменений могут чередоваться с непораженными, что бывает при двойных и множественных стриктурах. У больных с наложенной гастростомой для полноценного исследования пищевода применяют, помимо обычной, ретроградную эзофагоскопию.
При пептических РСП пищевод выше стриктуры обычно расширен, содержит пену, слизь, остатки пищи. Слизистая в области сужения частично или полностью разрушена. Стенки пищевода ригидны, на сохранившейся слизистой – изъязвления, покрытые некротическими тканями и пленками фибрина. Слизистая часто рыхлая и при малейшем контакте с эндоскопом кровоточит, хотя может выглядеть и малоизмененной.

Рис. 28. Рентгенограмма пищевода при короткой пептической стриктуре на почве ГПОД. Пищевод укорочен, часть кардиального отдела желудка находится в заднем средостении. (Приводится по: Е.М. Каган. Рентгенодиагностика заболеваний пищевода. М., 1968)
Пищеводные анастомозы чаще бывают сужены циркулярно. Реже соустье имеет неправильную форму за счет большего вовлечения в процесс одной из стенок. Супрастенотическое расширение обычно не выражено. Явления застойного эзофагита выявляются только при значительных сужениях. Как правило, стриктуры пищеводных соустий короткие (5-10 мм), реже – протяженные.
Инструментальная диагностика РСП базируется на рентгенологическом и эндоскопическом исследованиях.
Для рентгеноскопии пищевода применяют жидкую взвесь сульфата бария. При выраженных его сужениях эффективно использование водорастворимого контраста (урографин, триомбраст, омнипак).
Послеожоговые стриктуры обычно циркулярные – трубчатые или кольцевидные, реже мембранозные, клапанные. Просвет органа в области стриктуры резко сужен вплоть до полной облитерации, при этом определяется супрастенотическое расширение в виде конуса или чаши (рис. 27).
Контуры сужения бывают довольно гладкими, рельеф слизистой отсутствует, перистальтика обычно не выявляется. При наличии множественных стриктур вышележащая диагностируется легко, но мешает обнаружению нижележащих.
Пептические РСП могут быть различной протяженности и почти всегда сочетаются с ГПОД. Короткая стриктура имеет вид симметричного сужения с ровными контурами длиной 1–2 см (рис. 28).
Протяженная пептическая стриктура цилиндрической формы, расположена в дистальной части пищевода. Длина ее может превышать 3–5 см. Стенки стриктуры ригидны, складки слизистой утолщены, извилисты. В ряде случаев в зоне сужения можно обнаружить язвенную нишу.
Эндоскопическое исследование в случае послеожоговой РСП выше стриктуры выявляет картину хронического эзофагита. В пищеводе при этом задерживаются слизь, слюна, остатки пищи. Могут быть видны рубцы в виде перемычек, гребней, клапанов.

Рис. 27. Рентгенограмма пищевода при его послеожоговом рубцовом сужении. На снимке видны супрастенотическое расширение конической формы и протяженная стриктура средне– и нижнегрудного отделов пищевода.
Вход в стриктуру может располагаться как по центру, так и эксцентрично. Важной задачей эндоскопии является диагностика ожогового поражения глотки, что серьезно влияет на планирование объема операции. Участки рубцовых изменений могут чередоваться с непораженными, что бывает при двойных и множественных стриктурах. У больных с наложенной гастростомой для полноценного исследования пищевода применяют, помимо обычной, ретроградную эзофагоскопию.
При пептических РСП пищевод выше стриктуры обычно расширен, содержит пену, слизь, остатки пищи. Слизистая в области сужения частично или полностью разрушена. Стенки пищевода ригидны, на сохранившейся слизистой – изъязвления, покрытые некротическими тканями и пленками фибрина. Слизистая часто рыхлая и при малейшем контакте с эндоскопом кровоточит, хотя может выглядеть и малоизмененной.

Рис. 28. Рентгенограмма пищевода при короткой пептической стриктуре на почве ГПОД. Пищевод укорочен, часть кардиального отдела желудка находится в заднем средостении. (Приводится по: Е.М. Каган. Рентгенодиагностика заболеваний пищевода. М., 1968)
Пищеводные анастомозы чаще бывают сужены циркулярно. Реже соустье имеет неправильную форму за счет большего вовлечения в процесс одной из стенок. Супрастенотическое расширение обычно не выражено. Явления застойного эзофагита выявляются только при значительных сужениях. Как правило, стриктуры пищеводных соустий короткие (5-10 мм), реже – протяженные.
Дифференциальная диагностика
Ввиду наличия характерного анамнеза диагностика послеожоговых РСП, как правило, не вызывает затруднений. Гораздо труднее выявить раковую опухоль на фоне послеожоговых рубцов. Обычно это происходит через 10–15 и более лет после химического ожога. Клинические проявления рака пищевода возникают на фоне его послеожоговой стриктуры, что нередко приводит к запоздалой диагностике рака.
Пептическую стриктуру пищевода иногда следует дифференцировать с эндофитной циркулярной раковой опухолью. При доброкачественной РСП эндоскопически в месте сужения пищевода определяется гладкая слизистая с фиброзной тканью. Иногда нелегко отличить от опухоли и тяжелые эрозивно-язвенные изменения слизистой пищевода на фоне стриктуры, когда очаги изъязвления соседствуют с участками регенерации и пленками фибрина. Складки слизистой при этом либо отсутствуют, резко обрываясь на уровне стриктуры, либо изъедены и деформированы, что макроскопически соответствует «раковому рельефу». С целью дифференциальной диагностики рака пищевода и РСП применяют эндоскопию с биопсией, рентгеновское исследование, КТ, МРТ, эндосонографию пищевода.
При рубцовых сужениях пищеводных анастомозов нужно проводить дифференциальный диагноз с пептической стриктурой (при низкой локализации внутригрудного соустья) и рецидивом рака в зоне анастомоза. При рецидиве рака на одной из стенок пищевода (анастомоза) видны белесоватые разрастания, отличающиеся по виду от слизистой пищевода и полосок рубцовой ткани. Грануляции представляются ярко-красными разрастаниями, легко кровоточащими при контакте с эндоскопом и занимающими всю окружность анастомоза, тогда как рецидивная опухоль поражает обычно одну из его стенок. В таких случаях необходимо выполнять биопсию из нескольких участков окружности анастомоза.
Пептическую стриктуру пищевода иногда следует дифференцировать с эндофитной циркулярной раковой опухолью. При доброкачественной РСП эндоскопически в месте сужения пищевода определяется гладкая слизистая с фиброзной тканью. Иногда нелегко отличить от опухоли и тяжелые эрозивно-язвенные изменения слизистой пищевода на фоне стриктуры, когда очаги изъязвления соседствуют с участками регенерации и пленками фибрина. Складки слизистой при этом либо отсутствуют, резко обрываясь на уровне стриктуры, либо изъедены и деформированы, что макроскопически соответствует «раковому рельефу». С целью дифференциальной диагностики рака пищевода и РСП применяют эндоскопию с биопсией, рентгеновское исследование, КТ, МРТ, эндосонографию пищевода.
При рубцовых сужениях пищеводных анастомозов нужно проводить дифференциальный диагноз с пептической стриктурой (при низкой локализации внутригрудного соустья) и рецидивом рака в зоне анастомоза. При рецидиве рака на одной из стенок пищевода (анастомоза) видны белесоватые разрастания, отличающиеся по виду от слизистой пищевода и полосок рубцовой ткани. Грануляции представляются ярко-красными разрастаниями, легко кровоточащими при контакте с эндоскопом и занимающими всю окружность анастомоза, тогда как рецидивная опухоль поражает обычно одну из его стенок. В таких случаях необходимо выполнять биопсию из нескольких участков окружности анастомоза.
Лечение
Основным методом лечения различных РСП является бужирование, то есть расширение стриктуры с помощью специальных инструментов – бужей. При этом происходит растяжение и частичное разрушение грануляций и соединительной ткани в области стриктуры, что ведет к восстановлению просвета пищевода и, следовательно, полноценного перорального питания. При невозможности проведения бужирования или при его неэффективности прибегают к эзофагопластике (ЭП). Важными элементами лечения пептических РСП являются антирефлюксные операции и медикаментозная терапия.
Бужирование пищевода. Существует несколько способов бужирования. В прошлом широко применялось бужирование «вслепую», через рот. Однако этот метод сопровождался высокой частотой такого опасного осложнения, как перфорация пищевода. Поэтому сейчас «слепое» бужирование практически не используют. На смену ему пришли более надежные методы, позволяющие контролировать прохождение бужа через стриктуру.

Рис. 29 Бужи Savary-Gilliard с внутренним каналом для насаживания бужа на струну-направитель. (Приводится по: Э.А. Годжелло, Ю.И. Галлингер. Эндоскопическое лечение стриктур пищеводных анастомозов. М., 2006)
Возможно введение бужа под прямым контролем эндоскопа. Такой способ эффективен и безопасен для расширения коротких стриктур (например, стриктур пищеводных анастомозов). Для бужирования протяженных РСП он менее надежен, поскольку контролировать ход бужа через продленное сужение эндоскопическим путем почти невозможно.
В современных условиях применяют бужирование по направляющей струне специальными бужами, имеющими канал для проведения струны – типа Savary-Gilliard и им подобными (рис. 29).
Вначале металлическую струну с атравматическим пружинным наконечником проводят за область сужения под контролем эндоскопа. Затем нанизывают буж на струну-направитель и осторожно продвигают буж через стриктуру (рис. 30).

Рис. 30. Бужирование РСП по струне-направителю. Через стриктуру проводятся: А – струна (под контролем эндоскопа);
Б – кончик бужа; В – средняя часть бужа. (Приводится по: Т. Rice «Dilation of Peptic Esophageal Strictures», Operative Techniques in Cardiac & Thoracic Surgery, Vol. 2, No. 1 (February), 199: pp 100–116)
После небольшой экспозиции буж извлекают и проводят бужирование расширителем большего размера.
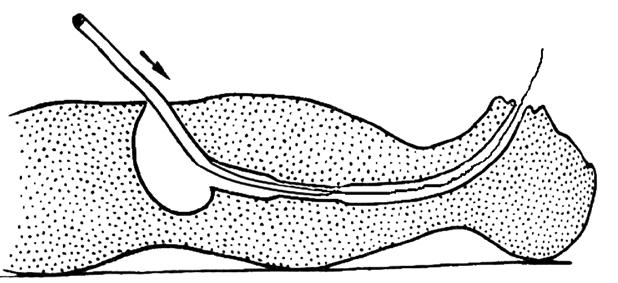
Рис. 31. Ретроградное форсированное бужирование пищевода. Кончик бужа пришит к направляющей нити. Тягой за нить осуществляют интраоперационное проведение бужа через гастротомическое отверстие… (Приводится с изменениями по: Г.Л. Ратнер, В. И. Белоконева. Ожоги пищевода и их последствия. М., 1982)
На следующий день выполняют контрольную рентгеноскопию пищевода для уточнения эффективности бужирования и исключения перфорации. Через 2–3 дня можно приступить к повторному бужированию.
Наконец, при множественных и протяженных стриктурах применяют метод бужирования за направляющую нить. Первое бужирование требует выполнения небольшой лапаротомии. Выполняется гастротомия, из желудка извлекают направляющую струну и заменяют ее прочной нитью (капрон № 4–5). Этой нитью прошивают кончик бужа. Затем производят ретроградное бужирование (рис. 31) и после необходимой экспозиции буж извлекают. Нить выводят наружу через желудок и переднюю брюшную стенку, желудочную стенку фиксируют к париетальной брюшине вокруг нити по типу гастростомы по Кадеру.
По окончании процедуры верхний конец нити выводят через нос. Тем самым сохраняется возможность для выполнения повторных бужирований (после выведения нити через рот и фиксации к ней бужа последний проводят ортоградно).
Многие технические детали бужирования могут существенно различаться у разных исполнителей и в разных клиниках. Так, обезболивание может быть местным (орошение глотки спреем лидокаина) или общим (внутривенный или эндотрахеальный наркоз). Экспозиция бужа варьирует от нескольких минут до часа и более. Используются разные схемы поддерживающего бужирования и т. д. Но в большинстве случаев лечение послеожоговых РСП довольно длительное и занимает от 6 месяцев до нескольких лет. Эндоскопическое наблюдение следует проводить пожизненно – ввиду опасности возникновения раковой опухоли на фоне стриктуры.
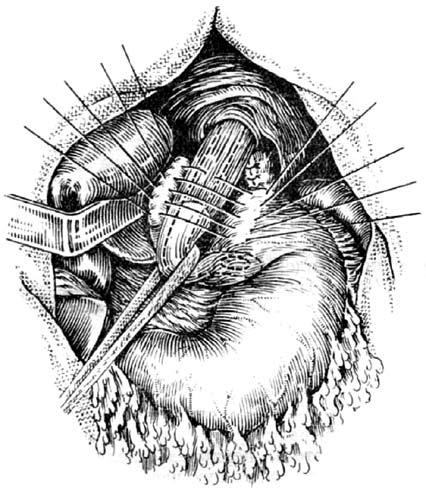
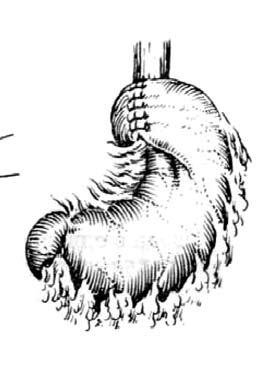
Рис. 32. Фундопликация по Ниссену. (Приводится по: А. А. Шалимов и соавт. Хирургия пищевода. М., 1975)
В последние годы в качестве альтернативы бужированию применяют баллонную дилатацию РСП. Результаты лечения примерно соответствуют таковым при бужировании, однако стоимость его значительно выше ввиду необходимости использования дорогостоящего расходного оборудования. Это обстоятельство существенно ограничивает широкое внедрение в практику данного метода лечения РСП.
Антирефлюксные операции. Применяются для лечения пептических стриктур пищевода. Как правило, используются различные виды фундопликации и эзофагофундорафии. В нашей стране наиболее распространена фундопликация типа Ниссена. При этом формируют манжетку из стенок желудка, сшиваемых вокруг пищевода. Образующийся в области кардии клапан функционирует как антирефлюксный барьер (рис. 32).
За рубежом популярны, кроме того, операции Белеи, Хилла, Коллиса, Дора, Тупе. Эти вмешательства устраняют ГПОД, препятствуют желудочно-пищеводному рефлюксу и в ряде случаев позволяют избежать развития осложнений, характерных для фундопликации по Ниссену (избыточная функция фундопликационной манжеты, с чем связаны затруднение или невозможность срыгивания и рвоты). При этих операциях выполняется парциальная фундопликация, заключающаяся не в полном окутывании пищевода стенками желудка, а в частичной фиксации дна желудка кпереди от пищевода (операция Дора) или кзади от него (операция Тупе). Основные этапы операции Белеи – мобилизация пищевода трансторакальным доступом, формирование фундопликационной манжеты на 240♦ и фиксация ее специальными швами к абдоминальной поверхности диафрагмы с дальнейшим ушиванием пищеводного отверстия диафрагмы до нормальных размеров.
Идея операции Коллиса заключается в удлинении абдоминальной части пищевода за счет создания желудочной трубки из правой половины желудка (т. е. части его, прилегающей к малой кривизне). При этом часть желудка низводится из грудной полости в брюшную, воссоздается острый угол Гиса (рис. 33). В современной практике эта операция применяется при сочетании рефлюкс-эзофагита или пептической стриктуры с вторичным укорочением пищевода и, как правило, сочетается с каким-либо вариантом фундопликации (операции Коллиса-Ниссена и Коллиса-Белси).
Тем самым купируется эзофагит и восстанавливается проходимость пищевода.
При необходимости после антирефлюксных операций делают поддерживающее бужирование. Обязательным элементом терапии рефлюкс-эзофагита является медикаментозное лечение (антациды, антисекреторные средства – обычно Н2-блокаторы гистаминорецепторов и блокаторы протонной помпы, прокинетики, антихелико-бактерные препараты и др.).
Резекция пищевода с одномоментной эзофагопластикой (ЭП) и шунтирующая ЭП. При неэффективности или невозможности бужирования, неудаче антирефлюксных операций показана резекция пищевода. Пораженный пищевод необходимо (при наличии технических возможностей и если позволяет состояние больного) удалить. Это позволяет радикально устранить риск озлокачествления в области стриктуры и использовать заднее средостение для проведения желудочного или кишечного трансплантата. Функциональные результаты заднемедиастинальных ЭП существенно лучше, чем загрудинных и тем более антестернальных. Оптимальным объемом операции является субтотальная резекция или экстирпация пищевода. У пациентов с высоким хирургическим риском допустимо не удалять собственный пищевод, а выполнять шунтирующую ЭП желудочным или кишечным трансплантатом. Главный недостаток резекционной операции – высокая травматичность.

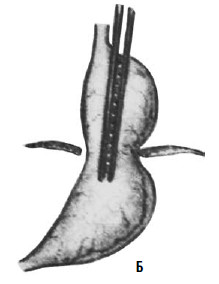
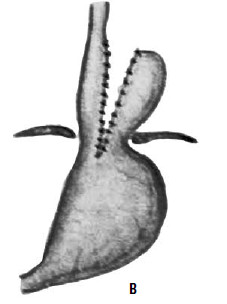
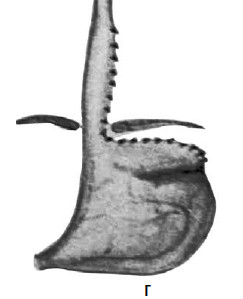
Рис. 33. Схема операции Коллиса: А – положение желудка до операции; Б – на желудок наложены жомы; В – рассеченные стенки желудка сшиты; Г – вновь созданное дно желудка низведено в брюшную полость. (Приводится по: Б. В. Петровский и соавт. Хирургия диафрагм. М., 1965)
Однако во многих специализированных клиниках процент осложнений и летальных исходов после ЭП сведен к минимуму. Так, послеоперационная летальность у больных неопухолевыми заболеваниями пищевода на современном этапе не превышает 3–5%. Функциональные исходы ЭП, как правило, хорошие. Пациенты после успешной операции избавляются от необходимости частых госпитализаций, курсов бужирования и перестают быть «привязанными» к клинике, поскольку бужирования до этого им выполняли многократно.
Бужирование пищевода. Существует несколько способов бужирования. В прошлом широко применялось бужирование «вслепую», через рот. Однако этот метод сопровождался высокой частотой такого опасного осложнения, как перфорация пищевода. Поэтому сейчас «слепое» бужирование практически не используют. На смену ему пришли более надежные методы, позволяющие контролировать прохождение бужа через стриктуру.

Рис. 29 Бужи Savary-Gilliard с внутренним каналом для насаживания бужа на струну-направитель. (Приводится по: Э.А. Годжелло, Ю.И. Галлингер. Эндоскопическое лечение стриктур пищеводных анастомозов. М., 2006)
Возможно введение бужа под прямым контролем эндоскопа. Такой способ эффективен и безопасен для расширения коротких стриктур (например, стриктур пищеводных анастомозов). Для бужирования протяженных РСП он менее надежен, поскольку контролировать ход бужа через продленное сужение эндоскопическим путем почти невозможно.
В современных условиях применяют бужирование по направляющей струне специальными бужами, имеющими канал для проведения струны – типа Savary-Gilliard и им подобными (рис. 29).
Вначале металлическую струну с атравматическим пружинным наконечником проводят за область сужения под контролем эндоскопа. Затем нанизывают буж на струну-направитель и осторожно продвигают буж через стриктуру (рис. 30).

Рис. 30. Бужирование РСП по струне-направителю. Через стриктуру проводятся: А – струна (под контролем эндоскопа);
Б – кончик бужа; В – средняя часть бужа. (Приводится по: Т. Rice «Dilation of Peptic Esophageal Strictures», Operative Techniques in Cardiac & Thoracic Surgery, Vol. 2, No. 1 (February), 199: pp 100–116)
После небольшой экспозиции буж извлекают и проводят бужирование расширителем большего размера.

Рис. 31. Ретроградное форсированное бужирование пищевода. Кончик бужа пришит к направляющей нити. Тягой за нить осуществляют интраоперационное проведение бужа через гастротомическое отверстие… (Приводится с изменениями по: Г.Л. Ратнер, В. И. Белоконева. Ожоги пищевода и их последствия. М., 1982)
На следующий день выполняют контрольную рентгеноскопию пищевода для уточнения эффективности бужирования и исключения перфорации. Через 2–3 дня можно приступить к повторному бужированию.
Наконец, при множественных и протяженных стриктурах применяют метод бужирования за направляющую нить. Первое бужирование требует выполнения небольшой лапаротомии. Выполняется гастротомия, из желудка извлекают направляющую струну и заменяют ее прочной нитью (капрон № 4–5). Этой нитью прошивают кончик бужа. Затем производят ретроградное бужирование (рис. 31) и после необходимой экспозиции буж извлекают. Нить выводят наружу через желудок и переднюю брюшную стенку, желудочную стенку фиксируют к париетальной брюшине вокруг нити по типу гастростомы по Кадеру.
По окончании процедуры верхний конец нити выводят через нос. Тем самым сохраняется возможность для выполнения повторных бужирований (после выведения нити через рот и фиксации к ней бужа последний проводят ортоградно).
Многие технические детали бужирования могут существенно различаться у разных исполнителей и в разных клиниках. Так, обезболивание может быть местным (орошение глотки спреем лидокаина) или общим (внутривенный или эндотрахеальный наркоз). Экспозиция бужа варьирует от нескольких минут до часа и более. Используются разные схемы поддерживающего бужирования и т. д. Но в большинстве случаев лечение послеожоговых РСП довольно длительное и занимает от 6 месяцев до нескольких лет. Эндоскопическое наблюдение следует проводить пожизненно – ввиду опасности возникновения раковой опухоли на фоне стриктуры.


Рис. 32. Фундопликация по Ниссену. (Приводится по: А. А. Шалимов и соавт. Хирургия пищевода. М., 1975)
В последние годы в качестве альтернативы бужированию применяют баллонную дилатацию РСП. Результаты лечения примерно соответствуют таковым при бужировании, однако стоимость его значительно выше ввиду необходимости использования дорогостоящего расходного оборудования. Это обстоятельство существенно ограничивает широкое внедрение в практику данного метода лечения РСП.
Антирефлюксные операции. Применяются для лечения пептических стриктур пищевода. Как правило, используются различные виды фундопликации и эзофагофундорафии. В нашей стране наиболее распространена фундопликация типа Ниссена. При этом формируют манжетку из стенок желудка, сшиваемых вокруг пищевода. Образующийся в области кардии клапан функционирует как антирефлюксный барьер (рис. 32).
За рубежом популярны, кроме того, операции Белеи, Хилла, Коллиса, Дора, Тупе. Эти вмешательства устраняют ГПОД, препятствуют желудочно-пищеводному рефлюксу и в ряде случаев позволяют избежать развития осложнений, характерных для фундопликации по Ниссену (избыточная функция фундопликационной манжеты, с чем связаны затруднение или невозможность срыгивания и рвоты). При этих операциях выполняется парциальная фундопликация, заключающаяся не в полном окутывании пищевода стенками желудка, а в частичной фиксации дна желудка кпереди от пищевода (операция Дора) или кзади от него (операция Тупе). Основные этапы операции Белеи – мобилизация пищевода трансторакальным доступом, формирование фундопликационной манжеты на 240♦ и фиксация ее специальными швами к абдоминальной поверхности диафрагмы с дальнейшим ушиванием пищеводного отверстия диафрагмы до нормальных размеров.
Идея операции Коллиса заключается в удлинении абдоминальной части пищевода за счет создания желудочной трубки из правой половины желудка (т. е. части его, прилегающей к малой кривизне). При этом часть желудка низводится из грудной полости в брюшную, воссоздается острый угол Гиса (рис. 33). В современной практике эта операция применяется при сочетании рефлюкс-эзофагита или пептической стриктуры с вторичным укорочением пищевода и, как правило, сочетается с каким-либо вариантом фундопликации (операции Коллиса-Ниссена и Коллиса-Белси).
Тем самым купируется эзофагит и восстанавливается проходимость пищевода.
При необходимости после антирефлюксных операций делают поддерживающее бужирование. Обязательным элементом терапии рефлюкс-эзофагита является медикаментозное лечение (антациды, антисекреторные средства – обычно Н2-блокаторы гистаминорецепторов и блокаторы протонной помпы, прокинетики, антихелико-бактерные препараты и др.).
Резекция пищевода с одномоментной эзофагопластикой (ЭП) и шунтирующая ЭП. При неэффективности или невозможности бужирования, неудаче антирефлюксных операций показана резекция пищевода. Пораженный пищевод необходимо (при наличии технических возможностей и если позволяет состояние больного) удалить. Это позволяет радикально устранить риск озлокачествления в области стриктуры и использовать заднее средостение для проведения желудочного или кишечного трансплантата. Функциональные результаты заднемедиастинальных ЭП существенно лучше, чем загрудинных и тем более антестернальных. Оптимальным объемом операции является субтотальная резекция или экстирпация пищевода. У пациентов с высоким хирургическим риском допустимо не удалять собственный пищевод, а выполнять шунтирующую ЭП желудочным или кишечным трансплантатом. Главный недостаток резекционной операции – высокая травматичность.




Рис. 33. Схема операции Коллиса: А – положение желудка до операции; Б – на желудок наложены жомы; В – рассеченные стенки желудка сшиты; Г – вновь созданное дно желудка низведено в брюшную полость. (Приводится по: Б. В. Петровский и соавт. Хирургия диафрагм. М., 1965)
Однако во многих специализированных клиниках процент осложнений и летальных исходов после ЭП сведен к минимуму. Так, послеоперационная летальность у больных неопухолевыми заболеваниями пищевода на современном этапе не превышает 3–5%. Функциональные исходы ЭП, как правило, хорошие. Пациенты после успешной операции избавляются от необходимости частых госпитализаций, курсов бужирования и перестают быть «привязанными» к клинике, поскольку бужирования до этого им выполняли многократно.
Дивертикулы пищевода
Дивертикул пищевода (ДП) представляет собой мешкообразное слепое выпячивание стенки органа, сообщающееся с его просветом.
Классификация
Пищеводные дивертикулы чаще всего развиваются в трех областях – на границе с глоткой, на уровне бифуркации трахеи и в нижнегрудном сегменте – над диафрагмой.
1. По локализации различают:
• глоточно-пищеводные (пограничные) дивертикулы, или дивертикулы Ценкера;
• собственно пищеводные дивертикулы:
♦ бифуркационные (в области бифуркации трахеи);
♦ эпифренальные (выше диафрагмы);
♦ абдоминальные (в абдоминальном отделе пищевода) встречаются крайне редко.
2. По механизму развития ДП делятся на пульсионные, тракционные и смешанные. Такое деление предложил патологоанатом К. Rokitansky еще в 1840 году. Пульсионные ДП образуются вследствие выпячивания пищеводной стенки под влиянием внутрипросветного давления (во время сокращения мускулатуры органа). Причина развития тракционных ДП – воспалительный процесс в окружающих тканях с последующим образованием рубцов, которые оттягивают стенку пищевода в направлении воспалительного очага (например, по направлению к лимфоузлам корня легкого или бифуркации трахеи при туберкулезном их поражении; в сторону позвоночника – при спондилите). По-видимому, в ряде случаев тракционный механизм наблюдается лишь в начале развития дивертикула, тогда как увеличение его размеров является результатом пульсионного механизма. Такие ДП обозначаются как смешанные, или пульсионно-тракционные.
3. Кроме того, ДП делятся на врожденные (они исключительно редки) и приобретенные.
Так называемые истинные дивертикулы содержат в себе все слои стенки пищевода, ложные – лишены мышечной оболочки. Ряд авторов проводят знак равенства между истинными и тракционными дивертикулами и, соответственно, ложными и пульсионными.
4. Наконец, различают неосложненные и осложненные ДП.
К осложнениям относят: дивертикулит, эзофагит, кровотечение, перфорацию, развитие в дивертикуле раковой опухоли. Перфорация ДП, в свою очередь, может привести к развитию флегмоны шеи, медиастинита, эмпиемы плевры. Легочные осложнения являются следствием аспирации содержимого дивертикула в дыхательные пути (трахеобронхит, пневмония, абсцесс легкого).
1. По локализации различают:
• глоточно-пищеводные (пограничные) дивертикулы, или дивертикулы Ценкера;
• собственно пищеводные дивертикулы:
♦ бифуркационные (в области бифуркации трахеи);
♦ эпифренальные (выше диафрагмы);
♦ абдоминальные (в абдоминальном отделе пищевода) встречаются крайне редко.
2. По механизму развития ДП делятся на пульсионные, тракционные и смешанные. Такое деление предложил патологоанатом К. Rokitansky еще в 1840 году. Пульсионные ДП образуются вследствие выпячивания пищеводной стенки под влиянием внутрипросветного давления (во время сокращения мускулатуры органа). Причина развития тракционных ДП – воспалительный процесс в окружающих тканях с последующим образованием рубцов, которые оттягивают стенку пищевода в направлении воспалительного очага (например, по направлению к лимфоузлам корня легкого или бифуркации трахеи при туберкулезном их поражении; в сторону позвоночника – при спондилите). По-видимому, в ряде случаев тракционный механизм наблюдается лишь в начале развития дивертикула, тогда как увеличение его размеров является результатом пульсионного механизма. Такие ДП обозначаются как смешанные, или пульсионно-тракционные.
3. Кроме того, ДП делятся на врожденные (они исключительно редки) и приобретенные.
Так называемые истинные дивертикулы содержат в себе все слои стенки пищевода, ложные – лишены мышечной оболочки. Ряд авторов проводят знак равенства между истинными и тракционными дивертикулами и, соответственно, ложными и пульсионными.
4. Наконец, различают неосложненные и осложненные ДП.
К осложнениям относят: дивертикулит, эзофагит, кровотечение, перфорацию, развитие в дивертикуле раковой опухоли. Перфорация ДП, в свою очередь, может привести к развитию флегмоны шеи, медиастинита, эмпиемы плевры. Легочные осложнения являются следствием аспирации содержимого дивертикула в дыхательные пути (трахеобронхит, пневмония, абсцесс легкого).
Этиология и патогенез
Причины развития ДП остаются окончательно не ясными.
Основными патогенетическими механизмами ДП являются:
1. Повышение давления в пищеводе приводит к выпячиванию очень эластичного и мобильного слизисто-подслизистого слоя через слабые участки («щели») мышечной оболочки. Повышение внутрипищеводного давления – естественное следствие сокращения глоточных и пищеводных мышц во время акта глотания. Это сугубо физиологическое явление. Для формирования дивертикула при этом необходимо наличие, помимо слабого места в стенке органа, еще и расстройства координации сокращения сфинктеров. Такая ситуация наиболее вероятна при ахалазии нижнего пищеводного сфинктера (НПС) (см. раздел «Кардиоспазм») или нижнего констриктора глотки.
2. Вторая важная причина развития ДП – вытягивание участка пищеводной стенки со стороны воспалительного очага, локализующегося в средостении или на шее (спондилит, туберкулезный лимфаденит и т. д.). Ретракция рубцов приводит к приближению стенки пищевода к разрешающемуся очагу воспаления в плевре или средостении с образованием ДП. По мере увеличения размеров дивертикула появляются и нарастают его клинические проявления. В дальнейшем развиваются разнообразные осложнения (см. ниже).
Дивертикулы Ценкера. Эти дивертикулы образуются в наиболее слабом месте задней стенки глотки, располагаясь непосредственно над входом в пищевод, в так называемом треугольнике Киллиана, где мышечная оболочка представлена пучками нижнего констриктора глотки. Сверху этот треугольник ограничен косо-вертикальными пучками волокон, которые обозначают как m. thyropharyngeus, снизу – циркулярными пучками т. cricopharyngeus (рис. 34).
Современные авторы считают главной причиной формирования глоточно-пищеводного дивертикула так называемую ахалазию крикофарингеальной мышцы.
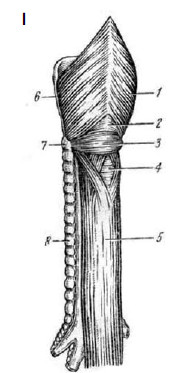
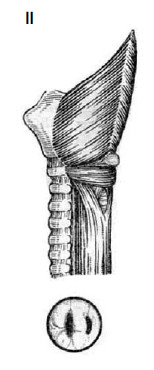
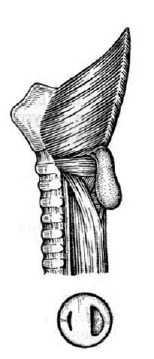
Рис. 34. Схема развития дивертикула Ценкера.
I – строение мышечной оболочки глотки и проксимальной части пищевода:
1 – m. thyreopharyngeus; 2 – треугольник Киллиана; 3 – m. cricopharyngeus;
4 – треугольник Лаймера, виден циркулярный слой мышечной оболочки пищевода;
5 – пищевод; 6 – трахея; II – этапы развития дивертикула Ценкера.
(Приводится по: В.Х. Василенко и соавт. Болезни пищевода. М., 1971)
Нерасслабление этой мышцы при глотании приводит к повышению давления в глотке и выпячиванию ее задней стенки в виде дивертикула. Поскольку сзади от глоточно-пищеводного перехода находятся тела шейных позвонков, растущий дивертикул раздвигает мягкие ткани слева или справа от пищевода и может выходить под боковые мышцы шеи, к надключичной области.
Гораздо реже дивертикул образуется в другом слабом месте задней стенки пищевода – треугольнике Лаймера, ограниченном сверху m. cricopharyngeus, а по бокам – пучками продольных мышечных волокон устья пищевода (рис. 34).
Надо заметить, что эпонимика (от греч. eponymos – дающий чему-либо свое имя) области глоточно-пищеводного перехода окончательно не устоялась. Так, ряд авторов называют верхний крикофарингеальный треугольник (Киллиана) треугольником Ланье-
Гаккермана (дивертикулы Киллиана-Джеймисона выходят на шею через одноименный треугольник по переднелатеральной поверхности пищевода чуть ниже крикофарингеальной мышцы), а нижний крикофарингеальный (Лаймера) именуют еще и треугольником Лаймера-Гаккермана. Использование схожих названий вносит некоторую путаницу в понимание рассматриваемого вопроса.
Бифуркационные дивертикулы чаще всего развиваются по тракционному механизму и являются следствием хронического воспаления в окружающих тканях (например, при туберкулезном лимфадените).
Эпифренальные дивертикулы возникают при растяжении врожденно слабых мест мышечной стенки пищевода под влиянием повышенного внутрипищеводного давления. По-видимому, в ряде случаев они образуются на фоне нарушения функции НПС (кардиоспазм). Иногда эпифренальный дивертикул возникает после операции Геллера (эзофагокардиомиотомии) по поводу кардиоспазма.
Основными патогенетическими механизмами ДП являются:
1. Повышение давления в пищеводе приводит к выпячиванию очень эластичного и мобильного слизисто-подслизистого слоя через слабые участки («щели») мышечной оболочки. Повышение внутрипищеводного давления – естественное следствие сокращения глоточных и пищеводных мышц во время акта глотания. Это сугубо физиологическое явление. Для формирования дивертикула при этом необходимо наличие, помимо слабого места в стенке органа, еще и расстройства координации сокращения сфинктеров. Такая ситуация наиболее вероятна при ахалазии нижнего пищеводного сфинктера (НПС) (см. раздел «Кардиоспазм») или нижнего констриктора глотки.
2. Вторая важная причина развития ДП – вытягивание участка пищеводной стенки со стороны воспалительного очага, локализующегося в средостении или на шее (спондилит, туберкулезный лимфаденит и т. д.). Ретракция рубцов приводит к приближению стенки пищевода к разрешающемуся очагу воспаления в плевре или средостении с образованием ДП. По мере увеличения размеров дивертикула появляются и нарастают его клинические проявления. В дальнейшем развиваются разнообразные осложнения (см. ниже).
Дивертикулы Ценкера. Эти дивертикулы образуются в наиболее слабом месте задней стенки глотки, располагаясь непосредственно над входом в пищевод, в так называемом треугольнике Киллиана, где мышечная оболочка представлена пучками нижнего констриктора глотки. Сверху этот треугольник ограничен косо-вертикальными пучками волокон, которые обозначают как m. thyropharyngeus, снизу – циркулярными пучками т. cricopharyngeus (рис. 34).
Современные авторы считают главной причиной формирования глоточно-пищеводного дивертикула так называемую ахалазию крикофарингеальной мышцы.



Рис. 34. Схема развития дивертикула Ценкера.
I – строение мышечной оболочки глотки и проксимальной части пищевода:
1 – m. thyreopharyngeus; 2 – треугольник Киллиана; 3 – m. cricopharyngeus;
4 – треугольник Лаймера, виден циркулярный слой мышечной оболочки пищевода;
5 – пищевод; 6 – трахея; II – этапы развития дивертикула Ценкера.
(Приводится по: В.Х. Василенко и соавт. Болезни пищевода. М., 1971)
Нерасслабление этой мышцы при глотании приводит к повышению давления в глотке и выпячиванию ее задней стенки в виде дивертикула. Поскольку сзади от глоточно-пищеводного перехода находятся тела шейных позвонков, растущий дивертикул раздвигает мягкие ткани слева или справа от пищевода и может выходить под боковые мышцы шеи, к надключичной области.
Гораздо реже дивертикул образуется в другом слабом месте задней стенки пищевода – треугольнике Лаймера, ограниченном сверху m. cricopharyngeus, а по бокам – пучками продольных мышечных волокон устья пищевода (рис. 34).
Надо заметить, что эпонимика (от греч. eponymos – дающий чему-либо свое имя) области глоточно-пищеводного перехода окончательно не устоялась. Так, ряд авторов называют верхний крикофарингеальный треугольник (Киллиана) треугольником Ланье-
Гаккермана (дивертикулы Киллиана-Джеймисона выходят на шею через одноименный треугольник по переднелатеральной поверхности пищевода чуть ниже крикофарингеальной мышцы), а нижний крикофарингеальный (Лаймера) именуют еще и треугольником Лаймера-Гаккермана. Использование схожих названий вносит некоторую путаницу в понимание рассматриваемого вопроса.
Бифуркационные дивертикулы чаще всего развиваются по тракционному механизму и являются следствием хронического воспаления в окружающих тканях (например, при туберкулезном лимфадените).
Эпифренальные дивертикулы возникают при растяжении врожденно слабых мест мышечной стенки пищевода под влиянием повышенного внутрипищеводного давления. По-видимому, в ряде случаев они образуются на фоне нарушения функции НПС (кардиоспазм). Иногда эпифренальный дивертикул возникает после операции Геллера (эзофагокардиомиотомии) по поводу кардиоспазма.
Клиническая картина и данные объективного исследования
ДП небольших размеров (до 1–2 см) протекают бессимптомно. Жалобы появляются у больного по мере увеличения дивертикула.
