Страница:
В восстановительном периоде проводится посиндромная терапия, а также лечение, направленное на улучшение трофики поврежденных тканей ЦНС: стимулирующая терапия (витамины В1, В6, церебролизин, АТФ, экстракт алоэ); ноотропы (пирацетам, фенибут, пантогам, энцефабол, когитум, глицин, лимонтар, биотредин, аминалон и др.); ангиопротекторы (кавинтон, циннаризин, трентал, танакан, сермион, инстенон); седативная терапия (седуксен, фенобарбитал, радедорм).
Физические методы реабилитации: массаж, упражнения в воде, физиотерапия (электрофорез) могут применяться уже с 7-10-го дня жизни.
Дети с перинатальными поражениями ЦНС должны находиться под наблюдением невролога. Необходимы периодические курсы лечения по 2–3 мес. (2 раза в год в течение нескольких лет).
Асфиксия новорожденного
Гемолитическая болезнь новорожденных
Геморрагическая болезнь новорожденных
Пневмопатии новорожденных
Физические методы реабилитации: массаж, упражнения в воде, физиотерапия (электрофорез) могут применяться уже с 7-10-го дня жизни.
Дети с перинатальными поражениями ЦНС должны находиться под наблюдением невролога. Необходимы периодические курсы лечения по 2–3 мес. (2 раза в год в течение нескольких лет).
Асфиксия новорожденного
Асфиксия новорожденного – симптомокомплекс, характеризующийся отсутствием дыхания, нерегулярными или неэффективными дыхательными движениями при рождении, у ребенка с наличием сердечной деятельности.
Различают первичную (при рождении) и вторичную (в первые часы и дни жизни) асфиксию новорожденного.
Этиология. Причины первичной асфиксии новорожденного: острая и хроническая гипоксия плода, перинатальная патология ЦНС, резус-несовместимость крови матери и плода, внутриутробная инфекция, закупорка дыхательных путей плода или новорожденного слизью, околоплодными водами (аспирационная асфиксия), пороки развития плода. Способствующими факторами являются: экстрагенитальные заболевания беременной (сердечно-сосудистые, тяжелые заболевания легких, выраженная анемия, сахарный диабет, тиреотоксикоз, инфекционные болезни и др.), отягощенный акушерский анамнез матери. Вторичная асфиксия может развиться вследствие аспирации, пневмопатий, родовой травмы головного и спинного мозга, врожденных пороков сердца, легких, мозга.
Асфиксия – это удушье, остро возникающий патологический процесс, вызванный различными причинами, в основе которых лежит недостаток кислорода в крови (гипоксемия) и тканях (гипоксия) и накопление в организме углекислоты (гиперкапния) и других кислых продуктов обмена веществ, что приводит к развитию метаболического ацидоза. Патологический ацидоз увеличивает проницаемость сосудистой стенки и клеточных мембран, что приводит к расстройству кровообращения, нарушению процессов свертывания крови, кровоизлияниям в различные органы, одновременно развиваются отек и дистрофические изменения в клетках всех органов и систем. Клетки организма теряют способность поглощать кислород.
Клиника. В соответствии с Международной статистической классификацией болезней и проблем, связанных со здоровьем (10-й пересмотр, 1995), выделяют асфиксию новорожденного среднюю (синюю) и тяжелую (белую); оценка по шкале Апгар на 1-й минуте после рождения соответственно 7–4 и 3–0 баллов. В клинической практике принято различать три степени тяжести асфиксии: легкую (оценка по шкале Апгар на 1-й минуте после рождения 7–6 баллов), средней тяжести (5–4 балла) и тяжелую (3–1 балл). Общая оценка 0 баллов свидетельствует о клинической смерти.
Степень тяжести асфиксии определяют в первую минуту после рождения ребенка по шкале Апгар. У здорового новорожденного общая сумма баллов по шкале Апгар на 1-й минуте жизни составляет 8-10.
Таблица 1
Шкала Апгар
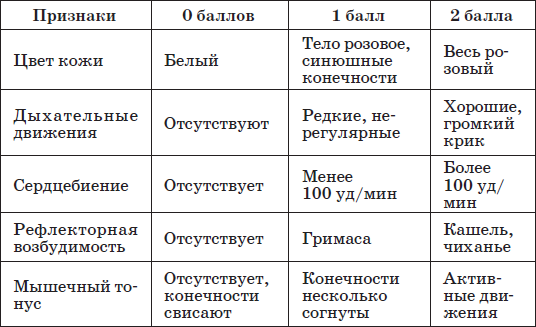
Легкая степень асфиксии – новорожденный делает первый вдох на первой минуте после рождения, но дыхание ослаблено, отмечаются акроцианоз и периоральный цианоз, некоторое снижение мышечного тонуса. Асфиксия средней тяжести – первый вдох происходит в течение первой минуты после рождения, дыхание ослаблено (регулярное или нерегулярное), крик слабый, часто брадикардия, но может быть и тахикардия, мышечный тонус и рефлексы снижены, кожа цианотичная, иногда преимущественно в области лица, кистей рук и стоп, пуповина пульсирует. Тяжелая асфиксия – дыхание нерегулярное (отдельные вдохи) либо отсутствует, ребенок не кричит, иногда стонет, брадикардия, в ряде случаев аритмия, мышечная гипотония или атония, рефлексы отсутствуют, кожа бледная (спазм периферических сосудов), пуповина не пульсирует; часто развивается надпочечниковая недостаточность. Общая оценка 0 баллов свидетельствует о клинической смерти.
Окончательную тяжесть асфиксии диагностируют не в родзале, а по окончании раннего неонатального периода. У новорожденных, перенесших асфиксию, развивается пост-гипоксический синдром в первые часы и дни жизни. Его основное проявление – поражение ЦНС. У каждого третьего ребенка, родившегося в состоянии асфиксии средней тяжести, наблюдаются нарушения мозгового кровообращения I–II степени, у всех детей, перенесших тяжелую асфиксию, – II–III степени. Выделяют две группы осложнений: ранние, развивающиеся в первые часы и сутки жизни, и поздние – с конца первой недели жизни и далее. Среди ранних осложнений, помимо поражений мозга (отек, внутричерепные кровоизлияния, некрозы), особенно часты гемо-динамические (сердечная недостаточность, легочная гипертензия), почечные, легочные (отек, кровотечения, синдром аспирации мекония, пневмония и др.), желудочно-кишечные (парезы, некротизирующий энтероколит), геморрагические (анемия, тромбоцитопения). Среди поздних осложнений превалируют инфекционные (пневмонии, менингит, сепсис, некротизирующий энтероколит и др.) и неврологические (гидроцефальный синдром, гипоксически-ишемическая энцефалопатия).
Диагноз основывается на оценке состояния ребенка по шкале Апгар на 1-й и 5-й мин жизни, исследовании кислотно-основного состояния (КОС), электролитов и газов крови, измерении АД, данных ЭКГ, ЭхоЭГ.
Лечение. Дети, родившиеся в асфиксии, нуждаются в реанимационной помощи. Основные принципы лечения асфиксии новорожденных: восстановление самостоятельного адекватного дыхания и устранение гипоксии – восстановление проходимости дыхательных путей, согревание ребенка, ИВЛ (искусственная вентиляция легких) с подачей кислорода; ликвидация нарушений центральной и периферической гемодинамики; коррекция метаболических нарушений; коррекция энергетического баланса.
Алгоритм первичной помощи новорожденному, родившемуся в асфиксии, включает несколько этапов. I этап реанимации начинается с отсасывания катетером содержимого полости рта в момент рождения головки или сразу после рождения ребенка. Если дыхание отсутствует, надо провести нежную, но активную тактильную стимуляцию – щелкнуть ребенка по подошве или энергично обтереть его спину. Ребенка принимают в стерильные подогретые пеленки, быстро переносят на реанимационный столик под источник лучистого тепла. При укладывании головной конец ребенка должен быть несколько опущен. Доношенный ребенок отделяется от матери сразу после рождения, а недоношенный – через 1 мин. В конце I этапа реанимации оценивают дыхание ребенка. При отсутствии или нерегулярном самостоятельном дыхании через 20 секунд после рождения, брадикардии (менее 100 сердечных сокращений в 1 мин) переходят ко II этапу реанимации (восстановление внешнего дыхания). Проводят вентиляцию легких с помощью маски и дыхательного мешка. Частота – 30–50 вдохов/мин. При аспирации околоплодных вод, потребовавшей санации трахеи, неэффективности масочной ИВЛ в течение 1 мин, подозрении на диафрагмальную грыжу, неадекватном самостоятельном дыхании у ребенка, гестационный возраст которого менее 28 недель, проводят интубацию трахеи и ИВЛ через эндотрахеальную трубку.
Если частота сердечных сокращений менее 80 в 1 мин, на фоне ИВЛ начинают закрытый массаж сердца (III этап реанимации), а в случае его неэффективности в течение 30 секунд в вену пуповины или эндотрахеально вводят раствор адреналина (1:10 000) в дозе 0,1–0,3 мл/кг (возможно повторное введение через каждые 5 мин). При сохраняющейся брадикардии (менее 80 сердечных сокращений в 1 мин) и подозрении на гиповолемический шок и декомпенсированный метаболический ацидоз на фоне продолжающейся ИВЛ и закрытого массажа сердца в вену пуповины вводят один из растворов для восполнения объема циркулирующей крови (например, 5 % раствор альбумина, изотонический раствор хлорида натрия в дозе 10 мл/кг в течение 5-10 мин) и 4 % раствор гидрокарбоната натрия (4 мл/кг не быстрее чем за 2 мин). После восстановления дыхания, сердечной деятельности и стабилизации состояния ребенка его переводят в палату интенсивной терапии отделения новорожденных. Объем лечебных мероприятий и их продолжительность определяются состоянием ребенка.
Важное значение имеет уход. Ребенку обеспечивают покой, головке придают возвышенное положение. Детей, перенесших легкую асфиксию, помещают в кислородную палатку; детей, перенесших асфиксию средней тяжести и тяжелую, – в кувез. В связи с возможностью осложнений со стороны ЦНС за детьми, родившимися в асфиксии, после выписки из родильного стационара устанавливают диспансерное наблюдение педиатра и невропатолога.
Различают первичную (при рождении) и вторичную (в первые часы и дни жизни) асфиксию новорожденного.
Этиология. Причины первичной асфиксии новорожденного: острая и хроническая гипоксия плода, перинатальная патология ЦНС, резус-несовместимость крови матери и плода, внутриутробная инфекция, закупорка дыхательных путей плода или новорожденного слизью, околоплодными водами (аспирационная асфиксия), пороки развития плода. Способствующими факторами являются: экстрагенитальные заболевания беременной (сердечно-сосудистые, тяжелые заболевания легких, выраженная анемия, сахарный диабет, тиреотоксикоз, инфекционные болезни и др.), отягощенный акушерский анамнез матери. Вторичная асфиксия может развиться вследствие аспирации, пневмопатий, родовой травмы головного и спинного мозга, врожденных пороков сердца, легких, мозга.
Асфиксия – это удушье, остро возникающий патологический процесс, вызванный различными причинами, в основе которых лежит недостаток кислорода в крови (гипоксемия) и тканях (гипоксия) и накопление в организме углекислоты (гиперкапния) и других кислых продуктов обмена веществ, что приводит к развитию метаболического ацидоза. Патологический ацидоз увеличивает проницаемость сосудистой стенки и клеточных мембран, что приводит к расстройству кровообращения, нарушению процессов свертывания крови, кровоизлияниям в различные органы, одновременно развиваются отек и дистрофические изменения в клетках всех органов и систем. Клетки организма теряют способность поглощать кислород.
Клиника. В соответствии с Международной статистической классификацией болезней и проблем, связанных со здоровьем (10-й пересмотр, 1995), выделяют асфиксию новорожденного среднюю (синюю) и тяжелую (белую); оценка по шкале Апгар на 1-й минуте после рождения соответственно 7–4 и 3–0 баллов. В клинической практике принято различать три степени тяжести асфиксии: легкую (оценка по шкале Апгар на 1-й минуте после рождения 7–6 баллов), средней тяжести (5–4 балла) и тяжелую (3–1 балл). Общая оценка 0 баллов свидетельствует о клинической смерти.
Степень тяжести асфиксии определяют в первую минуту после рождения ребенка по шкале Апгар. У здорового новорожденного общая сумма баллов по шкале Апгар на 1-й минуте жизни составляет 8-10.
Таблица 1
Шкала Апгар

Легкая степень асфиксии – новорожденный делает первый вдох на первой минуте после рождения, но дыхание ослаблено, отмечаются акроцианоз и периоральный цианоз, некоторое снижение мышечного тонуса. Асфиксия средней тяжести – первый вдох происходит в течение первой минуты после рождения, дыхание ослаблено (регулярное или нерегулярное), крик слабый, часто брадикардия, но может быть и тахикардия, мышечный тонус и рефлексы снижены, кожа цианотичная, иногда преимущественно в области лица, кистей рук и стоп, пуповина пульсирует. Тяжелая асфиксия – дыхание нерегулярное (отдельные вдохи) либо отсутствует, ребенок не кричит, иногда стонет, брадикардия, в ряде случаев аритмия, мышечная гипотония или атония, рефлексы отсутствуют, кожа бледная (спазм периферических сосудов), пуповина не пульсирует; часто развивается надпочечниковая недостаточность. Общая оценка 0 баллов свидетельствует о клинической смерти.
Окончательную тяжесть асфиксии диагностируют не в родзале, а по окончании раннего неонатального периода. У новорожденных, перенесших асфиксию, развивается пост-гипоксический синдром в первые часы и дни жизни. Его основное проявление – поражение ЦНС. У каждого третьего ребенка, родившегося в состоянии асфиксии средней тяжести, наблюдаются нарушения мозгового кровообращения I–II степени, у всех детей, перенесших тяжелую асфиксию, – II–III степени. Выделяют две группы осложнений: ранние, развивающиеся в первые часы и сутки жизни, и поздние – с конца первой недели жизни и далее. Среди ранних осложнений, помимо поражений мозга (отек, внутричерепные кровоизлияния, некрозы), особенно часты гемо-динамические (сердечная недостаточность, легочная гипертензия), почечные, легочные (отек, кровотечения, синдром аспирации мекония, пневмония и др.), желудочно-кишечные (парезы, некротизирующий энтероколит), геморрагические (анемия, тромбоцитопения). Среди поздних осложнений превалируют инфекционные (пневмонии, менингит, сепсис, некротизирующий энтероколит и др.) и неврологические (гидроцефальный синдром, гипоксически-ишемическая энцефалопатия).
Диагноз основывается на оценке состояния ребенка по шкале Апгар на 1-й и 5-й мин жизни, исследовании кислотно-основного состояния (КОС), электролитов и газов крови, измерении АД, данных ЭКГ, ЭхоЭГ.
Лечение. Дети, родившиеся в асфиксии, нуждаются в реанимационной помощи. Основные принципы лечения асфиксии новорожденных: восстановление самостоятельного адекватного дыхания и устранение гипоксии – восстановление проходимости дыхательных путей, согревание ребенка, ИВЛ (искусственная вентиляция легких) с подачей кислорода; ликвидация нарушений центральной и периферической гемодинамики; коррекция метаболических нарушений; коррекция энергетического баланса.
Алгоритм первичной помощи новорожденному, родившемуся в асфиксии, включает несколько этапов. I этап реанимации начинается с отсасывания катетером содержимого полости рта в момент рождения головки или сразу после рождения ребенка. Если дыхание отсутствует, надо провести нежную, но активную тактильную стимуляцию – щелкнуть ребенка по подошве или энергично обтереть его спину. Ребенка принимают в стерильные подогретые пеленки, быстро переносят на реанимационный столик под источник лучистого тепла. При укладывании головной конец ребенка должен быть несколько опущен. Доношенный ребенок отделяется от матери сразу после рождения, а недоношенный – через 1 мин. В конце I этапа реанимации оценивают дыхание ребенка. При отсутствии или нерегулярном самостоятельном дыхании через 20 секунд после рождения, брадикардии (менее 100 сердечных сокращений в 1 мин) переходят ко II этапу реанимации (восстановление внешнего дыхания). Проводят вентиляцию легких с помощью маски и дыхательного мешка. Частота – 30–50 вдохов/мин. При аспирации околоплодных вод, потребовавшей санации трахеи, неэффективности масочной ИВЛ в течение 1 мин, подозрении на диафрагмальную грыжу, неадекватном самостоятельном дыхании у ребенка, гестационный возраст которого менее 28 недель, проводят интубацию трахеи и ИВЛ через эндотрахеальную трубку.
Если частота сердечных сокращений менее 80 в 1 мин, на фоне ИВЛ начинают закрытый массаж сердца (III этап реанимации), а в случае его неэффективности в течение 30 секунд в вену пуповины или эндотрахеально вводят раствор адреналина (1:10 000) в дозе 0,1–0,3 мл/кг (возможно повторное введение через каждые 5 мин). При сохраняющейся брадикардии (менее 80 сердечных сокращений в 1 мин) и подозрении на гиповолемический шок и декомпенсированный метаболический ацидоз на фоне продолжающейся ИВЛ и закрытого массажа сердца в вену пуповины вводят один из растворов для восполнения объема циркулирующей крови (например, 5 % раствор альбумина, изотонический раствор хлорида натрия в дозе 10 мл/кг в течение 5-10 мин) и 4 % раствор гидрокарбоната натрия (4 мл/кг не быстрее чем за 2 мин). После восстановления дыхания, сердечной деятельности и стабилизации состояния ребенка его переводят в палату интенсивной терапии отделения новорожденных. Объем лечебных мероприятий и их продолжительность определяются состоянием ребенка.
Важное значение имеет уход. Ребенку обеспечивают покой, головке придают возвышенное положение. Детей, перенесших легкую асфиксию, помещают в кислородную палатку; детей, перенесших асфиксию средней тяжести и тяжелую, – в кувез. В связи с возможностью осложнений со стороны ЦНС за детьми, родившимися в асфиксии, после выписки из родильного стационара устанавливают диспансерное наблюдение педиатра и невропатолога.
Гемолитическая болезнь новорожденных
Этиология. Гемолитическая болезнь новорожденных (ГБН) развивается преимущественно в результате несовместимости крови матери и плода по резус-фактору (Rh-фактору) или групповым антигенам, реже – по другим антигенным системам из-за их меньшей иммуногенности.
Резус-конфликт возникает, если у резус-отрицательной женщины плод имеет резус-положительную кровь.
Резус-фактор, содержащийся в эритроцитах плода, попадая через плаценту в кровь матери, вызывает образование резус-антител. Часть этих антител переходит через плаценту в кровь плода и вызывает агглютинацию и гемолиз эритроцитов. Прямой зависимости между высоким титром резус-антител у матери и тяжестью гемолитической болезни у новорожденных нет. ГБН у новорожденных при резус-несовместимости развивается обычно после второй беременности либо в случае сенсибилизации женщины в результате переливаний резус-положительной крови.
АВО-конфликт развивается при наличии О (I) группы крови у женщины, а у плода – А (II) (в 2/3 случаев) или В (III) (в 1/3 случаев). При несовместимости крови по системе АВО обычно страдают дети уже при первой беременности.
Существует мнение, что гемолитическая болезнь новорожденных по системе АВО развивается не реже, а даже чаще, чем по резус-фактору, но протекает в большинстве случаев легче, и ее нередко не диагностируют.
Клиника. Различают отечную (2 %), желтушную (88 %), анемическую (10 %) формы заболевания.
Самая тяжелая – отечная форма, развивается внутриутробно. Ребенок погибает до рождения или рождается в крайне тяжелом состоянии с распространенными отеками, часто недоношенным и умирает в первые минуты или часы после рождения. Характерен внешний вид новорожденного: восковидная бледность, иногда легкая желтушность или цианотичность кожных покровов, лунообразное лицо, общий отек подкожной клетчатки, гепатоспленомегалия, живот большой, бочкообразный, свободная жидкость в полостях (плевральной, перикардиальной, брюшной), кровоподтеки, петехии.
В крови отмечаются резкое снижение содержания гемоглобина (менее 100 г/л) и эритроцитов (1,5–1,7 1012/л и менее), эритробластоз, лейкоцитоз, высокий ретикулоцитоз, нормобласты, миелоциты.
Желтушная форма – наиболее частая форма заболевания. Она может быть тяжелой, средней и легкой степени тяжести. Основные симптомы – рано возникающие желтуха, анемия и гепатоспленомегалия. Желтуха появляется сразу после рождения или спустя несколько часов и быстро нарастает. При тяжелых формах ребенок рождается желтушным. Околоплодные воды и первородная смазка могут быть окрашены в желтый цвет. При легких формах нередко выраженная желтуха появляется в первые двое суток.
По мере нарастания билирубиновой интоксикации дети становятся вялыми, сонливыми, плохо сосут, появляются гипорефлексия, гипотония, монотонный крик, патологическое зевание. Увеличиваются печень и селезенка. Наблюдается склонность к кровотечениям и кожным кровоизлияниям. Моча темного цвета, проба Гмелина положительная. Окраска стула нормальная.
На 3-4-е сутки содержание неконъюгированного билирубина может достигнуть максимума. В этих случаях, если не будет предпринята активная терапия, появляются симптомы ядерной желтухи: ригидность мышц затылка, тонические судороги мышц-разгибателей, «мозговой» крик, симптом «заходящего солнца», выбухание большого родничка.
К концу первой недели жизни развивается синдром сгущения желчи, появляются признаки холестаза. Кожа приобретает зеленоватый оттенок, кал обесцвечивается, моча темнеет, в крови повышается содержание конъюгированного билирубина. В тяжелых случаях желтушное окрашивание кожи сохраняется длительно. Желтушная форма гемолитической болезни новорожденных обычно сопровождается гиперхромной анемией. Продолжительность анемии зависит от тяжести заболевания и вида лечения и может составлять до 2–3 мес.
Анемическая форма по течению наиболее доброкачественная. Общее состояние ребенка изменяется мало. Характерны бледность кожных покровов (отчетливо выявляется к 7-10-му дню после рождения), гепатоспленомегалия. В крови снижено количество гемоглобина и эритроцитов, микроцитоз, анизоцитоз, ретикулоцитоз, эритробластоз (не всегда), полихромазия. Небольшой сдвиг нейтрофилов влево.
Концентрация неконъюгированного билирубина может быть слегка повышена.
Диагноз. Учитывают клинические симптомы и данные лабораторных исследований. Большое значение имеют акушерский анамнез матери (указание на самопроизвольные аборты, мертворождения, смерть предшествующих детей от желтухи в первые дни после рождения), определение резус-фактора крови матери (проводится повторно). Сразу же после рождения у ребенка определяют количество гемоглобина, уровень билирубина в крови, группу крови, резус-фактор и проводят пробу Кумбса.
Очень важна антенатальная диагностика возможного иммунологического конфликта.
Лечение. В настоящее время основным методом лечения гемолитической болезни новорожденных является заменное переливание крови. Абсолютные показания к заменному переливанию крови в первые сутки жизни у доношенных новорожденных следующие: концентрация неконъюгированного билирубина в пуповинной крови более 60 мкмоль/л; почасовой прирост концентрации неконъюгированного билирубина более 6-10 мкмоль/л; концентрация неконъюгированного билирубина в периферической крови более 340 мкмоль/л; тяжелая степень анемии (гемоглобин менее 100 г/л).
Для заменного переливания крови обычно используют резус-отрицательную кровь той же группы, что и кровь ребенка. В настоящее время переливают не цельную кровь, а резус-отрицательную эритроцитарную массу, смешанную со свежезамороженной плазмой. Если ГБН обусловлена групповой несовместимостью, то используют эритроцитарную массу 0 (I) группы, а плазму либо АВ (IV) группы, либо одногруппную.
При тяжелой форме гемолитической болезни заменное переливание крови делают многократно (3–5 раз).
Широко применяют фототерапию, назначают также индукторы микросомальных ферментов печени (например, фенобарбитал). Введение витаминов Е, В1, В2, В6, С, кокар-боксилазы улучшает работу печени и стабилизирует обменные процессы. При синдроме сгущения желчи назначают внутрь желчегонные средства (магния сульфат, аллохол, дротаверин). При выраженной анемии производят трансфузии эритроцитарной массы или отмытых эритроцитов. Прогноз зависит от степени тяжести ГБН.
Резус-конфликт возникает, если у резус-отрицательной женщины плод имеет резус-положительную кровь.
Резус-фактор, содержащийся в эритроцитах плода, попадая через плаценту в кровь матери, вызывает образование резус-антител. Часть этих антител переходит через плаценту в кровь плода и вызывает агглютинацию и гемолиз эритроцитов. Прямой зависимости между высоким титром резус-антител у матери и тяжестью гемолитической болезни у новорожденных нет. ГБН у новорожденных при резус-несовместимости развивается обычно после второй беременности либо в случае сенсибилизации женщины в результате переливаний резус-положительной крови.
АВО-конфликт развивается при наличии О (I) группы крови у женщины, а у плода – А (II) (в 2/3 случаев) или В (III) (в 1/3 случаев). При несовместимости крови по системе АВО обычно страдают дети уже при первой беременности.
Существует мнение, что гемолитическая болезнь новорожденных по системе АВО развивается не реже, а даже чаще, чем по резус-фактору, но протекает в большинстве случаев легче, и ее нередко не диагностируют.
Клиника. Различают отечную (2 %), желтушную (88 %), анемическую (10 %) формы заболевания.
Самая тяжелая – отечная форма, развивается внутриутробно. Ребенок погибает до рождения или рождается в крайне тяжелом состоянии с распространенными отеками, часто недоношенным и умирает в первые минуты или часы после рождения. Характерен внешний вид новорожденного: восковидная бледность, иногда легкая желтушность или цианотичность кожных покровов, лунообразное лицо, общий отек подкожной клетчатки, гепатоспленомегалия, живот большой, бочкообразный, свободная жидкость в полостях (плевральной, перикардиальной, брюшной), кровоподтеки, петехии.
В крови отмечаются резкое снижение содержания гемоглобина (менее 100 г/л) и эритроцитов (1,5–1,7 1012/л и менее), эритробластоз, лейкоцитоз, высокий ретикулоцитоз, нормобласты, миелоциты.
Желтушная форма – наиболее частая форма заболевания. Она может быть тяжелой, средней и легкой степени тяжести. Основные симптомы – рано возникающие желтуха, анемия и гепатоспленомегалия. Желтуха появляется сразу после рождения или спустя несколько часов и быстро нарастает. При тяжелых формах ребенок рождается желтушным. Околоплодные воды и первородная смазка могут быть окрашены в желтый цвет. При легких формах нередко выраженная желтуха появляется в первые двое суток.
По мере нарастания билирубиновой интоксикации дети становятся вялыми, сонливыми, плохо сосут, появляются гипорефлексия, гипотония, монотонный крик, патологическое зевание. Увеличиваются печень и селезенка. Наблюдается склонность к кровотечениям и кожным кровоизлияниям. Моча темного цвета, проба Гмелина положительная. Окраска стула нормальная.
На 3-4-е сутки содержание неконъюгированного билирубина может достигнуть максимума. В этих случаях, если не будет предпринята активная терапия, появляются симптомы ядерной желтухи: ригидность мышц затылка, тонические судороги мышц-разгибателей, «мозговой» крик, симптом «заходящего солнца», выбухание большого родничка.
К концу первой недели жизни развивается синдром сгущения желчи, появляются признаки холестаза. Кожа приобретает зеленоватый оттенок, кал обесцвечивается, моча темнеет, в крови повышается содержание конъюгированного билирубина. В тяжелых случаях желтушное окрашивание кожи сохраняется длительно. Желтушная форма гемолитической болезни новорожденных обычно сопровождается гиперхромной анемией. Продолжительность анемии зависит от тяжести заболевания и вида лечения и может составлять до 2–3 мес.
Анемическая форма по течению наиболее доброкачественная. Общее состояние ребенка изменяется мало. Характерны бледность кожных покровов (отчетливо выявляется к 7-10-му дню после рождения), гепатоспленомегалия. В крови снижено количество гемоглобина и эритроцитов, микроцитоз, анизоцитоз, ретикулоцитоз, эритробластоз (не всегда), полихромазия. Небольшой сдвиг нейтрофилов влево.
Концентрация неконъюгированного билирубина может быть слегка повышена.
Диагноз. Учитывают клинические симптомы и данные лабораторных исследований. Большое значение имеют акушерский анамнез матери (указание на самопроизвольные аборты, мертворождения, смерть предшествующих детей от желтухи в первые дни после рождения), определение резус-фактора крови матери (проводится повторно). Сразу же после рождения у ребенка определяют количество гемоглобина, уровень билирубина в крови, группу крови, резус-фактор и проводят пробу Кумбса.
Очень важна антенатальная диагностика возможного иммунологического конфликта.
Лечение. В настоящее время основным методом лечения гемолитической болезни новорожденных является заменное переливание крови. Абсолютные показания к заменному переливанию крови в первые сутки жизни у доношенных новорожденных следующие: концентрация неконъюгированного билирубина в пуповинной крови более 60 мкмоль/л; почасовой прирост концентрации неконъюгированного билирубина более 6-10 мкмоль/л; концентрация неконъюгированного билирубина в периферической крови более 340 мкмоль/л; тяжелая степень анемии (гемоглобин менее 100 г/л).
Для заменного переливания крови обычно используют резус-отрицательную кровь той же группы, что и кровь ребенка. В настоящее время переливают не цельную кровь, а резус-отрицательную эритроцитарную массу, смешанную со свежезамороженной плазмой. Если ГБН обусловлена групповой несовместимостью, то используют эритроцитарную массу 0 (I) группы, а плазму либо АВ (IV) группы, либо одногруппную.
При тяжелой форме гемолитической болезни заменное переливание крови делают многократно (3–5 раз).
Широко применяют фототерапию, назначают также индукторы микросомальных ферментов печени (например, фенобарбитал). Введение витаминов Е, В1, В2, В6, С, кокар-боксилазы улучшает работу печени и стабилизирует обменные процессы. При синдроме сгущения желчи назначают внутрь желчегонные средства (магния сульфат, аллохол, дротаверин). При выраженной анемии производят трансфузии эритроцитарной массы или отмытых эритроцитов. Прогноз зависит от степени тяжести ГБН.
Геморрагическая болезнь новорожденных
Это коагулопатия, которая возникает у ребенка между 24 и 72 часами жизни и часто связана с нехваткой витамина К. Как следствие его дефицита развивается недостаток производства в печени факторов свертывания II, VII, IX, X, С, S.
Этиология. Сравнительно низкий уровень витамина К у новорожденных вызван несколькими причинами: имеют пониженные запасы витамина; витамин плохо проходит через плаценту; его может быть мало в молоке; нормальная микрофлора кишечника еще не развита (в норме витамин К производится бактериями в кишечнике). У новорожденных уровень факторов VII, X, II и IX уменьшен до 30–70 % нормы. В течение первых 4–7 дней после рождения наблюдается дальнейшее снижение концентрации этих факторов в плазме. Болезни матери и прием ею во время беременности препаратов, способствующих К-гиповитаминозу, а также акушерская патология (асфиксия плода, травматичные роды) способствуют развитию геморрагической болезни новорожденных. Она усугубляется и энтеропатией новорожденных, назначением им антибиотиков при пневмонии, сепсисе и других заболеваниях.
Клиника. Кровоизлияния бывают видимые (кровавый стул, кровавая рвота, кровотечения из пупочной ранки, носа, легких, мочеполовых путей, кровоизлияния в кожу, конъюктивы и т. д.) и скрытые (внутричерепные, в надпочечники, печеночные и др.). Частым проявлением геморрагической болезни новорожденных является истинная мелена, характеризующаяся кровавой рвотой и кровавыми испражнениями 3–4 раза в день. Испражнения темно-красного цвета или черные. Заболевание выявляется на 2-3-й день после рождения, реже сразу после рождения и продолжается 1–3 дня. Редко встречаются тяжелые формы, при которых кровь выделяется из ануса почти непрерывно, имеется упорная кровянистая рвота, развивается тяжелая анемия. Ребенок становится вялым, худеет, может развиться транзиторная лихорадка.
Раннее кормление молозивом смягчает эту депрессию К-витаминзависимых факторов, также решающую роль играет заселение кишечника ребенка нормальной микрофлорой, продуцирующей витамин К. К концу 2-й недели жизни дефицит К-витаминзависимых факторов у большинства детей полностью устраняется.
Чаще недостаточность К-витаминзависимых факторов у новорожденных остается субклинической. Клинически выраженные формы в основном наблюдаются при недоношенности.
Диагноз. Ставят на основании клинических данных. Дифференцировать следует от синдрома проглоченной крови, так называемой ложной мелены (заглатывание крови во время рождения, при трещинах сосков, кровотечениях из носа у ребенка; при этом наблюдаются рвота с кровью и примесь крови в кале); гемофилии и тромбопатии.
Лечение. Витамин К в дозе 2–5 мг 2–3 раза в день внутримышечно в виде 1 % раствора викасола: 0,3–0,5 мл доношенным, 0,2–0,3 мл недоношенным.
В тяжелых случаях немедленное переливание свежей крови одноименной группы из расчета 10–15 мл/кг, внутривенные вливания 10–20 мл/кг тромбоцитной массы. При мелене можно назначить внутрь раствор тромбина в аминокапроновой кислоте по 1 чайной ложке 3 раза в день (ампулу сухого тромбина растворяют в 50 мл 5 % раствора аминокапроновой кислоты и добавляют 1 мл 0,025 % раствора андроксона).
Прогноз благоприятный только при своевременном принятии необходимых мер.
Этиология. Сравнительно низкий уровень витамина К у новорожденных вызван несколькими причинами: имеют пониженные запасы витамина; витамин плохо проходит через плаценту; его может быть мало в молоке; нормальная микрофлора кишечника еще не развита (в норме витамин К производится бактериями в кишечнике). У новорожденных уровень факторов VII, X, II и IX уменьшен до 30–70 % нормы. В течение первых 4–7 дней после рождения наблюдается дальнейшее снижение концентрации этих факторов в плазме. Болезни матери и прием ею во время беременности препаратов, способствующих К-гиповитаминозу, а также акушерская патология (асфиксия плода, травматичные роды) способствуют развитию геморрагической болезни новорожденных. Она усугубляется и энтеропатией новорожденных, назначением им антибиотиков при пневмонии, сепсисе и других заболеваниях.
Клиника. Кровоизлияния бывают видимые (кровавый стул, кровавая рвота, кровотечения из пупочной ранки, носа, легких, мочеполовых путей, кровоизлияния в кожу, конъюктивы и т. д.) и скрытые (внутричерепные, в надпочечники, печеночные и др.). Частым проявлением геморрагической болезни новорожденных является истинная мелена, характеризующаяся кровавой рвотой и кровавыми испражнениями 3–4 раза в день. Испражнения темно-красного цвета или черные. Заболевание выявляется на 2-3-й день после рождения, реже сразу после рождения и продолжается 1–3 дня. Редко встречаются тяжелые формы, при которых кровь выделяется из ануса почти непрерывно, имеется упорная кровянистая рвота, развивается тяжелая анемия. Ребенок становится вялым, худеет, может развиться транзиторная лихорадка.
Раннее кормление молозивом смягчает эту депрессию К-витаминзависимых факторов, также решающую роль играет заселение кишечника ребенка нормальной микрофлорой, продуцирующей витамин К. К концу 2-й недели жизни дефицит К-витаминзависимых факторов у большинства детей полностью устраняется.
Чаще недостаточность К-витаминзависимых факторов у новорожденных остается субклинической. Клинически выраженные формы в основном наблюдаются при недоношенности.
Диагноз. Ставят на основании клинических данных. Дифференцировать следует от синдрома проглоченной крови, так называемой ложной мелены (заглатывание крови во время рождения, при трещинах сосков, кровотечениях из носа у ребенка; при этом наблюдаются рвота с кровью и примесь крови в кале); гемофилии и тромбопатии.
Лечение. Витамин К в дозе 2–5 мг 2–3 раза в день внутримышечно в виде 1 % раствора викасола: 0,3–0,5 мл доношенным, 0,2–0,3 мл недоношенным.
В тяжелых случаях немедленное переливание свежей крови одноименной группы из расчета 10–15 мл/кг, внутривенные вливания 10–20 мл/кг тромбоцитной массы. При мелене можно назначить внутрь раствор тромбина в аминокапроновой кислоте по 1 чайной ложке 3 раза в день (ампулу сухого тромбина растворяют в 50 мл 5 % раствора аминокапроновой кислоты и добавляют 1 мл 0,025 % раствора андроксона).
Прогноз благоприятный только при своевременном принятии необходимых мер.
Пневмопатии новорожденных
Пневмопатии – это неинфекционные патологические процессы в легких, которые формируются во внутриутробном и раннем неонатальном периодах и проявляются клинически в первые дни жизни синдромом дыхательных расстройств (СДР). Как правило, болезнь регистрируется у недоношенных детей. При рациональном и своевременном лечении младенцев летальность исхода составляет примерно 10 %.
Этиология. СДР (респираторный дистресс-синдром новорожденных) чаще наблюдается у недоношенных детей (60 % —при 28-недельном сроке недонашивания, 15–20 % – при сроке 32–36 недель). К развитию СДР приводят ателектазы легких, гиалиновые мембраны, отечно-геморрагический синдром, массивные кровоизлияния в легкие, врожденные пороки развития легких, а также пневмонии и внутричерепная родовая травма.
Клиника. СДР характеризуется общим тяжелым состоянием сразу после рождения. Дыхание затрудненное и учащенное до 100 в мин (норма 40 в мин). Кожные покровы при рождении могут быть розовыми, но через 1–2 часа в тяжелых случаях быстро нарастает цианоз, ребенок не реагирует на раздражители и впадает в кому. При более легком течении СДР отмечается умеренное угнетение, слабый крик, симптомы раздражения ЦНС в виде тремора, гиперестезии кожи, смена угнетения возбуждением и др.
Постоянным клиническим симптомом СДР является изменение частоты и характера дыхания – смена учащенного дыхания на периоды апноэ продолжительностью от нескольких секунд до минуты. Дыхание сопровождается втяжением и западением нижней части грудной клетки, может наблюдаться дыхание типа «качелей», при котором грудная клетка втягивается, а живот выпячивается. В некоторых случаях при СДР отмечается опускание нижней челюсти и звучный выдох. При аускультации в легких определяются ослабленное дыхание и крепитирующие хрипы. Со стороны сердечно-сосудистой системы характерна тахикардия, приглушенность тонов сердца, повышенное артериальное давление, цианоз. У большинства детей с СДР наблюдается отек рук и стоп. Физиологическая убыль веса достигает 10–12 %.
При тяжелой форме СДР отмечается угнетение функции ЦНС: резкая вялость, мышечная гипотония, ограничение двигательной активности вплоть до полной адинамии, снижение физиологических рефлексов, гипотермия, слабый крик.
Ателектазы легких. Под ателектазом легких у новорожденных подразумевают сохранение после 48 часов жизни участков нерасправившейся или вторично спавшейся после первого вдоха легочной ткани.
Основные причины – недоразвитие дыхательного центра, снижение его возбудимости, незрелость легочной ткани, нарушение образования сурфактанта, в связи с чем наиболее часто эта патология отмечается у недоношенных детей.
Различают два типа ателектазов: рассеянные (мелкие) и обширные (сегментарные и полисегментарные). Сегментарные ателектазы отмечаются у более зрелых детей.
Обширные ателектазы характеризуются синдромом дыхательных расстройств; аускультативно – ослабленное дыхание и непостоянная крепитация на стороне поражения; усиленное дыхание на здоровой стороне. Иногда наблюдается одностороннее уплощение грудной клетки. Распространенные полисегментарные ателектазы сопровождаются сердечно-сосудистыми нарушениями (цианоз, тахикардия, пульсация крупных сосудов).
Мелкие рассеянные ателектазы обычно характеризуются различной степени дыхательной недостаточностью в сочетании с общим угнетением нервной системы и сердечно-сосудистыми нарушениями. При перкуссии звук может иметь коробочный оттенок, при аускультации – равномерно ослабленное дыхание, возможна крепитация. Неосложненные ателектазы в большинстве случаев расправляются в течение 4–5 дней. Летальный исход наступает в случаях, когда ателектазы сочетаются с другими пневмопатиями.
Длительно нерасправляющиеся ателектазы осложняются воспалительным процессом.
Гиалиновые мембраны – это патологические изменения в легких, при которых на внутренней поверхности альвеол, альвеолярных ходов и респираторных бронхиол отмечается отложение гиалиноподобного вещества, состоящего из сложного белково-углеводного комплекса. Чаще встречается у недоношенных детей, у детей больных матерей (сахарный диабет и др.), особенно у извлеченных с помощью кесарева сечения и родившихся в асфиксии. Важными патогенетическими факторами являются незрелость легких, гипоксия, гиперкапния, повышенная проницаемость капилляров, нарушение процессов свертывания крови. Патогенез гиалиновых мембран связан также с нарушением синтеза сурфактанта.
Новорожденные с гиалиновыми мембранами в первые часы после рождения могут казаться здоровыми. Постепенно усиливаются одышка и цианоз, достигая крайней степени. Ярким клиническим симптомом является инспираторная одышка (60-100 в минуту) с западением грудины, втяжением межреберных промежутков, надключичных впадин и раздуванием крыльев носа. Дыхание поверхностное, судорожное. При общем тяжелом состоянии физикальные данные часто скудны. Параллельно развивается сердечная недостаточность. Кожные покровы бледные с сероватоземлистым оттенком, появляются периферические отеки, вслед за ними – пенистая розовая жидкость из носа и рта, судороги.
Типичный рентгенологический признак – «нодозно-ретикулярная сетка», в наиболее тяжелых случаях на рентгенограмме наблюдаются гомогенные затемнения легочных полей различной интенсивности, делающие неразличимыми контуры сердца, больших сосудов и диафрагмы.
Большинство детей погибает в первые 2–3 дня. Если ребенок переживает этот срок, прогноз может быть благоприятным.
Отечно-геморрагический синдром – одна из самых тяжелых форм пневмопатий, возникающая вследствие общей патологической гидратации всего организма, наступающая вследствие нарушения обменных процессов и внутриутробной гипоксии. Этот синдром связан с патологической незрелостью органов дыхания. Всегда сочетается с рассеянными ателектазами легких, особенно у недоношенных детей.
Выражены синдром дыхательных расстройств; нарушения сердечно-сосудистой деятельности: аритмия, цианоз, бледность кожных покровов; возникают или усиливаются судороги, нарушаются сосание и глотание. При обильной гидратации изо рта выделяется пенистая жидкость. Аускультативно выявляют жесткое дыхание, разнокалиберные хрипы. Рентгенологически детали легочных структур выглядят расплывчатыми, воздухоносность легочной ткани снижается, особенно в прикорневых и корневых отделах. При значительной отечности все легкое становится гомогенно затемненным.
Этиология. СДР (респираторный дистресс-синдром новорожденных) чаще наблюдается у недоношенных детей (60 % —при 28-недельном сроке недонашивания, 15–20 % – при сроке 32–36 недель). К развитию СДР приводят ателектазы легких, гиалиновые мембраны, отечно-геморрагический синдром, массивные кровоизлияния в легкие, врожденные пороки развития легких, а также пневмонии и внутричерепная родовая травма.
Клиника. СДР характеризуется общим тяжелым состоянием сразу после рождения. Дыхание затрудненное и учащенное до 100 в мин (норма 40 в мин). Кожные покровы при рождении могут быть розовыми, но через 1–2 часа в тяжелых случаях быстро нарастает цианоз, ребенок не реагирует на раздражители и впадает в кому. При более легком течении СДР отмечается умеренное угнетение, слабый крик, симптомы раздражения ЦНС в виде тремора, гиперестезии кожи, смена угнетения возбуждением и др.
Постоянным клиническим симптомом СДР является изменение частоты и характера дыхания – смена учащенного дыхания на периоды апноэ продолжительностью от нескольких секунд до минуты. Дыхание сопровождается втяжением и западением нижней части грудной клетки, может наблюдаться дыхание типа «качелей», при котором грудная клетка втягивается, а живот выпячивается. В некоторых случаях при СДР отмечается опускание нижней челюсти и звучный выдох. При аускультации в легких определяются ослабленное дыхание и крепитирующие хрипы. Со стороны сердечно-сосудистой системы характерна тахикардия, приглушенность тонов сердца, повышенное артериальное давление, цианоз. У большинства детей с СДР наблюдается отек рук и стоп. Физиологическая убыль веса достигает 10–12 %.
При тяжелой форме СДР отмечается угнетение функции ЦНС: резкая вялость, мышечная гипотония, ограничение двигательной активности вплоть до полной адинамии, снижение физиологических рефлексов, гипотермия, слабый крик.
Ателектазы легких. Под ателектазом легких у новорожденных подразумевают сохранение после 48 часов жизни участков нерасправившейся или вторично спавшейся после первого вдоха легочной ткани.
Основные причины – недоразвитие дыхательного центра, снижение его возбудимости, незрелость легочной ткани, нарушение образования сурфактанта, в связи с чем наиболее часто эта патология отмечается у недоношенных детей.
Различают два типа ателектазов: рассеянные (мелкие) и обширные (сегментарные и полисегментарные). Сегментарные ателектазы отмечаются у более зрелых детей.
Обширные ателектазы характеризуются синдромом дыхательных расстройств; аускультативно – ослабленное дыхание и непостоянная крепитация на стороне поражения; усиленное дыхание на здоровой стороне. Иногда наблюдается одностороннее уплощение грудной клетки. Распространенные полисегментарные ателектазы сопровождаются сердечно-сосудистыми нарушениями (цианоз, тахикардия, пульсация крупных сосудов).
Мелкие рассеянные ателектазы обычно характеризуются различной степени дыхательной недостаточностью в сочетании с общим угнетением нервной системы и сердечно-сосудистыми нарушениями. При перкуссии звук может иметь коробочный оттенок, при аускультации – равномерно ослабленное дыхание, возможна крепитация. Неосложненные ателектазы в большинстве случаев расправляются в течение 4–5 дней. Летальный исход наступает в случаях, когда ателектазы сочетаются с другими пневмопатиями.
Длительно нерасправляющиеся ателектазы осложняются воспалительным процессом.
Гиалиновые мембраны – это патологические изменения в легких, при которых на внутренней поверхности альвеол, альвеолярных ходов и респираторных бронхиол отмечается отложение гиалиноподобного вещества, состоящего из сложного белково-углеводного комплекса. Чаще встречается у недоношенных детей, у детей больных матерей (сахарный диабет и др.), особенно у извлеченных с помощью кесарева сечения и родившихся в асфиксии. Важными патогенетическими факторами являются незрелость легких, гипоксия, гиперкапния, повышенная проницаемость капилляров, нарушение процессов свертывания крови. Патогенез гиалиновых мембран связан также с нарушением синтеза сурфактанта.
Новорожденные с гиалиновыми мембранами в первые часы после рождения могут казаться здоровыми. Постепенно усиливаются одышка и цианоз, достигая крайней степени. Ярким клиническим симптомом является инспираторная одышка (60-100 в минуту) с западением грудины, втяжением межреберных промежутков, надключичных впадин и раздуванием крыльев носа. Дыхание поверхностное, судорожное. При общем тяжелом состоянии физикальные данные часто скудны. Параллельно развивается сердечная недостаточность. Кожные покровы бледные с сероватоземлистым оттенком, появляются периферические отеки, вслед за ними – пенистая розовая жидкость из носа и рта, судороги.
Типичный рентгенологический признак – «нодозно-ретикулярная сетка», в наиболее тяжелых случаях на рентгенограмме наблюдаются гомогенные затемнения легочных полей различной интенсивности, делающие неразличимыми контуры сердца, больших сосудов и диафрагмы.
Большинство детей погибает в первые 2–3 дня. Если ребенок переживает этот срок, прогноз может быть благоприятным.
Отечно-геморрагический синдром – одна из самых тяжелых форм пневмопатий, возникающая вследствие общей патологической гидратации всего организма, наступающая вследствие нарушения обменных процессов и внутриутробной гипоксии. Этот синдром связан с патологической незрелостью органов дыхания. Всегда сочетается с рассеянными ателектазами легких, особенно у недоношенных детей.
Выражены синдром дыхательных расстройств; нарушения сердечно-сосудистой деятельности: аритмия, цианоз, бледность кожных покровов; возникают или усиливаются судороги, нарушаются сосание и глотание. При обильной гидратации изо рта выделяется пенистая жидкость. Аускультативно выявляют жесткое дыхание, разнокалиберные хрипы. Рентгенологически детали легочных структур выглядят расплывчатыми, воздухоносность легочной ткани снижается, особенно в прикорневых и корневых отделах. При значительной отечности все легкое становится гомогенно затемненным.
