I – преобладание симптомов отравления билирубином – слабость, понижение мышечного тонуса и аппетита вплоть до отказа от еды, монотонный неэмоциональный крик, отрыжка, рвота.
II – появление классических признаков ядерной желтухи – спастичность, ригидность затылочных мышц, вынужденное положение тела с негнущимися конечностями и сжатыми в кулак кистями; периодическое возбуждение и резкий высокочастотный крик, выбухание большого родничка, подергивание мышц лица или полная амимия, судороги, исчезновение реакции на звук, сосательного рефлекса; остановки дыхания, иногда повышение температуры тела; прогрессирующее ухудшение неврологической симптоматики (обычно продолжается в течение суток).
III – период ложного благополучия и исчезновения спастичности (начиная с середины 2-й недели жизни), когда наблюдается обратное развитие неврологической симптоматики.
IV – период формирования клинической картины неврологических осложнений, начинается в конце периода новорожденности или на 3-5-м месяце жизни: параличи, парезы, нарушение слуха, детский церебральный паралич, задержка нервно-психического развития и др.
Летальный исход как следствие поражения мозга возможен как в первой, так и во второй фазе билирубиновой энцефалопатии и отмечается на фоне появления геморрагического синдрома, расстройств сердечной деятельности и дыхания. Анемическая форма выявляется у 10–20 % больных. Кожный покров у детей бледный, преобладает слабость, плохо развит сосательный рефлекс. У них наблюдается увеличение размеров печени и селезенки, в периферической крови – проявления анемии. Уровень непрямого билирубина обычно нормальный или умеренно повышенный. Признаки анемии появляются в конце 1-й или даже на 2-й неделе жизни. В ряде случаев анемия впервые развивается на 3-й неделе жизни и под влиянием внешних факторов – инфекционные заболевания, назначение некоторых медикаментов (сульфаниламиды, нитрофураны, парацетамол, витамин К, ацетилсалициловая кислота, антигистаминные препараты, тетрациклин и др.). Течение и прогноз ГБН зависят от формы и тяжести болезни, своевременности и правильности лечения. При отечной форме прогноз нередко неблагоприятный. Прогноз для жизни у большинства детей с желтушной формой болезни благоприятный. У 5-30 % больных с гипербилирубинемией 257–342 мкмоль/л, не имевших отчетливых неврологических расстройств в неонатальном периоде, в дальнейшем отмечаются задержки психомоторного развития, астенический синдром, неврозы и другие отклонения от нормы в нервно-психическом статусе. У детей, перенесших желтушную форму ГБН, наблюдается высокая инфекционная заболеваемость на 1-м году жизни. Течение АВ0-ГБН, как правило, более легкое, чем резус-ГБН: практически не встречается отечная форма, чаще бывает анемическая, а также – легкие и средней тяжести желтушные формы.
ДИАГНОСТИКА
ПРОГНОЗ
ПРОФИЛАКТИКА
ЛЕЧЕНИЕ
ЧАСТЬ III
ГЛАВА 1. БОЛЕЗНИ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
ВОСПАЛЕНИЕ СЕРДЕЧНОЙ МЫШЦЫ (МИОКАРДИТ)
II – появление классических признаков ядерной желтухи – спастичность, ригидность затылочных мышц, вынужденное положение тела с негнущимися конечностями и сжатыми в кулак кистями; периодическое возбуждение и резкий высокочастотный крик, выбухание большого родничка, подергивание мышц лица или полная амимия, судороги, исчезновение реакции на звук, сосательного рефлекса; остановки дыхания, иногда повышение температуры тела; прогрессирующее ухудшение неврологической симптоматики (обычно продолжается в течение суток).
III – период ложного благополучия и исчезновения спастичности (начиная с середины 2-й недели жизни), когда наблюдается обратное развитие неврологической симптоматики.
IV – период формирования клинической картины неврологических осложнений, начинается в конце периода новорожденности или на 3-5-м месяце жизни: параличи, парезы, нарушение слуха, детский церебральный паралич, задержка нервно-психического развития и др.
Летальный исход как следствие поражения мозга возможен как в первой, так и во второй фазе билирубиновой энцефалопатии и отмечается на фоне появления геморрагического синдрома, расстройств сердечной деятельности и дыхания. Анемическая форма выявляется у 10–20 % больных. Кожный покров у детей бледный, преобладает слабость, плохо развит сосательный рефлекс. У них наблюдается увеличение размеров печени и селезенки, в периферической крови – проявления анемии. Уровень непрямого билирубина обычно нормальный или умеренно повышенный. Признаки анемии появляются в конце 1-й или даже на 2-й неделе жизни. В ряде случаев анемия впервые развивается на 3-й неделе жизни и под влиянием внешних факторов – инфекционные заболевания, назначение некоторых медикаментов (сульфаниламиды, нитрофураны, парацетамол, витамин К, ацетилсалициловая кислота, антигистаминные препараты, тетрациклин и др.). Течение и прогноз ГБН зависят от формы и тяжести болезни, своевременности и правильности лечения. При отечной форме прогноз нередко неблагоприятный. Прогноз для жизни у большинства детей с желтушной формой болезни благоприятный. У 5-30 % больных с гипербилирубинемией 257–342 мкмоль/л, не имевших отчетливых неврологических расстройств в неонатальном периоде, в дальнейшем отмечаются задержки психомоторного развития, астенический синдром, неврозы и другие отклонения от нормы в нервно-психическом статусе. У детей, перенесших желтушную форму ГБН, наблюдается высокая инфекционная заболеваемость на 1-м году жизни. Течение АВ0-ГБН, как правило, более легкое, чем резус-ГБН: практически не встречается отечная форма, чаще бывает анемическая, а также – легкие и средней тяжести желтушные формы.
ДИАГНОСТИКА
Подозрение на ГБН возникает при: ГБН у предшествующих детей в семье; желтухе, появившейся в первые сутки жизни; Rh(-) и/или 0(I) матери и Rh(+) А(II), В(III), АВ(IV) предполагает принадлежности ребенка; неэффективности фототерапии; увеличении уровня билирубина более 3,4 мкмоль/л/ч; наличии у ребенка анемии, бледности и /или увеличения размеров печени и селезенки. Диагностировать ГБН тяжелого течения можно антенатально. У всех женщин с резус-отрицательной кровью не менее трех раз исследуется титр антирезусных антител. Первое исследование проводят при постановке на учет в женскую консультацию. Повторное исследование оптимально провести в 18–20 недель, а в III триместре беременности производить его каждые 4 недели. Титр резус-антител у матери не позволяет точно предсказать будущую тяжесть ГБН у ребенка, и большую ценность имеет определение уровня билирубина в околоплодных водах. Если титр резус-антител 1: 16-1: 32 и больший, то в 26–28 недель проводят амниоцентез и определяют концентрацию билирубиноподобных веществ в околоплодных водах. За 2–3 недели до предполагаемых родов надо оценить зрелость легких, и если они незрелы, назначить матери дексаметазон или бетаметазон. Однако не всегда степень повышения титра резус-антител в крови беременной соответствует тяжести ГБН. Прогностически неблагоприятным является «скачущий» титр резус-антител у беременной; в этом случае чаще развиваются тяжелые желтушные формы ГБН. Другим современным методом диагностики врожденной отечной формы ГБН является ультразвуковое исследование, выявляющее отек плода.
План обследования при подозрении на ГБН.
1. Определение группы крови и резус-принадлежности матери и ребенка.
2. Анализ периферической крови ребенка с оценкой мазка крови.
3. Анализ крови с подсчетом количества ретикулоцитов.
4. Динамическое определение концентрации билирубина в сыворотке крови ребенка.
5. Иммунологические исследования.
У всех детей резус-отрицательных матерей в пуповинной крови определяют группу крови и резус-принадлежность, уровень билирубина сыворотки. При резус-несовместимости определяют титр резус-антител в крови и молоке матери, анализируют динамику резус-антител в крови матери во время беременности и исход предыдущих беременностей. Изменения в периферической крови ребенка: анемия, гиперретикулоцитоз.
План обследования при подозрении на ГБН.
1. Определение группы крови и резус-принадлежности матери и ребенка.
2. Анализ периферической крови ребенка с оценкой мазка крови.
3. Анализ крови с подсчетом количества ретикулоцитов.
4. Динамическое определение концентрации билирубина в сыворотке крови ребенка.
5. Иммунологические исследования.
У всех детей резус-отрицательных матерей в пуповинной крови определяют группу крови и резус-принадлежность, уровень билирубина сыворотки. При резус-несовместимости определяют титр резус-антител в крови и молоке матери, анализируют динамику резус-антител в крови матери во время беременности и исход предыдущих беременностей. Изменения в периферической крови ребенка: анемия, гиперретикулоцитоз.
ПРОГНОЗ
Физическое и психомоторное развитие подавляющего большинства детей, перенесших желтушную форму ГБН, соответствует средним возрастным нормативам. В то же время у детей, перенесших ГБН, отмечается повышенная заболеваемость инфекционными болезнями.
ПРОФИЛАКТИКА
Учитывая большое значение предшествующей сенсибилизации в механизмах развития ГБН, а также важную роль иммунологических механизмов в развитии гестоза, каждую девочку надо рассматривать как будущую мать и проводить гемотранс-фузию только по жизненным показаниям. В профилактике ГБН важное место отводится работе по разъяснению женщинам вреда аборта. Для предупреждения рождения ребенка с ГБН всем женщинам, имеющим резус-отрицательную принадлежность крови, в первый день после родов или аборта следует ввести анти-D-глобулин, который способствует быстрой элиминации эритроцитов ребенка из кровотока матери, предотвращая синтез резус-антител матерью. Женщинам с высоким титром резус-антител в крови во время беременности для профилактики ГБН делают подсадку кожи мужа (в подмышечную область – лоскут размером 2 × 2 см); на 16–32 неделе беременности 2-3-кратно с интервалом в 4-6-8 недель проводят плазмаферез (удаление плазмы с резус-антителами и введение обратно эритроцитов); проводят родоразрешение на 37-39-й неделе беременности путем кесарева сечения. Беременных с высоким титром антирезус-антител целесообразно госпитализировать на 12–14 дней в дородовое отделение в сроки 8, 16, 24, 28 и 32 недели. Женщинам проводится неспецифическое лечение: внутривенные вливания глюкозы с аскорбиновой кислотой, кокарбоксилазой, витамины Е, В6, глюконат кальция, кислородная и антианемическая терапия.
ЛЕЧЕНИЕ
При врожденной отечной форме ГБН необходимо немедленно (в течение 5-10 с) пережать пуповину. Необходимы температурная защита, срочное начало инфузионной терапии. При желтушной форме кормление начинают как можно раньше и проводят донорским молоком в количестве, соответствующем возрасту, до исчезновения изоантител в молоке матери, что бывает обычно в конце 1-й недели жизни. Однако даже если мать какое-то время не кормит грудью, нужно сделать все для сохранения лактации, т. е. она должна тщательно сцеживать молоко. После пастеризации материнское молоко можно давать и ее ребенку с ГБН. Лечение повышенного содержания билирубина в крови делится на консервативное и оперативное. Фототерапия в настоящее время – это наиболее широко используемый метод консервативного лечения желтухи новорожденных с непрямым билирубином в крови. Установлено, что это практически безопасный и эффективный метод лечения. Положительный эффект фототерапии заключается в увеличении выделения билирубина из организма с калом и мочой, уменьшении токсичности непрямого билирубина и риска ядерной желтухи при высоком уровне непрямого билирубина. Длительность фототерапии зависит от ее эффективности, т. е. темпов снижения уровня непрямого билирубина в крови. Обычная длительность фототерапии составляет 72–96 ч, но она может быть и меньшей, если уровень непрямого билирубина достиг физиологического для ребенка соответствующего возраста. Эффективность фототерапии повышается при сочетании ее с инфузионной терапией. Фототерапия – единственный метод консервативного лечения гипербилирубинемий, эффективность которого общепризнанна. Однако в настоящее время рассматривается возможность применения препаратов, адсорбирующих в кишечнике непрямой билирубин. Абсолютным показанием для заменного переливания крови у доношенных детей в России является гипербилирубинемия выше 342 мкмоль/л, темп нарастания билирубина – выше 9,0 мкмоль/л/ч и уровень его в пуповинной крови – выше 60,0 мкмоль/л. Показанием к заменному переливанию крови в 1-е сутки жизни является также появление желтухи или выраженной бледности кожных покровов в первые часы жизни ребенка с увеличением размеров печени или селезенки, а со стороны крови – тяжелой анемии и доказанной несовместимости крови матери и ребенка по группе или фактору. При резус-конфликте для заменного переливания крови используют кровь той же группы, что и у ребенка, резус-отрицательную не более 2–3 дней консервации в количестве 160–170 мл/кг. При АВ0-конфликте переливают кровь 0(I) в количестве 250–400 мл. После заменного переливания крови обязательно назначают консервативную терапию-фототерапию, инфузионную для лечения или предотвращения гипогликемии. Энтеральное питание начинают через 6–8 ч.
ЧАСТЬ III
ДЕТСКИЕ БОЛЕЗНИ
ГЛАВА 1. БОЛЕЗНИ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
ВОСПАЛЕНИЕ СЕРДЕЧНОЙ МЫШЦЫ (МИОКАРДИТ)
Миокардит – заболевание миокарда, не связанное с β-гемолитическим стрептококком группы А, системными заболеваниями соединительной ткани или другими системными заболеваниями. Миокардит представляет собой воспаление сердечной мышцы инфекционно-аллергической или инфекционно-токсической природы.
Распространенность. Миокардиты встречаются довольно часто. Чаще наблюдаются у мальчиков, чем у девочек. Они нередко возникают в 4–5 лет и в подростковом возрасте.
Причины заболевания. Механизмы развития заболевания. Миокардиты часто развиваются под воздействием различных факторов. Это могут быть:
1) вирусная инфекция;
2) бактерии, риккетсии и спирохеты;
3) различные виды простейших;
4) грибковая инфекция;
5) токсические агенты;
6) биологически активные вещества.
Для большинства миокардитов характерен аллергический и аутосомный компонент. При вирусной, риккетсиозной, трипаносомной инфекции возбудитель локализуется внутриклеточно в кардиомиоцитах или интерстициальной ткани миокарда, где образуются микроабсцессы.
При воздействии токсинов при миокардитах дифтерийной этиологии, стрептококковой, стафилококковой инфекции развивается инфекционно-токсический шок.
При риккетсиозных инфекциях повреждается эпителий сосудов и развивается воспаление, при этом цитотоксины негативно влияют на миокардит.
Различают паренхиматозный и интерстициальный миокардиты.
Миокардит может быть очаговым или распространенным.
По данным миокардиальной биопсии миокардит может быть лимфоцитарным – при вирусной инфекции; нейтрофильным – при бактериальной инфекции; эозинофильным – при повышенной чувствительности при паразитарной инвазии, приеме лекарственных препаратов.
Классификация. Имеется классификация на основе МКБ-10 (Коваленко В. Н., 2000 г.).
1. Острый миокардит:
1) с установленной этиологией;
2) неуточненной этиологией.
2. Хронический неуточненный миокардит.
3. Миокардиофиброз.
4. Распространенность: изолированный (очаговый).
5. Течение: легкое, среднее, тяжелое.
6. Клинические варианты: аритмия, нарушение реполяризации, кардиалгии.
7. Сердечная недостаточность (СН 0-III степени).
Признаки сердечной недостаточности при неревматических кардитах делятся на следующие стадии.
I стадия. Признаки сердечной недостаточности отсутствуют и появляются после нагрузки в виде тахикардии или одышки.
IIА стадия. При левожелудочковой недостаточности число сердечных сокращений и число дыханий в минуту увеличены соответственно на 10–20 и 30–50 % относительно нормы. При правожелудочковой недостаточности печень выступает на 2–3 см из-под реберной дуги.
IIБ стадия. При левожелудочковой недостаточности число сердечных сокращений увеличено на 30–50 и 50–70 % от нормы, появляются акроцианоз, навязчивый кашель, влажные мелкие пузырчатые хрипы в легких.
При правожелудочковой недостаточности желудочки увеличены на 50–60 и 70-100 % и более относительно нормальных величин. При правожелудочковой недостаточности отмечаются увеличение печени и отечный синдром, сопровождающийся отеками на лице, ногах, гидраборакс, гидроперикард, асцит.
III стадия – тяжелые нарушения гемодинамики, нарушения обменных процессов и функций всех органов.
Клиника. Клиническая картина частично зависит от врожденного или приобретенного характера миокардита.
Внутриутробный миокардит часто диагностируется в первые недели или месяцы жизни обычно в связи с появлением сердечной недостаточности. Различают ранние и поздние кардиты. Ранние кардиты возникают на 4-7-м месяцах внутриутробной жизни и характеризуются развитием эластичной и фиброзной ткани в слоях миокардита без проявлений воспаления.
Поздние кардиты возникают после 7-го месяца внутриутробной жизни. В этих случаях имеет место воспаление миокардита без образования эластичной и фиброзной ткани.
Признаки раннего врожденного кардита отмечаются уже во внутриутробном периоде, но обычно он проявляется в первые недели жизни развитием острой сердечной недостаточности. У ребенка в первые часы жизни могут появиться следующие симптомы:
1) вялость;
2) мышечная гипотония;
3) пастозность или отечность лица;
4) одышка;
5) частые срыгивания;
6) цианоз;
7) отечность мягких тканей;
8) увеличение печени.
Границы сердца смещаются влево, отмечаются глухие тоны, учащение сердцебиения. На верхушке прослушивается систолический шум.
Рентгенологически устанавливается гипертрофия сердца и левого желудочка.
На ЭКГ определяются снижение вольтажа зубцов, преобладание биопотенциалов левого желудочка, удлинение интервала Q T, смещение сегмента ST, зубца Т.
На ФКГ отмечается снижение амплитуды I тона у верхушки.
ЭХО КГ отмечает расширение полости и гипертрофию миокарда левого желудочка при нормальных размерах правого желудочка. В дальнейшем прогрессирует сердечная недостаточность.
При поздних кардитах в первые месяцы жизни выявляются утомляемость ребенка при кормлении, отставание физического развития, потливость, признаки сердечной недостаточности.
Границы сердца умеренно расширены, тоны громкие или приглушенные. На рентгенограмме определяется увеличение размеров сердца. На ЭКГ регистрируются тахикардия, атриовентрикулярные блокады. При эхокардиографии отмечается расширение полости левого желудочка и левого предсердия.
Лечение. При тяжелых формах назначаются оксигенотерапия, антибактериальные препараты. В качестве противовоспалительной терапии – вольтарен и индометацин. Витаминотерапия.
В тяжелых случаях применяются глюкокортикоиды, антиагреганты, препараты калия.
При аритмиях показаны антиритмические средства.
В периоде обратного развития используются производные хинолина 6-12 месяцев, анаболические препараты.
В течение 5 лет проводится динамическое наблюдение с осмотром 1 раз в 3–6 месяцев.
Исходом неревматического кардита являются кардиосклероз, гипертрофия миокарда, слипчивый перикардит или клапанный порок.
Прогноз скорее неблагоприятный, но в некоторых случаях возможно выздоровление.
Клиника приобретенных миокардитов. Различают острый, подострый и хронический кардиты.
Клиника заболевания зависит от возраста больного, характера течения болезни.
Острый неревматический миокардит развивается в первые 2–3 года жизни вскоре после перенесенной инфекции. На первый план при развитии приобретенных миокардитов выступают экстракардиальные симптомы:
1) вялость;
2) утомляемость;
3) понижение аппетита;
4) срыгивания, рвота;
5) бледность;
6) цианоз в виде приступов.
На этом фоне нарастают симптомы левожелудочковой недостаточности.
Выражены следующие симптомы:
1) одышка;
2) шумы слабого наполнения;
3) ослабление сердечного толчка;
4) тахикардия;
5) ритм галопа;
6) короткий систолический шум на верхушке;
7) приглушенность тонов сердца.
Часто к приобретенному миокардиту присоединяются эндокардит и перикардит.
Подострый неревматический миокардит наблюдается у детей старшего возраста. Он отличается от острого миокардита более длительным течением и неэффективностью медикаментозной терапии. В этих случаях на первый план выступают поражения проводящей системы сердца с нарушениями ритма и формирования блокад.
Хронический рецидивирующий кардит встречается у детей старше трехлетнего возраста как результат острого или подострого кардита или как первично-хронический процесс. При первично-хроническом кардите начальный период протекает скрытно, он распознается при появлении признаков недостаточности кровообращения. Обычно появляются жалобы на повышенную утомляемость, боли в области сердца, одышку, учащенное сердцебиение, иногда – навязчивый кашель. У детей выявляется отставание в физическом развитии, пульсация в эпигастральной области, цианоз с малиновым оттенком. При обследовании отмечаются увеличение сердца, аритмия, систолический шум на верхушке или другие сердечные шумы.
У детей дошкольного и школьного возраста миокардиты протекают доброкачественно.
Различают три степени тяжести миокардита:
1) легкую;
2) среднюю;
3) тяжелую.
При легкой степени отмечаются очаговое поражение миокарда без расширения границ сердца, слабая выраженность клинических и параклинических признаков, отсутствие сердечной недостаточности.
Средняя тяжесть характеризуется многоочаговым поражением миокарда, выраженными общими симптомами, увеличением сердца, сердечной недостаточностью без застойных явлений.
В случае тяжелой степени отмечается диффузное поражение миокарда с увеличением сердца и выраженной сердечной недостаточностью с застойными явлениями.
Различают большие и малые признаки поражений миокарда.
К большим признакам относят:
1) патологические изменения на ЭКГ;
2) изменение в сторону повышения активности ферментов и коферментов в сыворотке крови;
3) кардиомегалии;
4) застойную сердечную недостаточность или кардиогенный шок.
К малым признакам относятся:
1) тахикардия;
2) ослабление I тона на верхушке;
3) ритм галопа.
Диагностика проводится путем:
1) исследования клинических анализов крови и мочи;
2) исследования биохимических анализов крови, в том числе протеинограммы, коагулограммы, С-реактивного белка, серомукоида, сиаловых кислот, лабораторных исследований на выявление возбудителя;
3) иммунологических обследований;
4) инструментальных обследований ЭКГ, ФКГ, ЭХО КГ, рентгенографии органов грудной клетки и др.;
5) медико-генетического консультирования.
Лечение. На госпитальном этапе назначается строгий постельный режим до ликвидации признаков сердечной недостаточности.
Назначаются ограничение соли, повышенное содержание витаминов, солей калия. Диета предусматривает уменьшение объема жидкости с целью уменьшения диуреза на 200–300 мл.
Проводится этиотропная терапия в зависимости от выявленного возбудителя (иммуноглобулины, антибиотики и другие средства). При грибковой этиологии назначаются противогрибковые препараты.
Из патогенетической терапии назначаются:
1) противовоспалительные средства (салицилаты, индометацин и др.);
2) глюкокортикоиды при тяжелом миокардите;
3) антиопротекторы (пармодин и др.);
4) антиагреганты;
5) антикоагулянты по показаниям при высокой активности процесса в миокарде;
6) антиоксиданты (β-токоферол, эссенциале, аскорутин).
При сердечной недостаточности назначаются сердечные гликозиды. Они показаны при выраженной систолической дисфункции, наджелудочковой тахикардии.
Диуретики назначаются по показаниям.
Антиаритмические средства назначаются при аритмиях.
После проведенного лечения при отсутствии активного воспалительного процесса в миокарде, признаков сердечной недостаточности дети направляются на долечивание в местный санаторий.
В случае установления этиологического фактора назначаются следующие препараты курсом 2–3 недели (см. табл. 19).
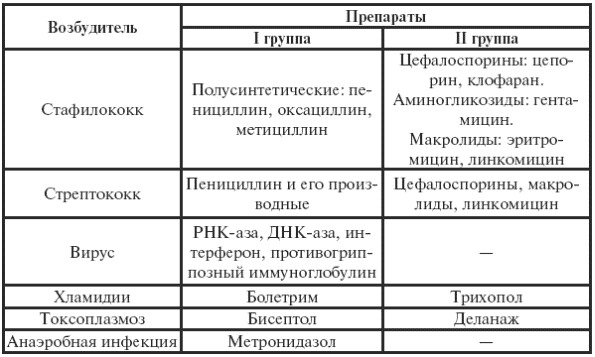 Препараты назначаются в среднетерапевтических дозах.
Препараты назначаются в среднетерапевтических дозах.
Кроме того, показаны кардтиотрофические препараты: кокорбоксилаза, панангин, рибоксин, фолиевая кислота, витамины В1, В3, В12, В15, аскорутин. Курсы повторяются 2–3 раза в год.
Из физиопроцедур рекомендуются гальванизация, электрофорез лекарственных средств.
Из фитотерапии применяются:
1) астрагал шерстистый (при сердечной недостаточности с тахикардией, отеками и венозным застоем);
2) боярышник (плоды и цветки) – при тахикардии, слабости сердечной мышцы;
3) горицвет весенний (назначается при сердечной недостаточности);
4) желтушник сероватый (входит в состав кардиовалена, так как улучшает функции нервно-мышечных волокон миокарда);
5) ландыш майский (оказывает кардиотическое седативное действие);
6) рододендрон золотистый (оказывает бактерицидное действие на стафилококки, стрептококки, синегнойную палочку, понижает одышку, уменьшает отеки);
7) черноплодная рябина (показана при повышении артериального давления);
8) чеснок (понижает артериальное давление, замедляет частоту сердечных сокращений).
При миокардитах рекомендована санация очагов инфекции.
Вторым этапом является местное санаторное лечение. Его проводят после купирования воспалительного процесса в сердечной мышце при отсутствии признаков сердечной недостаточности. Здесь продолжается начатое в стационаре лечение.
Показанием для лечения в санаториях является инфекционно-аллергический миокардит в период стихания активности.
Противопоказанием является миокардит в острой стадии.
Показанием для детей на курортах является неактивная фаза миокардита без недостаточности кровообращения, без нарушений проводимости.
Противопоказаниями для лечения детей на курортах являются:
1) недостаточность кровообращения любой степени;
2) органические и стойкие нарушения ритма сердца, мерцательная аритмия;
3) атриовентрикулярная блокада, нарушения ритма.
Показаниями к госпитализации являются: обострение заболевания, осложнения, побочные действия назначенных препаратов.
Стационар на дому может быть организован при отказе от госпитализации и легком течении заболевания.
На третьем этапе проводится диспансерное наблюдение детской поликлиники.
Клинико-инструментальный контроль осуществляется 2 раза в месяц в течение первых 3 месяцев наблюдения, затем – ежемесячно на протяжении первого года жизни, ежеквартально – на протяжении второго года жизни, затем – по индивидуальному плану. Длительность диспансерного наблюдения составляет не менее 5 лет. При хронических миокардитах больной находится на постоянном диспансерном наблюдении и с учета не снимается.
Допуск к занятиям по физическому воспитанию
Дети при удовлетворительных функциональных пробах в течение первого года наблюдаются и занимаются в специальной группе.
Первичной профилактикой миокардитов являются закаливание, рациональный режим питания, оздоровление группы часто болеющих детей.
Особенности миокардитов специфической этиологии
Болезнь Чагаса. Встречается эндемично в сельских районах Америки и некоторых других регионах. При хроническом течении заболевания может развиться острое расширение кишечника и пищевода. Это протозойная инфекция, вызываемая Trypanasoma crusi.
Это заболевание вызывается застойной сердечной недостаточностью, нарушениями сердечного ритма и проводимости. В области верхушки сердца на ЭХО КГ выявляются аневризмы.
Диагноз основывается на повышении титра антител к трипаносомам круза.
Распространенность. Миокардиты встречаются довольно часто. Чаще наблюдаются у мальчиков, чем у девочек. Они нередко возникают в 4–5 лет и в подростковом возрасте.
Причины заболевания. Механизмы развития заболевания. Миокардиты часто развиваются под воздействием различных факторов. Это могут быть:
1) вирусная инфекция;
2) бактерии, риккетсии и спирохеты;
3) различные виды простейших;
4) грибковая инфекция;
5) токсические агенты;
6) биологически активные вещества.
Для большинства миокардитов характерен аллергический и аутосомный компонент. При вирусной, риккетсиозной, трипаносомной инфекции возбудитель локализуется внутриклеточно в кардиомиоцитах или интерстициальной ткани миокарда, где образуются микроабсцессы.
При воздействии токсинов при миокардитах дифтерийной этиологии, стрептококковой, стафилококковой инфекции развивается инфекционно-токсический шок.
При риккетсиозных инфекциях повреждается эпителий сосудов и развивается воспаление, при этом цитотоксины негативно влияют на миокардит.
Различают паренхиматозный и интерстициальный миокардиты.
Миокардит может быть очаговым или распространенным.
По данным миокардиальной биопсии миокардит может быть лимфоцитарным – при вирусной инфекции; нейтрофильным – при бактериальной инфекции; эозинофильным – при повышенной чувствительности при паразитарной инвазии, приеме лекарственных препаратов.
Классификация. Имеется классификация на основе МКБ-10 (Коваленко В. Н., 2000 г.).
1. Острый миокардит:
1) с установленной этиологией;
2) неуточненной этиологией.
2. Хронический неуточненный миокардит.
3. Миокардиофиброз.
4. Распространенность: изолированный (очаговый).
5. Течение: легкое, среднее, тяжелое.
6. Клинические варианты: аритмия, нарушение реполяризации, кардиалгии.
7. Сердечная недостаточность (СН 0-III степени).
Признаки сердечной недостаточности при неревматических кардитах делятся на следующие стадии.
I стадия. Признаки сердечной недостаточности отсутствуют и появляются после нагрузки в виде тахикардии или одышки.
IIА стадия. При левожелудочковой недостаточности число сердечных сокращений и число дыханий в минуту увеличены соответственно на 10–20 и 30–50 % относительно нормы. При правожелудочковой недостаточности печень выступает на 2–3 см из-под реберной дуги.
IIБ стадия. При левожелудочковой недостаточности число сердечных сокращений увеличено на 30–50 и 50–70 % от нормы, появляются акроцианоз, навязчивый кашель, влажные мелкие пузырчатые хрипы в легких.
При правожелудочковой недостаточности желудочки увеличены на 50–60 и 70-100 % и более относительно нормальных величин. При правожелудочковой недостаточности отмечаются увеличение печени и отечный синдром, сопровождающийся отеками на лице, ногах, гидраборакс, гидроперикард, асцит.
III стадия – тяжелые нарушения гемодинамики, нарушения обменных процессов и функций всех органов.
Клиника. Клиническая картина частично зависит от врожденного или приобретенного характера миокардита.
Внутриутробный миокардит часто диагностируется в первые недели или месяцы жизни обычно в связи с появлением сердечной недостаточности. Различают ранние и поздние кардиты. Ранние кардиты возникают на 4-7-м месяцах внутриутробной жизни и характеризуются развитием эластичной и фиброзной ткани в слоях миокардита без проявлений воспаления.
Поздние кардиты возникают после 7-го месяца внутриутробной жизни. В этих случаях имеет место воспаление миокардита без образования эластичной и фиброзной ткани.
Признаки раннего врожденного кардита отмечаются уже во внутриутробном периоде, но обычно он проявляется в первые недели жизни развитием острой сердечной недостаточности. У ребенка в первые часы жизни могут появиться следующие симптомы:
1) вялость;
2) мышечная гипотония;
3) пастозность или отечность лица;
4) одышка;
5) частые срыгивания;
6) цианоз;
7) отечность мягких тканей;
8) увеличение печени.
Границы сердца смещаются влево, отмечаются глухие тоны, учащение сердцебиения. На верхушке прослушивается систолический шум.
Рентгенологически устанавливается гипертрофия сердца и левого желудочка.
На ЭКГ определяются снижение вольтажа зубцов, преобладание биопотенциалов левого желудочка, удлинение интервала Q T, смещение сегмента ST, зубца Т.
На ФКГ отмечается снижение амплитуды I тона у верхушки.
ЭХО КГ отмечает расширение полости и гипертрофию миокарда левого желудочка при нормальных размерах правого желудочка. В дальнейшем прогрессирует сердечная недостаточность.
При поздних кардитах в первые месяцы жизни выявляются утомляемость ребенка при кормлении, отставание физического развития, потливость, признаки сердечной недостаточности.
Границы сердца умеренно расширены, тоны громкие или приглушенные. На рентгенограмме определяется увеличение размеров сердца. На ЭКГ регистрируются тахикардия, атриовентрикулярные блокады. При эхокардиографии отмечается расширение полости левого желудочка и левого предсердия.
Лечение. При тяжелых формах назначаются оксигенотерапия, антибактериальные препараты. В качестве противовоспалительной терапии – вольтарен и индометацин. Витаминотерапия.
В тяжелых случаях применяются глюкокортикоиды, антиагреганты, препараты калия.
При аритмиях показаны антиритмические средства.
В периоде обратного развития используются производные хинолина 6-12 месяцев, анаболические препараты.
В течение 5 лет проводится динамическое наблюдение с осмотром 1 раз в 3–6 месяцев.
Исходом неревматического кардита являются кардиосклероз, гипертрофия миокарда, слипчивый перикардит или клапанный порок.
Прогноз скорее неблагоприятный, но в некоторых случаях возможно выздоровление.
Клиника приобретенных миокардитов. Различают острый, подострый и хронический кардиты.
Клиника заболевания зависит от возраста больного, характера течения болезни.
Острый неревматический миокардит развивается в первые 2–3 года жизни вскоре после перенесенной инфекции. На первый план при развитии приобретенных миокардитов выступают экстракардиальные симптомы:
1) вялость;
2) утомляемость;
3) понижение аппетита;
4) срыгивания, рвота;
5) бледность;
6) цианоз в виде приступов.
На этом фоне нарастают симптомы левожелудочковой недостаточности.
Выражены следующие симптомы:
1) одышка;
2) шумы слабого наполнения;
3) ослабление сердечного толчка;
4) тахикардия;
5) ритм галопа;
6) короткий систолический шум на верхушке;
7) приглушенность тонов сердца.
Часто к приобретенному миокардиту присоединяются эндокардит и перикардит.
Подострый неревматический миокардит наблюдается у детей старшего возраста. Он отличается от острого миокардита более длительным течением и неэффективностью медикаментозной терапии. В этих случаях на первый план выступают поражения проводящей системы сердца с нарушениями ритма и формирования блокад.
Хронический рецидивирующий кардит встречается у детей старше трехлетнего возраста как результат острого или подострого кардита или как первично-хронический процесс. При первично-хроническом кардите начальный период протекает скрытно, он распознается при появлении признаков недостаточности кровообращения. Обычно появляются жалобы на повышенную утомляемость, боли в области сердца, одышку, учащенное сердцебиение, иногда – навязчивый кашель. У детей выявляется отставание в физическом развитии, пульсация в эпигастральной области, цианоз с малиновым оттенком. При обследовании отмечаются увеличение сердца, аритмия, систолический шум на верхушке или другие сердечные шумы.
У детей дошкольного и школьного возраста миокардиты протекают доброкачественно.
Различают три степени тяжести миокардита:
1) легкую;
2) среднюю;
3) тяжелую.
При легкой степени отмечаются очаговое поражение миокарда без расширения границ сердца, слабая выраженность клинических и параклинических признаков, отсутствие сердечной недостаточности.
Средняя тяжесть характеризуется многоочаговым поражением миокарда, выраженными общими симптомами, увеличением сердца, сердечной недостаточностью без застойных явлений.
В случае тяжелой степени отмечается диффузное поражение миокарда с увеличением сердца и выраженной сердечной недостаточностью с застойными явлениями.
Различают большие и малые признаки поражений миокарда.
К большим признакам относят:
1) патологические изменения на ЭКГ;
2) изменение в сторону повышения активности ферментов и коферментов в сыворотке крови;
3) кардиомегалии;
4) застойную сердечную недостаточность или кардиогенный шок.
К малым признакам относятся:
1) тахикардия;
2) ослабление I тона на верхушке;
3) ритм галопа.
Диагностика проводится путем:
1) исследования клинических анализов крови и мочи;
2) исследования биохимических анализов крови, в том числе протеинограммы, коагулограммы, С-реактивного белка, серомукоида, сиаловых кислот, лабораторных исследований на выявление возбудителя;
3) иммунологических обследований;
4) инструментальных обследований ЭКГ, ФКГ, ЭХО КГ, рентгенографии органов грудной клетки и др.;
5) медико-генетического консультирования.
Лечение. На госпитальном этапе назначается строгий постельный режим до ликвидации признаков сердечной недостаточности.
Назначаются ограничение соли, повышенное содержание витаминов, солей калия. Диета предусматривает уменьшение объема жидкости с целью уменьшения диуреза на 200–300 мл.
Проводится этиотропная терапия в зависимости от выявленного возбудителя (иммуноглобулины, антибиотики и другие средства). При грибковой этиологии назначаются противогрибковые препараты.
Из патогенетической терапии назначаются:
1) противовоспалительные средства (салицилаты, индометацин и др.);
2) глюкокортикоиды при тяжелом миокардите;
3) антиопротекторы (пармодин и др.);
4) антиагреганты;
5) антикоагулянты по показаниям при высокой активности процесса в миокарде;
6) антиоксиданты (β-токоферол, эссенциале, аскорутин).
При сердечной недостаточности назначаются сердечные гликозиды. Они показаны при выраженной систолической дисфункции, наджелудочковой тахикардии.
Диуретики назначаются по показаниям.
Антиаритмические средства назначаются при аритмиях.
После проведенного лечения при отсутствии активного воспалительного процесса в миокарде, признаков сердечной недостаточности дети направляются на долечивание в местный санаторий.
В случае установления этиологического фактора назначаются следующие препараты курсом 2–3 недели (см. табл. 19).
Таблица 19
Антибактериальная терапия миокардитов (А. В. Ваганова, 1999 г.)

Кроме того, показаны кардтиотрофические препараты: кокорбоксилаза, панангин, рибоксин, фолиевая кислота, витамины В1, В3, В12, В15, аскорутин. Курсы повторяются 2–3 раза в год.
Из физиопроцедур рекомендуются гальванизация, электрофорез лекарственных средств.
Из фитотерапии применяются:
1) астрагал шерстистый (при сердечной недостаточности с тахикардией, отеками и венозным застоем);
2) боярышник (плоды и цветки) – при тахикардии, слабости сердечной мышцы;
3) горицвет весенний (назначается при сердечной недостаточности);
4) желтушник сероватый (входит в состав кардиовалена, так как улучшает функции нервно-мышечных волокон миокарда);
5) ландыш майский (оказывает кардиотическое седативное действие);
6) рододендрон золотистый (оказывает бактерицидное действие на стафилококки, стрептококки, синегнойную палочку, понижает одышку, уменьшает отеки);
7) черноплодная рябина (показана при повышении артериального давления);
8) чеснок (понижает артериальное давление, замедляет частоту сердечных сокращений).
При миокардитах рекомендована санация очагов инфекции.
Вторым этапом является местное санаторное лечение. Его проводят после купирования воспалительного процесса в сердечной мышце при отсутствии признаков сердечной недостаточности. Здесь продолжается начатое в стационаре лечение.
Показанием для лечения в санаториях является инфекционно-аллергический миокардит в период стихания активности.
Противопоказанием является миокардит в острой стадии.
Показанием для детей на курортах является неактивная фаза миокардита без недостаточности кровообращения, без нарушений проводимости.
Противопоказаниями для лечения детей на курортах являются:
1) недостаточность кровообращения любой степени;
2) органические и стойкие нарушения ритма сердца, мерцательная аритмия;
3) атриовентрикулярная блокада, нарушения ритма.
Показаниями к госпитализации являются: обострение заболевания, осложнения, побочные действия назначенных препаратов.
Стационар на дому может быть организован при отказе от госпитализации и легком течении заболевания.
На третьем этапе проводится диспансерное наблюдение детской поликлиники.
Клинико-инструментальный контроль осуществляется 2 раза в месяц в течение первых 3 месяцев наблюдения, затем – ежемесячно на протяжении первого года жизни, ежеквартально – на протяжении второго года жизни, затем – по индивидуальному плану. Длительность диспансерного наблюдения составляет не менее 5 лет. При хронических миокардитах больной находится на постоянном диспансерном наблюдении и с учета не снимается.
Допуск к занятиям по физическому воспитанию
Дети при удовлетворительных функциональных пробах в течение первого года наблюдаются и занимаются в специальной группе.
Первичной профилактикой миокардитов являются закаливание, рациональный режим питания, оздоровление группы часто болеющих детей.
Особенности миокардитов специфической этиологии
Болезнь Чагаса. Встречается эндемично в сельских районах Америки и некоторых других регионах. При хроническом течении заболевания может развиться острое расширение кишечника и пищевода. Это протозойная инфекция, вызываемая Trypanasoma crusi.
Это заболевание вызывается застойной сердечной недостаточностью, нарушениями сердечного ритма и проводимости. В области верхушки сердца на ЭХО КГ выявляются аневризмы.
Диагноз основывается на повышении титра антител к трипаносомам круза.
