Страница:
лучистое равновесие
)
.Построение моделей А. з. (вычисление распределения плотности, давления, температуры и других физических характеристик атмосферы по глубине) позволяет теоретически рассчитать распределение энергии в непрерывном и линейчатом спектре звезды. Сравнение теоретического и наблюдаемого спектров для звёзд различных классов является критерием правильности положенных в основу теории предположений. Основные сведения о звёздах (химический состав, движения в атмосфере, вращение, магнитные поля) получены на основе изучения их спектров.
Один из важнейших параметров теории А. з. — коэффициент поглощения звёздного вещества, т. к. он определяет геометрическую глубину фотосферы. Для горячих звёзд основную роль играет поглощение лучистой энергии атомами водорода (для очень горячих добавляется поглощение гелием и рассеяние свободными электронами), в атмосферах холодных звёзд — отрицательными ионами водорода. Химический состав внешних слоев А. з. определяют сравнением наблюдённой и теоретической (полученной методом кривой роста или из модели А. з.) эквивалентной ширины линий поглощения (т. е. ширины соседнего с линией участка непрерывного спектра, энергия которого равна энергии, поглощённой в линии). Наиболее распространённые элементы — водород и гелий; за ними — углерод, азот, кислород. Число атомов всех металлов составляет примерно одну десятитысячную числа атомов водорода. К 60-м гг. 20 в. подробно рассчитаны звёздные модели всех спектральных классов, которые в общем хорошо объясняют их наблюдаемые спектры. В общих чертах химический состав А. з. одинаков, однако наблюдаются существенные отклонения, связанные как с особым состоянием атмосфер ( магнитные звёзды,тесные двойные звёзды ) ,так и с реальными различиями в химическом составе (красные звёзды-гиганты, металлические «гелиевые», «бариевые» и «литиевые» звёзды и др.), вероятно, вызванными эволюционными процессами. Такие звёзды и звёздные группы изучают особенно интенсивно.
Лит.:Мустель Э. Р., Звездные атмосферы, М., 1960; Адлер Л., Распространенность химических элементов [во вселенной], пер. с англ., М., 1963; Звездные атмосферы, пер. с англ., М., 1963; Теория звездных спектров, М., 1966; Соболев В. В., Курс теоретической астрофизики, М., 1967.
А. Г. Масевич.
Планеты,а также статьи об отдельных планетах.
Один из важнейших параметров теории А. з. — коэффициент поглощения звёздного вещества, т. к. он определяет геометрическую глубину фотосферы. Для горячих звёзд основную роль играет поглощение лучистой энергии атомами водорода (для очень горячих добавляется поглощение гелием и рассеяние свободными электронами), в атмосферах холодных звёзд — отрицательными ионами водорода. Химический состав внешних слоев А. з. определяют сравнением наблюдённой и теоретической (полученной методом кривой роста или из модели А. з.) эквивалентной ширины линий поглощения (т. е. ширины соседнего с линией участка непрерывного спектра, энергия которого равна энергии, поглощённой в линии). Наиболее распространённые элементы — водород и гелий; за ними — углерод, азот, кислород. Число атомов всех металлов составляет примерно одну десятитысячную числа атомов водорода. К 60-м гг. 20 в. подробно рассчитаны звёздные модели всех спектральных классов, которые в общем хорошо объясняют их наблюдаемые спектры. В общих чертах химический состав А. з. одинаков, однако наблюдаются существенные отклонения, связанные как с особым состоянием атмосфер ( магнитные звёзды,тесные двойные звёзды ) ,так и с реальными различиями в химическом составе (красные звёзды-гиганты, металлические «гелиевые», «бариевые» и «литиевые» звёзды и др.), вероятно, вызванными эволюционными процессами. Такие звёзды и звёздные группы изучают особенно интенсивно.
Лит.:Мустель Э. Р., Звездные атмосферы, М., 1960; Адлер Л., Распространенность химических элементов [во вселенной], пер. с англ., М., 1963; Звездные атмосферы, пер. с англ., М., 1963; Теория звездных спектров, М., 1966; Соболев В. В., Курс теоретической астрофизики, М., 1967.
А. Г. Масевич.
Планеты,а также статьи об отдельных планетах.
Лит.:Мороз В. И., Физика планет, М., 1967; Брандт Дж., Ходж П., Астрофизика солнечной системы, пер. с англ., М., 1967.
геохимической классификации элементов
к А. э. относятся: водород, азот и инертные газы (гелий, неон, аргон, криптон, ксенон и радон). Кислород, слагающий 47% литосферы, принадлежит к
литофильным элементам.
молекулы
, всё огромное многообразие химических соединений обусловлено различными сочетаниями А. в молекулах. Связываясь друг с другом непосредственно .или в составе молекул, А. образуют жидкости и твёрдые тела.
Свойства макроскопических тел — газообразных, жидких и твёрдых — и свойства отдельных молекул зависят от свойств входящих в их состав А. Все свойства А., физические и химические, определяются его строением как системы, состоящей из ядра и электронов, и подчиняются характерным для микроскопических явлений квантовым законам. Ниже излагаются современные представления о строении и свойствах А. (историю развития учения об А. см. в ст.
Атомная физика
).
Общая характеристика строения атома.А. состоит из тяжёлого ядра, обладающего положительным электрическим зарядом, и окружающих его лёгких электронов с отрицательными электрическими зарядами, образующих электронные оболочки А. Размеры А. в целом определяются размерами его электронной оболочки и велики по сравнению с размерами ядра А.
Характерные порядки размеров:
| Линейные размеры | Площадь* | Объем | |
| Атом | 10 —8 см | 10 —16 см 2 | 10 —24 см 3 |
| Ядро | 10 —12 см | 10 —24 см 2 | 10 —36 см 3 |
| Отношение | 10 4 | 10 8 | 10 12 |
* Поперечное сечение.
Электронные оболочки А. не имеют строго определённой границы; значения размеров А. в большей или меньшей степени зависят от способов их определения и весьма разнообразны (см. Атомные радиусы ).
Заряд ядра — основная характеристика А., обусловливающая его принадлежность определённому элементу. Заряд ядра всегда является целым кратным элементарного положительного электрич. заряда е, равного по абсолютному значению заряду электрона —е. Заряд ядра равен + Ze, где Z— порядковый номер (атомный номер). Z= 1, 2, 3, 4,... для А. последовательных элементов в периодической системе элементов Менделеева, т. е. для атомов Н, Не, Li, Be, ...В нейтральном А. ядро с зарядом + Zeудерживает Zэлектронов с общим зарядом — Zeи полный заряд А. равен нулю; в положительном ионе —А., потерявшем kэлектронов (ионизованном А.), остаётся Z— kэлектронов ( k= 1, 2, 3, ... — кратность ионизации) и его заряд равен + ke, в отрицательном ионе —А., присоединившем kэлектронов,— содержится Z+ kэлектронов, и его заряд равен — ke. Для положительного иона максимальное значение k= Z(такой ион потерял все свои электроны и состоит из «голого» ядра); для отрицательного свободного иона k= 1, для связанных А. возможно образование отрицательных ионов с k> 1 (в растворах, комплексных соединениях и ионных кристаллах ). Говоря об А. определённого элемента, подразумевают как нейтральные А., так и ионы этого элемента. Но иногда под А. понимают нейтральный А., в противоположность ионам. Положительные и отрицательные ионы при написании отличают от нейтрального А. индексом k+ и k—, например О обозначает нейтральный А. кислорода ( Z= 8), О +, О 2+(или O ++), O 3+,..., O 8+— его положительные ионы,О —, O 2—(или О —— его отрицательные ионы. Совокупность нейтрального А. и ионов других элементов с тем же числом электронов образует изоэлектронный ряд. Простейший такой ряд начинается с А. водорода: H, He +, Li 2+, Be 3+, ...; члены этого ряда состоят из ядра и одного электрона.
Порядок значений зарядов ядер различных А. был определён английским физиком Э. Резерфордом в его первоначальных опытах по рассеянию альфа-частиц (1911). Значения Zбыли надёжно установлены английским физиком Г. Мозли (1913—14) на основе изучения рентгеновских спектров последовательных элементов в периодической системе. Кратность заряда ядра А. элементарному заряду еполучила объяснение, исходя из представлений о строении ядра: Zравно числу протонов в ядре, протон имеет заряд + е, и полный заряд ядра равен сумме зарядов всех Zпротонов, т. е. + Ze.
Масса атома возрастает с увеличением Z. Масса ядра А. приближённо пропорциональна массовому числу А — общему числу протонов и нейтронов в ядре. Масса электрона (0,91 10 —27 г) значительно меньше (примерно в 1840 раз) массы протона или нейтрона (1,67 10 —24 г), и поэтому масса А. в целом определяется в основном массой его ядра.
А. данного элемента могут отличаться массой ядра (число протонов Zпостоянно, число нейтронов А—Zможет меняться); такие разновидности А. одного и того же элемента называются изотопами . Различие массы ядра почти не сказывается на строении их электронных оболочек, зависящем от заряда ядра Z. Химические и большинство физических свойств (оптические, электрические, магнитные), определяемые строением электронных оболочек, одинаковы или очень близки для всех изотопов данною элемента. Наибольшие отличия в свойствах (изотонические эффекты) получаются для изотопов водорода ( Z= 1) из-за большой разницы в массах обычного лёгкого А. водорода ( А= 1), А. дейтерия ( А= 2) и А. трития ( А= 3).
Масса А. приближённо равна массовому числу Аи изменяется от 1,67 10 —24 гдля самого лёгкого А. водорода (основного изотопа: Z= 1, A= 1) до примерно 4 10 —22 гдля самых тяжёлых А. трансурановых элементов ( Z= 100, А= 250).
Наиболее точные значения масс А. могут быть определены методами масс-спектроскопии . Масса А. не равна в точности сумме массы ядра и масс электронов, а несколько меньше — на дефект массы D М = W/c 2',где W —энергия образования А. из ядра и электронов, а с —скорость света. Эта поправка — порядка массы одного электрона m едля тяжёлых А., а для лёгких А. пренебрежимо мала (порядка 10 —4массы электрона).
Энергия атома и её квантование. Благодаря малым размерам и большой массе ядра его можно приближённо считать точечным и покоящимся в центре масс А. (общий центр масс ядра и электронов находится вблизи ядра, а скорость движения ядра относительно центра масс А. мала по сравнению со скоростями движения электронов). Соответственно А. можно рассматривать как систему, в которой Nэлектронов с зарядами — едвижутся вокруг неподвижного притягивающего центра. Движение электронов в А. происходит в ограниченном объёме — оно является связанным. Полная внутренняя энергия А. Еравна сумме кинетических энергий всех электронов Ти потенциальной энергии U —энергии притяжения их ядром и отталкивания их друг от друга (электростатической энергии взаимодействия электрических зарядов ядра и электронов, согласно закону Кулона).
В простейшем случае А. водорода один электрон с зарядом — едвижется вокруг неподвижного центра с зарядом + е. В этом случае, согласно классической механике, кинетическая энергия
Т = 1/ 2 mv =p 2/2 m (1)
где m —масса, v —скорость, p = mv —количество движения (импульс) электрона. Потенциальная энергия (сводящаяся к энергии притяжения электрона ядром)
U = U( r) = —e 2/r (2)
и зависит только от расстояния rэлектрона от ядра. Графически функция U( r) изображается кривой ( рис. 1 , а) ,неограниченно убывающей при уменьшении r, т. е. при приближении электрона к ядру. Значение U( r) на бесконечности принято за нуль. При отрицательных значениях полной энергии Е= Т + U< 0 движение электрона является связанным: оно ограничено в пространстве значениями r= r max, при которых Т= 0, Е = U( r max) .При положительных значениях полной энергии E = T + U> 0 движение электрона является свободным — он может уйти на бесконечность с энергией Е = Т = 1/ 2mv 2,что соответствует ионизованному А. водорода Н +. Нейтральный А. водорода Н представляет, т. о., систему, состоящую из ядра и электрона в связанном состоянии с энергией E <0.
Полная внутренняя энергия А. Еявляется его основной характеристикой как квантовой системы — системы, подчиняющейся квантовым законам (см. Квантовая механика ). Как показывает огромный экспериментальный материал (см., например, Франка—Герца опыт ) ,А. может длительно находиться лишь в состояниях с определённой энергией — стационарных (неизменных во времени) состояниях.
Существование стационарных состояний — один из основных законов физики микроскопических явлений — квантовой физики. Внутренняя энергия квантовой системы, состоящей из связанных микрочастиц (такой системой и является А.), может принимать одно из дискретного (прерывного) ряда значений
E 1, E 2, E 3, ...( E 1< E 2< E 3< ...) . (3)
Каждому из этих «дозволенных» значений энергии соответствует одно или несколько стационарных квантовых состояний движения. Промежуточными значениями энергии (например, лежащими между E 1и E 2, E 2и E 3и т.д.) система обладать не может, о такой системе говорят, что её энергия квантована, а нахождение возможных значений энергии называется квантованием энергии. Любое изменение энергии Есвязано с квантовым (скачкообразным) переходом системы из одного стационарного квантового состояния в другое (см. ниже).
Графически возможные дискретные значения энергии (3) А. можно изобразить, по аналогии с потенциальной энергией тела, поднятого на различные высоты (на различные уровни), в виде схемы уровней энергии,где каждому значению энергии соответствует прямая, проведённая на высоте E i( i =1, 2, 3, ...); такая схема приведена на рис. 1 , б для А. водорода (на рис. 1 , а при E< 0 оказываются, т. о., возможными лишь определённые ступеньки, соединённые горизонтальным пунктиром с уровнями схемы на рис. 1, б). Самый нижний уровень E i,соответствующий наименьшей возможной энергии системы, называется основным, а все остальные ( E i > Ei, г= 2, 3, 4, ...) — возбуждёнными, т. к. для перехода на них (перехода в соответствующие стационарные возбуждённые состояния из стационарного основного состояния) необходимо возбудить систему — сообщить ей извне энергию E i—E 1.
Квантование энергии А. является следствием волновых свойств электронов. Нельзя считать, что электрон в А. движется как материальная точка по определённой траектории, согласно законам классической механики. Эти законы справедливы лишь для частиц большой массы (макрочастиц), а для электрона, как микрочастицы, необходимо учитывать, наряду с его корпускулярными свойствами (свойствами частицы), и его волновые свойства. Согласно квантовой механике, движению микрочастицы массы mсо скоростью vсоответствует длина волны l = h/mv,где h — Планка постоянная.Для электрона в А. l ~10 —8 см,т. е. порядка линейных размеров А., и учёт волновых свойств электрона в А. является необходимым. Связанное движение электрона в А. схоже со стоячей волной,и его следует рассматривать не как движение материальной точки по траектории, а как сложный колебательный процесс. Для стоячей волны в ограниченном объёме возможны лишь определённые значения длины волны l (и, следовательно, частоты колебаний v). Так как, согласно квантовой механике, v = E/h,отсюда следует, что система, состоящая, подобно А., из связанных микрочастиц, может иметь лишь определённые значения энергии, т. е. энергия квантуется и получается дискретная последовательность уровней энергии — дискретный энергетический спектр. Для А. водорода такая дискретная последовательность получается при Е< 0 (см. рис. 1 ). Свободное, т. е. не ограниченное в пространстве, поступательное движение микрочастицы, например движение электрона, оторванного от А. (в случае А. водорода — электрона с энергией Е> 0) ,сходно с распространением бегущей волны в неограниченном объёме, для которой возможны любые значения l (и v). Энергия такой свободной микрочастицы может принимать любые значения, т. е. не квантуется, и получается непрерывная последовательность уровней энергии — непрерывный энергетический спектр. Для А. водорода такая непрерывная последовательность, соответствующая ионизованному А., получается при E> 0. Значение Е Ґ= 0 соответствует границе ионизации, а разность Е Ґ— Е 1= Е ионпредставляет энергию ионизации: для А. водорода она равна 13,6 эв.
Распределение электронной плотности. Состояние электрона в А. можно характеризовать распределением в пространстве его электрического заряда с некоторой плотностью — распределением электронной плотности. При этом электроны рассматриваются наглядным образом, как «размазанные» в пространстве и образующие «электронное облако». Такая модель правильнее характеризует электроны в А., чем модель точечного электрона, движущегося, согласно теории Бора (см. Атомная физика ) ,по строго определённым орбитам. Вместе с тем боровским орбитам можно сопоставить определённые распределения электронной плотности. Для основного уровня энергии Е 1электронная плотность концентрируется вблизи ядра; для возбуждённых уровней энергии E 2, E 3, E 4,... она распределяется на всё больших средних расстояниях от ядра (что соответствует возрастанию размера орбит в теории Бора). В сложном А. эти электроны группируются в оболочки, окружающие ядро на различных расстояниях и характеризующиеся определёнными распределениями электронной плотности. Прочность связи электронов в более внешних оболочках меньше, чем во внутренних, и слабее всего электроны связаны в самой внешней оболочке, обладающей наибольшими размерами, которые и определяют размеры А. в целом. При ионизации А. теряет внешние электроны; размеры положительных ионов тем меньше размеров нейтрального А., чем выше кратность иона. Наоборот, размеры отрицательных ионов больше размеров нейтрального А.
Учёт спина электрона и спина ядра. В теории А. весьма существен учёт спина электрона — его собственного (спинового) момента количества движения, с наглядной точки зрения соответствующего вращению электрона вокруг собственной оси (если электрон рассматривать как частицу малых размеров). Со спином электрона связан его магнитный момент.Поэтому в А. необходимо учитывать, наряду с электростатическими взаимодействиями (см. выше), и магнитные взаимодействия, определяемые спиновым магнитным моментом, а также орбитальным магнитным моментом, связанным с движением электрона вокруг ядра; магнитные взаимодействия малы по сравнению с электростатическими. Наиболее существенное влияние спина проявляется в сложных А.: от спина электронов зависит заполнение электронных оболочек А. определённым числом электронов (см. ниже).
Ядро в А. также может обладать собственным механическим моментом — ядерным спином, с которым связан небольшой ядерный магнитный момент (в сотни и тысячи раз меньший электронного магнитного момента), а в некоторых случаях и т. н. квадрупольный электрический момент (см. Моменты атомных ядер ) .Это приводит к дополнительным очень малым взаимодействиям ядра и электронов, обусловливающим дополнительное расщепление уровней энергии А. — т. н. сверхтонкую структуру (малую по сравнению с тонкой структурой).
Квантовые состояния атома водорода.Важнейшую роль в квантовой теории А. играет теория простейшего одноэлектронного А., состоящего из ядра с зарядом + Zeи электрона с зарядом — е, —теория А. водорода Н и водородоподобных ионов Не +, Li 2+, Ве 3+,... (изоэлектронного ряда, см. выше), называется обычно теорией А. водорода. Методами квантовой механики можно получить точную и полную характеристику состояний электрона в одноэлектронном А. Задача о сложных (многоэлектронных) атомах решается лишь приближённо; при этом исходят из результатов решения задачи об одноэлектронном А.
Уровни энергии А. водорода и водородоподобных ионов. Энергия одноэлектронного А. (без учёта спина электрона) равна

Е ион= E Ґ — E 1= RZ 2= 13,6Z 2 (5)
что даёт для Н, Не +, Li 2+, ... значения 13,6 эв, 54,4 эв, 122,4 эв, ...
Основная формула (4) соответствует выражению U( r) = —Ze 2/rдля потенциальной энергии электрона, притягиваемого ядром с зарядом +Ze[см. (2) и рис. 1 , а для случая Z= 1]. Эта формула была впервые выведена Н. Бором в его теории А. (1913) путём рассмотрения движения электрона вокруг ядра по круговой орбите радиуса r. Уровням энергии (4) соответствуют орбиты радиуса
a nZ= a 0 n 2/ Z (6)
где постоянная a 0= 0,529 10 —8 см= 0,529
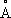 — радиус первой круговой орбиты А. водорода, соответствующей его основному уровню (этим боровским радиусом часто пользуются в качестве удобной единицы для измерений длин в атомной физике). Радиус орбит пропорционален квадрату главного квантового числа
n
2и обратно пропорционален
Z; для водородоподобных ионов масштаб линейных размеров уменьшается в
Zраз по сравнению с А. водорода.
— радиус первой круговой орбиты А. водорода, соответствующей его основному уровню (этим боровским радиусом часто пользуются в качестве удобной единицы для измерений длин в атомной физике). Радиус орбит пропорционален квадрату главного квантового числа
n
2и обратно пропорционален
Z; для водородоподобных ионов масштаб линейных размеров уменьшается в
Zраз по сравнению с А. водорода.Характеристика квантовых состояний атома водорода. Согласно квантовой механике, состояние А. водорода полностью определяется дискретными значениями четырёх физических величин: энергии Е,орбитального момента
