Страница:
П. М. Зоркий.
спектры оптические,получающиеся при испускании или поглащении света (электромагнитных волн) свободными или слабо связанными атомами; такими спектрами обладают, в частности, одноатомные газы и пары. А. с. являются линейчатыми — они состоят из отдельных спектральных линий. А. с. наблюдаются в виде ярких цветных линий при свечении газов или паров в электрической дуге или разряде (спектры испускания) и в виде тёмных линий (спектров поглощения). Каждая спектральная линия характеризуется определённой частотой колебаний
vиспускаемого или поглощаемого света и соответствует определённому
квантовому переходу
между
уровнями энергииE
iи
E
kатома согласно соотношению:
hv=
E
i
- E
k
,где
h —
Планка постоянная)
.Наряду с частотой спектральную линию можно характеризовать длиной волны
l=
c/v,волновым числом 1/
l=
v/
c(
c— скорость света) и энергией фотона
hv.
спектры оптические,получающиеся при испускании или поглащении света (электромагнитных волн) свободными или слабо связанными атомами; такими спектрами обладают, в частности, одноатомные газы и пары. А. с. являются линейчатыми — они состоят из отдельных спектральных линий. А. с. наблюдаются в виде ярких цветных линий при свечении газов или паров в электрической дуге или разряде (спектры испускания) и в виде тёмных линий (спектров поглощения). Каждая спектральная линия характеризуется определённой частотой колебаний
vиспускаемого или поглощаемого света и соответствует определённому
квантовому переходу
между
уровнями энергииE
iи
E
kатома согласно соотношению:
hv=
E
i
- E
k
,где
h —
Планка постоянная)
.Наряду с частотой спектральную линию можно характеризовать длиной волны
l=
c/v,волновым числом 1/
l=
v/
c(
c— скорость света) и энергией фотона
hv.
А. с. возникают при переходах между уровнями энергии внешних электронов атома и наблюдаются в видимой, ультрафиолетовой и близкой инфракрасной областях. Такими спектрами обладают как нейтральные, так и ионизованные атомы; их часто называют соответственно дуговыми и искровыми спектрами (нейтральные атомы легко возбуждаются и дают спектры испускания в электрических дугах, а положительные ионы возбуждаются труднее и дают спектры испускания преимущественно в искровых электрических разрядах). Спектры ионизованных атомов смещены по отношению к спектрам нейтральных атомов в область больших частот, т. е. в ультрафиолетовую область. Это смещение тем больше, чем выше кратность ионизации атома — чем больше электронов он потерял. Спектры нейтрального атома и его последовательных ионов обозначают в спектроскопии цифрами I, II, III, ... В реально наблюдаемых спектрах часто присутствуют одновременно линии нейтрального и ионизованных атомов; так говорят, например, о линиях FeI, FeII, FeIII в спектре железа, соответствующих Fe, Fe
+, Fe
2+.
Линии А. с. образуют закономерные группы, называются спектральными сериями. Промежутки между линиями в серии убывают в сторону коротких длин волн, и линии сходятся к границе серии. Наиболее прост спектр атома водорода. Волновые числа линий его спектра с огромной точностью определяются формулой Бальмера:
1/l=
R(
1/n
2
1- 1/n
2
2),
где
n
1и
n
2значения главного квантового числа для уровней энергии, между которыми происходит квантовый переход (см.
Атом,
рис. 1
, б). Значение
n
1= 1, 2, 3, ... определяет серию, а значение
n
2=
n
1+ 1, n
1+ 2, n
1+ 3,... определяет отдельные линии данной серии;
R —
Ридберга постоянная(выраженная в волновых числах). При
n
1= 1 получается серия Лаймана, лежащая в далёкой ультрафиолетовой области спектра, при
n
1= 2 — серия Бальмера, линии которой расположены в видимой и близкой ультрафиолетовой областях. Серии Пашена (
n
1= 3), Брэкета (
n
1= 4), Пфаунда (
n
1= 5), Хамфри (
n
1= 6) лежат в инфракрасной области спектра. Аналогичными спектрами, только с увеличенным в Z
2раз масштабом (Z — атомный номер), обладают водородоподобные ионы Не
+, Li
2+, ... (cпектры HeII, LiIII, ...).
Спектры атомов щелочных металлов, обладающих одним внешним (оптическим) электроном помимо заполненных оболочек, схожи со спектром атома водорода, но смещены в область меньших частот; число спектральных серий увеличивается, а закономерности в расположении линий усложняются. Пример — спектр Na, атом которого обладает нормальной электронной конфигурацией 1
s
2
2
s
22
p
6
3
s(см. в ст.
Атом—Заполнение электронных оболочек и слоев) с легко возбуждаемым внешним электроном 3
s; переходу этого электрона из состояния 3
sв состояние 3
pсоответствует жёлтая линия Na (дублет
l= 5690
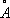 и
l= 5696
и
l= 5696
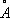 ; см.
рис
.), с которой начинается т. н. главная серия Na, члены которой соответствуют переходам между состоянием 3
sи состояниями 3
p,4
p,5
p,...
граница серии соответствует ионизации атома Na.
; см.
рис
.), с которой начинается т. н. главная серия Na, члены которой соответствуют переходам между состоянием 3
sи состояниями 3
p,4
p,5
p,...
граница серии соответствует ионизации атома Na.
Для атомов с двумя или несколькими внешними электронами спектры значительно усложняются, что обусловлено взаимодействием электронов. А. с. особенно сложны для атомов с заполняющимися
d-и
f-оболочками; число линий доходит до многих тысяч, и уже нельзя обнаружить простых серий, аналогичных сериям в спектрах водорода и щелочных металлов. Однако и в сложных спектрах можно установить определённые закономерности в расположении линий, произвести систематику спектра и определить схему уровней энергии.
Систематика спектров атомов с двумя или более внешними электронами основана на приближённой характеристике отдельных электронов при помощи квантовых чисел
nи
l(см.
Атом
)
сучётом взаимодействия этих электронов друг с другом. При этом приходится учитывать электростатические взаимодействия электронов — отталкивание по закону Кулона, и магнитные взаимодействия спиновых и орбитальных моментов (см.
Спин,
Спин-орбитальное взаимодействие)
,которые приводят к тонкому расщеплению уровней энергии (см.
Тонкая структура
)
.Благодаря этому у большинства атомов спектральные линии представляют собой более или менее тесную группу линий, называемую мультиплетом. Так, у всех щелочных металлов линии двойные (дублеты), причём расстояния между мультиплетными уровнями увеличиваются с увеличением атомного номера элемента. У щёлочноземельных элементов наблюдаются одиночные линии (сингулеты) и тройные (триплеты). Спектры следующих столбцов таблицы Менделеева образуют всё более сложные мультиплеты, причём нечётным столбцам соответствуют чётные мультиплеты, а четным столбцам — нечётные.
Кроме тонкой структуры, в А. с. наблюдается
сверхтонкая структура,обусловленная магнитными моментами ядер. Сверхтонкая структура по порядку величины в 1000 раз уже обычной мультиплетной структуры и исследуется методами
радиоспектроскопии.
В А. с. проявляются не все переходы между уровнями энергии данного атома или иона, а лишь вполне определённые, допускаемые (разрешенные) т. н.
отбора правилами,зависящими от характеристик уровней энергии. В случае одного внешнего электрона возможны лишь переходы, для которых азимутальное квантовое число
lувеличивается или уменьшается на 1; правило отбора имеет вид: D
l= ±1
.В результате s-yровни (
l= 0) комбинируют с
р-уровнями (
l= 1),
р-уровни — с
d-yровнями (
l= 2) и т. д., что определяет возможные спектральные серии для атомов щелочных металлов, частный случай которых представляет главная серия Na (переходы 3
s®
np,где
n =3, 4, 5, ...); другие переходы этим правилом отбора запрещены. Для многоэлектронных атомов правила отбора имеют более сложный вид.
Количественной характеристикой разрешенного оптического перехода является его вероятность (см.
Вероятность перехода
)
,определяющая, как часто этот переход может происходить; вероятность запрещенных переходов равна нулю. От вероятностей переходов зависят интенсивности спектральных линий. В простейших случаях вероятности переходов для А. с. могут быть рассчитаны по методам
квантовой механики.
Наряду с изучением А. с. для свободных атомов значительный интерес представляет исследование изменений в А. с. при внешних воздействиях на атомы. Под действием внешнего магнитного или электрического поля происходит расщепление уровней энергии атома и соответствующее расщепление спектральных линий (см.
Зеемана явление
и
Штарка явление
)
.
Исследование А. с. сыграло важную роль в развитии представлений о строении атома (см.
Атомная физика
)
.Методы, основанные на изучении А. с., очень широко распространены в различных областях науки и техники. А. с. позволяют определить ряд весьма важных характеристик атомов и получить ценные сведения о строении электронных оболочек атома. Чрезвычайно существенно применение А. с. в эмиссионном
спектральном анализе
(по А. с. испускания), который благодаря высокой чувствительности, быстроте и универсальности завоевал прочное место в металлургии, горнорудной промышленности, машиностроении и во многих других отраслях народного хозяйства; наряду с эмиссионным спектральным анализом успешно применяют и абсорбционный спектральный анализ (по А. с. поглощения).
Лит.:Шпольский Э. В., Атомная физика, 5 изд., т. 1, М., 1963, т. 2, М., 1951: Фриш С. Э., Оптические спектры атомов, М.—Л., 1963; Ельяшевич М. А., Атомная и молекулярная спектроскопия, М., 1962.
М. А. Ельяшевич.
 Жёлтая линия в спектре атома Na (дублет l = 5690
Жёлтая линия в спектре атома Na (дублет l = 5690
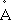 и l = 5696 ).
и l = 5696 ).


