Страница:
M
l,(момента количества движения электрона относительно ядра); проекции
M
lzорбитального момента на направление
z(выбранное произвольно в пространстве); проекции
M
szспинового момента (собственного момента количества движения электрона
M
s)
.Возможные значения этих физических величин, в свою очередь, определяются соответствующими квантовыми числами:
1) Е — по закону (4) — главным квантовым числом n=1, 2, 3, ...;
2) М l—по закону M l 2=( h 2/4p 2 ) l( l+ 1) [при l" 1, M l 2=( h 2/4p 2 ) l 2—орбитальным (или азимутальным) квантовым числом l= 0,1, 2, ..., n—1;
3) M lz—по закону M lz=( h/2p) m lz—магнитным орбитальным квантовым числом m l= l, l—1, ..., — l;
4) M sz—по закону M sz=( h/2p) m s—магнитным спиновым квантовым числом m s = 1/ 2, — 1/ 2 .
Значения квантовых чисел n, l, m l, m sи характеризуют состояние электрона в А. водорода. Энергия А. водорода зависит только от n,и уровню энергии с заданным nсоответствует ряд состояний, отличающихся значениями l, m lи m s.Состояния с заданными значениями nи lпринято обозначать как 1 s,2 s,2 p,3 s,..., где цифры указывают значение n,а буквы s, р, d, f(дальше по латинскому алфавиту) — соответственно значения l= 0, 1, 2, 3, ... При заданных nи lчисло различных состояний равно 2(2 l+ 1) — числу комбинаций значений m lи m s(первое принимает 2 l+ 1 значение, второе — 2 значения). Общее число различных состояний с заданными nи lпри учёте, что lможет принимать значения от 0 до n—1, получается равным
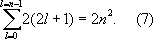 Т. о., каждому уровню энергии А. водорода соответствует 2, 8, 18, ...,
2n
2(при
n =1, 2, 3, ...) различных стационарных квантовых состояний (
рис. 2
). Если уровню энергии соответствует лишь одно квантовое состояние, то его называют невырожденным, если два или более — вырожденным (см.
Вырождение
)
,а число таких состояний
gназываются степенью или кратностью вырождения (для невырожденных уровней энергии
g= 1). Уровни энергии А. водорода являются вырожденными, а их степень вырождения g
n=2
n
2.
Т. о., каждому уровню энергии А. водорода соответствует 2, 8, 18, ...,
2n
2(при
n =1, 2, 3, ...) различных стационарных квантовых состояний (
рис. 2
). Если уровню энергии соответствует лишь одно квантовое состояние, то его называют невырожденным, если два или более — вырожденным (см.
Вырождение
)
,а число таких состояний
gназываются степенью или кратностью вырождения (для невырожденных уровней энергии
g= 1). Уровни энергии А. водорода являются вырожденными, а их степень вырождения g
n=2
n
2.
Для различных состояний А. водорода получается и различное распределение электронной плотности. Оно зависит от квантовых чисел n, lи / m i/ .При этом электронная плотность для s-cocтояний ( l= 0) отлична от нуля в центре, т. е. в месте нахождения ядра, и не зависит от направления (сферически симметрична), а для остальных состояний ( l> 0) она равна нулю в центре и зависит от направления. Распределение электронной плотности для состояний А. водорода с n =1, 2 и 3 показано на рис. 3 (оно получено фотографированием специальных моделей); размеры «электронного облака» растут примерно пропорционально n 2(масштаб на рис. 3 уменьшается при переходе от n= 1 к n= 2 и от n= 2 к n= 3) ,что соответствует увеличению радиуса орбит по формуле (6) в теории Бора.
Квантовые состояния электрона в водородоподобных ионах характеризуются теми же четырьмя квантовыми числами n, l, m lи m s,что и в А. водорода. Сохраняется и распределение электронной плотности, только она увеличивается в Zраз и на рис. 3 масштабы нужно уменьшить также в Zраз. Соответственно уменьшаются и размеры орбит.
Действие внешних полей на уровни энергии атома водорода. Во внешнем электрическом и магнитном полях А. как электрическая система приобретает дополнительную энергию. Электрическое поле поляризует А. — смещает электронное облако относительно ядра, а магнитное поле ориентирует определённым образом магнитный момент А., связанный с движением электрона вокруг ядра (с орбитальным моментом M l) и его спином. Различным состояниям А. водорода с той же энергией Е nво внешнем поле соответствует различная дополнительная энергия D Eи вырожденный уровень энергии Е nрасщепляется на ряд подуровней ( рис. 4 ). Как расщепление в электрическом поле — Штарка явление,так и расщепление в магнитном поле — Зеемана явление,для уровней энергии А. водорода пропорциональны напряжённости полей.
К расщеплению уровней энергии приводят и малые магнитные взаимодействия внутри А. Для А. водорода и водородоподобных ионов имеет место спин-орбитальное взаимодействие — взаимодействие спинового и орбитального моментов электрона, не учитываемое при выводе основной формулы (4); оно обусловливает т.н. тонкую структуру уровней энергии — расщепление возбуждённых уровней Е n(при n> 1) на подуровни. Наиболее точные исследования тонкой структуры методами радиоспектроскопии показали наличие т. н. сдвига уровней, объясняемого в квантовой электродинамике.
Для всех уровней энергии А. водорода наблюдается и сверхтонкая структура, обусловленная очень малыми магнитными взаимодействиями ядерного спина с электронными моментами. Уровень E 1расщепляется на 2 подуровня с расстоянием между ними примерно 5 10 —6 эв.
Электронные оболочки сложных атомов.Теория сложных А., содержащих 2 или более электронов, принципиально отличается от теории А. водорода, т. к. в сложном А. имеются взаимодействующие друг с другом одинаковые частицы — электроны. Взаимное отталкивание электронов в многоэлектронном А. существенно уменьшает прочность их связи с ядром. Например, энергия отрыва единственного электрона в ионе гелия (Не +) равна 54,4 эв,в нейтральном же атоме гелия в результате отталкивания электронов энергия отрыва одного из них уменьшается до 24,6 эв.Для внешних электронов более тяжёлых А. уменьшение прочности их связи из-за отталкивания внутренними электронами ещё более значительно. Чрезвычайно важную роль в сложных А. играют свойства электронов как одинаковых микрочастиц (см. Тождественности принцип ) ,обладающих спином s= 1/ 2, для которых справедлив Паули принцип.Согласно этому принципу, в системе электронов не может быть более одного электрона в каждом квантовом состоянии, что для сложного А. приводит к образованию электронных оболочек, заполняющихся строго определёнными числами электронов.
Учитывая неразличимость взаимодействующих между собой электронов, имеет смысл говорить только о квантовых состояниях А. в целом. Однако приближённо можно рассматривать квантовые состояния отдельных электронов и характеризовать каждый из них совокупностью четырёх квантовых чисел n, l, m lи m s,аналогично электрону в А. водорода. При этом энергия электрона оказывается зависящей не только от n,как в А. водорода, но и от l; от m l; и m sона по-прежнему не зависит. Электроны с данными nи l всложном А. имеют одинаковую энергию и образуют определённую электронную оболочку; их называют эквивалентными электронами. Такие электроны и образованные ими оболочки обозначают, как и квантовые состояния и уровни энергии с заданными nи l, символами ns, nр, nd, nf, ...(для l =0, 1, 2, 3 ....) и говорят о 2 р-электронах, 3 s-oболочках и т. п.
Заполнение электронных оболочек и слоёв. В силу принципа Паули любые 2 электрона в А. должны находиться в различных квантовых состояниях и, следовательно, отличаться хотя бы одним из четырёх квантовых чисел n, l, m lи ms.Для эквивалентных электронов ( nи lодинаковы) должны быть различны пары значений m iи m s.Число таких пар равно числу различных квантовых состояний электрона с заданными nи l, т. е. степени вырождения его уровня энергии. Это число g l=2 (2 l+ 1) = 2, 6, 10, 14, ... и определяет число электронов, полностью заполняющих данную оболочку. Т. о., s-, р-, d-, f-,... оболочки заполняются 2, 6, 10, 14, ... электронами, независимо от значения n.Электроны с данным nобразуют слой, состоящий из оболочек с l= 0, 1, 2, ..., n—1 и заполняемый 2n 2электронами, т. н. К-, L-, М-, N-,...слой. При полном заполнении имеем:
Наиболее близко к ядру расположен К-слой, затем идёт L-cлой, М-слой, N-cлой, ... В каждом слое оболочки с меньшими lхарактеризуются большей электронной плотностью вблизи ядра. Прочность связи электрона уменьшается с увеличением n,а при заданном n —с увеличением l; на рис. 5 схематически показаны (без соблюдения масштаба энергий) уровни энергии отдельного электрона в сложном А. Чем слабее связан электрон в соответствующей оболочке, тем выше лежит его уровень энергии. Ядро с заданным Zприсоединяет электроны в порядке уменьшения прочности их связи: сначала два электрона 1 s, затем два электрона 2 s, шесть электронов 2pи т. д. в соответствии со схемой рис. 5. Это определяет электронные конфигурации, т. е. распределения электронов по оболочкам, для ионов и нейтрального А. данного элемента. Например, для азота ( Z= 7) получаются электронные конфигурации
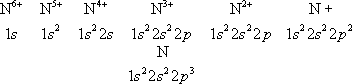 (число электронов в данной оболочке указывается индексом справа сверху). Такие же электронные конфигурации, как и ионы азота, имеют нейтральные атомы последовательных элементов в периодической системе, обладающие тем же числом электронов: Н, Не, Li, Be, В, С (
Z= 1,2,3,4,5,6). Периодичность в свойствах элементов определяется сходством внешних электронных оболочек А. Например, нейтральные А. Р, As, Sb, Bi (
Z= 15, 33, 51, 83) имеют по три
р-электрона во внешней электронной оболочке подобно А. N и схожи с ним по химическим и многим физическим свойствам.
(число электронов в данной оболочке указывается индексом справа сверху). Такие же электронные конфигурации, как и ионы азота, имеют нейтральные атомы последовательных элементов в периодической системе, обладающие тем же числом электронов: Н, Не, Li, Be, В, С (
Z= 1,2,3,4,5,6). Периодичность в свойствах элементов определяется сходством внешних электронных оболочек А. Например, нейтральные А. Р, As, Sb, Bi (
Z= 15, 33, 51, 83) имеют по три
р-электрона во внешней электронной оболочке подобно А. N и схожи с ним по химическим и многим физическим свойствам.
При рассмотрении заполнения электронных оболочек необходимо учитывать, что, начиная с n= 4, электроны с меньшим l, но большим n,связываются прочнее, чем электроны с большим l, но меньшим n,например электроны 4 sсвязаны прочнее, чем электроны 3 d. Это отражает рис. 5 , показывающий расположение уровней энергии, соответствующее действительному порядку (несколько схематизированному) заполнения электронных оболочек для последовательных элементов в периодической системе элементов Д. И. Менделеева. Числа, стоящие справа у скобок, определяют числа элементов в периодах этой системы, заканчивающихся атомами инертных газов с внешними оболочками типа nр 6( n= 2, 3, 4, 5, 6) для Ne, Ar, Kr, Xe, Rn ( Z= 10, 18, 36, 54, 86).
Уровни энергии сложных атомов. Каждый А. характеризуется нормальной электронной конфигурацией, получающейся, когда все электроны в А. связываются наиболее прочно, и возбуждёнными электронными конфигурациями, когда один или несколько электронов связаны более слабо — находятся на более высоких уровнях энергии. Например, для А. гелия наряду с нормальной электронной конфигурацией 1 s 2возможны возбуждённые: 1 s2 s,1 s2 p,... (возбуждён один электрон), 2 s '2,2 s2 p, ...(возбуждены оба электрона). Определённой электронной конфигурации соответствует один уровень энергии А. в целом, если электронные оболочки целиком заполнены (например, нормальная конфигурация А. Ne 1 s 22 s 22 p 6) ,и ряд уровней энергии, если имеются частично заполненные оболочки (например, нормальная конфигурация A. N 1 s 22 s 22 p 3,для которой оболочка 2 pзаполнена как раз наполовину). При наличии частично заполненных d-и f-oболочек число уровней энергии, соответствующих каждой конфигурации, может достигать многих сотен, так что схема уровней энергии А. с частично заполненными внешними оболочками получается очень сложной. Основным уровнем энергии А. является самый нижний уровень нормальной электронной конфигурации.
Квантовые переходы в атоме.При квантовых переходах А. переходит из одного стационарного состояния в другое — с одного уровня энергии на другой. При переходе с более высокого уровня энергии E iна более низкий E kА. отдаёт энергию E i—E k,при обратном переходе получает её. Как для любой квантовой системы, для А. квантовые переходы могут быть двух типов: с излучением (оптические переходы) и без излучения (безызлучательные или неоптические переходы). Важнейшая характеристика квантового перехода — вероятность перехода,определяющая, как часто этот переход будет происходить.
Квантовые переходы с излучением. При этих переходах А. поглощает (переход E k® E i) или испускает (переход E I® E k) электромагнитное излучение, например видимый свет, ультрафиолетовые лучи, инфракрасные лучи, СВЧ (микроволновое) излучение. Электромагнитная энергия поглощается и испускается А. в виде кванта света — фотона, характеризуемого определённой частотой колебаний v, согласно соотношению:
E i—E k= hv, (8)
где h —постоянная Планка; hv —энергия фотона. Закон (8) представляет собой закон сохранения энергии для микроскопических процессов, связанных с излучением.
А. в основном состоянии может только поглощать фотоны, а А. в возбуждённых состояниях может как поглощать, так и испускать их. Свободный А. в основном состоянии может существовать неограниченно долго; продолжительность пребывания А. в возбуждённом состоянии — время жизни на возбуждённом уровне энергии — ограничена, А. спонтанно, т. е. самопроизвольно, частично или полностью теряет энергию возбуждения, испуская фотон и переходя на более низкий уровень энергии (наряду с таким спонтанным испусканием возможно и вынужденное испускание, происходящее, подобно поглощению, под действием фотонов той же частоты; см. Квантовые переходы ) .Время жизни возбуждённого А. тем меньше, чем больше вероятность спонтанного перехода. Для возбуждённых А. водорода это время порядка 10 —8 сек.
Совокупность частот возможных переходов с излучением определяет оптический спектр соответствующего А.: совокупность частот переходов с нижних уровней на верхние — его спектр поглощения, совокупность частот переходов с верхних уровней на нижние — его спектр испускания. Каждому такому переходу соответствует определённая спектральная линия. Для А. водорода, согласно формулам (4) и (8), получаем совокупность спектральных линий с частотами
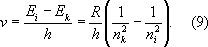 При
n
k= 1 и
n
I= 2, 3, 4, 5, ... получается спектральная серия Лаймана (линии
L
a
, L
b
.,
L
g,...), при
n
k= 2 и
n
i=3, 4,5,... — серия Бальмера (линии
Н
a
,
H
b,
Н
g...), при
n
k= 3 и
n
I= 4, 5, ... — серия Пашена (
рис. 1
, б). Для А. других элементов в соответствии с более сложной схемой уровней энергии получается и более сложный спектр (см.
Атомные спектры
)
.
При
n
k= 1 и
n
I= 2, 3, 4, 5, ... получается спектральная серия Лаймана (линии
L
a
, L
b
.,
L
g,...), при
n
k= 2 и
n
i=3, 4,5,... — серия Бальмера (линии
Н
a
,
H
b,
Н
g...), при
n
k= 3 и
n
I= 4, 5, ... — серия Пашена (
рис. 1
, б). Для А. других элементов в соответствии с более сложной схемой уровней энергии получается и более сложный спектр (см.
Атомные спектры
)
.
Квантовые переходы без излучения. При этих переходах А. получает или отдаёт энергию при взаимодействии с другими частицами, с которыми он сталкивается в газе или длительно связан в молекуле, жидкости или твёрдом теле. В газе А. можно считать свободным в промежутках времени между столкновениями; во время столкновения (удара) А. может, благодаря кратковременному взаимодействию, перейти на другой уровень энергии. Такое столкновение называется неупругим (в противоположность упругому столкновению, при котором изменяется только кинетическая энергия поступательного движения А., а его внутренняя энергия остаётся неизменной). Важный частный случай — столкновение свободного А. с электроном; обычно электрон движется быстро по сравнению с А., время столкновения очень мало и можно говорить об электронном ударе. Возбуждение А. электронным ударом является одним из методов определения уровней энергии А. Вероятности неупругих столкновений и, в частности, возбуждения А" электронным ударом могут быть рассчитаны методами квантовой механики (см. Столкновения атомные ) .
Химические и физические свойства атома.Большинство свойств А. определяется строением и характеристиками его внешних электронных оболочек, в которых электроны связаны сравнительно слабо (энергии связи от нескольких эвдо нескольких десятков эв). Строение внутренних оболочек А., электроны которых связаны гораздо прочнее (энергии связи в сотни, тысячи и десятки тысяч эв) ,проявляется лишь при взаимодействиях А. с быстрыми частицами и фотонами больших энергий (более сотен эв.) Такие взаимодействия определяют рентгеновские спектры А. и рассеяние атомом быстрых частиц (см. Рассеяние микрочастиц, Дифракция частиц) .От массы А., определяемой массой его ядра, зависят его механические свойства при движении А. как целого — количество движения, кинетическая энергия. От механических и связанных с ними магнитных и электрических моментов А. зависят некоторые тонкие эффекты, проявляющиеся при изучении физических свойств А. (см. Моменты атомных ядер , Ядерный магнитный резонанс , Ядерный квадрупольный резонанс , Сверхтонкая структура ).
Свойства атома, определяемые его внешними электронами. Электроны во внешних оболочках А., связанные сравнительно слабо, легко подвергаются внешним воздействиям. При сближении данного А. с другими возникают сильные электростатические взаимодействия (включая т. н. обменные взаимодействия ) ,которые могут приводить к возникновению химической связи А., т. е. к образованию молекулы. В химической связи участвуют электроны внешних оболочек; в случае ковалентной связи эти электроны принадлежат уже не отдельным А., а образовавшейся молекуле в целом, и входят в состав её молекулярных электронных оболочек. Т. о., внешние электроны А. определяют его химические свойства.
Более слабые электростатические взаимодействия двух А. проявляются в их взаимной поляризации — смещении электронов относительно ядер, наиболее сильном для слабо связанных внешних электронов (см. Поляризация частиц ) .Возникают поляризационные силы притяжения между А., которые надо учитывать уже на больших расстояниях между ними (см. Межмолекулярное взаимодействие ). Поляризация А. происходит и во внешних электрических полях; в результате уровни энергии А. смещаются и, что особенно важно, вырожденные уровни энергии расщепляются (поляризация различна для различных квантовых состояний А., соответствующих той же его энергии) — имеет место Штарка явление.Поляризация А. может возникнуть под действием электрического поля световой (электромагнитной) волны; она зависит от частоты света, что обусловливает зависимость от неё и показателя преломления (см. Дисперсия света ) ,связанного со способностью А. поляризоваться — с поляризуемостью А. (см. Поляризуемость атомов, ионов и молекул ) .Тесная связь оптических характеристик А. с его электрическими свойствами особенно ярко проявляется в его оптических спектрах.
Внешними электронами определяются и магнитные свойства А. Они схожи для элементов с аналогичными внешними электронными оболочками А. Магнитный момент А. зависит от его механического момента (см. Магнитомеханическое отношение ) ,в А. с полностью заполненными электронными оболочками он равен нулю, так же как и механический момент. При наличии частично заполненных внешних электронных оболочек магнитные моменты А., как правило, постоянны, и А. являются парамагнитными (см. Парамагнетизм ) .Во внешнем магнитном поле все уровни А., у которых магнитный момент не равен нулю, расщепляются (см. Зеемана явление ) .Все А. обладают диамагнетизмом,который обусловлен возникновением у них магнитного момента под действием магнитного поля (т. н. индуцированного магнитного момента, аналогичного электрическому дипольному моменту А.).
Свойства ионизованного атома. При последовательной ионизации А., т. е. при отрыве его электронов, начиная с самых внешних, в порядке увеличения прочности их связи ( рис. 5 ), соответственно изменяются все свойства А., определяемые его внешней оболочкой. Внешними становятся все более прочно связанные электроны; в результате сильно уменьшается способность А. поляризоваться в электрическое поле, увеличиваются расстояния между уровнями энергии и частоты оптических переходов между этими уровнями (что приводит к смещению спектров в сторону всё более коротких длин волн). Ряд свойств обнаруживает периодичность: сходными оказываются свойства ионов с аналогичными внешними электронами, например N 7+и N 3+(один и два электрона 2 s) обнаруживают сходство с N 6+и N 5+(один и два электрона 1 s). Это относится к характеристикам и относительному расположению уровней энергии и к оптическим спектрам, к магнитным моментам А. и т. д. Наиболее резкое изменение свойств происходит при удалении последнего электрона из внешней оболочки, когда остаются лишь полностью заполненные оболочки; например при переходе от N 4+к N 5+(электронные конфигурации 1 s 22 sи 1 s 2). В этом случае ион наиболее устойчив и его полный механический и полный магнитный моменты равны нулю. Особенно устойчивы, помимо ионов с электронной конфигурацией 1 s 2, ионы с полностью заполненной внешней оболочкой nр( n= 2, 3, 4, ...).
Свойства связанных атомов. Свойства А., находящегося в связанном состоянии, например входящего в состав молекулы, отличаются от свойств свободного А. Наибольшие изменения претерпевают свойства А., определяемые самыми внешними электронами, принимающими участие в присоединении данного А. к другому. Вместе с тем свойства, определяемые электронами внутренних оболочек, могут практически не измениться, как это имеет место для рентгеновских спектров. Некоторые свойства А. могут испытывать сравнительно небольшие изменения, по которым можно получить информацию о характере взаимодействий связанных А. Важным примером может служить расщепление уровней энергии А. в кристаллах и комплексных соединениях , которое происходит под действием электрических полей, создаваемых окружающими ионами (см. Кристаллического поля теория ).
Лит.см. при ст. Атомная физика .
М. А. Ельяшевич.
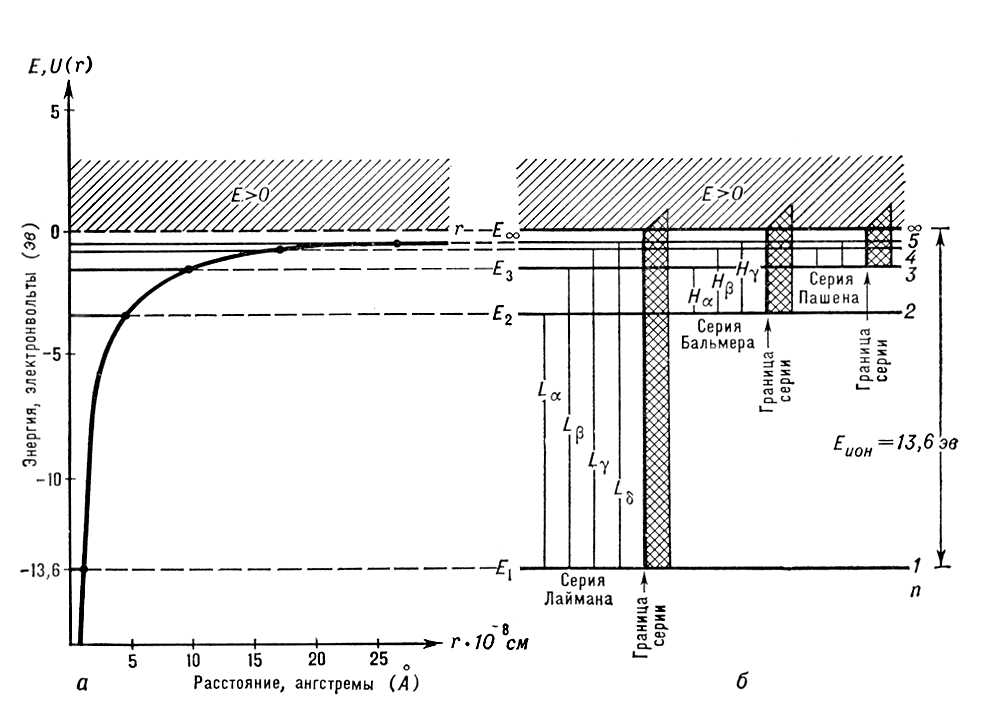 Рис. 1. Энергия атома водорода: а — возможные значения полной энергии
E
1,
E
2,
E
3, ... (горизонтальные линии) и график потенциальной энергии (жирная кривая; точками показаны значения
r
maxпри
Е=
E1,
E2,
E3,...); б — схема уровней энергии (горизонтальные линии) и оптических квантовых переходов (вертикальные линии). Заштрихованная область (
Е> 0) соответствует свободному состоянию электрона.
Рис. 1. Энергия атома водорода: а — возможные значения полной энергии
E
1,
E
2,
E
3, ... (горизонтальные линии) и график потенциальной энергии (жирная кривая; точками показаны значения
r
maxпри
Е=
E1,
E2,
E3,...); б — схема уровней энергии (горизонтальные линии) и оптических квантовых переходов (вертикальные линии). Заштрихованная область (
Е> 0) соответствует свободному состоянию электрона.
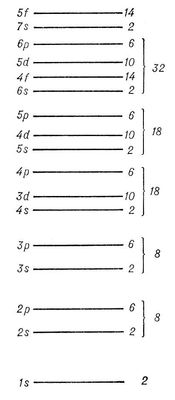 Рис. 4. Последовательность заполнения уровней энергии отдельного электрона в сложном атоме. Справа даны числа заполнения оболочек.
Рис. 4. Последовательность заполнения уровней энергии отдельного электрона в сложном атоме. Справа даны числа заполнения оболочек.
1) Е — по закону (4) — главным квантовым числом n=1, 2, 3, ...;
2) М l—по закону M l 2=( h 2/4p 2 ) l( l+ 1) [при l" 1, M l 2=( h 2/4p 2 ) l 2—орбитальным (или азимутальным) квантовым числом l= 0,1, 2, ..., n—1;
3) M lz—по закону M lz=( h/2p) m lz—магнитным орбитальным квантовым числом m l= l, l—1, ..., — l;
4) M sz—по закону M sz=( h/2p) m s—магнитным спиновым квантовым числом m s = 1/ 2, — 1/ 2 .
Значения квантовых чисел n, l, m l, m sи характеризуют состояние электрона в А. водорода. Энергия А. водорода зависит только от n,и уровню энергии с заданным nсоответствует ряд состояний, отличающихся значениями l, m lи m s.Состояния с заданными значениями nи lпринято обозначать как 1 s,2 s,2 p,3 s,..., где цифры указывают значение n,а буквы s, р, d, f(дальше по латинскому алфавиту) — соответственно значения l= 0, 1, 2, 3, ... При заданных nи lчисло различных состояний равно 2(2 l+ 1) — числу комбинаций значений m lи m s(первое принимает 2 l+ 1 значение, второе — 2 значения). Общее число различных состояний с заданными nи lпри учёте, что lможет принимать значения от 0 до n—1, получается равным
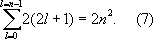
Для различных состояний А. водорода получается и различное распределение электронной плотности. Оно зависит от квантовых чисел n, lи / m i/ .При этом электронная плотность для s-cocтояний ( l= 0) отлична от нуля в центре, т. е. в месте нахождения ядра, и не зависит от направления (сферически симметрична), а для остальных состояний ( l> 0) она равна нулю в центре и зависит от направления. Распределение электронной плотности для состояний А. водорода с n =1, 2 и 3 показано на рис. 3 (оно получено фотографированием специальных моделей); размеры «электронного облака» растут примерно пропорционально n 2(масштаб на рис. 3 уменьшается при переходе от n= 1 к n= 2 и от n= 2 к n= 3) ,что соответствует увеличению радиуса орбит по формуле (6) в теории Бора.
Квантовые состояния электрона в водородоподобных ионах характеризуются теми же четырьмя квантовыми числами n, l, m lи m s,что и в А. водорода. Сохраняется и распределение электронной плотности, только она увеличивается в Zраз и на рис. 3 масштабы нужно уменьшить также в Zраз. Соответственно уменьшаются и размеры орбит.
Действие внешних полей на уровни энергии атома водорода. Во внешнем электрическом и магнитном полях А. как электрическая система приобретает дополнительную энергию. Электрическое поле поляризует А. — смещает электронное облако относительно ядра, а магнитное поле ориентирует определённым образом магнитный момент А., связанный с движением электрона вокруг ядра (с орбитальным моментом M l) и его спином. Различным состояниям А. водорода с той же энергией Е nво внешнем поле соответствует различная дополнительная энергия D Eи вырожденный уровень энергии Е nрасщепляется на ряд подуровней ( рис. 4 ). Как расщепление в электрическом поле — Штарка явление,так и расщепление в магнитном поле — Зеемана явление,для уровней энергии А. водорода пропорциональны напряжённости полей.
К расщеплению уровней энергии приводят и малые магнитные взаимодействия внутри А. Для А. водорода и водородоподобных ионов имеет место спин-орбитальное взаимодействие — взаимодействие спинового и орбитального моментов электрона, не учитываемое при выводе основной формулы (4); оно обусловливает т.н. тонкую структуру уровней энергии — расщепление возбуждённых уровней Е n(при n> 1) на подуровни. Наиболее точные исследования тонкой структуры методами радиоспектроскопии показали наличие т. н. сдвига уровней, объясняемого в квантовой электродинамике.
Для всех уровней энергии А. водорода наблюдается и сверхтонкая структура, обусловленная очень малыми магнитными взаимодействиями ядерного спина с электронными моментами. Уровень E 1расщепляется на 2 подуровня с расстоянием между ними примерно 5 10 —6 эв.
Электронные оболочки сложных атомов.Теория сложных А., содержащих 2 или более электронов, принципиально отличается от теории А. водорода, т. к. в сложном А. имеются взаимодействующие друг с другом одинаковые частицы — электроны. Взаимное отталкивание электронов в многоэлектронном А. существенно уменьшает прочность их связи с ядром. Например, энергия отрыва единственного электрона в ионе гелия (Не +) равна 54,4 эв,в нейтральном же атоме гелия в результате отталкивания электронов энергия отрыва одного из них уменьшается до 24,6 эв.Для внешних электронов более тяжёлых А. уменьшение прочности их связи из-за отталкивания внутренними электронами ещё более значительно. Чрезвычайно важную роль в сложных А. играют свойства электронов как одинаковых микрочастиц (см. Тождественности принцип ) ,обладающих спином s= 1/ 2, для которых справедлив Паули принцип.Согласно этому принципу, в системе электронов не может быть более одного электрона в каждом квантовом состоянии, что для сложного А. приводит к образованию электронных оболочек, заполняющихся строго определёнными числами электронов.
Учитывая неразличимость взаимодействующих между собой электронов, имеет смысл говорить только о квантовых состояниях А. в целом. Однако приближённо можно рассматривать квантовые состояния отдельных электронов и характеризовать каждый из них совокупностью четырёх квантовых чисел n, l, m lи m s,аналогично электрону в А. водорода. При этом энергия электрона оказывается зависящей не только от n,как в А. водорода, но и от l; от m l; и m sона по-прежнему не зависит. Электроны с данными nи l всложном А. имеют одинаковую энергию и образуют определённую электронную оболочку; их называют эквивалентными электронами. Такие электроны и образованные ими оболочки обозначают, как и квантовые состояния и уровни энергии с заданными nи l, символами ns, nр, nd, nf, ...(для l =0, 1, 2, 3 ....) и говорят о 2 р-электронах, 3 s-oболочках и т. п.
Заполнение электронных оболочек и слоёв. В силу принципа Паули любые 2 электрона в А. должны находиться в различных квантовых состояниях и, следовательно, отличаться хотя бы одним из четырёх квантовых чисел n, l, m lи ms.Для эквивалентных электронов ( nи lодинаковы) должны быть различны пары значений m iи m s.Число таких пар равно числу различных квантовых состояний электрона с заданными nи l, т. е. степени вырождения его уровня энергии. Это число g l=2 (2 l+ 1) = 2, 6, 10, 14, ... и определяет число электронов, полностью заполняющих данную оболочку. Т. о., s-, р-, d-, f-,... оболочки заполняются 2, 6, 10, 14, ... электронами, независимо от значения n.Электроны с данным nобразуют слой, состоящий из оболочек с l= 0, 1, 2, ..., n—1 и заполняемый 2n 2электронами, т. н. К-, L-, М-, N-,...слой. При полном заполнении имеем:
| n | 1 | 2 | 3 | 4 |
| Слои | К-слой | L-слой | M-слой | N-слой |
| l | 0 | 0 1 | 0 1 2 | 0 1 2 3 |
| Оболочки | 1s | 2s 2p | 3s 3p 3d | 4s 4p 4d 4f |
| Число электронов в слое | 2 |
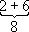
|
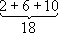
|
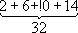
|
Наиболее близко к ядру расположен К-слой, затем идёт L-cлой, М-слой, N-cлой, ... В каждом слое оболочки с меньшими lхарактеризуются большей электронной плотностью вблизи ядра. Прочность связи электрона уменьшается с увеличением n,а при заданном n —с увеличением l; на рис. 5 схематически показаны (без соблюдения масштаба энергий) уровни энергии отдельного электрона в сложном А. Чем слабее связан электрон в соответствующей оболочке, тем выше лежит его уровень энергии. Ядро с заданным Zприсоединяет электроны в порядке уменьшения прочности их связи: сначала два электрона 1 s, затем два электрона 2 s, шесть электронов 2pи т. д. в соответствии со схемой рис. 5. Это определяет электронные конфигурации, т. е. распределения электронов по оболочкам, для ионов и нейтрального А. данного элемента. Например, для азота ( Z= 7) получаются электронные конфигурации
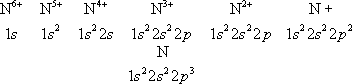
При рассмотрении заполнения электронных оболочек необходимо учитывать, что, начиная с n= 4, электроны с меньшим l, но большим n,связываются прочнее, чем электроны с большим l, но меньшим n,например электроны 4 sсвязаны прочнее, чем электроны 3 d. Это отражает рис. 5 , показывающий расположение уровней энергии, соответствующее действительному порядку (несколько схематизированному) заполнения электронных оболочек для последовательных элементов в периодической системе элементов Д. И. Менделеева. Числа, стоящие справа у скобок, определяют числа элементов в периодах этой системы, заканчивающихся атомами инертных газов с внешними оболочками типа nр 6( n= 2, 3, 4, 5, 6) для Ne, Ar, Kr, Xe, Rn ( Z= 10, 18, 36, 54, 86).
Уровни энергии сложных атомов. Каждый А. характеризуется нормальной электронной конфигурацией, получающейся, когда все электроны в А. связываются наиболее прочно, и возбуждёнными электронными конфигурациями, когда один или несколько электронов связаны более слабо — находятся на более высоких уровнях энергии. Например, для А. гелия наряду с нормальной электронной конфигурацией 1 s 2возможны возбуждённые: 1 s2 s,1 s2 p,... (возбуждён один электрон), 2 s '2,2 s2 p, ...(возбуждены оба электрона). Определённой электронной конфигурации соответствует один уровень энергии А. в целом, если электронные оболочки целиком заполнены (например, нормальная конфигурация А. Ne 1 s 22 s 22 p 6) ,и ряд уровней энергии, если имеются частично заполненные оболочки (например, нормальная конфигурация A. N 1 s 22 s 22 p 3,для которой оболочка 2 pзаполнена как раз наполовину). При наличии частично заполненных d-и f-oболочек число уровней энергии, соответствующих каждой конфигурации, может достигать многих сотен, так что схема уровней энергии А. с частично заполненными внешними оболочками получается очень сложной. Основным уровнем энергии А. является самый нижний уровень нормальной электронной конфигурации.
Квантовые переходы в атоме.При квантовых переходах А. переходит из одного стационарного состояния в другое — с одного уровня энергии на другой. При переходе с более высокого уровня энергии E iна более низкий E kА. отдаёт энергию E i—E k,при обратном переходе получает её. Как для любой квантовой системы, для А. квантовые переходы могут быть двух типов: с излучением (оптические переходы) и без излучения (безызлучательные или неоптические переходы). Важнейшая характеристика квантового перехода — вероятность перехода,определяющая, как часто этот переход будет происходить.
Квантовые переходы с излучением. При этих переходах А. поглощает (переход E k® E i) или испускает (переход E I® E k) электромагнитное излучение, например видимый свет, ультрафиолетовые лучи, инфракрасные лучи, СВЧ (микроволновое) излучение. Электромагнитная энергия поглощается и испускается А. в виде кванта света — фотона, характеризуемого определённой частотой колебаний v, согласно соотношению:
E i—E k= hv, (8)
где h —постоянная Планка; hv —энергия фотона. Закон (8) представляет собой закон сохранения энергии для микроскопических процессов, связанных с излучением.
А. в основном состоянии может только поглощать фотоны, а А. в возбуждённых состояниях может как поглощать, так и испускать их. Свободный А. в основном состоянии может существовать неограниченно долго; продолжительность пребывания А. в возбуждённом состоянии — время жизни на возбуждённом уровне энергии — ограничена, А. спонтанно, т. е. самопроизвольно, частично или полностью теряет энергию возбуждения, испуская фотон и переходя на более низкий уровень энергии (наряду с таким спонтанным испусканием возможно и вынужденное испускание, происходящее, подобно поглощению, под действием фотонов той же частоты; см. Квантовые переходы ) .Время жизни возбуждённого А. тем меньше, чем больше вероятность спонтанного перехода. Для возбуждённых А. водорода это время порядка 10 —8 сек.
Совокупность частот возможных переходов с излучением определяет оптический спектр соответствующего А.: совокупность частот переходов с нижних уровней на верхние — его спектр поглощения, совокупность частот переходов с верхних уровней на нижние — его спектр испускания. Каждому такому переходу соответствует определённая спектральная линия. Для А. водорода, согласно формулам (4) и (8), получаем совокупность спектральных линий с частотами
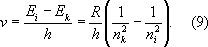
Квантовые переходы без излучения. При этих переходах А. получает или отдаёт энергию при взаимодействии с другими частицами, с которыми он сталкивается в газе или длительно связан в молекуле, жидкости или твёрдом теле. В газе А. можно считать свободным в промежутках времени между столкновениями; во время столкновения (удара) А. может, благодаря кратковременному взаимодействию, перейти на другой уровень энергии. Такое столкновение называется неупругим (в противоположность упругому столкновению, при котором изменяется только кинетическая энергия поступательного движения А., а его внутренняя энергия остаётся неизменной). Важный частный случай — столкновение свободного А. с электроном; обычно электрон движется быстро по сравнению с А., время столкновения очень мало и можно говорить об электронном ударе. Возбуждение А. электронным ударом является одним из методов определения уровней энергии А. Вероятности неупругих столкновений и, в частности, возбуждения А" электронным ударом могут быть рассчитаны методами квантовой механики (см. Столкновения атомные ) .
Химические и физические свойства атома.Большинство свойств А. определяется строением и характеристиками его внешних электронных оболочек, в которых электроны связаны сравнительно слабо (энергии связи от нескольких эвдо нескольких десятков эв). Строение внутренних оболочек А., электроны которых связаны гораздо прочнее (энергии связи в сотни, тысячи и десятки тысяч эв) ,проявляется лишь при взаимодействиях А. с быстрыми частицами и фотонами больших энергий (более сотен эв.) Такие взаимодействия определяют рентгеновские спектры А. и рассеяние атомом быстрых частиц (см. Рассеяние микрочастиц, Дифракция частиц) .От массы А., определяемой массой его ядра, зависят его механические свойства при движении А. как целого — количество движения, кинетическая энергия. От механических и связанных с ними магнитных и электрических моментов А. зависят некоторые тонкие эффекты, проявляющиеся при изучении физических свойств А. (см. Моменты атомных ядер , Ядерный магнитный резонанс , Ядерный квадрупольный резонанс , Сверхтонкая структура ).
Свойства атома, определяемые его внешними электронами. Электроны во внешних оболочках А., связанные сравнительно слабо, легко подвергаются внешним воздействиям. При сближении данного А. с другими возникают сильные электростатические взаимодействия (включая т. н. обменные взаимодействия ) ,которые могут приводить к возникновению химической связи А., т. е. к образованию молекулы. В химической связи участвуют электроны внешних оболочек; в случае ковалентной связи эти электроны принадлежат уже не отдельным А., а образовавшейся молекуле в целом, и входят в состав её молекулярных электронных оболочек. Т. о., внешние электроны А. определяют его химические свойства.
Более слабые электростатические взаимодействия двух А. проявляются в их взаимной поляризации — смещении электронов относительно ядер, наиболее сильном для слабо связанных внешних электронов (см. Поляризация частиц ) .Возникают поляризационные силы притяжения между А., которые надо учитывать уже на больших расстояниях между ними (см. Межмолекулярное взаимодействие ). Поляризация А. происходит и во внешних электрических полях; в результате уровни энергии А. смещаются и, что особенно важно, вырожденные уровни энергии расщепляются (поляризация различна для различных квантовых состояний А., соответствующих той же его энергии) — имеет место Штарка явление.Поляризация А. может возникнуть под действием электрического поля световой (электромагнитной) волны; она зависит от частоты света, что обусловливает зависимость от неё и показателя преломления (см. Дисперсия света ) ,связанного со способностью А. поляризоваться — с поляризуемостью А. (см. Поляризуемость атомов, ионов и молекул ) .Тесная связь оптических характеристик А. с его электрическими свойствами особенно ярко проявляется в его оптических спектрах.
Внешними электронами определяются и магнитные свойства А. Они схожи для элементов с аналогичными внешними электронными оболочками А. Магнитный момент А. зависит от его механического момента (см. Магнитомеханическое отношение ) ,в А. с полностью заполненными электронными оболочками он равен нулю, так же как и механический момент. При наличии частично заполненных внешних электронных оболочек магнитные моменты А., как правило, постоянны, и А. являются парамагнитными (см. Парамагнетизм ) .Во внешнем магнитном поле все уровни А., у которых магнитный момент не равен нулю, расщепляются (см. Зеемана явление ) .Все А. обладают диамагнетизмом,который обусловлен возникновением у них магнитного момента под действием магнитного поля (т. н. индуцированного магнитного момента, аналогичного электрическому дипольному моменту А.).
Свойства ионизованного атома. При последовательной ионизации А., т. е. при отрыве его электронов, начиная с самых внешних, в порядке увеличения прочности их связи ( рис. 5 ), соответственно изменяются все свойства А., определяемые его внешней оболочкой. Внешними становятся все более прочно связанные электроны; в результате сильно уменьшается способность А. поляризоваться в электрическое поле, увеличиваются расстояния между уровнями энергии и частоты оптических переходов между этими уровнями (что приводит к смещению спектров в сторону всё более коротких длин волн). Ряд свойств обнаруживает периодичность: сходными оказываются свойства ионов с аналогичными внешними электронами, например N 7+и N 3+(один и два электрона 2 s) обнаруживают сходство с N 6+и N 5+(один и два электрона 1 s). Это относится к характеристикам и относительному расположению уровней энергии и к оптическим спектрам, к магнитным моментам А. и т. д. Наиболее резкое изменение свойств происходит при удалении последнего электрона из внешней оболочки, когда остаются лишь полностью заполненные оболочки; например при переходе от N 4+к N 5+(электронные конфигурации 1 s 22 sи 1 s 2). В этом случае ион наиболее устойчив и его полный механический и полный магнитный моменты равны нулю. Особенно устойчивы, помимо ионов с электронной конфигурацией 1 s 2, ионы с полностью заполненной внешней оболочкой nр( n= 2, 3, 4, ...).
Свойства связанных атомов. Свойства А., находящегося в связанном состоянии, например входящего в состав молекулы, отличаются от свойств свободного А. Наибольшие изменения претерпевают свойства А., определяемые самыми внешними электронами, принимающими участие в присоединении данного А. к другому. Вместе с тем свойства, определяемые электронами внутренних оболочек, могут практически не измениться, как это имеет место для рентгеновских спектров. Некоторые свойства А. могут испытывать сравнительно небольшие изменения, по которым можно получить информацию о характере взаимодействий связанных А. Важным примером может служить расщепление уровней энергии А. в кристаллах и комплексных соединениях , которое происходит под действием электрических полей, создаваемых окружающими ионами (см. Кристаллического поля теория ).
Лит.см. при ст. Атомная физика .
М. А. Ельяшевич.


