Перенесение генетических представлений в область иммунологии позволило советскому учёному В. П. Эфроимсону сформулировать эволюционно-генетическую концепцию иммуногенеза, объясняющую внутривидовое антигенное разнообразие и гетерогенность антител по специфичности. Каждая здоровая зрелая в иммунологическом отношении особь способна к иммунному ответу на тканевые антигены особи с другим генотипом. Таким образом, тканевая несовместимость — универсальная биологическая закономерность. Лишь однояйцевые близнецы и животные одной
чистой линии
не разделены барьером тканевой несовместимости, выраженность которой зависит от степени несходства генотипов донора и реципиента. Для успешных пересадок органов и тканей, переливаний крови и клеток костного мозга очень важно снизить до минимума величину этого несходства путём подбора совместимого донора. Изучение клеточных антигенов, их наследования и разнообразия, их обнаружение (типирование) — это те разделы И. , которые особенно важны для трансплантологии, трансфузиологии, иммуногематологии и клинической иммунологии. См. также
Иммунология
.
Лит.:Медведев Н. Н., Линейные мыши, Л., 1964; Хатт Ф., Генетика животных. пер. с англ., М., 1969; Эфроимсон В. П., Иммуногенетика, М., 1971; Hildemann W. Н., Immunogenetics, San Francisco, 1970.
А. Н. Мац, О. В. Рохлин.
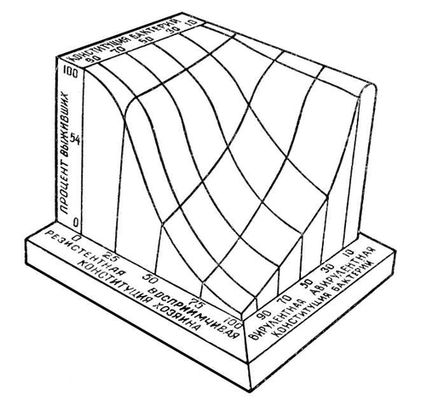 Трёхмерное изображение зависимости жизнеспособности макроорганизма от его устойчивости к патогенным агентам и от вирулентности возбудителя.
Трёхмерное изображение зависимости жизнеспособности макроорганизма от его устойчивости к патогенным агентам и от вирулентности возбудителя.
антителами
к каким-либо
антигенам
. Известно 5 классов И. человека: G, М, A, D, Е (
см. табл.
). Наиболее полно изучены И. класса G (IgG). Их молекулы построены из двух идентичных лёгких (молекулярная масса 22000) и двух идентичных тяжёлых (молекулярная масса 55000—70000) полипептидных цепей, скрепленных дисульфидными связями (
см. рис.
). При расщеплении протеолитическими ферментами (например, папаином) молекула И. распадается на три части: два одинаковых фрагмента (обозначаются Fab), каждый из которых сохраняет способность к связыванию с антигеном, и фрагмент (обозначается Fc), способствующий прохождению И. через
биологические мембраны
. Все три фрагмента соединены короткими гибкими участками, расположенными в середине тяжёлой цепи. Гибкость позволяет молекулам И. оптимально присоединяться к антигенам, имеющим разное пространственное строение. Участки молекулы, ответственные за связывание с антигеном (
активный центр
), образованы N-кoнцевыми (несут на конце аминогруппу — NH
2) отрезками тяжёлых и лёгких цепей. Последовательность аминокислот в этих отрезках специфична для каждого IgG, в других участках цепей она почти не варьирует. На основании различий в строении тяжёлых цепей И. относят к определённым классам.
Большинство антител находится главным образом среди IgG (применяемые в лечебных целях препараты гамма-глобулинов состоят преимущественно из IgG). IgM эволюционно наиболее древние И.; они синтезируются на первых стадиях иммунной реакции. Их молекулы состоят из 5 мономерных субъединиц, каждая из которых напоминает молекулу IgG. Для IgA характерна способность проникать в различные секреты (слюну, молозиво, кишечный сок), где они встречаются в полимерной форме. Антитела, участвующие в аллергических реакциях (см. Аллергия ), относятся к недавно открытым IgE.
И. синтезируются лимфатическими клетками. При некоторых поражениях этих клеток в крови и моче накапливается большое количество так называемых миеломных И., которые, в отличие от И. здорового организма, однородны по составу. См. также Иммунология и Иммуногенетика .
Лит.:Гауровиц Ф., Иммунохимия и биосинтез антител, пер. с англ., М., 1969: Незлин Р. С., Биохимия антител, М., 1966; Портер Р., Структура антител, в сборнике: Молекулы и клетки, в. 4, пер. с англ., М., 1969; Kabat Е. A., Structural concepts in immunology and immunochemistry, N. Y., 1968.
Р. С. Незлин.
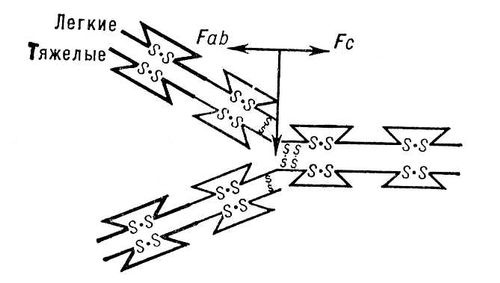 Схема молекулы иммуноглобулина G. Показаны две тяжёлые и две лёгкие полипептидные цепи, соединённые межцепьевыми дисульфидными связями. Лёгкая цепь состоит из 2, тяжёлая — из 4 структурных единиц (петель), образованных внутрицепьевыми дисульфидными связями. Жирными линиями обозначены N-кoнцевые участки цепей, стрелкой — участок, чувствительный к протеолитическому расщеплению, в результате которого молекула распадается на два Fab —фрагмента, сохраняющих активность антител, и на Fc —фрагмент.
Схема молекулы иммуноглобулина G. Показаны две тяжёлые и две лёгкие полипептидные цепи, соединённые межцепьевыми дисульфидными связями. Лёгкая цепь состоит из 2, тяжёлая — из 4 структурных единиц (петель), образованных внутрицепьевыми дисульфидными связями. Жирными линиями обозначены N-кoнцевые участки цепей, стрелкой — участок, чувствительный к протеолитическому расщеплению, в результате которого молекула распадается на два Fab —фрагмента, сохраняющих активность антител, и на Fc —фрагмент.
Лит.:Медведев Н. Н., Линейные мыши, Л., 1964; Хатт Ф., Генетика животных. пер. с англ., М., 1969; Эфроимсон В. П., Иммуногенетика, М., 1971; Hildemann W. Н., Immunogenetics, San Francisco, 1970.
А. Н. Мац, О. В. Рохлин.

антителами
к каким-либо
антигенам
. Известно 5 классов И. человека: G, М, A, D, Е (
см. табл.
). Наиболее полно изучены И. класса G (IgG). Их молекулы построены из двух идентичных лёгких (молекулярная масса 22000) и двух идентичных тяжёлых (молекулярная масса 55000—70000) полипептидных цепей, скрепленных дисульфидными связями (
см. рис.
). При расщеплении протеолитическими ферментами (например, папаином) молекула И. распадается на три части: два одинаковых фрагмента (обозначаются Fab), каждый из которых сохраняет способность к связыванию с антигеном, и фрагмент (обозначается Fc), способствующий прохождению И. через
биологические мембраны
. Все три фрагмента соединены короткими гибкими участками, расположенными в середине тяжёлой цепи. Гибкость позволяет молекулам И. оптимально присоединяться к антигенам, имеющим разное пространственное строение. Участки молекулы, ответственные за связывание с антигеном (
активный центр
), образованы N-кoнцевыми (несут на конце аминогруппу — NH
2) отрезками тяжёлых и лёгких цепей. Последовательность аминокислот в этих отрезках специфична для каждого IgG, в других участках цепей она почти не варьирует. На основании различий в строении тяжёлых цепей И. относят к определённым классам.
Особенности разных классов иммуноглобулинов здорового человека
| Класс иммуноглобулина | Молекулярная масса | Содержание углеводов, % | Содержание в сыворотке, мг % |
| lgG | 140 000 | 2 | 800-1680 |
| lgM | 900 000 | 10 | 50-190 |
| lgA | 170 000 и выше | 7 | 140-420 |
| lgD | 180 000 | 12 | 3-40 |
| lgE | 196 000 | 10 | 0,01-0,14 |
Большинство антител находится главным образом среди IgG (применяемые в лечебных целях препараты гамма-глобулинов состоят преимущественно из IgG). IgM эволюционно наиболее древние И.; они синтезируются на первых стадиях иммунной реакции. Их молекулы состоят из 5 мономерных субъединиц, каждая из которых напоминает молекулу IgG. Для IgA характерна способность проникать в различные секреты (слюну, молозиво, кишечный сок), где они встречаются в полимерной форме. Антитела, участвующие в аллергических реакциях (см. Аллергия ), относятся к недавно открытым IgE.
И. синтезируются лимфатическими клетками. При некоторых поражениях этих клеток в крови и моче накапливается большое количество так называемых миеломных И., которые, в отличие от И. здорового организма, однородны по составу. См. также Иммунология и Иммуногенетика .
Лит.:Гауровиц Ф., Иммунохимия и биосинтез антител, пер. с англ., М., 1969: Незлин Р. С., Биохимия антител, М., 1966; Портер Р., Структура антител, в сборнике: Молекулы и клетки, в. 4, пер. с англ., М., 1969; Kabat Е. A., Structural concepts in immunology and immunochemistry, N. Y., 1968.
Р. С. Незлин.

