Страница:
В распределении токсикантов в организме большую роль играют гистогематические барьеры. У детей эти барьеры более проницаемы даже для плохо растворимых в липидах веществ. Проницаемость гематоэнцефалического барьера возрастает при гипоксии, ацидозе и других патологических состояниях.
Влияние трансплацентарного барьера на распределение токсикантов изучено меньше, однако считается, что если вещество может свободно проходить гематоэнцефалический барьер, то оно также проходит и трансплацентарный.
Второй этап биотрансформации – конъюгация – представлен следующим образом: сульфатирование осуществляется в полной мере уже к рождению ребенка; метилирование – к концу первого месяца жизни; глюкуронизация – к концу второго; соединение с глутатионом – в 3 мес.; с глицином – в 6 мес. Недостаточное функционирование одного пути образования полярных соединений у детей может компенсироваться другим.
Скорость биотрансформации в печени и других органах зависит от ряда факторов: уровня артериального давления, гипоксии, ацидоза, нарушений функций печени, связанных с перенесенными ранее заболеваниями, и пр.
В периоде новорожденности у некоторых больных могут проявиться нарушения активности ферментных систем, биотрансформирующих лекарственные средства. В связи с этим педиатр или токсиколог первыми обнаруживают у детей необычные реакции на различные токсиканты. Это может быть обусловлено врожденными изменениями (активности) отдельных энзимов. Например, при недостаточности глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) и редуктазы глутатиона у больных с отравлениями препаратами-окислителями (хинин, парацетамол, викасол и пр.) возможно появление гемолиза эритроцитов с развитием гемолитической анемии. У больного с недостаточностью редуктазы увеличивается уровень метгемоглобина с развитием цианоза, тканевой гипоксии и пр. Таким образом, в будущем можно рассчитывать на появление нового подраздела клинической токсикологии – токсикогенетики.
Необходимо отметить, что у новорожденных и грудных детей моча носит кислый характер, поэтому алкалоиды и основания, в отличие от слабых кислот, могут выводиться из организма быстрее.
При патологии почек необходимо исследовать их экскреторную функцию, так как почечная недостаточность может привести к замедлению выведения токсикантов. В отдельных фармакологических справочниках приводятся показатели фармакокинетики лекарственных средств с учетом возраста детей и состояния выделительной функции почек.
Выведение веществ через кишечник, с дыханием и через кожные покровы протекает так же, как и у взрослых.
Основные токсико-кинетические особенности острых отравлений у детей представлены по материалам И.В. Марковой (1998 г.).
5. Дополнительная литература
Глава 1. ПРИНЦИПЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ОСТРЫХ ОТРАВЛЕНИЙ
1.1. Клиническая и инструментальная диагностика острых отравлений
Влияние трансплацентарного барьера на распределение токсикантов изучено меньше, однако считается, что если вещество может свободно проходить гематоэнцефалический барьер, то оно также проходит и трансплацентарный.
Особенности биотрансформации токсикантов
Известно, что главной окисляющей системой выступают изоферменты цитохрома Р-450. У детей младшего возраста она менее активна, чем у взрослых, что замедляет биотрансформацию некоторых токсикантов.Второй этап биотрансформации – конъюгация – представлен следующим образом: сульфатирование осуществляется в полной мере уже к рождению ребенка; метилирование – к концу первого месяца жизни; глюкуронизация – к концу второго; соединение с глутатионом – в 3 мес.; с глицином – в 6 мес. Недостаточное функционирование одного пути образования полярных соединений у детей может компенсироваться другим.
Скорость биотрансформации в печени и других органах зависит от ряда факторов: уровня артериального давления, гипоксии, ацидоза, нарушений функций печени, связанных с перенесенными ранее заболеваниями, и пр.
В периоде новорожденности у некоторых больных могут проявиться нарушения активности ферментных систем, биотрансформирующих лекарственные средства. В связи с этим педиатр или токсиколог первыми обнаруживают у детей необычные реакции на различные токсиканты. Это может быть обусловлено врожденными изменениями (активности) отдельных энзимов. Например, при недостаточности глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) и редуктазы глутатиона у больных с отравлениями препаратами-окислителями (хинин, парацетамол, викасол и пр.) возможно появление гемолиза эритроцитов с развитием гемолитической анемии. У больного с недостаточностью редуктазы увеличивается уровень метгемоглобина с развитием цианоза, тканевой гипоксии и пр. Таким образом, в будущем можно рассчитывать на появление нового подраздела клинической токсикологии – токсикогенетики.
Особенности выведения токсикантов из организма ребенка
Установленных закономерностей, которые могли бы предсказать величину почечного клиренса у детей, не существует. Для каждого лекарственного средства параметры почечной экскреции устанавливаются индивидуально в каждой возрастной группе. У детей раннего возраста клубочковая фильтрация осуществляется хуже, чем у взрослых. Она достигает постоянного уровня примерно к 1–2 годам. Канальцевая секреция происходит, как у взрослых, с 4-10 месяцев жизни.Необходимо отметить, что у новорожденных и грудных детей моча носит кислый характер, поэтому алкалоиды и основания, в отличие от слабых кислот, могут выводиться из организма быстрее.
При патологии почек необходимо исследовать их экскреторную функцию, так как почечная недостаточность может привести к замедлению выведения токсикантов. В отдельных фармакологических справочниках приводятся показатели фармакокинетики лекарственных средств с учетом возраста детей и состояния выделительной функции почек.
Выведение веществ через кишечник, с дыханием и через кожные покровы протекает так же, как и у взрослых.
Основные токсико-кинетические особенности острых отравлений у детей представлены по материалам И.В. Марковой (1998 г.).
5. Дополнительная литература
1. Бадюгин И.С. Экстремальная токсикология. – М.: ГЭОТАР-Медиа, 2006. – 416 с.
2. Бонитенко Ю.Ю., Никифоров А.М. Чрезвычайные ситуации химической природы. – СПб.: Гиппократ, 2004. – 464 с.
3. Дагаев В.Н., Лужников Е.А., Казачков В.И. Клиническая токсикометрия острых отравлений. – Екатеринбург: Чароид, 2001. – 152 с.
4. Курляндский Б.А., Филов В.А. (ред.). Общая токсикология. – М.: Медицина, 2002. – 608 с.
5. Лужников Е.А. (ред.). Неотложная клиническая токсикология. – М.: Медпрактика-М, 2007. – 608 с.
6. Маркова И.В. и др. (ред.). Клиническая токсикология детей и подростков. – М.: Медицина, 2003. – Т. 1. – 1048 с.
7. Элленхорн М.Дж. Медицинская токсикология (пер. с англ.). – М.: Медицина, 2003. – Т. 1. – 1048 с.
2. Бонитенко Ю.Ю., Никифоров А.М. Чрезвычайные ситуации химической природы. – СПб.: Гиппократ, 2004. – 464 с.
3. Дагаев В.Н., Лужников Е.А., Казачков В.И. Клиническая токсикометрия острых отравлений. – Екатеринбург: Чароид, 2001. – 152 с.
4. Курляндский Б.А., Филов В.А. (ред.). Общая токсикология. – М.: Медицина, 2002. – 608 с.
5. Лужников Е.А. (ред.). Неотложная клиническая токсикология. – М.: Медпрактика-М, 2007. – 608 с.
6. Маркова И.В. и др. (ред.). Клиническая токсикология детей и подростков. – М.: Медицина, 2003. – Т. 1. – 1048 с.
7. Элленхорн М.Дж. Медицинская токсикология (пер. с англ.). – М.: Медицина, 2003. – Т. 1. – 1048 с.
Глава 1. ПРИНЦИПЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ОСТРЫХ ОТРАВЛЕНИЙ
1.1. Клиническая и инструментальная диагностика острых отравлений
Клиническая диагностика – наиболее доступный метод, применяемый как на догоспитальном этапе, так и в стационаре. Он заключается в выявлении симптомов, характерных для воздействия на организм токсичного вещества в соответствии с его «избирательной токсичностью». Воздействуя на рецептор токсичности, вещество или группа веществ с одинаковым или сходным механизмом действия вызывают ответную реакцию организма в виде определенных симптомов, характерных для того или иного вида пораженных рецепторов, входящих в состав определенной физиологической системы (дыхание, кровообращение и пр.).
Большинство химических веществ, встречающихся в быту в качестве токсикантов, при попадании в организм вызывают быстрое развитие и клиническое проявление основных характерных симптомов отравления. Например, быстро развиваются коматозное состояние при отравлении снотворными и нейролептическими средствами, этиловым спиртом; мускарино– и никотиноподобные симптомы при отравлении антихолинэстеразными ядами; нарушения ритма и проводимости сердца при отравлении веществами кардиотропного действия; поражения крови (гемолиз, метгемоглобинемия) при попадании «кровяных» ядов. Выявить специфическое действие бывает сложно при отравлении веществами гепато– и нефротоксического действия. Определить гепато– и нефропатию при обычном осмотре, не имея лабораторных данных, а также без признаков у больного желтухи, уремии, отеков и других симптомов не представляется возможным, так как они проявляются не ранее, чем на 3-4-е сутки после приема яда. Аналогичная ситуация возникает при отравлении метанолом, при котором токсическое поражение глаз выявляется не ранее, чем через 2–3 суток после отравления, когда патологический процесс приобретает необратимый характер. Через несколько дней (до 7-10) происходит токсическое поражение периферической нервной системы (полинейропатия, полиневриты) при отравлении соединениями металлов, фосфорорганическими соединениями.
В подобных случаях клиническую диагностику осуществляют по совокупности данных анамнеза (если таковой имеется), а также с учетом неспецифических, но патогномоничных для многих отравлений симптомов. Один из них наиболее часто отмечается при отравлении – это синдром поражения желудочно-кишечного тракта (ЖКТ) в виде гастроэнтерита, химического ожога пищеварительного тракта. Рвота, понос – характерные признаки при отравлении солями тяжелых металлов, дихлорэтаном, некоторыми суррогатами алкоголя, фосфорорганическими соединениями (ФОС), ядами растительного происхождения. При отравлении метанолом, этиленгликолем, хлорированными углеводородами диагностическое значение имеет симптомокомплекс, описываемый в литературе как токсическая энцефалопатия. В него входят соматовегетативные проявления (гиперемия лица, инъекция склер, артериальная гипертензия, тахикардия) и нарушения сознания (неадекватность поведения, дезориентированность, возбуждение, иногда судорожные припадки).
В тех случаях, когда не представляется возможным точно определить наименование вещества, вызвавшего острое отравление, диагноз ставят по ведущему или ведущим патологическим синдромам, развившимся у больного. Например, «отравление ядом антихолинэстеразного действия или фосфорорганическим веществом», «ядом прижигающего действия» и т. д. Неправильным следует считать широко используемый диагноз «отравление неизвестным ядом», так как самостоятельной нозологической формы «неизвестный яд» не существует. Правильнее использовать термин по МКБ-10 – «неуточненное вещество».
Химико-токсикологическая диагностика – наиболее надежный способ диагностики отравления, так как по клинической картине далеко не всегда можно определить конкретное вещество, особенно в случае употребления нескольких отравляющих веществ или на фоне алкогольного опьянения. Существует специальная хроматографическая система быстрой, надежной, достаточно чувствительной и воспроизводимой лабораторной идентификации токсичных веществ в наиболее доступных биологических средах организма (кровь, моча) (М.В. Белова и др., 2007).
Наиболее часто в клинической практике используется эзофагогастродуоденоскопия (ЭГДС) для выявления химического ожога пищеварительного тракта. Она позволяет определить характер поражения, степень выраженности, протяженность, наличие пищеводно-желудочного кровотечения. Наблюдаемая картина описывается как катаральное, эрозивное или фибринозно-эрозивное, некротическое поражение слизистой пищеварительного тракта.
Электрокардиография позволяет выявить специфическое нарушение ритма и проводимости сердца, так называемый первичный кардиотоксический эффект (ПКЭ), патогномоничный для отравления ФОС, соединениями бария.
При отравлении токсикантами гепато– и нефротропного действия используется радиоизотопная гепаторенография, позволяющая выявить нарушения секреторной и экскреторной функции этих органов, а также УЗИ печени и почек.
Рентгенологическое исследование легких применяется для раннего выявления токсического поражения дыхательных путей (токсический трахеобронхит, отек легких) при отравлении парами хлора, аммиака и др. газов раздражающего, прижигающего действия.
С целью дифференциальной диагностики коматозных состояний широко используются ЭЭГ и компьютерная томография головного мозга.
Основные показатели, имеющие определенный физиологический смысл, следующие: Мо (мода) – наиболее часто встречающееся значение длительности интервалов R-R, выраженное в сек; АМо (амплитуда моды) – число значений интервалов, разных Мо в % к общему числу зарегистрированных кардиоциклов; DХ (вариационный размах) – разница между максимальным и минимальным значением длительности зарегистрированных интервалов R-R в сек; ИН (индекс напряжения) – в условных единицах. Последний рассчитывается по формуле:
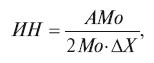
где Мо – характеризует гуморальный канал регуляции ритма сердца; АМо– активность симпатического и DХ – активность парасимпатического отдела вегетативной нервной системы; ИН – суммарный показатель, отражающий степень напряжения компенсаторных механизмов организма. Кроме того, ИН может служить показателем исходного вегетативного тонуса.
Исходный вегетативный тонус оценивается следующим образом: эйтония, сбалансированное состояние регуляторных систем ВНС характеризуется ИН, равным 30–90 усл. ед.; ваготония – ИН меньше 30 усл. ед.; симпатикотония – ИН от 90 до 160 усл. ед.; гиперсимпатикотония – ИН более 160 усл. ед.

У детей раннего возраста (1–3 года) состоянию средней тяжести соответствуют следующие показатели КИГ: Мо – 0,58-0,46 сек; АМо – 34–40 %; DХ – 0,13-0,06 сек; ИН – 200–650 усл. ед.; тяжелому: Мо – 0,48-0,36 сек; АМо – 46–60 %; DХ – 0,06-0,04 сек; ИН – 700-2500 усл. ед.; крайне тяжелому: Мо – 0,40-0,30 сек; АМо – более 60 %; DХ – 0,04-0,02 сек; ИН – более 2500–3000 усл. ед. Показатели КИГ в возрасте 14–15 лет соответствуют показателям у взрослых.
Большинство химических веществ, встречающихся в быту в качестве токсикантов, при попадании в организм вызывают быстрое развитие и клиническое проявление основных характерных симптомов отравления. Например, быстро развиваются коматозное состояние при отравлении снотворными и нейролептическими средствами, этиловым спиртом; мускарино– и никотиноподобные симптомы при отравлении антихолинэстеразными ядами; нарушения ритма и проводимости сердца при отравлении веществами кардиотропного действия; поражения крови (гемолиз, метгемоглобинемия) при попадании «кровяных» ядов. Выявить специфическое действие бывает сложно при отравлении веществами гепато– и нефротоксического действия. Определить гепато– и нефропатию при обычном осмотре, не имея лабораторных данных, а также без признаков у больного желтухи, уремии, отеков и других симптомов не представляется возможным, так как они проявляются не ранее, чем на 3-4-е сутки после приема яда. Аналогичная ситуация возникает при отравлении метанолом, при котором токсическое поражение глаз выявляется не ранее, чем через 2–3 суток после отравления, когда патологический процесс приобретает необратимый характер. Через несколько дней (до 7-10) происходит токсическое поражение периферической нервной системы (полинейропатия, полиневриты) при отравлении соединениями металлов, фосфорорганическими соединениями.
В подобных случаях клиническую диагностику осуществляют по совокупности данных анамнеза (если таковой имеется), а также с учетом неспецифических, но патогномоничных для многих отравлений симптомов. Один из них наиболее часто отмечается при отравлении – это синдром поражения желудочно-кишечного тракта (ЖКТ) в виде гастроэнтерита, химического ожога пищеварительного тракта. Рвота, понос – характерные признаки при отравлении солями тяжелых металлов, дихлорэтаном, некоторыми суррогатами алкоголя, фосфорорганическими соединениями (ФОС), ядами растительного происхождения. При отравлении метанолом, этиленгликолем, хлорированными углеводородами диагностическое значение имеет симптомокомплекс, описываемый в литературе как токсическая энцефалопатия. В него входят соматовегетативные проявления (гиперемия лица, инъекция склер, артериальная гипертензия, тахикардия) и нарушения сознания (неадекватность поведения, дезориентированность, возбуждение, иногда судорожные припадки).
В тех случаях, когда не представляется возможным точно определить наименование вещества, вызвавшего острое отравление, диагноз ставят по ведущему или ведущим патологическим синдромам, развившимся у больного. Например, «отравление ядом антихолинэстеразного действия или фосфорорганическим веществом», «ядом прижигающего действия» и т. д. Неправильным следует считать широко используемый диагноз «отравление неизвестным ядом», так как самостоятельной нозологической формы «неизвестный яд» не существует. Правильнее использовать термин по МКБ-10 – «неуточненное вещество».
Химико-токсикологическая диагностика – наиболее надежный способ диагностики отравления, так как по клинической картине далеко не всегда можно определить конкретное вещество, особенно в случае употребления нескольких отравляющих веществ или на фоне алкогольного опьянения. Существует специальная хроматографическая система быстрой, надежной, достаточно чувствительной и воспроизводимой лабораторной идентификации токсичных веществ в наиболее доступных биологических средах организма (кровь, моча) (М.В. Белова и др., 2007).
Клинический пример № 1
Больной Л., 34 года,Клинико-биохимическая лабораторная диагностика, не обладая специфичностью, может быть ценным дополнением, позволяя выявить изменения, характерные для определенных отравлений, в частности определение КОС при отравлении такими суррогатами алкоголя, как метанол, этиленгликоль, высшие спирты; поражение крови (анемия, лейкопения, нейтропения и др.) при отравлении ядами группы ароматических углеводородов; увеличение ферментов печени, билирубина, мочевины и креатинина, исследование крови на токсичность (пул средних молекул) и др. при поражении токсикантами гепато– и нефротропного действия.
страдает наркоманией. Был обнаружен родственниками в бессознательном состоянии через 10 ч после введения героина. Доставлен СМП в отделение токсикологической реанимации НИИ СП им. Н.В. Склифосовского.
На ДГЭ отмечались потеря сознания с нарушением дыхания, гипотония до 70/30 мм рт. ст. СМП проводилась инфузионная, симптоматическая терапия.
При поступлении 25.03.08 г. отмечались проявления интоксикации, опухоль от длительного сдавливания мягких тканей в области левого плеча, предплечья: уровень сознания – сопор (по шкале Глазго – 7б). Зрачки расширены, кожные покровы бледные, гемодинамика нестабильная: ЧСС 113 уд/мин, АД 80/40 мм рт. ст.
Лабораторные данные: креатинин – 305,3 ммоль/л, мочевина – 15,3 ммоль/л, Нв – 153 г/л, лейкоциты – 33 х 109/л, тромбоциты – 261.
В крови этанол не обнаружен, в моче реакция на опиаты – положительная, психотропные препараты не обнаружены. В моче обнаружен этиленгликоль – 0,4 мг/мл.
В отделении реанимации проводилась инфузионная детоксикационная терапия, симптоматическая, антибактериальная, витаминотерапия, введение гормонов, прессорных аминов, гемодиализ в течение 1 ч.
На фоне проведенной терапии состояние улучшилось, проявления интоксикации купированы, гемодинамика стабилизировалась.
Течение заболевания осложнилось гнойным трахеобронхитом, пневмонией, синдромом позиционного сдавления мягких тканей левой верхней конечности, токсической гепатонефропатией, обострением реактивного панкреатита, энцефалопатией.
На R-графии легких от 26.03.08 г. – венозное полнокровие с двух сторон.
Заключение после УЗИ органов брюшной полости от 26.03.08 г.: диффузные изменения печени. Застойный желчный пузырь. Отек паранефральной клетчатки справа.
Биохимический анализ крови от 26.03.08 г.: креатинин – 233,0 ммоль/л, мочевина – 10,2 ммоль/л, амилаза в крови – 1646,1 (N до 90). Ферменты: АлТ – 267,8 Е/л (N 0-45), АсТ – 715,3 Е/л (N 0-35), ЛДГ – 611,0 Е/л (N 0-248).
Консультирован хирургом.
Заключение: данных за острую хирургическую патологию нет. Явления реактивного панкреатита.
30.03.08 г. продолжалась симптоматическая, витамино– (витамины группы В, витамин С), антибактериальная (ампиокс, диоксидин, метрожил) терапия, психофармакологическая коррекция (реланиум, феназепам), ноотропная терапия (глицин, пирацетам), прием гепатопротекторов (липоевая кислота), введение мексидола, актовегина.
Осмотрен физиотерапевтом, проводилась ЛФК, УФО на гр. клетку, левую в/конечность.
В результате проведенного лечения состояние улучшилось. Проявления интоксикации и осложнений купированы. Больной в сознании, контактен, ориентирован. Жалобы на слабость. Дыхание ровное, жесткое, проводится во все отделы. ЧД – 18 в мин. Аускультативно – без хрипов. Тоны сердца ритмичны. ЧСС – 88 уд/мин. АД – 120/80 мм рт. ст. Диурез адекватный. Отечность левой верхней конечности уменьшилась. Температура тела – 36,7 °C.
Заключение после УЗИ органов брюшной полости от 07.04.08 г. – эхо-признаки диффузных изменений печени, застойного желчного пузыря.
На R-графии легких от 07.04.08 г. – легочные поля прозрачные.
Повторно осмотрен психиатром.
Заключение: наркомания, передозировка героином. По психическому статусу может быть выписан.
Выписывается домой в сопровождении родственников. Рекомендовано наблюдение нарколога по месту жительства.
Лечебные рекомендации: Диета – стол № 5, мексидол – по 1 таб. х 3 раза, аевит – по 1 таб. х 3 раза, липоевая кислота – по 1 таб. х 3 раза, рибоксин – по 1 таб. х 3 раза, ноотропил – по 2 капс. (утром, днем), фосфоглив – по 1 капс. х 3 раза, панкреатин – по 2 таб. (во время еды).
Клинический диагноз. Основной: комбинированное отравление опиатами и этиленгликолем (Т40.6, Т52.3).
Осложнение: гнойный трахеобронхит. Пневмония. Синдром позиционного сдавления мягких тканей левой верхней конечности. Токсическая гепатонефропатия. Обострение реактивного панкреатита. Энцефалопатия смешанного генеза (токсическая, постгипоксическая). Астенический синдром.
Сопутствующий: опийная наркомания.
P.S. Представлен редкий случай комбинированного острого отравления, диагностика которого стала возможной только после химико-токсикологического исследования, позволившего определить этиленгликоль в моче, провести ранний гемодиализ, предотвратить развитие ОПН, характерной для данной патологии.
Клинический пример № 2
Больной З.,Функциональная или инструментальная диагностика дополняет клиническую картину и данные лабораторного химико-токсикологического исследования. В отличие от последнего она неспецифична и направлена на выявление какого-либо важного синдрома, без указания на конкретное вещество, вызвавшее отравление.
находился в Центре острых отравлений НИИ скорой помощи им. Н.В. Склифосовского с 22.06.06 г. (8 кален. дней). Доставлен СМП из дома после употребления неизвестной спиртосодержащей жидкости. На ДГЭ СМП начата инфузионная терапия. Больной страдает хроническим алкоголизмом. Госпитализации предшествовало запойное состояние в течение 6 месяцев.
При поступлении состояние тяжелое. Тяжесть состояния обусловлена проявлениями алкогольного абстинентного синдрома, алкогольного делирия: уровень сознания – оглушение, периодически неадекватен, суетлив, возбужден, заторможен, контакт затруднен, гемодинамика стабильная, АД 150/90 мм рт. ст., ЧСС 90 уд/мин.
В биосредах: этанол, метанол, этиленгликоль не обнаружены. Зарегистрирован выраженный метаболический ацидоз, рН крови – 7,0, ВЕ – 20 ммоль/л. Осмотрен психиатром.
Заключение: алкогольный делирий. Проводилась инфузионная детоксикационная терапия (гипохлорит натрия 0,6 % – 500 мл в вену), форсированный диурез, симптоматическая и витаминотерапия с положительной динамикой. На фоне проведенной терапии проявления алкогольного делирия купированы, но течение заболевания осложнилось астеническим синдромом. Продолжалась инфузионная, симптоматическая, витаминотерапия, психофармакологическая коррекция. После улучшения состояния повторно осмотрен психиатром.
Заключение: астенический синдром, хронический алкоголизм II ст.
Больной в сознании, контактен, ориентирован, заторможен. Жалобы на слабость, нарушение зрения. Зрачки средней величины. OS=OD. Кожные покровы обычной окраски. Дыхание жесткое, без хрипов, ЧД – 18 в мин. Гемодинамика стабильная. АД – 110/70 мм рт. ст. ЧСС – 88 уд/мин. Живот мягкий, не вздут, пальпация безболезненная. Диурез адекватный.
Осмотрен офтальмологом.
Заключение: двусторонний токсический алкогольный неврит зрительного нерва. Рекомендован перевод в многопрофильный стационар, имеющий глазное отделение.
Клинический анализ крови: Hb – 150 г/л, Ht – 36 %, эритроциты – 4,7 х 1012/л, лейкоциты – 4,9 х 109/л.
Показатели биохимического анализа крови: общий белок – 80 г/л, мочевина – 6,8 ммоль/л, креатинин – 135 ммоль/л, билирубин общий – 9,7 мкмоль/л. Ферменты: ЛДГ – 677,3 U/I (N 225,00-460,00), АсТ – 75,5 U/I (N 10,00–40,00), АлТ – 46,6 U/I (N 10,00–40,00). Амилаза крови – 93,7 U/I (N 0-220). рН крови – 7,3, ВЕ – 2 ммоль/л.
Клинический диагноз: 1. Хроническая алкогольная интоксикация. Алкогольный абстинентный синдром. Алкогольный делирий. Энцефалопатия смешанного генеза. Запойное состояние. 2. Двусторонний токсический алкогольный неврит зрительного нерва. 3. Хронический алкоголизм II ст.
P.S. Это клиническое наблюдение – пример сложной дифференциальной диагностики острых расстройств зрения при химических отравлениях, которые имеют разный патогенез: прямой токсикогенный при отравлении метанолом и запойных состояниях, с этанолом, особенностью которых является развитие метаболического ацидоза с последующим невритом зрительного нерва и психосоматогенный алкогольный амовроз, имеющий приходящий характер. Основа правильной диагностики – офтальмологическое обследование.
Наиболее часто в клинической практике используется эзофагогастродуоденоскопия (ЭГДС) для выявления химического ожога пищеварительного тракта. Она позволяет определить характер поражения, степень выраженности, протяженность, наличие пищеводно-желудочного кровотечения. Наблюдаемая картина описывается как катаральное, эрозивное или фибринозно-эрозивное, некротическое поражение слизистой пищеварительного тракта.
Электрокардиография позволяет выявить специфическое нарушение ритма и проводимости сердца, так называемый первичный кардиотоксический эффект (ПКЭ), патогномоничный для отравления ФОС, соединениями бария.
При отравлении токсикантами гепато– и нефротропного действия используется радиоизотопная гепаторенография, позволяющая выявить нарушения секреторной и экскреторной функции этих органов, а также УЗИ печени и почек.
Рентгенологическое исследование легких применяется для раннего выявления токсического поражения дыхательных путей (токсический трахеобронхит, отек легких) при отравлении парами хлора, аммиака и др. газов раздражающего, прижигающего действия.
С целью дифференциальной диагностики коматозных состояний широко используются ЭЭГ и компьютерная томография головного мозга.
Клинический пример № 3
Больной С., 32 года,Для исследования адаптационно-компенсаторной реакции вегетативной нервной системы на химическую травму (отравление) используется метод кардиоинтервалографии (КИГ), с помощью которого можно в динамике проводить объективную оценку тяжести общего состояния больного, эффективности проводимого лечения и прогноза отравления у взрослых и детей.
поступил 21.12.07 г. в 18:35 в Центр отравлений НИИ СП им. Н.В. Склифосовского.
Доставлен бригадой СМП из дома, где 20.12.07 г. якобы вводил себе раствор опиатов, после чего находился без сознания. На ДГЭ – кома, ЧДД – 12–14 в мин.
При поступлении: состояние больного тяжелое. В коме, на болевой раздражитель некоординированная двигательная реакция (5б по шкале Глазго), зрачки расширены, фотореакция отсутствует. Кожные покровы бледные, сухие. Дыхание самостоятельное, неадекватное, поверхностное, ЧДД 8-10 в мин. В легких выслушиваются жесткие, диффузно влажные хрипы. В связи с неадекватным дыханием больной интубирован, переведен на аппаратное дыхание. Тоны сердца приглушены, ритмичные, АД – 165/100 мм рт. ст., ЧСС – 110 уд/мин. Живот не вздут, мягкий, без реакции к пальпации. При катетеризации мочевого пузыря выделилось 300,0 мл светлой мочи.
В лаборатории: этанол в крови, моче не обнаружен, психотропные препараты не обнаружены, реакция на морфин, кокаин, метадон, метамфетамины – отрицательная.
Начато проведение инфузионной, детоксикационной, симптоматической, антибактериальной терапии, форсированный диурез.
Больному произведена R-графия черепа, грудной клетки – без патологии. Но в связи с сохраняющимся нарушением сознания и отсутствия токсиканта в биосредах, больной консультирован нейрохирургом, произведена КТ головного мозга.
Заключение: признаки объемного образования левой височной доли с перифокальным отеком (34 смЗх171 смЗ) – астроцитома, поперечная и аксиальная дислокация, отек головного мозга.
21.12.07 г. состояние больного крайне тяжелое, с отрицательной динамикой – нестабильная гемодинамика АД – 70/45 мм рт. ст., больному начато введение вазопрессорных аминов.
Больному продолжается проведение инфузионной, симптоматической, антибактериальной терапии, форсированный диурез.
25.12.07 г. был проведен консилиум с хирургом, нейрохирургом и токсикологом – принято решение, что больному в связи с тяжестью состояния не показано активное дообследование и оперативное лечение.
Несмотря на проводимую терапию, состояние больного продолжало ухудшаться. 26.12.07 г. в 08:25 на фоне ИВЛ и некупирующегося коллапса наступила остановка сердечной деятельности и дыхания. На мониторе – отсутствие электрической активности сердца. Реанимационные мероприятия – без эффекта.
26.12.07 г. в 08:55 констатирована смерть.
Клинический диагноз: 1. Основной: внутримозговая опухоль левой височной доли. Отек, дислокация головного мозга. 2. Осложнения основного: кома, осложненная нарушением дыхания по смешанному типу. Острая сердечно-сосудистая недостаточность. Гнойный трахеобронхит, пневмония, флебиты подкожных вен конечностей.
Патологоанатомический диагноз. Наркомания: множественные следы уколов медицинской иглой, посткатетеризационные флебиты подкожных вен конечностей; гепатит С; дистрофические изменения миокарда, печени, почек. Септикопиемия: пиодермия, миокардит, карбункул левой почки, абсцессы в коре правой почки, пневмония, абсцесс в коре и белом веществе левой височной доли головного мозга, с прорывом в полость левого бокового желудочка (гнойный вентрикулит). Отек и дислокация головного мозга: обширные очаги ишемического размягчения паравентрикулярных отделов головного мозга, вторичные кровоизлияния в веществе варолиева моста. Состояние после операции нижней трахеостомии, длительной ИВЛ.
Заключение: смерть наступила в результате отека и дислокации головного мозга, вследствие абсцесса в коре и белом веществе левой височной доли головного мозга.
P.S. Представлен случай сложной дифференциальной диагностики коматозного состояния, которое, на первый взгляд, могло быть вызвано обычным отравлением наркотиками у наркомана. Только дополнительное лабораторное исследование позволило исключить первоначальную версию диагноза и провести инструментальное (КТ) обследование головного мозга, показавшее наличие в нем объемного образования с дислокацией.
Недостатком обследования следует считать отсутствие результатов посева крови и спинномозговой жидкости на наличие инфекции, которые могли бы уточнить природу объемного образования и установить развитие септического состояния. Это всегда нужно делать у наркоманов при наличии флебитов вен конечностей и пневмонии. Однако в данном случае, по мнению консилиума, состояние больного уже было неоперабельным и безнадежным.
Основные показатели, имеющие определенный физиологический смысл, следующие: Мо (мода) – наиболее часто встречающееся значение длительности интервалов R-R, выраженное в сек; АМо (амплитуда моды) – число значений интервалов, разных Мо в % к общему числу зарегистрированных кардиоциклов; DХ (вариационный размах) – разница между максимальным и минимальным значением длительности зарегистрированных интервалов R-R в сек; ИН (индекс напряжения) – в условных единицах. Последний рассчитывается по формуле:
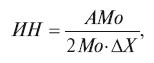
где Мо – характеризует гуморальный канал регуляции ритма сердца; АМо– активность симпатического и DХ – активность парасимпатического отдела вегетативной нервной системы; ИН – суммарный показатель, отражающий степень напряжения компенсаторных механизмов организма. Кроме того, ИН может служить показателем исходного вегетативного тонуса.
Исходный вегетативный тонус оценивается следующим образом: эйтония, сбалансированное состояние регуляторных систем ВНС характеризуется ИН, равным 30–90 усл. ед.; ваготония – ИН меньше 30 усл. ед.; симпатикотония – ИН от 90 до 160 усл. ед.; гиперсимпатикотония – ИН более 160 усл. ед.

У детей раннего возраста (1–3 года) состоянию средней тяжести соответствуют следующие показатели КИГ: Мо – 0,58-0,46 сек; АМо – 34–40 %; DХ – 0,13-0,06 сек; ИН – 200–650 усл. ед.; тяжелому: Мо – 0,48-0,36 сек; АМо – 46–60 %; DХ – 0,06-0,04 сек; ИН – 700-2500 усл. ед.; крайне тяжелому: Мо – 0,40-0,30 сек; АМо – более 60 %; DХ – 0,04-0,02 сек; ИН – более 2500–3000 усл. ед. Показатели КИГ в возрасте 14–15 лет соответствуют показателям у взрослых.
