Страница:
Выявление выраженного преобладания парасимпатической активности при отравлениях веществами, не вызывающими ваготонический эффект, следует расценивать как состояние декомпенсации с плохим прогнозом заболевания.
1.2. Ведущие патологические синдромы и их лечение
1.2.1. Клиническая симптоматика и симптоматическая терапия
1.2. Ведущие патологические синдромы и их лечение
Лечение острых отравлений проводят по единому принципу независимо от уровня оказания медицинской помощи. Объем лечебного вмешательства может быть различным: от мероприятий первой самопомощи или врачебной помощи до максимального в специализированном стационаре. Причем многие приемы оказания первой помощи (например, промывание желудка) включаются также в объем лечебных мероприятий в специализированных стационарах, если их не проводили ранее.
Комплекс лечебных мероприятий складывается из детоксикационной, необходимой для удаления токсиканта из организма и симптоматической (интенсивной посиндромной) терапии, направленной на поддержание жизненно важных функций в токсикогенной стадии отравлений, а также реабилитации больных в соматогенной стадии.
Комплекс лечебных мероприятий складывается из детоксикационной, необходимой для удаления токсиканта из организма и симптоматической (интенсивной посиндромной) терапии, направленной на поддержание жизненно важных функций в токсикогенной стадии отравлений, а также реабилитации больных в соматогенной стадии.
1.2.1. Клиническая симптоматика и симптоматическая терапия
Симптоматическая (интенсивная посиндромная) терапия заключается в экстренном устранении развившихся в связи с действием токсичного вещества нарушений функций жизненно важных органов и систем. Среди разнообразных синдромов, отмечаемых в реаниматологии вообще и в токсикологии в частности, необходимо выделить основные, связанные с избирательной токсичностью данного вещества, имеющие решающее значение в интенсивной терапии и последующей реабилитации больных с острыми отравлениями.
Синдром поражения сердечно-сосудистой системы проявляется в основном в форме первичного токсикогенного коллапса, экзотоксического шока (ЭТШ). Последний – наиболее тяжелый синдром, требующий неотложной коррекции. Основными принципами лечения шока при острых экзогенных отравлениях, который имеет гиповолемический характер, – восстановление эффективной гемоциркуляции и фармакотерапия. Первое достигается при помощи инфузионной терапии, являющейся одним из ведущих компонентов комплексного лечения этого синдрома и направленной на восстановление объема циркулирующей крови, улучшение клеточного метаболизма, реологических свойств крови и ликвидацию патологической внутрисосудистой коагуляции. Объем, состав и длительность введения инфузионных растворов определяется тяжестью состояния больного, характером и степенью выраженности гемодинамических сдвигов. Контроль адекватности инфузионной терапии при ЭТШ осуществляется по следующим критериям: ударный объем сердца, центральный объем крови, объем циркулирующей крови (ОЦК), центральное венозное давление.
Первоочередная задача – восполнение ОЦК, что осуществляется путем внутривенного введения плазмозамещающих кристаллоидных и коллоидных растворов, а также сбалансированных растворов электролитов, согласно общим реанимационным правилам.
Фармакотерапия ЭТШ при восполненном ОЦК будет зависеть от нижеперечисленных критериев. В частности:
1. При низком ударном объеме сердца в сочетании с высоким общим периферическим сопротивлением сосудов на фоне высокого АД показано введение спазмолитиков, глюкозоновокаиновой смеси.
2. При низком ударном объеме сердца и сниженных показателях АД и периферического сопротивления сосудов показано непрерывное в течение от 3 до 24 ч введение вазоконстрикторов (эфедрин, норадреналин, лучше допамин). Начальная минимальная доза норадреналина составляет 20–40 мкг/мл, допамина – 300–500 мкг/мин, добутамина – до 200 мкг/мин.
3. При выраженной гипотензии и высоком общем периферическом сопротивлении сосудов вводят глюкокортикоиды (гидрокортизон до 500 мг, преднизолон до 1000 мг в сутки).
Кардиотоксическое действие различных веществ растительного, животного или химического происхождения клинически выражается нарушением ритма и проводимости сердца вследствие расстройства проницаемости клеточной мембраны для электролитов (калия, натрия, кальция) или изменения нейрогуморальной регуляции работы сердца.
Следует различать первичный специфический кардиотоксический эффект, который проявляется в токсикогенной стадии интоксикации кардиотропными веществами и носит преимущественно функциональный характер. Вторичный неспецифический кардиотоксический эффект развивается вследствие выраженной токсической дистрофии миокарда в соматогенной стадии тяжелых отравлений практически любым токсичным веществом.
Первичный специфический кардиотоксический эффект может привести к быстрому развитию синдрома «малого выброса» с летальным исходом в виде скоропостижной смерти вследствие первичного токсикогенного (аритмогенного) коллапса или обусловить особое клиническое течение экзотоксического шока, принимающего кардиогенный характер.
Известно несколько видов лекарственных препаратов и других химических веществ, способных вызвать выраженный первичный кардиотоксический эффект (см. раздел 2.1).
Наиболее типично кардиотоксическое действие дигиталиса. При этом обнаруживаются следующие изменение электрокардиограммы:
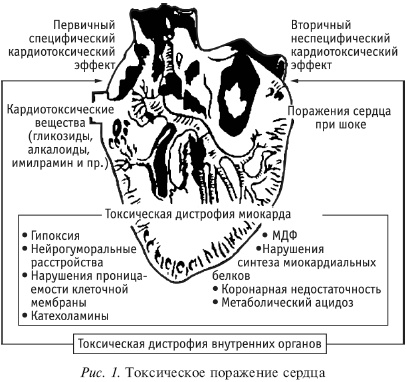
Выделение указанных выше первичного специфического и вторичного неспецифического кардиотоксических эффектов условно, поскольку морфологическая основа этих нарушений – единый патологический процесс дистрофии миокарда токсической этиологии. Повреждение миокарда при острых отравлениях в целом однотипно. Обращают на себя внимание диффузность поражения сердечной мышцы, неспецифические изменения ЭКГ (снижение сегмента S-T, появление изоэлектрических, двухфазных и отрицательных зубцов Т) и изменения структуры, характерные для острой дистрофии миокарда.
Клинические проявления данной патологии также выглядят достаточно однотипно, за исключением преобладания нарушений ритма и проводимости сердца при первичном специфическом эффекте и изменений фазы реполяризации при неспецифическом эффекте на фоне экзотоксического шока или вторичного соматогенного коллапса.
Развитие острой левожелудочковой недостаточности (отек легких) – редкое осложнение острых отравлений, что, вероятно, связано с гиповолемическим характером гемодинамических расстройств и диффузным дистрофическим процессом в сердце. Причина коллапса в позднем периоде отравлений – падение сократительной способности миокарда вследствие тяжелых осложнений: пневмонии, печеночно-почечной недостаточности и т. д.
Лечение первичного токсикогенного коллапса представляет значительные трудности ввиду его быстрого развития и скоропостижной смерти больных. Наиболее ярко эта особенность проявляется при отравлении цианидами, блокирующими тканевое дыхание, и угарным газом, вызывающим тяжелую гемическую гипоксию. Патогенетическое лечение направлено на купирование острой недостаточности дыхания. Одновременно проводят специфическую антидотную терапию и обычные при клинической смерти реанимационные мероприятия.
Несколько большие возможности открываются в лечении кардиогенного коллапса, вызванного кардиотоксическими средствами, особенно в начальной фазе, когда поражение сердца носит преимущественно функциональный характер.
Для лечения опасных аритмий, вызванных кардиотоксическими веществами, предложено использовать ряд фармакологических препаратов, общий принцип действия которых заключается в удержании внутриклеточного калия и нормализации электролитного обмена в миокарде.
Оправдало себя применение поляризующей смеси (гипертонический раствор глюкозы с инсулином). Последняя подавляет эктопический ритм и нарушения проводимости, нормализует трансмембранный потенциал, снижает потери калия и задержку натрия, улучшает сократимость миокарда и коронарный кровоток. Хорошее действие оказывает внутримышечное введение витамина Е (токоферол-ацетат) в дозе до 700 мг, а также 1–2 мл глюкагона (гормон поджелудочной железы). Эти препараты значительно улучшают внутрисердечную проводимость. Если в кардиотоксическом эффекте преобладают нарушения ритма сердца (типа желудочковой экстрасистолии, пароксизмальной тахикардии и фибрилляции желудочков), показан лидокаин (до 500 мг внутривенно). При этом в качестве кардиотонического средства используют добутрекс в индивидуальной дозировке. Для снижения повышенной возбудимости миокарда в условиях усиленного выброса катехоламинов, отмечающегося при отравлении амитриптилином, применяют индерал (0,25 мг).
Указанные антиаритмические препараты показаны при отравлениях многими кардиотоксическими веществами, включая алкалоиды аконита и чемерицы, хинин, амитриптилин и др. Вид и степень развившихся нарушений ритма и проводимости сердца учитываются динамическим мониторным контролем ЭКГ, так как в конечном счете нарушения ЭКГ, а не вид кардиотоксического вещества определяют выбор противоаритмического препарата. При отравлениях некоторыми кардиотоксическими веществами рекомендуется также использовать ряд специфических лекарственных средств, применение которых носит более выраженный патогенетический характер.
В патогенезе сердечных аритмий видную роль играет нарушение состояния симпатической и парасимпатической нервной системы. Учитывая это, при отравлении холинолитиками (амитриптилин) для устранения их центрального холинолитического действия применяется 0,5 %-ный раствор нивалина. Происходит более быстрое купирование аритмий, чем при использовании обычных противоаритмических средств.
При выраженной парасимпатической стимуляции сердца, которая ярко проявляется при отравлениях многими растительными алкалоидами – мускарином (мухоморы), вератрином (чемерица), кониином (болиголов), аконитином (аконит) и др., а также клофелином – с успехом применяются холинолитические препараты (атропин, метацин, скополамин), блокирующие действие ацетилхолина на холинреактивные структуры.
Общий недостаток указанной консервативной терапии токсикогенных нарушений ритма и проводимости сердца – ее надежность при фибрилляции желудочков (в случаях тяжелых отравлений), которая может возникать очень быстро, даже без заметных клинических и электрокардиографических предвестников, с исходом в асистолию. В связи с этим при острых отравлениях кардиотоксичными средствами рекомендуется раннее профилактическое применение противоаритмической терапии независимо от выраженности электрокардиографических изменений.
Кроме того, в случаях с четкими анамнестическими данными о приеме внутрь токсической дозы кардиотропных веществ или лабораторном определении токсической концентрации этих препаратов в крови необходимо предусмотреть возможность экстренного применения электроимпульсной терапии и электрической стимуляции сердца.
Электрическая стимуляция находит клиническое применение при полной поперечной блокаде, выраженной брадикардии, не поддающейся консервативному лечению, и при остановке сердца.
Электрическая стимуляция сердца может успешно сочетаться с электроимпульсной терапией и наружным массажем сердца, который дает некоторое время для подготовки электроимпульсной аппаратуры.
Абсолютными показаниями к дефибрилляции служат мерцание и трепетание желудочков. С клинической точки зрения электроимпульсная терапия показана во всех случаях внезапной остановки сердца. Оптимальные параметры электрического разряда создаются при емкости конденсатора 16–24 мкф, напряжение на пластинах конденсатора должно составлять не менее 4–5 кВ, а продолжительность разряда – 0,01 с.
С целью профилактики дыхательной недостаточности для купирования рефлекторных воздействий дают вдыхать нанесенный на ватку фицилин либо противодымную смесь (хлороформ и этиловый спирт – по 40 мл, серный эфир – 20 мл, нашатырный спирт – 5 капель).
Для лечения токсического трахеобронхита применяют антибиотики в обычных дозировках, бронхоспастические и антигистаминные препараты, отхаркивающие средства. При явлениях дыхательной недостаточности вследствие нарастающего отека слизистой гортани, трахеи или бронхоспазма проводят нейролептанальгезию с интубацией трахеи либо наложением трахеостомы и после введения миорелаксантов начинают ИВЛ.
При угрозе развития токсического отека легких в скрытом периоде используют антигистаминные препараты, внутривенно струйно вводят 10 %-ный раствор хлористого кальция по 10 мл 1–2 раза в сутки.
При рентгенологических признаках гипергидратации и отека легких применяют умеренную дегидратационную терапию (200 мл 20 %-ного раствора глюкозы с инсулином внутривенно капельно либо повторное введение 20–40 мл 40 %-ного раствора). Верошпирон – 0,25 мг 3 раза в день внутрь, при необходимости лазикс. При повышении ЦВД в сочетании с тахикардией показаны сердечные гликозиды в общепринятых дозах.
При наступлении альвеолярного отека легких больному придают функционально удобное положение – с приподнятой верхней половиной туловища. Активная дегидратационная терапия: осмотические диуретики (мочевина или маннитол в количестве 1–2 г сухого препарата на 1 кг массы тела больного). Через 20–30 мин после окончания инфузии – внутривенно лазикс (60–80 мг). Целесообразно внутривенное введение сухой плазмы (200 г) или 10–20 %-ного раствора альбумина (100–200 мл). Проводят оксигенотерапию: при «синей гипоксемии» во вдыхаемом воздухе содержится 40–60 % кислорода, а при «серой» – в смесь добавляют 4–7% углекислого газа (карбоген). Длительность сеансов – 5–7 мин. В тяжелых случаях, сопровождающихся выделением пены изо рта, необходимы мероприятия по пеногашению: вдыхание паров 10 %-ного раствора антифомсилана в этиловом спирте или паров 10 %-ного этилового спирта. При неэффективности указанных мероприятий показана ИВЛ с положительным давлением на выдохе, ультрафильтрация с выведением 1–2 л жидкости на аппарате «искусственная почка».
Наиболее важное мероприятие по предупреждению и лечению отека легких – применение массивных доз кортикостероидов. Начиная с догоспитального этапа и далее в стационаре больному назначают гидрокортизон (125 мг 1–2 раза в сутки) или преднизолон (30 мг 2–4 раза в сутки) внутримышечно. В стадии альвеолярного отека наиболее эффективен преднизолон в дозе 120–300 мг повторно до 1 г, в отдельных случаях до 2–3 г в сутки внутривенно.
Лечение поражения дыхательной системы при отравлениях необходимо рассматривать в тесной взаимосвязи с изменениями, происходящими в других важных системах организма – сердечно-сосудистой, иммунной и др.
Сложный и многофакторный характер патогенеза кардиореспираторных расстройств при наиболее распространенных видах острых отравлений диктует определенные требования к лечению, которое включает комплекс экстренных и плановых мероприятий.
Экстренные мероприятия направлены, в первую очередь, на восстановление нарушенных функций жизненно важных систем организма и включают: искусственное аппаратное дыхание, интубацию трахеи, трахеостомию, электростимуляцию и массаж сердца. Второй важный момент этого направления – восстановление эффективной гемоциркуляции путем ликвидации гиповолемии, устранения метаболического ацидоза, поддержания коллоидно-осмотического давления плазмы и электролитного состава крови (сбалансированная инфузионная терапия). Обязательное мероприятие – ускоренная детоксикация организма и специфическая антидотная терапия.
Плановые включают комплекс лечебных мероприятий, направленных на коррекцию респираторной функции легких: ИВЛ, лечебную фибробронхоскопию с применением различных фармакологических препаратов (муколитики, иодинол, ацемин, диоксидин и др.); методы, усиливающие дренажную функцию легких: отхаркивающие средства, постуральный дренаж, перкуссионный и вибрационный массаж грудной клетки, оксигенотерапию, антибиотикотерапию.
Особое внимание следует уделять коррекции кровообращения в легких, что достигается восстановлением микроциркуляции органа с помощью введения дезагрегантов и антикоагулянтов, а также за счет поддержания эффективной гемоциркуляции с помощью фармакотерапии, включающей кардиотонические препараты инотропного действия, вазоактивные вещества, глюкокортикостероиды.
Для коррекции некоторых параметров гомеостаза применяют немедикаментозные методы лечения, оказывающие быстрое корригирующее влияние на активность нейрогуморальных систем и, кроме того, обладающие преимущественным избирательным действием: ультрафиолетовая физиогемотерапия (основное действие – иммунокоррекция), лазерная гемотерапия (коррекция перекисного окисления липидов и антиоксидантной системы), химиогемотерапия (снижение эндотоксикоза).
Патологические процессы в легких, составляющие особую клиническую форму дыхательной недостаточности, как правило, носят вторичный характер, так как в значительной мере обусловлены предшествующим развитием нарушений нервной регуляции акта дыхания и проходимости дыхательных путей. Наиболее распространенный вид подобных осложнений – острые пневмонии.
В их патогенезе обращают внимание на два основных фактора: длительное коматозное состояние, осложненное аспирационно-обтурационными расстройствами дыхания (аспирация желудочного содержимого с низким рН), и ожог верхних дыхательных путей прижигающими веществами. Вероятность возникновения пневмонии тем выше, чем глубже и длительнее токсическая кома. Пневмонии развиваются практически у всех больных при коме длительностью более 60 ч, особенно часто у лиц пожилого возраста.
Для острых отравлений характерна определенная локализация воспалительных процессов в легких. Как правило, развивается двусторонняя нижнедолевая пневмония, носящая очаговый или сливной характер. При исследовании микрофлоры верхних дыхательных путей наиболее часто обнаруживают золотистый гемолитический стафилококк.
Своевременная диагностика острых пневмоний при токсической коме нередко затруднена, так как отсутствуют типичные клинические признаки пневмонии (повышение температуры тела, кашель и др.). Физикальные признаки пневмонии (локальные влажные хрипы) при проведении аппаратного искусственного дыхания часто не выявляются. Бронхорея затрудняет оценку локальных физикальных данных вследствие проводных крупнопузырчатых хрипов. При рентгенографии грудной клетки больных в коматозном состоянии часто не получается отчетливого рисунка легочной ткани в результате сохранения дыхательных движений во время съемки и явлений гипергидратации легких. Показатели формулы крови в этих условиях малоинформативны, так как любая интоксикация вызывает повышенную реакцию гипофизарно-адреналовой системы с появлением значительного лейкоцитоза, палочкоядерного сдвига нейтрофилов влево и лимфопении. Учитывая указанные трудности, лечение и профилактику пневмонии надо проводить в каждом случае токсической комы независимо от результатов первоначальной диагностики.
В последнее время в патогенезе острой пневмонии большое внимание уделяется нарушениям коагулирующих свойств крови. Учитывая широкое распространение синдрома РВС, ему придают большое значение в развитии пневмонии при тяжелых формах острых отравлений снотворными средствами и ФОИ, протекающих с длительно выраженной фазой гиперкоагуляции. При отравлениях уксусной эссенцией и хлорированными углеводородами, осложненных шоком, основную роль в развитии пневмонии наряду с рассеянным внутрисосудистым свертыванием крови, вероятно, играют и другие специфичные для шока нарушения микроциркуляции.
Синдром поражения сердечно-сосудистой системы проявляется в основном в форме первичного токсикогенного коллапса, экзотоксического шока (ЭТШ). Последний – наиболее тяжелый синдром, требующий неотложной коррекции. Основными принципами лечения шока при острых экзогенных отравлениях, который имеет гиповолемический характер, – восстановление эффективной гемоциркуляции и фармакотерапия. Первое достигается при помощи инфузионной терапии, являющейся одним из ведущих компонентов комплексного лечения этого синдрома и направленной на восстановление объема циркулирующей крови, улучшение клеточного метаболизма, реологических свойств крови и ликвидацию патологической внутрисосудистой коагуляции. Объем, состав и длительность введения инфузионных растворов определяется тяжестью состояния больного, характером и степенью выраженности гемодинамических сдвигов. Контроль адекватности инфузионной терапии при ЭТШ осуществляется по следующим критериям: ударный объем сердца, центральный объем крови, объем циркулирующей крови (ОЦК), центральное венозное давление.
Первоочередная задача – восполнение ОЦК, что осуществляется путем внутривенного введения плазмозамещающих кристаллоидных и коллоидных растворов, а также сбалансированных растворов электролитов, согласно общим реанимационным правилам.
Фармакотерапия ЭТШ при восполненном ОЦК будет зависеть от нижеперечисленных критериев. В частности:
1. При низком ударном объеме сердца в сочетании с высоким общим периферическим сопротивлением сосудов на фоне высокого АД показано введение спазмолитиков, глюкозоновокаиновой смеси.
2. При низком ударном объеме сердца и сниженных показателях АД и периферического сопротивления сосудов показано непрерывное в течение от 3 до 24 ч введение вазоконстрикторов (эфедрин, норадреналин, лучше допамин). Начальная минимальная доза норадреналина составляет 20–40 мкг/мл, допамина – 300–500 мкг/мин, добутамина – до 200 мкг/мин.
3. При выраженной гипотензии и высоком общем периферическом сопротивлении сосудов вводят глюкокортикоиды (гидрокортизон до 500 мг, преднизолон до 1000 мг в сутки).
Кардиотоксическое действие различных веществ растительного, животного или химического происхождения клинически выражается нарушением ритма и проводимости сердца вследствие расстройства проницаемости клеточной мембраны для электролитов (калия, натрия, кальция) или изменения нейрогуморальной регуляции работы сердца.
Следует различать первичный специфический кардиотоксический эффект, который проявляется в токсикогенной стадии интоксикации кардиотропными веществами и носит преимущественно функциональный характер. Вторичный неспецифический кардиотоксический эффект развивается вследствие выраженной токсической дистрофии миокарда в соматогенной стадии тяжелых отравлений практически любым токсичным веществом.
Первичный специфический кардиотоксический эффект может привести к быстрому развитию синдрома «малого выброса» с летальным исходом в виде скоропостижной смерти вследствие первичного токсикогенного (аритмогенного) коллапса или обусловить особое клиническое течение экзотоксического шока, принимающего кардиогенный характер.
Известно несколько видов лекарственных препаратов и других химических веществ, способных вызвать выраженный первичный кардиотоксический эффект (см. раздел 2.1).
Наиболее типично кардиотоксическое действие дигиталиса. При этом обнаруживаются следующие изменение электрокардиограммы:
• укорочение интервала Q-Т;При патоморфологическом исследовании сердца обращают на себя внимание многочисленные субэндокардиальные кровоизлияния.
• повышение или снижение сегмента S-T;
• инверсия начальной части зубца Т;
• удлинение интервала P-Q;
• желудочковая экстрасистолия, эктопические аритмии;
• различные стадии атриовентрикулярной блокады;
• фибрилляция желудочков, отмечаются выраженная слабость, боли в области сердца, подобные стенокардии, изменения пульса, падение артериального давления.

Выделение указанных выше первичного специфического и вторичного неспецифического кардиотоксических эффектов условно, поскольку морфологическая основа этих нарушений – единый патологический процесс дистрофии миокарда токсической этиологии. Повреждение миокарда при острых отравлениях в целом однотипно. Обращают на себя внимание диффузность поражения сердечной мышцы, неспецифические изменения ЭКГ (снижение сегмента S-T, появление изоэлектрических, двухфазных и отрицательных зубцов Т) и изменения структуры, характерные для острой дистрофии миокарда.
Клинические проявления данной патологии также выглядят достаточно однотипно, за исключением преобладания нарушений ритма и проводимости сердца при первичном специфическом эффекте и изменений фазы реполяризации при неспецифическом эффекте на фоне экзотоксического шока или вторичного соматогенного коллапса.
Развитие острой левожелудочковой недостаточности (отек легких) – редкое осложнение острых отравлений, что, вероятно, связано с гиповолемическим характером гемодинамических расстройств и диффузным дистрофическим процессом в сердце. Причина коллапса в позднем периоде отравлений – падение сократительной способности миокарда вследствие тяжелых осложнений: пневмонии, печеночно-почечной недостаточности и т. д.
Лечение первичного токсикогенного коллапса представляет значительные трудности ввиду его быстрого развития и скоропостижной смерти больных. Наиболее ярко эта особенность проявляется при отравлении цианидами, блокирующими тканевое дыхание, и угарным газом, вызывающим тяжелую гемическую гипоксию. Патогенетическое лечение направлено на купирование острой недостаточности дыхания. Одновременно проводят специфическую антидотную терапию и обычные при клинической смерти реанимационные мероприятия.
Несколько большие возможности открываются в лечении кардиогенного коллапса, вызванного кардиотоксическими средствами, особенно в начальной фазе, когда поражение сердца носит преимущественно функциональный характер.
Для лечения опасных аритмий, вызванных кардиотоксическими веществами, предложено использовать ряд фармакологических препаратов, общий принцип действия которых заключается в удержании внутриклеточного калия и нормализации электролитного обмена в миокарде.
Оправдало себя применение поляризующей смеси (гипертонический раствор глюкозы с инсулином). Последняя подавляет эктопический ритм и нарушения проводимости, нормализует трансмембранный потенциал, снижает потери калия и задержку натрия, улучшает сократимость миокарда и коронарный кровоток. Хорошее действие оказывает внутримышечное введение витамина Е (токоферол-ацетат) в дозе до 700 мг, а также 1–2 мл глюкагона (гормон поджелудочной железы). Эти препараты значительно улучшают внутрисердечную проводимость. Если в кардиотоксическом эффекте преобладают нарушения ритма сердца (типа желудочковой экстрасистолии, пароксизмальной тахикардии и фибрилляции желудочков), показан лидокаин (до 500 мг внутривенно). При этом в качестве кардиотонического средства используют добутрекс в индивидуальной дозировке. Для снижения повышенной возбудимости миокарда в условиях усиленного выброса катехоламинов, отмечающегося при отравлении амитриптилином, применяют индерал (0,25 мг).
Указанные антиаритмические препараты показаны при отравлениях многими кардиотоксическими веществами, включая алкалоиды аконита и чемерицы, хинин, амитриптилин и др. Вид и степень развившихся нарушений ритма и проводимости сердца учитываются динамическим мониторным контролем ЭКГ, так как в конечном счете нарушения ЭКГ, а не вид кардиотоксического вещества определяют выбор противоаритмического препарата. При отравлениях некоторыми кардиотоксическими веществами рекомендуется также использовать ряд специфических лекарственных средств, применение которых носит более выраженный патогенетический характер.
В патогенезе сердечных аритмий видную роль играет нарушение состояния симпатической и парасимпатической нервной системы. Учитывая это, при отравлении холинолитиками (амитриптилин) для устранения их центрального холинолитического действия применяется 0,5 %-ный раствор нивалина. Происходит более быстрое купирование аритмий, чем при использовании обычных противоаритмических средств.
При выраженной парасимпатической стимуляции сердца, которая ярко проявляется при отравлениях многими растительными алкалоидами – мускарином (мухоморы), вератрином (чемерица), кониином (болиголов), аконитином (аконит) и др., а также клофелином – с успехом применяются холинолитические препараты (атропин, метацин, скополамин), блокирующие действие ацетилхолина на холинреактивные структуры.
Общий недостаток указанной консервативной терапии токсикогенных нарушений ритма и проводимости сердца – ее надежность при фибрилляции желудочков (в случаях тяжелых отравлений), которая может возникать очень быстро, даже без заметных клинических и электрокардиографических предвестников, с исходом в асистолию. В связи с этим при острых отравлениях кардиотоксичными средствами рекомендуется раннее профилактическое применение противоаритмической терапии независимо от выраженности электрокардиографических изменений.
Кроме того, в случаях с четкими анамнестическими данными о приеме внутрь токсической дозы кардиотропных веществ или лабораторном определении токсической концентрации этих препаратов в крови необходимо предусмотреть возможность экстренного применения электроимпульсной терапии и электрической стимуляции сердца.
Электрическая стимуляция находит клиническое применение при полной поперечной блокаде, выраженной брадикардии, не поддающейся консервативному лечению, и при остановке сердца.
Электрическая стимуляция сердца может успешно сочетаться с электроимпульсной терапией и наружным массажем сердца, который дает некоторое время для подготовки электроимпульсной аппаратуры.
Абсолютными показаниями к дефибрилляции служат мерцание и трепетание желудочков. С клинической точки зрения электроимпульсная терапия показана во всех случаях внезапной остановки сердца. Оптимальные параметры электрического разряда создаются при емкости конденсатора 16–24 мкф, напряжение на пластинах конденсатора должно составлять не менее 4–5 кВ, а продолжительность разряда – 0,01 с.
Клинический пример № 4
Больная К., 20 лет,Синдром поражения системы дыхания выражен преимущественно в виде нескольких основных форм. По частоте развития в токсикогенной фазе отравлений преобладают нарушения дыхания за счет обтурационно-аспирационных расстройств, паралича дыхательного центра, гипертонуса или паралича скелетной дыхательной мускулатуры. Реже встречаются нарушения вследствие гемической гипоксии (карбокси– и метгемоглобинемия) и тканевой гипоксии (цианиды). Лечение этих расстройств достаточно хорошо известно врачам анестезиологам-реаниматологам и представляет собой комплекс санационных мероприятий и искусственной вентиляции легких. При отравлении ядами гемотоксического действия и цианидами – обязательна антидотная терапия и ГБО. При ингаляционном поражении дыхательных путей ядами раздражающего, прижигающего действия (аммиак, хлор, пары крепких кислот и др.) развивается токсический трахеобронхит и токсический отек легких, лечение которого, как правило, мало знакомо врачам общего профиля и складывается из профилактических и лечебных мероприятий.
была доставлена в Центр лечения острых отравлений НИИ СП им. Н.В. Склифосовского машиной «Скорой помощи» из дома, где за 2 ч до поступления выпила 70 мл уксусной эссенции. Была повторная рвота с примесью крови.
Бригада «Скорой помощи» застала больную в тяжелом состоянии. Отмечалось выраженное психомоторное возбуждение, резко затрудненное глотание, боли по ходу пищевода и в эпигастральной области. АД 90/60 мм рт. ст., пульс 100 уд/мин.
Мероприятия на ДГЭ лечения: промывание желудка через зонд, подкожное введение наркотических и спазмолитических препаратов (морфин, атропин).
При поступлении – общее состояние тяжелое. Бледна. В сознании, заторможена. Стонет, жалуется на сильные боли в горле и эпигастральной области. В промывных водах из желудка – примесь алой крови. Кожные покровы холодные. Число дыханий в минуту – 28. В легких – везикулярное дыхание, хрипы не выслушиваются. Границы относительной сердечной тупости не изменены. Тоны сердца ясные, шумов нет. Пульс – 116 уд/мин. АД – 100/60 мм рт. ст. ЦВД – 10,0 мм водн. ст. Слизистая полости рта резко гиперемирована, отечна, некротические налеты на миндалинах, задней стенки глотки. Пальпация шейного отдела пищевода и эпигастральной области болезненна. Симптомов раздражения брюшины нет. Мочеиспускание самостоятельное, моча цвета «мясных помоев». Диурез – 20,0 мл/ч.
Данные дополнительных методов исследования. Анализ крови: эритроциты – 4,60 х 1012/л, Нв – 137 г/л, лейкоциты – 16,0 х 109/л, палочкоядерные нейтрофилы – 18, сегментоядерные – 63, лимфоциты – 17, моноциты – 2. Анализ мочи: относительная плотность – 1,024, белок – 0,990 г/л, гемоглобиновые шлаки.
Содержание свободного гемоглобина: в плазме – 8,5 г/л, в моче – 10,20 г/л. КЩС: рН – 7,17, АВ – 14,8 ммоль/л, ВВ – 34 ммоль/л, SB – 14,4 ммоль/л, ВЕ – 13,4 ммоль/л, рСО2 – 42 мм рт. ст. Гематокрит – 0,52 л/л. ЭКГ – синусная тахикардия, признаки диффузной гипоксии миокарда.
Предварительный клинический диагноз: отравление уксусной эссенцией (тяжелой степени). Экзотоксический шок. Гемолиз.
Лечебные мероприятия: полиглюкин – 800,0, реополиглюкин – 400,0, растворы глюкозы 5 %-ный – 800,0, 10 %-ный – 400,0 с добавлением 8 ЕД инсулина, 20 %-ный – 400, с добавлением 16 ЕД инсулина, раствор электролитов 2000,0, раствор гидрокарбоната натрия 4 %-ный – 1200,0, раствор хлорида натрия 0,9 %-ный – 2000,0 внутривенно, преднизолон 60 мг в вену, гидрокортизон 250 мг внутримышечно, антибиотики, наркотические, спазмолитические, мочегонные препараты.
Через 2,5 ч интенсивной противошоковой терапии состояние больной улучшилось. Кожные покровы обычной окраски, теплые на ощупь. Сознание ясное. Жалобы на болезненное глотание. Пульс – 100 уд/мин. АД – 105/70 мм рт. ст. Основные параметры гемодинамики, резко нарушенные при поступлении больной в стационар, улучшились.
Спустя 6 ч – состояние относительно удовлетворительное, показатели гемодинамики по сравнению с исходными значительно улучшились, восстановился диурез, а спустя 9 ч основные гемодинамические параметры приблизились к контрольным. Через сутки на фоне поддерживающей инфузионной терапии функциональное состояние гемодинамики полностью нормализовалось за исключением умеренно сниженного периферического кровотока. В дальнейшем течение заболевания гладкое, выписана домой в удовлетворительном состоянии на 21-е сутки после отравления.
Заключительный клинический диагноз: 1. Отравление уксусной эссенцией тяжелой степени. Химический ожог слизистой полости рта, зева, глотки, пищевода, желудка. 2. Гемолиз. Экзотоксический шок. Токсическая нефропатия.
P.S. У больной с тяжелым отравлением уксусной эссенцией на фоне гемолиза и химического ожога пищеварительного тракта развился экзотоксический шок с типичными для этой патологии гемодинамическими расстройствами. Проведение интенсивной противошоковой терапии способствовало быстрой (в течение первых 6 ч) положительной динамике и дальнейшей нормализации функционального состояния системы гемоциркуляции.
См. клинический пример № 22 в главе 2.
С целью профилактики дыхательной недостаточности для купирования рефлекторных воздействий дают вдыхать нанесенный на ватку фицилин либо противодымную смесь (хлороформ и этиловый спирт – по 40 мл, серный эфир – 20 мл, нашатырный спирт – 5 капель).
Для лечения токсического трахеобронхита применяют антибиотики в обычных дозировках, бронхоспастические и антигистаминные препараты, отхаркивающие средства. При явлениях дыхательной недостаточности вследствие нарастающего отека слизистой гортани, трахеи или бронхоспазма проводят нейролептанальгезию с интубацией трахеи либо наложением трахеостомы и после введения миорелаксантов начинают ИВЛ.
При угрозе развития токсического отека легких в скрытом периоде используют антигистаминные препараты, внутривенно струйно вводят 10 %-ный раствор хлористого кальция по 10 мл 1–2 раза в сутки.
При рентгенологических признаках гипергидратации и отека легких применяют умеренную дегидратационную терапию (200 мл 20 %-ного раствора глюкозы с инсулином внутривенно капельно либо повторное введение 20–40 мл 40 %-ного раствора). Верошпирон – 0,25 мг 3 раза в день внутрь, при необходимости лазикс. При повышении ЦВД в сочетании с тахикардией показаны сердечные гликозиды в общепринятых дозах.
При наступлении альвеолярного отека легких больному придают функционально удобное положение – с приподнятой верхней половиной туловища. Активная дегидратационная терапия: осмотические диуретики (мочевина или маннитол в количестве 1–2 г сухого препарата на 1 кг массы тела больного). Через 20–30 мин после окончания инфузии – внутривенно лазикс (60–80 мг). Целесообразно внутривенное введение сухой плазмы (200 г) или 10–20 %-ного раствора альбумина (100–200 мл). Проводят оксигенотерапию: при «синей гипоксемии» во вдыхаемом воздухе содержится 40–60 % кислорода, а при «серой» – в смесь добавляют 4–7% углекислого газа (карбоген). Длительность сеансов – 5–7 мин. В тяжелых случаях, сопровождающихся выделением пены изо рта, необходимы мероприятия по пеногашению: вдыхание паров 10 %-ного раствора антифомсилана в этиловом спирте или паров 10 %-ного этилового спирта. При неэффективности указанных мероприятий показана ИВЛ с положительным давлением на выдохе, ультрафильтрация с выведением 1–2 л жидкости на аппарате «искусственная почка».
Наиболее важное мероприятие по предупреждению и лечению отека легких – применение массивных доз кортикостероидов. Начиная с догоспитального этапа и далее в стационаре больному назначают гидрокортизон (125 мг 1–2 раза в сутки) или преднизолон (30 мг 2–4 раза в сутки) внутримышечно. В стадии альвеолярного отека наиболее эффективен преднизолон в дозе 120–300 мг повторно до 1 г, в отдельных случаях до 2–3 г в сутки внутривенно.
Лечение поражения дыхательной системы при отравлениях необходимо рассматривать в тесной взаимосвязи с изменениями, происходящими в других важных системах организма – сердечно-сосудистой, иммунной и др.
Сложный и многофакторный характер патогенеза кардиореспираторных расстройств при наиболее распространенных видах острых отравлений диктует определенные требования к лечению, которое включает комплекс экстренных и плановых мероприятий.
Экстренные мероприятия направлены, в первую очередь, на восстановление нарушенных функций жизненно важных систем организма и включают: искусственное аппаратное дыхание, интубацию трахеи, трахеостомию, электростимуляцию и массаж сердца. Второй важный момент этого направления – восстановление эффективной гемоциркуляции путем ликвидации гиповолемии, устранения метаболического ацидоза, поддержания коллоидно-осмотического давления плазмы и электролитного состава крови (сбалансированная инфузионная терапия). Обязательное мероприятие – ускоренная детоксикация организма и специфическая антидотная терапия.
Плановые включают комплекс лечебных мероприятий, направленных на коррекцию респираторной функции легких: ИВЛ, лечебную фибробронхоскопию с применением различных фармакологических препаратов (муколитики, иодинол, ацемин, диоксидин и др.); методы, усиливающие дренажную функцию легких: отхаркивающие средства, постуральный дренаж, перкуссионный и вибрационный массаж грудной клетки, оксигенотерапию, антибиотикотерапию.
Особое внимание следует уделять коррекции кровообращения в легких, что достигается восстановлением микроциркуляции органа с помощью введения дезагрегантов и антикоагулянтов, а также за счет поддержания эффективной гемоциркуляции с помощью фармакотерапии, включающей кардиотонические препараты инотропного действия, вазоактивные вещества, глюкокортикостероиды.
Для коррекции некоторых параметров гомеостаза применяют немедикаментозные методы лечения, оказывающие быстрое корригирующее влияние на активность нейрогуморальных систем и, кроме того, обладающие преимущественным избирательным действием: ультрафиолетовая физиогемотерапия (основное действие – иммунокоррекция), лазерная гемотерапия (коррекция перекисного окисления липидов и антиоксидантной системы), химиогемотерапия (снижение эндотоксикоза).
Патологические процессы в легких, составляющие особую клиническую форму дыхательной недостаточности, как правило, носят вторичный характер, так как в значительной мере обусловлены предшествующим развитием нарушений нервной регуляции акта дыхания и проходимости дыхательных путей. Наиболее распространенный вид подобных осложнений – острые пневмонии.
В их патогенезе обращают внимание на два основных фактора: длительное коматозное состояние, осложненное аспирационно-обтурационными расстройствами дыхания (аспирация желудочного содержимого с низким рН), и ожог верхних дыхательных путей прижигающими веществами. Вероятность возникновения пневмонии тем выше, чем глубже и длительнее токсическая кома. Пневмонии развиваются практически у всех больных при коме длительностью более 60 ч, особенно часто у лиц пожилого возраста.
Для острых отравлений характерна определенная локализация воспалительных процессов в легких. Как правило, развивается двусторонняя нижнедолевая пневмония, носящая очаговый или сливной характер. При исследовании микрофлоры верхних дыхательных путей наиболее часто обнаруживают золотистый гемолитический стафилококк.
Своевременная диагностика острых пневмоний при токсической коме нередко затруднена, так как отсутствуют типичные клинические признаки пневмонии (повышение температуры тела, кашель и др.). Физикальные признаки пневмонии (локальные влажные хрипы) при проведении аппаратного искусственного дыхания часто не выявляются. Бронхорея затрудняет оценку локальных физикальных данных вследствие проводных крупнопузырчатых хрипов. При рентгенографии грудной клетки больных в коматозном состоянии часто не получается отчетливого рисунка легочной ткани в результате сохранения дыхательных движений во время съемки и явлений гипергидратации легких. Показатели формулы крови в этих условиях малоинформативны, так как любая интоксикация вызывает повышенную реакцию гипофизарно-адреналовой системы с появлением значительного лейкоцитоза, палочкоядерного сдвига нейтрофилов влево и лимфопении. Учитывая указанные трудности, лечение и профилактику пневмонии надо проводить в каждом случае токсической комы независимо от результатов первоначальной диагностики.
В последнее время в патогенезе острой пневмонии большое внимание уделяется нарушениям коагулирующих свойств крови. Учитывая широкое распространение синдрома РВС, ему придают большое значение в развитии пневмонии при тяжелых формах острых отравлений снотворными средствами и ФОИ, протекающих с длительно выраженной фазой гиперкоагуляции. При отравлениях уксусной эссенцией и хлорированными углеводородами, осложненных шоком, основную роль в развитии пневмонии наряду с рассеянным внутрисосудистым свертыванием крови, вероятно, играют и другие специфичные для шока нарушения микроциркуляции.
