В медицинской литературе сегодня невозможно найти ясного ответа на довольно трудный вопрос: какой же должна быть оптимальная реакция крови у человека? Реакцию крови, равную 7,4, о которой говорилось чуть выше, никак нельзя считать оптимальной. Это всего лишь сложившаяся по ряду причин такая реакция крови. И множество болезней, сопутствующих такой реакции, является наглядным подтверждением тому, что это не оптимальная реакция крови.
Повторю еще раз, что вопрос об оптимальной реакции крови – это очень трудный вопрос. Возможно, что в правильном ответе на него и заложены истоки нашего здоровья.
Если мы откроем популярную у нас книгу Поля Брэгга «Чудо голодания», то найдем в ней такие слова: «Наша кровь должна иметь щелочную реакцию, а у большинства из нас она проявляет кислую реакцию».
Следует сразу заявить, что в вопросе реакции крови Брэгг ошибался – большинство людей имеют щелочную кровь, а не кислую. Но кислая кровь тоже бывает. И это не больные люди имеют такую кровь, а даже более здоровые, чем люди со щелочной кровью. И это по большей части долгожители, и проживают они в районах с повышенным числом долгожителей.
Как видите, не так-то просто ответить на вопрос: какую реакцию крови следует считать оптимальной? Поэтому попытаемся постепенно и более подготовлено подойти к решению этого вопроса, тем более что для большинства читателей это новое понятие, которое они, по-видимому, никак не связывают с состоянием своего здоровья. А кроме того, если сейчас будет названа цифра оптимальной реакции крови, то как смогут воспользоваться этой информацией неподготовленные читатели, ведь мы не в состоянии каждодневно определять реакцию крови? Но косвенно, по состоянию своего самочувствия и по некоторым другим признакам мы можем чуть ли не ежечасно судить, в какую сторону – кислую или щелочную – сдвигается реакция нашей крови. То есть реакция крови не является каким-то отвлеченным понятием – нет, она постоянно связана с состоянием нашего здоровья. А точнее следует сказать, что состояние нашего здоровья имеет непосредственную связь с реакцией нашей крови. Например, когда у нас плохое самочувствие или болит голова – это следствие сдвига реакции крови в щелочную сторону. Вот в таких случаях Бутейко и советует дышать поверхностно, неглубоко, чтобы поднакопить в организме углекислый газ (и тем самым подкислить кровь). Но такое действие всего лишь полумера на пути к настоящему здоровью, а поэтому нам столь важно подробнее изучить все явления, оказывающие влияние на реакцию крови.
Учитывая тот несомненный факт, что главную роль в подкислении нашей крови природа отвела все же углекислому газу, а точнее, угольной кислоте, мы и рассмотрим более подробно свойства этой кислоты.
Угольная кислота и реакция крови
Для чего нам нужны ионы водорода?
АТФ – универсальное клеточное горючее
Повторю еще раз, что вопрос об оптимальной реакции крови – это очень трудный вопрос. Возможно, что в правильном ответе на него и заложены истоки нашего здоровья.
Если мы откроем популярную у нас книгу Поля Брэгга «Чудо голодания», то найдем в ней такие слова: «Наша кровь должна иметь щелочную реакцию, а у большинства из нас она проявляет кислую реакцию».
Следует сразу заявить, что в вопросе реакции крови Брэгг ошибался – большинство людей имеют щелочную кровь, а не кислую. Но кислая кровь тоже бывает. И это не больные люди имеют такую кровь, а даже более здоровые, чем люди со щелочной кровью. И это по большей части долгожители, и проживают они в районах с повышенным числом долгожителей.
Как видите, не так-то просто ответить на вопрос: какую реакцию крови следует считать оптимальной? Поэтому попытаемся постепенно и более подготовлено подойти к решению этого вопроса, тем более что для большинства читателей это новое понятие, которое они, по-видимому, никак не связывают с состоянием своего здоровья. А кроме того, если сейчас будет названа цифра оптимальной реакции крови, то как смогут воспользоваться этой информацией неподготовленные читатели, ведь мы не в состоянии каждодневно определять реакцию крови? Но косвенно, по состоянию своего самочувствия и по некоторым другим признакам мы можем чуть ли не ежечасно судить, в какую сторону – кислую или щелочную – сдвигается реакция нашей крови. То есть реакция крови не является каким-то отвлеченным понятием – нет, она постоянно связана с состоянием нашего здоровья. А точнее следует сказать, что состояние нашего здоровья имеет непосредственную связь с реакцией нашей крови. Например, когда у нас плохое самочувствие или болит голова – это следствие сдвига реакции крови в щелочную сторону. Вот в таких случаях Бутейко и советует дышать поверхностно, неглубоко, чтобы поднакопить в организме углекислый газ (и тем самым подкислить кровь). Но такое действие всего лишь полумера на пути к настоящему здоровью, а поэтому нам столь важно подробнее изучить все явления, оказывающие влияние на реакцию крови.
Учитывая тот несомненный факт, что главную роль в подкислении нашей крови природа отвела все же углекислому газу, а точнее, угольной кислоте, мы и рассмотрим более подробно свойства этой кислоты.
Угольная кислота и реакция крови
Растворяясь в воде, углекислый газ лишь частично вступает с ней во взаимодействие с образованием угольной кислоты (около 1 %). Отдельно определить содержание окиси углерода и угольной кислоты в воде достаточно трудно, а поэтому суммарную концентрацию этих компонентов принимают за концентрацию свободной угольной кислоты. И так как только незначительное количество растворенного в воде углекислого газа образует угольную кислоту, то расчет содержания свободной угольной кислоты ведется по двуокиси углерода СО2 своб.. И константу диссоциации угольной кислоты можно определить как «истинную», если в расчет брать только ионы действительно образующейся угольной кислоты и только первую ступень диссоциации. Тогда эта константа будет равна 1,32 ґ 10-4. Но можно определять константу диссоциации угольной кислоты и при условии, что весь углекислый газ образует угольную кислоту, и эту константу называют «кажущейся». Она равна 4,45 х 10-7.
Здесь следует заметить, что общее количество углекислого газа, переносимого кровью, всегда намного больше того, которое растворяется в крови. Примерно 10 % углекислого газа транспортируется в виде карбогемоглобина (его соединение с гемоглобином), примерно 3 % – в растворенном виде, а большая часть – в виде гидрокарбонатов.
Сравнивая константу диссоциации угольной кислоты «истинную» с константами диссоциации приводимых ниже органических кислот (табл. 1), мы видим, что угольная кислота сильнее янтарной, уксусной, бензойной и аскорбиновой и лишь немного уступает по силе молочной.

Кислоты в этой таблице перечислены в порядке возрастания их силы. Сила кислот определяется их константами диссоциации – сильнее та кислота, у которой больше константа диссоциации.
Другой формой содержания угольной кислоты в воде являются гидрокарбонаты, образующиеся при диссоциации угольной кислоты по 1-й ступени (Н2СО3 <-> Н+ + НСО3-), а также при диссоциации гидрокарбонатных солей, образующихся в результате растворения карбонатных пород под действием угольной кислоты:
СаСО3 + СО2 + Н2О = Са2+ + 2НСО3
Гидрокарбонаты – наиболее распространенная форма содержания угольной кислоты в природных водах при средних значениях рН. Они обусловливают щелочность воды, и это нам прежде всего необходимо помнить.
Кроме того, угольная кислота может содержаться в карбонат-ионах (СО32-), образующихся при диссоциации угольной кислоты по 2-й ступени: НСО3- <->Н + СО32-. Карбонат-ионы содержатся только в щелочной среде (при рН > 8,35). Но в присутствии ионов кальция содержание СО32- бывает небольшим вследствие малой растворимости карбоната кальция (СаСО3). А при наличии в растворе свободной угольной кислоты растворимость карбоната кальция возрастает в результате образования гидрокарбонатов, как об этом и было сказано чуточку выше.
Одновременно все формы угольной кислоты в растворе присутствовать не могут, наиболее вероятными и устойчивыми системами являются СО2 + НСО3- и НСО3- + СО32-. А какая из этих систем будет преобладать, зависит только от концентрации ионов водорода в растворе. Но на концентрацию ионов водорода может оказывать существенное влияние концентрация ионов кальция в растворе.
Основная карбонатная система природных вод представляет собой систему из свободной угольной кислоты и гидрокарбонат-ионов. От соотношения этих форм зависит рН природных вод. Например, при низких значениях рН (<4,2) в воде присутствует практически только свободная угольная кислота, а повышение рН (от 4,2 до 8,35) происходит при снижении концентрации свободной угольной кислоты в растворе и одновременном повышении гидрокарбонатов. При рН больше 8,35 в воде практически отсутствует свободная угольная кислота и остаются только гидрокарбонат-ионы. Но зависимость рН от соотношения различных форм угольной кислоты в растворе можно рассматривать и по-иному – как зависимость содержания различных форм угольной кислоты от рН раствора. Такая зависимость хорошо видна на рисунке 2.
Угольная кислота в форме карбонат-ионов называется связанной. Принято считать, что гидрокарбонаты наполовину состоят из связанной и свободной угольной кислоты, так как при разложении они дают карбонаты (связанную) и свободную угольную кислоту:
2НСО3 – ->СО2 + СО3 2- + Н2О.
Если в водном растворе одновременно присутствуют свободная угольная кислота и гидрокарбонаты, то в состоянии равновесия определенному содержанию гидрокарбонат-ионов соответствует вполне определенное количество свободной угольной кислоты, которую называют равновесной угольной кислотой.
Если содержание свободной угольной кислоты в растворе будет меньше равновесного с гидрокарбонатами:
Са 2+ + 2НСО3 – < СО2 + СаСО3 + Н2О (2.1),
то (по принципу Ле Шателье) равновесие смещается вправо, гидрокарбонат-ионы разрушаются с образованием свободной угольной кислоты и карбонат-ионов. Но избыток карбонат-ионов легко взаимодействует с ионами кальция (Са2+), содержащимися в растворе, с образованием труднорастворимого карбоната кальция (СаСО3).
Если же свободной угольной кислоты в водном растворе будет больше, чем необходимо для состояния равновесия:
Са 2+ + 2НСО3 – <СО2 + СаСО3 + Н2О (2.2),
то часть свободной угольной кислоты будет взаимодействовать с карбонатом кальция и переводить его в растворимый гидрокарбонат кальция. Такая реакция постоянно происходит в природных водах, соприкасающихся с почвами, содержащими в себе много известняков.
В крови, которая более чем на 90 % состоит из воды, угольная кислота ведет себя точно так же, как и в любом водном растворе, а поэтому все приведенные выше рассуждения о соотношении различных форм этой кислоты применимы и для крови. Кстати сказать, в физиологии также принято считать, что весь растворившийся в крови углекислый газ существует в ней в виде угольной кислоты, и вследствие этого константу диссоциации принимают не «истинную», а «кажущуюся».
Поэтому в поисках оптимальной реакции крови мы будем полагаться на то, что и в крови основная карбонатная система состоит из свободной угольной кислоты и гидрокарбонат-ионов. И в таком случае неравенство (2.1) будет говорить нам о том, что в крови содержится мало свободной угольной кислоты, но много ионов кальция и гидрокарбонат-ионов. В результате равновесие такой системы будет смещаться вправо с разрушением гидрокарбонат-ионов и образованием свободной угольной кислоты и карбонат-ионов. Последние будут взаимодействовать с ионами кальция, которые в избытке находятся в крови, образуя труднорастворимый карбонат кальция (СаСО3), который и будет откладываться то в суставах, то в артериях, а мы при этом будем только недоумевать, почему это у нас везде откладываются соли. И если учесть, что мы живем при постоянном избытке кальция у нас в крови и со щелочной реакцией ее, то все призывы пополнять наш организм кальцием сводятся только ко все большему и большему отложению его солей в нашем организме.
Когда умер писатель Максим Горький (в 68 лет), выяснилось, что все легкие у него были забиты солями кальция. Это тот вроде бы безобидный кальциноз, который обнаруживается почти у каждого взрослого человека при рентгеновском снимке легких.
А когда умер Ленин (в 54 года), обнаружилось, что мозг его был полностью закальцинирован.
Всем медицинским работникам хорошо известно, что отложения солей кальция в кровеносных сосудах делают их неимоверно хрупкими.
И все эти случаи избыточного накопления солей кальция в организме человека происходят по причине неравновесного состояния свободной угольной кислоты с гидрокарбонат-ионами по неравенству (2.1), а само неравновесное состояние является следствием повышенного содержания ионов кальция в крови.
Хорошей иллюстрацией к неравенству (2.1) может служить следующая цитата из книги Ю. Андреева «Три кита здоровья».
«…По какому-то стечению обстоятельств я обладаю возможностью диагностировать людей, не прикасаясь к ним. За время, что мне пришлось заниматься такого рода диагностикой, сотни и сотни людей прошли „через меня“. Поэтому-то я смею весьма категорично возразить некоторым постулатам официальной медицины, и вот в каком плане. Все знают, что заболеванием номер один, как утверждает медицина, болезнью, уносящей больше человеческих жизней, является онкология (в ее различных вариантах). Медицинская статистика показывает, что на втором месте находятся сердечно-сосудистые заболевания, а на третье место сейчас, в связи с экологической обстановкой в мире, выходят аллергические заболевания. Так вот, все это не совсем так. Болезнью номер один является общее загрязнение человеческого организма.
Что я понимаю под этим? Практически, кого ни посмотришь, видишь отложения солей на суставах даже у самых молодых людей. Кого ни посмотришь – склерозированные сосуды. Почти кого ни посмотришь (из ста человек девяносто восемь) – сигналит забитая всякой дрянью печень, «поддерживаемая» камнями в желчном пузыре. Практически каждый второй диагностируемый дает сигналы со стороны почек. То есть, когда я принимаю подобные «картины», я ощущаю, насколько загрязнен человек изнутри. Он может каждый день чистить зубы, мыть шею, но он загрязнен изнутри, и это внутреннее зашлакование его организма становится все тяжелее и гуще с каждым годом. А уже дальше дело сугубо индивидуальное, у кого какие будут последствия от этой «грязи», у кого что получится. Один заболеет онкологически, другой станет склеротиком, третий будет мучиться аллергиями и т. п. Короче говоря, у кого что слабее, тот тем и заболеет. Повторяю: болезнь номер один человечества – это общее зашлаковывание человеческого организма».
Все, о чем говорится в этой цитате, является, вероятнее всего, следствием только высокой концентрации ионов кальция в крови. А высокое содержание кальция в крови обеспечивает нам щелочную реакцию крови, при которой соли кальция становятся менее растворимыми и легко выпадают в осадок.

Если же свободной угольной кислоты будет больше, чем необходимо для состояния равновесия:
Са2+ + 2НСО3 – <СО 2 + СаСО3 + Н2О (2.2),
то часть ее будет взаимодействовать с карбонатом кальция и переводить его в растворимый гидрокарбонат. И в таком случае накопившиеся в нашем организме отложения солей начнут растворяться и постепенно выводиться из него, а наши суставы будут становиться более подвижными.
Так мы из чисто теоретических рассуждений выяснили и причину отложения солей кальция во многих наших органах, и возможные пути избавления от этих отложений.
И вновь мы продолжим поиск величины оптимальной реакции крови. Мы уже видели, что при недостаточном содержании в крови свободной угольной кислоты происходит отложение солей кальция в организме, а при повышенном содержании этой кислоты, наоборот, уже отложившиеся соли кальция начинают растворяться. По-видимому, для организма более благоприятна вторая ситуация, когда в крови будет достаточно много свободной углекислоты. Но нас в данный момент интересует тот случай, когда в крови наступает равновесное состояние между свободной угольной кислотой и гидрокарбонатами:
Са2+ + 2НСО3 – = СО2 + СаСО3 + Н2О (2.3)
По этому равенству мы видим, что соотношение между СО2 и НСО3- в таком случае будет равно 1: 2 (а при рН крови, равном 7,4, это соотношение равно 1: 6, а при рН = 8,0 – 1: 20). По рисунку 2 мы легко найдем, что такое соотношение между свободной угольной кислотой и гидрокарбонатами (1: 2) будет соответствовать реакции крови, равной 6,9. Такую величину и следует считать оптимальной реакцией крови.
Но каким способом будет достигнута необходимая концентрация ионов водорода в крови, это, по сути, не имеет никакого значения. И углекислый газ в таком случае, а точнее, углекислота, создаваемая этим газом при его растворении в крови, может находиться в одном ряду со всеми другими органическими кислотами, которые также могут повысить концентрацию ионов водорода в крови.
Еще в 1909 году датский химик Сёренсон первым указал на исключительное влияние ионов водорода на биологические реакции. Он же первым предложил оценивать кислотность растворов не по истинной концентрации ионов водорода в растворе, а по величине рН.
Здесь следует заметить, что общее количество углекислого газа, переносимого кровью, всегда намного больше того, которое растворяется в крови. Примерно 10 % углекислого газа транспортируется в виде карбогемоглобина (его соединение с гемоглобином), примерно 3 % – в растворенном виде, а большая часть – в виде гидрокарбонатов.
Сравнивая константу диссоциации угольной кислоты «истинную» с константами диссоциации приводимых ниже органических кислот (табл. 1), мы видим, что угольная кислота сильнее янтарной, уксусной, бензойной и аскорбиновой и лишь немного уступает по силе молочной.
Таблица 1. Константы диссоциации органических кислот

Кислоты в этой таблице перечислены в порядке возрастания их силы. Сила кислот определяется их константами диссоциации – сильнее та кислота, у которой больше константа диссоциации.
Другой формой содержания угольной кислоты в воде являются гидрокарбонаты, образующиеся при диссоциации угольной кислоты по 1-й ступени (Н2СО3 <-> Н+ + НСО3-), а также при диссоциации гидрокарбонатных солей, образующихся в результате растворения карбонатных пород под действием угольной кислоты:
СаСО3 + СО2 + Н2О = Са2+ + 2НСО3
Гидрокарбонаты – наиболее распространенная форма содержания угольной кислоты в природных водах при средних значениях рН. Они обусловливают щелочность воды, и это нам прежде всего необходимо помнить.
Кроме того, угольная кислота может содержаться в карбонат-ионах (СО32-), образующихся при диссоциации угольной кислоты по 2-й ступени: НСО3- <->Н + СО32-. Карбонат-ионы содержатся только в щелочной среде (при рН > 8,35). Но в присутствии ионов кальция содержание СО32- бывает небольшим вследствие малой растворимости карбоната кальция (СаСО3). А при наличии в растворе свободной угольной кислоты растворимость карбоната кальция возрастает в результате образования гидрокарбонатов, как об этом и было сказано чуточку выше.
Одновременно все формы угольной кислоты в растворе присутствовать не могут, наиболее вероятными и устойчивыми системами являются СО2 + НСО3- и НСО3- + СО32-. А какая из этих систем будет преобладать, зависит только от концентрации ионов водорода в растворе. Но на концентрацию ионов водорода может оказывать существенное влияние концентрация ионов кальция в растворе.
Основная карбонатная система природных вод представляет собой систему из свободной угольной кислоты и гидрокарбонат-ионов. От соотношения этих форм зависит рН природных вод. Например, при низких значениях рН (<4,2) в воде присутствует практически только свободная угольная кислота, а повышение рН (от 4,2 до 8,35) происходит при снижении концентрации свободной угольной кислоты в растворе и одновременном повышении гидрокарбонатов. При рН больше 8,35 в воде практически отсутствует свободная угольная кислота и остаются только гидрокарбонат-ионы. Но зависимость рН от соотношения различных форм угольной кислоты в растворе можно рассматривать и по-иному – как зависимость содержания различных форм угольной кислоты от рН раствора. Такая зависимость хорошо видна на рисунке 2.
Угольная кислота в форме карбонат-ионов называется связанной. Принято считать, что гидрокарбонаты наполовину состоят из связанной и свободной угольной кислоты, так как при разложении они дают карбонаты (связанную) и свободную угольную кислоту:
2НСО3 – ->СО2 + СО3 2- + Н2О.
Если в водном растворе одновременно присутствуют свободная угольная кислота и гидрокарбонаты, то в состоянии равновесия определенному содержанию гидрокарбонат-ионов соответствует вполне определенное количество свободной угольной кислоты, которую называют равновесной угольной кислотой.
Если содержание свободной угольной кислоты в растворе будет меньше равновесного с гидрокарбонатами:
Са 2+ + 2НСО3 – < СО2 + СаСО3 + Н2О (2.1),
то (по принципу Ле Шателье) равновесие смещается вправо, гидрокарбонат-ионы разрушаются с образованием свободной угольной кислоты и карбонат-ионов. Но избыток карбонат-ионов легко взаимодействует с ионами кальция (Са2+), содержащимися в растворе, с образованием труднорастворимого карбоната кальция (СаСО3).
Если же свободной угольной кислоты в водном растворе будет больше, чем необходимо для состояния равновесия:
Са 2+ + 2НСО3 – <СО2 + СаСО3 + Н2О (2.2),
то часть свободной угольной кислоты будет взаимодействовать с карбонатом кальция и переводить его в растворимый гидрокарбонат кальция. Такая реакция постоянно происходит в природных водах, соприкасающихся с почвами, содержащими в себе много известняков.
В крови, которая более чем на 90 % состоит из воды, угольная кислота ведет себя точно так же, как и в любом водном растворе, а поэтому все приведенные выше рассуждения о соотношении различных форм этой кислоты применимы и для крови. Кстати сказать, в физиологии также принято считать, что весь растворившийся в крови углекислый газ существует в ней в виде угольной кислоты, и вследствие этого константу диссоциации принимают не «истинную», а «кажущуюся».
Поэтому в поисках оптимальной реакции крови мы будем полагаться на то, что и в крови основная карбонатная система состоит из свободной угольной кислоты и гидрокарбонат-ионов. И в таком случае неравенство (2.1) будет говорить нам о том, что в крови содержится мало свободной угольной кислоты, но много ионов кальция и гидрокарбонат-ионов. В результате равновесие такой системы будет смещаться вправо с разрушением гидрокарбонат-ионов и образованием свободной угольной кислоты и карбонат-ионов. Последние будут взаимодействовать с ионами кальция, которые в избытке находятся в крови, образуя труднорастворимый карбонат кальция (СаСО3), который и будет откладываться то в суставах, то в артериях, а мы при этом будем только недоумевать, почему это у нас везде откладываются соли. И если учесть, что мы живем при постоянном избытке кальция у нас в крови и со щелочной реакцией ее, то все призывы пополнять наш организм кальцием сводятся только ко все большему и большему отложению его солей в нашем организме.
Когда умер писатель Максим Горький (в 68 лет), выяснилось, что все легкие у него были забиты солями кальция. Это тот вроде бы безобидный кальциноз, который обнаруживается почти у каждого взрослого человека при рентгеновском снимке легких.
А когда умер Ленин (в 54 года), обнаружилось, что мозг его был полностью закальцинирован.
Всем медицинским работникам хорошо известно, что отложения солей кальция в кровеносных сосудах делают их неимоверно хрупкими.
И все эти случаи избыточного накопления солей кальция в организме человека происходят по причине неравновесного состояния свободной угольной кислоты с гидрокарбонат-ионами по неравенству (2.1), а само неравновесное состояние является следствием повышенного содержания ионов кальция в крови.
Хорошей иллюстрацией к неравенству (2.1) может служить следующая цитата из книги Ю. Андреева «Три кита здоровья».
«…По какому-то стечению обстоятельств я обладаю возможностью диагностировать людей, не прикасаясь к ним. За время, что мне пришлось заниматься такого рода диагностикой, сотни и сотни людей прошли „через меня“. Поэтому-то я смею весьма категорично возразить некоторым постулатам официальной медицины, и вот в каком плане. Все знают, что заболеванием номер один, как утверждает медицина, болезнью, уносящей больше человеческих жизней, является онкология (в ее различных вариантах). Медицинская статистика показывает, что на втором месте находятся сердечно-сосудистые заболевания, а на третье место сейчас, в связи с экологической обстановкой в мире, выходят аллергические заболевания. Так вот, все это не совсем так. Болезнью номер один является общее загрязнение человеческого организма.
Что я понимаю под этим? Практически, кого ни посмотришь, видишь отложения солей на суставах даже у самых молодых людей. Кого ни посмотришь – склерозированные сосуды. Почти кого ни посмотришь (из ста человек девяносто восемь) – сигналит забитая всякой дрянью печень, «поддерживаемая» камнями в желчном пузыре. Практически каждый второй диагностируемый дает сигналы со стороны почек. То есть, когда я принимаю подобные «картины», я ощущаю, насколько загрязнен человек изнутри. Он может каждый день чистить зубы, мыть шею, но он загрязнен изнутри, и это внутреннее зашлакование его организма становится все тяжелее и гуще с каждым годом. А уже дальше дело сугубо индивидуальное, у кого какие будут последствия от этой «грязи», у кого что получится. Один заболеет онкологически, другой станет склеротиком, третий будет мучиться аллергиями и т. п. Короче говоря, у кого что слабее, тот тем и заболеет. Повторяю: болезнь номер один человечества – это общее зашлаковывание человеческого организма».
Все, о чем говорится в этой цитате, является, вероятнее всего, следствием только высокой концентрации ионов кальция в крови. А высокое содержание кальция в крови обеспечивает нам щелочную реакцию крови, при которой соли кальция становятся менее растворимыми и легко выпадают в осадок.

Если же свободной угольной кислоты будет больше, чем необходимо для состояния равновесия:
Са2+ + 2НСО3 – <СО 2 + СаСО3 + Н2О (2.2),
то часть ее будет взаимодействовать с карбонатом кальция и переводить его в растворимый гидрокарбонат. И в таком случае накопившиеся в нашем организме отложения солей начнут растворяться и постепенно выводиться из него, а наши суставы будут становиться более подвижными.
Так мы из чисто теоретических рассуждений выяснили и причину отложения солей кальция во многих наших органах, и возможные пути избавления от этих отложений.
И вновь мы продолжим поиск величины оптимальной реакции крови. Мы уже видели, что при недостаточном содержании в крови свободной угольной кислоты происходит отложение солей кальция в организме, а при повышенном содержании этой кислоты, наоборот, уже отложившиеся соли кальция начинают растворяться. По-видимому, для организма более благоприятна вторая ситуация, когда в крови будет достаточно много свободной углекислоты. Но нас в данный момент интересует тот случай, когда в крови наступает равновесное состояние между свободной угольной кислотой и гидрокарбонатами:
Са2+ + 2НСО3 – = СО2 + СаСО3 + Н2О (2.3)
По этому равенству мы видим, что соотношение между СО2 и НСО3- в таком случае будет равно 1: 2 (а при рН крови, равном 7,4, это соотношение равно 1: 6, а при рН = 8,0 – 1: 20). По рисунку 2 мы легко найдем, что такое соотношение между свободной угольной кислотой и гидрокарбонатами (1: 2) будет соответствовать реакции крови, равной 6,9. Такую величину и следует считать оптимальной реакцией крови.
Но каким способом будет достигнута необходимая концентрация ионов водорода в крови, это, по сути, не имеет никакого значения. И углекислый газ в таком случае, а точнее, углекислота, создаваемая этим газом при его растворении в крови, может находиться в одном ряду со всеми другими органическими кислотами, которые также могут повысить концентрацию ионов водорода в крови.
Еще в 1909 году датский химик Сёренсон первым указал на исключительное влияние ионов водорода на биологические реакции. Он же первым предложил оценивать кислотность растворов не по истинной концентрации ионов водорода в растворе, а по величине рН.
Для чего нам нужны ионы водорода?
На этот вопрос мы уже частично ответили: при снижении концентрации ионов водорода в крови (при повышении рН крови) повышается сродство кислорода с гемоглобином, в результате чего организм начинает испытывать гипоксию. Но не только для этого организму нужны ионы водорода.
Наш организм состоит из множества клеток. Клетка – это самая элементарная единица, способная поддерживать жизнь, но в то же время она представляет собой весьма сложный объект. Клетка – это отдельный микромир, имеющий четкие границы, внутри которых существуют непрерывная химическая активность и непрерывный поток энергии. Клетка имеет наружную мембрану, главная функция которой состоит в регулировании обмена различных веществ между клеткой и внешней средой.
Внутри клетка также с помощью мембран поделена на отдельные отсеки (компартменты). И чем, прежде всего, для нас интересны в данный момент эти отсеки, так это разной концентрацией ионов водорода в каждом из них. То есть в каждом отсеке поддерживается не только кислая среда, но и с различной величиной рН, иногда ниже 4 единиц.
А какую роль выполняют ионы водорода в клетке, говорится и в 10-й главе (об атеросклерозе), и чуть ниже («АТФ – универсальное клеточное горючее»). А чтобы создавать такие повышенные концентрации ионов водорода в отсеках, в каждой мембране имеются механизмы активного переноса ионов водорода из внеклеточной среды в эти отсеки, которые называются протонными помпами. Напомню здесь, что ионы водорода – это и есть в чистом виде протоны. А чтобы протонные помпы могли перекачивать ионы водорода, нужны по крайней мере сами эти ионы, а проще говоря, нужна подкисленная межклеточная среда, а такую среду может создать только подкисленная кровь. Так мы опосредованно пришли к выводу, что кровь обязательно должна содержать в себе достаточную концентрацию ионов водорода.
Но сама по себе концентрация ионов водорода еще не дает нам полной наглядной информации о достаточности или недостаточности этих ионов в крови. Поэтому более информативным для нас будет соотношение Н+ и ОН- при различных значениях рН.
Здесь мы остановимся на четырех реакциях крови, которые ситуативно могут быть у нас, и посмотрим, как отношение Н+/ОН- может сказываться на нашем здоровье. Реакции эти равны 6,0, 6,9, 7,4 и 8,0.
Если мы считаем, что реакция крови с рН = 7,4 является нормальной реакцией для нашей артериальной крови, тогда следует считать нормальным и такое отношение Н+/ОН-, когда на один ион водорода приходится шесть гидроксид-ионов. При такой реакции крови мы если и не постоянно, то довольно часто болеем.
Но если эту реакцию крови (рН = 7,4), которую мы в настоящее время считаем нормальной, повысить всего на 0,6 единицы, то получим алкалоз (рН = 8,0) – значительное повышение щелочных компонентов в крови. А это не только очень болезненное состояние организма, но и почти безжизненное. А отношение Н+/ОН- при этом будет выглядеть как один к ста. Как видим, и при достаточно щелочной реакции крови (рН = 8) в ней еще имеются ионы водорода, но каждый из них находится в «густом лесу», состоящем из ионов ОН-. Легко ли при таком соотношении ионов водорода и гидроксид-ионов протонным помпам найти и перенести внутрь клетки необходимое число протонов? Такой поиск можно сравнить только с поиском иглы в стоге сена. То есть при таком соотношении между Н+ и ОН- протонные помпы просто не в состоянии будут найти в крови и перекачать внутрь клетки ионы водорода, хотя эти ионы и будут находиться в крови. И в результате мы будем постоянно болеть. И это всего лишь при незначительном сдвиге реакции крови в сторону повышения рН.
А теперь понизим рН крови (повысим концентрацию ионов водорода в ней) относительно так называемой нормальной ее реакции (относительно рН = 7,4) всего лишь на 0,5 единицы. Мы получим оптимальную реакцию крови. При такой реакции крови (при рН = 6,9) наступает оздоровление организма. А отношение Н+/ОН- при этом будет равно 5/3, а при рН = 7,4 это отношение было равно 5/30. И абсолютное число ионов водорода при переходе от рН = 7,4 к рН = 6,9 увеличивается в три раза. Ионов водорода, таким образом, становится достаточно для нормального функционирования всех систем организма.
Как видим, при незначительном и почти равном сдвиге реакции крови в одну и в другую сторону относительно постоянно имеющейся у нас реакции крови (относительно рН = 7,4), происходят очень большие изменения концентрации ионов водорода и гидроксид-ионов в крови, что незамедлительно сказывается на нашем здоровье.
Если мы продолжим подкисливать кровь, ее реакция может понизиться до рН = 6,0. По медицинской терминологии это уже ацидоз, то есть повышенно кислая кровь. При такой реакции крови отношение Н+/ОН- равно 100 к 1. И если при рН = 8,0 человек становится очень больным, то при рН = 6,0 может происходить интенсивное оздоровление организма человека (такое состояние бывает при оздоровительном беге, когда кровь подкисливается молочной кислотой). Уже одно такое краткое сравнение состояний нашего организма при четырех разных, но реальных для нас реакциях крови, говорит нам о большом влиянии концентрации ионов водорода в крови на наше здоровье.
Нам всегда следует помнить и об эффекте Вериго-Бора, согласно которому с увеличением кислотности крови (с увеличением в ней концентрации ионов водорода) уменьшается связь оксигемоглобина с кислородом, и таким образом улучшается снабжение организма кислородом (хотя этот эффект был выражен его авторами в несколько иной интерпретации). Наглядно эта ситуация представлена на рисунке 3.
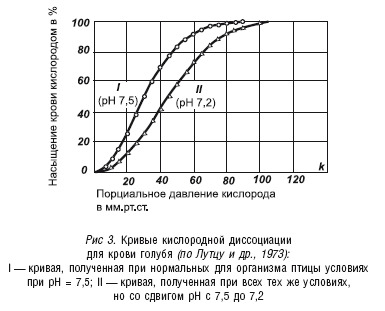
На рисунке 3 изображены две кривые кислородной диссоциации, которые получены для одной и той же крови при нормальных условиях по парциальному давлению, но при разных значениях рН крови. Первое, на что следует обратить внимание при анализе рисунка 3, – это на то обстоятельство, что при различных значениях рН полное насыщение крови кислородом происходит при значительно меньшем парциальном давлении кислорода, чем оно реально существует на уровне моря или просто на равнинной местности. А это означает, что нас не должна особенно волновать проблема насыщения нашей крови кислородом, по сути, мы всегда имеем полное насыщение крови кислородом, если только мы не живем высоко в горах. А вот другая проблема – отдача кислорода тканям – нас должна особенно беспокоить. Очень часто наша кровь возвращается в легкие, не истратив даже 50 % запасенного в ней кислорода. И в таком случае нам может помочь эффект Вериго-Бора. Например, при парциальном давлении кислорода в крови равном 40 мм рт. ст. с рН = 7,2 (по рис. 3) кровь может отдать 60 % связанного кислорода, но та же кровь с рН = 7,5 – только 30 %. Ясно, что для организма более благоприятна кровь с рН = 7,2, чем с рН = 7,5.
Наш организм состоит из множества клеток. Клетка – это самая элементарная единица, способная поддерживать жизнь, но в то же время она представляет собой весьма сложный объект. Клетка – это отдельный микромир, имеющий четкие границы, внутри которых существуют непрерывная химическая активность и непрерывный поток энергии. Клетка имеет наружную мембрану, главная функция которой состоит в регулировании обмена различных веществ между клеткой и внешней средой.
Внутри клетка также с помощью мембран поделена на отдельные отсеки (компартменты). И чем, прежде всего, для нас интересны в данный момент эти отсеки, так это разной концентрацией ионов водорода в каждом из них. То есть в каждом отсеке поддерживается не только кислая среда, но и с различной величиной рН, иногда ниже 4 единиц.
А какую роль выполняют ионы водорода в клетке, говорится и в 10-й главе (об атеросклерозе), и чуть ниже («АТФ – универсальное клеточное горючее»). А чтобы создавать такие повышенные концентрации ионов водорода в отсеках, в каждой мембране имеются механизмы активного переноса ионов водорода из внеклеточной среды в эти отсеки, которые называются протонными помпами. Напомню здесь, что ионы водорода – это и есть в чистом виде протоны. А чтобы протонные помпы могли перекачивать ионы водорода, нужны по крайней мере сами эти ионы, а проще говоря, нужна подкисленная межклеточная среда, а такую среду может создать только подкисленная кровь. Так мы опосредованно пришли к выводу, что кровь обязательно должна содержать в себе достаточную концентрацию ионов водорода.
Но сама по себе концентрация ионов водорода еще не дает нам полной наглядной информации о достаточности или недостаточности этих ионов в крови. Поэтому более информативным для нас будет соотношение Н+ и ОН- при различных значениях рН.
Здесь мы остановимся на четырех реакциях крови, которые ситуативно могут быть у нас, и посмотрим, как отношение Н+/ОН- может сказываться на нашем здоровье. Реакции эти равны 6,0, 6,9, 7,4 и 8,0.
Если мы считаем, что реакция крови с рН = 7,4 является нормальной реакцией для нашей артериальной крови, тогда следует считать нормальным и такое отношение Н+/ОН-, когда на один ион водорода приходится шесть гидроксид-ионов. При такой реакции крови мы если и не постоянно, то довольно часто болеем.
Но если эту реакцию крови (рН = 7,4), которую мы в настоящее время считаем нормальной, повысить всего на 0,6 единицы, то получим алкалоз (рН = 8,0) – значительное повышение щелочных компонентов в крови. А это не только очень болезненное состояние организма, но и почти безжизненное. А отношение Н+/ОН- при этом будет выглядеть как один к ста. Как видим, и при достаточно щелочной реакции крови (рН = 8) в ней еще имеются ионы водорода, но каждый из них находится в «густом лесу», состоящем из ионов ОН-. Легко ли при таком соотношении ионов водорода и гидроксид-ионов протонным помпам найти и перенести внутрь клетки необходимое число протонов? Такой поиск можно сравнить только с поиском иглы в стоге сена. То есть при таком соотношении между Н+ и ОН- протонные помпы просто не в состоянии будут найти в крови и перекачать внутрь клетки ионы водорода, хотя эти ионы и будут находиться в крови. И в результате мы будем постоянно болеть. И это всего лишь при незначительном сдвиге реакции крови в сторону повышения рН.
А теперь понизим рН крови (повысим концентрацию ионов водорода в ней) относительно так называемой нормальной ее реакции (относительно рН = 7,4) всего лишь на 0,5 единицы. Мы получим оптимальную реакцию крови. При такой реакции крови (при рН = 6,9) наступает оздоровление организма. А отношение Н+/ОН- при этом будет равно 5/3, а при рН = 7,4 это отношение было равно 5/30. И абсолютное число ионов водорода при переходе от рН = 7,4 к рН = 6,9 увеличивается в три раза. Ионов водорода, таким образом, становится достаточно для нормального функционирования всех систем организма.
Как видим, при незначительном и почти равном сдвиге реакции крови в одну и в другую сторону относительно постоянно имеющейся у нас реакции крови (относительно рН = 7,4), происходят очень большие изменения концентрации ионов водорода и гидроксид-ионов в крови, что незамедлительно сказывается на нашем здоровье.
Если мы продолжим подкисливать кровь, ее реакция может понизиться до рН = 6,0. По медицинской терминологии это уже ацидоз, то есть повышенно кислая кровь. При такой реакции крови отношение Н+/ОН- равно 100 к 1. И если при рН = 8,0 человек становится очень больным, то при рН = 6,0 может происходить интенсивное оздоровление организма человека (такое состояние бывает при оздоровительном беге, когда кровь подкисливается молочной кислотой). Уже одно такое краткое сравнение состояний нашего организма при четырех разных, но реальных для нас реакциях крови, говорит нам о большом влиянии концентрации ионов водорода в крови на наше здоровье.
Нам всегда следует помнить и об эффекте Вериго-Бора, согласно которому с увеличением кислотности крови (с увеличением в ней концентрации ионов водорода) уменьшается связь оксигемоглобина с кислородом, и таким образом улучшается снабжение организма кислородом (хотя этот эффект был выражен его авторами в несколько иной интерпретации). Наглядно эта ситуация представлена на рисунке 3.

На рисунке 3 изображены две кривые кислородной диссоциации, которые получены для одной и той же крови при нормальных условиях по парциальному давлению, но при разных значениях рН крови. Первое, на что следует обратить внимание при анализе рисунка 3, – это на то обстоятельство, что при различных значениях рН полное насыщение крови кислородом происходит при значительно меньшем парциальном давлении кислорода, чем оно реально существует на уровне моря или просто на равнинной местности. А это означает, что нас не должна особенно волновать проблема насыщения нашей крови кислородом, по сути, мы всегда имеем полное насыщение крови кислородом, если только мы не живем высоко в горах. А вот другая проблема – отдача кислорода тканям – нас должна особенно беспокоить. Очень часто наша кровь возвращается в легкие, не истратив даже 50 % запасенного в ней кислорода. И в таком случае нам может помочь эффект Вериго-Бора. Например, при парциальном давлении кислорода в крови равном 40 мм рт. ст. с рН = 7,2 (по рис. 3) кровь может отдать 60 % связанного кислорода, но та же кровь с рН = 7,5 – только 30 %. Ясно, что для организма более благоприятна кровь с рН = 7,2, чем с рН = 7,5.
АТФ – универсальное клеточное горючее
И снова мы возвращаемся к энергетике клетки. Вспомним, что клетка – это отдельный микромир, имеющий четкие границы, внутри которых существуют непрерывная химическая активность и непрерывный поток энергии. В переносе энергии от энергодающих химических реакций к процессам, идущим с потреблением энергии (которые собственно и составляют работу клетки), принимает участие АТФ (аденозинтрифосфат), выполняющий очень важную роль носителя энергии в биологических системах.
Как же образуется универсальное клеточное горючее – знаменитый АТФ?
Ответ на этот вопрос можно найти в статье Л. И. Верховского, имеющей символическое название «Кажется, рождается биопротоника» (Химия и жизнь. 1990. № 10). Вот что говорится в ней об энергетике клетки.
Известно, что наружная мембрана клеток поддерживает не только разность в концентрации отдельных веществ внутри и снаружи клеток, но также поддерживает и разность электрических потенциалов.
Предложенная лауреатом Нобелевской премии Питером Митчелом теория образования АТФ утверждает, что при окислении жиров и углеводов ферментами дыхательной цепи через мембрану переносятся электрические заряды, а затем созданный мембраной электрохимический градиент протонов используется другим ферментом – АТФ-синтетазой, которая присоединяет к АДФ (аденозиндифосфат) неорганический фосфат:
АДФ + Фн <-> АТФ + Н2О.
Эта реакция называется реакцией фосфорилирования, то есть реакцией переноса и присоединения еще одной фосфатной группы к АДФ. Последний отличается от АТФ тем, что в нем находятся две фосфатные группы, а в АТФ – три. На присоединение еще одной фосфатной группы к АДФ затрачивается энергия, которая и запасается в АТФ. Такое накопление энергии в АТФ достигается благодаря сопряжению реакции фосфорилирования с реакциями окисления. Получается, и это уже твердо установлено, что мембранный потенциал (а он возможен только при наличии достаточной концентрации ионов водорода в межклеточной жидкости, то есть при достаточном подкислении крови) – это связующее звено окисления и фосфорилирования. И поэтому своеобразная гипоксия клеток может возникать и при резко выраженном разобщении процессов окисления и фосфорилирования в дыхательной цепи. Потребление клетками кислорода при этом может даже возрастать, однако значительное увеличение доли энергии, рассеиваемой в виде тепла, приводит к энергетическому «обесцениванию» клеточного дыхания. Возникает относительная недостаточность биологического окисления, при которой, несмотря на высокую интенсивность функционирования дыхательной цепи, образование АТФ не покрывает потребности в них клеток, и последние находятся по существу в состоянии гипоксии.
Как же образуется универсальное клеточное горючее – знаменитый АТФ?
Ответ на этот вопрос можно найти в статье Л. И. Верховского, имеющей символическое название «Кажется, рождается биопротоника» (Химия и жизнь. 1990. № 10). Вот что говорится в ней об энергетике клетки.
Известно, что наружная мембрана клеток поддерживает не только разность в концентрации отдельных веществ внутри и снаружи клеток, но также поддерживает и разность электрических потенциалов.
Предложенная лауреатом Нобелевской премии Питером Митчелом теория образования АТФ утверждает, что при окислении жиров и углеводов ферментами дыхательной цепи через мембрану переносятся электрические заряды, а затем созданный мембраной электрохимический градиент протонов используется другим ферментом – АТФ-синтетазой, которая присоединяет к АДФ (аденозиндифосфат) неорганический фосфат:
АДФ + Фн <-> АТФ + Н2О.
Эта реакция называется реакцией фосфорилирования, то есть реакцией переноса и присоединения еще одной фосфатной группы к АДФ. Последний отличается от АТФ тем, что в нем находятся две фосфатные группы, а в АТФ – три. На присоединение еще одной фосфатной группы к АДФ затрачивается энергия, которая и запасается в АТФ. Такое накопление энергии в АТФ достигается благодаря сопряжению реакции фосфорилирования с реакциями окисления. Получается, и это уже твердо установлено, что мембранный потенциал (а он возможен только при наличии достаточной концентрации ионов водорода в межклеточной жидкости, то есть при достаточном подкислении крови) – это связующее звено окисления и фосфорилирования. И поэтому своеобразная гипоксия клеток может возникать и при резко выраженном разобщении процессов окисления и фосфорилирования в дыхательной цепи. Потребление клетками кислорода при этом может даже возрастать, однако значительное увеличение доли энергии, рассеиваемой в виде тепла, приводит к энергетическому «обесцениванию» клеточного дыхания. Возникает относительная недостаточность биологического окисления, при которой, несмотря на высокую интенсивность функционирования дыхательной цепи, образование АТФ не покрывает потребности в них клеток, и последние находятся по существу в состоянии гипоксии.
