Страница:
Некоторое время спустя Нуреева стали лечить появившимся тогда одним из первых медицинских препаратов под кодовым названием НРА-23. Это дало определенный эффект, состояние здоровья улучшилось, и артист решил, что он выздоровел. В то время это казалось вполне возможным. Рудольф всегда черпал силу в несчастьях, а СПИД выглядел просто очередным препятствием, и он чувствовал, что может его преодолеть. Нуреев продолжал много работать, много выступать, однако постепенно критические отзывы о его выступлениях становились все менее благоприятными, так как его сравнивали в тех же ролях с ним самим в более молодом возрасте и еще здоровым. И действительно, улучшение оказалось ложным. Весной 1985 г. у Нуреева начался сильный приступ пневмонии во время выступления в «Ромео и Джульетте» в Пале-де-Конгресс. Далее все шло по нарастающей. Ничто не помогало. Свидетели говорят, что в 1989-м, когда он еще танцевал «Сильфиду» на сцене Кировского театра после возвращения в СССР, на его танец невозможно было смотреть без слез. Неизбежный финал наступил 6 января 1993 г., когда Нурееву было всего 54 года.
Что и как защищает нас от внешних врагов?
Прежде чем продолжить наш рассказ о СПИДе и причинах, его вызывающих, нельзя не сказать несколько слов об основных механизмах устройства защитной системы человека, которая спасает нас на протяжении всей жизни от всевозможных вредных микроорганизмов (в том числе и вирусов) и которая-то в первую очередь «ломается» при СПИДе. Без общего представления о работе этой системы будет трудно понять, что же происходит в организме у больных СПИДом, как осуществляются другие «поломки» и почему все это столь критично для жизни человека, почему при СПИДе неизбежно наступает exitus letalis (смертельный исход).
Наш организм нередко сравнивают с хорошо укрепленной крепостью, все подступы к которой находятся под неусыпным надзором многочисленных защитников. Вообще-то эти защитники весьма сильны, и микробу обычно очень трудно проникнуть внутрь организма.
Первый эшелон обороны представлен кожей и слизистыми оболочками, преодолеть которые, если они не повреждены, многие микроорганизмы не в состоянии (рис. 1). Начнем с кожи, которая покрывает нас с головы до ног. Она не только механически защищает нас, но и обладает специальной системой для самоочищения от микроорганизмов, которые попадают на ее поверхность. Осуществляют это самоочищение сальные и потовые железы, которые выделяют молочные и жирные кислоты.
Чистая кожа лучше самостерилизуется, поскольку в ней лучше работают кожные железы. Например, возбудитель дизентерии, попав на чистую кожу, погибает через 15 минут, а на грязной коже большая часть бактерий и через 30 минут продолжает себя нормально чувствовать.
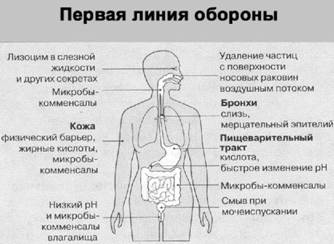 Рис. 1. Большинство возбудителей болезней человека не способны проникать во внутреннюю среду организма благодаря разнообразным физическим, биохимическим и микробным барьерам, которые представляют собой первый эшелон защиты. Размножение многих вредных микроорганизмов подавляется микробами-комменсалами, которые живут в организме человека в обычной нормальной обстановке без всякого вреда для него
Рис. 1. Большинство возбудителей болезней человека не способны проникать во внутреннюю среду организма благодаря разнообразным физическим, биохимическим и микробным барьерам, которые представляют собой первый эшелон защиты. Размножение многих вредных микроорганизмов подавляется микробами-комменсалами, которые живут в организме человека в обычной нормальной обстановке без всякого вреда для него
Общая площадь слизистых оболочек значительно превышает площадь поверхности кожи. Тибетская медицина утверждает, что «рот является воротами всех болезней». И вот микроб с грязных рук попал в рот или в глаз. Здесь он сразу встречается с секретом слюнных или слезных желез. И в слюне, и в слезах содержатся специальные вещества-ферменты, которые губительны для многих микробов (не зря животные вылизывают раны). Если случится, что микроорганизм сумел проскочить ротовую полость, то далее он встречается с еще одним защитником – слизистой оболочкой желудочно-кишечного тракта. В ней также содержатся вещества, губительные для микробов-«пришельцев». В желудке (если микроб туда добрался), он подвергается действию желудочного сока, содержащего соляную кислоту.
Но это еще не все. На нас и внутри нас проживают разнообразные и многочисленные микроорганизмы – «постоянные обитатели», комменсалы, – совокупность которых называют микрофлорой (может быть, лучше было бы их назвать микрофауной). Так, в нашем кишечнике содержится огромное количество микроорганизмов, которые приобрели способность жить там постоянно, не причиняя нам никакого вреда, а, наоборот, чаще всего помогая нашему организму нормально функционировать. «Постоянные обитатели» весьма ревностно относятся к «пришельцам» и, как правило, побеждают их, отвоевывая для себя «место под солнцем» (для «постоянных обитателей» наш кишечник равносилен солнцу, без которого они жить не могут). Здесь действует принцип «микробы против микробов». На нашей коже также существуют «постоянные обитатели», они, например, способны успешно бороться с таким грозным микробом, как возбудитель сибирской язвы. Прижившиеся у нас в верхних дыхательных путях пневмококки успешно справляются с вирусами гриппа. Еще одни ворота для инфекции – влагалище у женщин. Нормальная флора влагалища содержит около шести разных видов бактерий, поддерживающих среду, неблагоприятную для проживания других бактерий. В частности, там «прописан» постоянный обитатель по имени палочка Додерлейна, который занимается глубоким самоочищением влагалища от микробов-«пришельцев».
Из сказанного ясно, что микрофлора человека – еще один важный защитник организма от внешних врагов. Об этом следует помнить, когда бесконтрольно применяются для лечения антибактериальные препараты, такие, например, как антибиотики. При этом развивается так называемый дисбактериоз – разрушение и обеднение нормальной микрофлоры. Недаром еще в позапрошлом веке известный микробиолог И. И. Мечников настоятельно советовал внимательно относиться к микробному «населению» нашего кишечника, вовремя обогащать его полезными микроорганизмами, такими как молочно-кислые бактерии. Сейчас это доступно всем – в любом молочном магазине можно купить кефир с бифидобактериями.
Все выше перечисленные барьеры обусловливают так называемую естественную неспецифическую устойчивость организма, направленную сразу на многие (если не на все) инфекционные агенты.
Но вот, несмотря на многочисленные заслоны, вредный микроорганизм все-таки все преодолел, сумел выжить и стал изнутри разрушать наш организм. Тут и вступает в действие основной щит – наша собственная иммунная система, основная функция которой – распознавание и удаление из организма всего чужеродного – микробов, вирусов, грибков и даже собственных клеток и тканей, если они под действием факторов окружающей среды изменяются и становятся чужеродными. Иммунная система обеспечивает как дополнительный неспецифический, так и строго специфический иммунный ответ. Последний проявляется при попадании микроба во внутреннюю среду организма и мешает развитию только этого конкретного вида микроорганизма.
Немного истории
Сам термин «иммунитет» возник от латинского слова immuni-tas – освобождение, избавление от чего-либо. В медицинскую практику он вошел в XIX в., когда им стали обозначать «освобождение от болезни» (французский словарь Литте, 1869). Но еще задолго до появления самого термина у медиков уже существовало понятие об иммунитете в значении невосприимчивости человека к болезни, которое обозначалось как «самоисцеляющая сила организма» (vis medicatrix naturae) (Гиппократ), «жизненная сила» (Гален) или «залечивающая сила» (Парацельс). Врачам давно была известна присущая людям от рождения невосприимчивость (или, как говорят специалисты, резистентность) к болезням животных (например, куриной холере, чуме собак). Сейчас это называют врожденным (естественным) иммунитетом. С древних времен медики знали, что человек не болеет некоторыми болезнями дважды. Так, еще в IV в. до н. э. Фукидид, описывая чуму в Афинах, отмечал факты, когда те люди, которые чудом выживали, могли ухаживать за больными без риска заболеть вновь. Жизненный опыт показывал, что у людей может возникать стойкая невосприимчивость к повторному заражению после перенесенных тяжелых инфекций, таких, например, как тиф, оспа, скарлатина. Такое явление сегодня называют приобретенным иммунитетом. Это более совершенный механизм защиты организма от биологической агрессии. Он возник в эволюции позже и означает распознавание самых тонких различий между чужеродными агентами.
Лишь в конце XVIII в. произошел первый важный прорыв в практическом использовании накопленных ранее абстрактных представлений об иммунитете. Им стала знаменитая работа англичанина Эдварда Дженнера. Много лет он тщательно изучал разные случаи заболевания человека «коровьей» оспой. В конечном итоге все это навело Дженнера на мысль о возможности практического использования коровьей оспы для защиты человека от такого страшного заболевания, как натуральная оспа. Будучи убежденным, что такая форма искусственного заражения человека – безвредный способ предотвращения тяжелой болезни, которой является оспа, он в 1796 г. провел первый успешный эксперимент на человеке. Результат превзошел все ожидания! Подробнее мы еще поговорим об этом, когда речь пойдет о вакцинах. Но для справедливости заметим, что в Китае и Индии прививку оспы практиковали еще за несколько столетий до ее введения в Европе. Болячками переболевшего оспой человека расцарапывали кожу здорового человека, который обычно после этого переносил инфекцию в слабой, не смертельной форме, после чего выздоравливал и оставался устойчивым к последующим заражениям оспой.
Однако существовавшие эмпирические знания и даже успех Дженнера, за который он получил довольно большую денежную премию от Британского парламента, долгое время не находили своего полного объяснения, и природа иммунитета оставалась загадкой за семью печатями.
Спустя почти 100 лет открытый Э. Дженнером факт лег в основу дальнейших экспериментов Л. Пастера на куриной холере, завершившихся формулировкой принципа профилактики от инфекционных заболеваний – принцип иммунизации ослабленными или убитыми возбудителями (1881 г.). Чуть позднее (в 1890 г.) Эмиль фон Беринг сообщил, что после введения в организм животного не целых дифтерийных бактерий, а всего лишь некоего токсина, выделенного из них, в крови появляется нечто, способное нейтрализовать или разрушать токсин и тем самым предотвращать само заболевание, вызываемое целой бактерией. Более того, оказалось, что приготовленные из крови таких животных препараты (их назвали сыворотками) исцеляли детей, уже больных дифтерией. Вещество, которое нейтрализовало токсин и появлялось в крови только в его присутствии, получило название антитоксина. В дальнейшем это и подобные ему вещества стали называть общим термином – антитела. А тот агент, который вызывает образование этих антител, стали называть антигеном. За эти работы Эмиль фон Беринг был удостоен в 1901 г. Нобелевской премии по физиологии и медицине. (Хотелось бы отметить, что термин «антиген» сегодня кажется крайне неудачным, поскольку по смыслу он может быть применен к некоему агенту, направленному против гена. Но термин «прижился», и, по всей видимости, никуда теперь от него не уйти. Еще наши предки подметили: Multa sunt in moribus dissentanea, multa sine ratione – в обычаях много несообразного, много неразумного.) В дальнейшем П. Эрлих разработал на этой базе теорию гуморального иммунитета (т. е. иммунитета, обеспечиваемого антителами, которые, продвигаясь по жидким внутренним средам организма, такими как кровь и лимфа (от лат. humor – жидкость), поражают чужеродные тела на любом расстоянии от лимфоцита, который их производит.
Если с антигеном все было более или менее ясно почти с самого начала, то, чтобы понять природу антител, потребовалось еще более полувека, пока Арне Тизелиус (Нобелевская премия по химии за 1948 г.) не показал, что это всего лишь обычные белки, но с очень большим молекулярным весом. Химическую структуру антител расшифровали Джералд Морис Эдельман (США) и Родни Роберт Портер (Великобритания), за что они оба получили Нобелевскую премию в 1972 г. В конечном итоге было установлено, что каждое антитело (они еще называются иммуноглобулинами) состоит из четырех белков – двух легких цепей и двух тяжелых цепей. Такая структура в электронном микроскопе по своему виду напоминает «рогатку» (рис. 2). Часть молекулы антитела, которая связывается с антигеном, очень изменчива, поэтому ее называют вариабельной. Эта область содержится на самом кончике антитела, поэтому защитную молекулу иногда сравнивают с пинцетом, ухватывающим с помощью острых концов мельчайшие детали самого замысловатого часового механизма. Активный центр распознает в молекуле антигена небольшие участки, состоящие обычно из 4–8 аминокислот. Эти участки антигена подходят к структуре антитела, «как ключ к замку». «Родственные объятия» антител с антигеном (микробом) редко кончаются для последнего благополучно. Если даже антитела не могут с ним справиться самостоятельно, на помощь им придут другие компоненты, и в первую очередь специальные «клетки-пожиратели».
Значительно позднее, японец Сусумо Тонегава, основываясь на достижении Эдельмана и Портера, показал то, что никто в принципе не мог даже ожидать: те гены в геноме, которые отвечают за синтез антител, в отличие от всех других генов человека, обладают потрясающей способностью – многократно изменять свою структуру в отдельных клетках человека в течение его жизни. При этом они, варьируя в своей структуре, перераспределяются так, что потенциально готовы обеспечить производство нескольких сотен миллионов различных белков-антител, т. е. намного больше теоретического количества, потенциально действующих на человеческий организм извне чужеродных веществ – антигенов. В 1987 г. С. Тонегаве была присуждена Нобелевская премия по физиологии и медицине «за открытие генетических принципов генерации антител».
Параллельно с создателем теории гуморального иммунитета Эрлихом в те же годы наш соотечественник И. И. Мечников («поэт микробиологии», по образному определению Эмиля Ру) создавал учение о невосприимчивости (иммунитете), разработав теорию фагоцитоза и обосновав фагоцитарную теорию иммунитета. Он доказал, что у животных и человека существуют специальные клетки, —
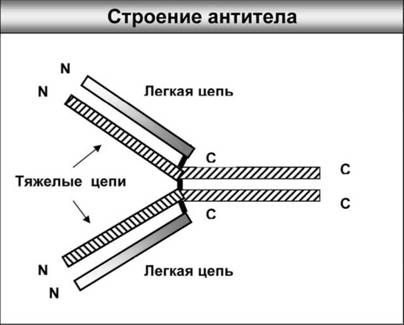 Рис. 2. Антитела (иммуноглобулины) – сложные белковые агрегаты, которые состоят из четырех взаимосвязанных между собой цепей молекул белков: двух одинаковых коротких (легких) цепей и двух одинаковых длинных (тяжелых). Темные участки – связи между белковыми молекулами. N – обозначение начала молекулы белка, С – обозначение конца молекулы белка. У всех антител С-концы молекул белков одинаковы (их называют константными), а N-концы отличаются (они вариабельны)
Рис. 2. Антитела (иммуноглобулины) – сложные белковые агрегаты, которые состоят из четырех взаимосвязанных между собой цепей молекул белков: двух одинаковых коротких (легких) цепей и двух одинаковых длинных (тяжелых). Темные участки – связи между белковыми молекулами. N – обозначение начала молекулы белка, С – обозначение конца молекулы белка. У всех антител С-концы молекул белков одинаковы (их называют константными), а N-концы отличаются (они вариабельны)
фагоциты (или «пожирающие» клетки), – способные поглощать и разрушать патогенные микроорганизмы и другой генетически чужеродный материал, волею судьбы оказавшийся в нашем организме. Осуществляемый фагоцитами процесс – фагоцитоз – был известен ученым с 1862 г. по работам Э. Геккеля, но только Мечников первым связал фагоцитоз с защитной функцией иммунной системы. В последующей многолетней и плодотворной дискуссии между сторонниками фагоцитарной и гуморальной теорий были раскрыты многие механизмы иммунитета. Спор между Мечниковым и Эрлихом привлек интерес не только ученых, но и широкой публики. Бернард Шоу даже написал на эту тему пьесу под названием «Врач на распутье». Фагоцитоз, открытый Мечниковым, получил в дальнейшем название клеточного иммунитета, а антителообразование, обнаруженное Эрлихом, – гуморального иммунитета. Все завершилось тем, что оба ученых были признаны мировой научной общественностью и разделили между собой Нобелевскую премию по физиологии и медицине за 1908 г.
Это были первые Нобелевские премии по зарождавшейся в те годы новой науке иммунологии, а всего за XX в. около 30 ученых стали Нобелевскими лауреатами по иммунологии и близким к иммунологии областям. В результате работ всех этих исследователей наши знания о защитной системе постоянно расширялись, дополнялись и уточнялись. Так постепенно складывалось современное представление об иммунной системе животного организма и тончайших механизмах ее функционирования. Нынешним людям трудно осознать, насколько каждый из нас, ныне живущих, обязан французу Пастеру, русскому Мечникову, немцу Берингу и другим ученым, раскрывшим тайны инфекционных болезней и иммунитета. До XIX в. средняя продолжительность жизни в Европе составляла немногим более 30 лет. Если принять во внимание, что теперь она в большинстве развитых стран более 60 лет, то выходит, что перечисленные выше труженики науки подарили всем нам по меньшей мере вторую жизнь!
Благодаря наличию иммунной системы организм защищен от большинства болезнетворных микроорганизмов (вирусов, бактерий, грибков, простейших, гельминтов) и токсических продуктов их жизнедеятельности. Иммунитет также защищает организм от воздействия различных веществ, обладающих чужеродными свойствами (например, растительных и животных ядов), от развития опухолевых клеток. Кроме того, иммунитет определяет исход трансплантации органов и тканей, в том числе переливания крови, контролирует внутриутробное развитие плода и процессы старения. Таким образом, иммунитет направлен на защиту организма, поддержание его целостности и индивидуальности.
Сегодня мы знаем, что иммунная система нашего организма, наш главный щит, многослойна. Она, как и другие системы организма, состоит из органов и клеток. Иммунитет обеспечивается совокупностью лимфоидных органов и клеток, которые порой не имеют строго фиксированных анатомических связей, но трудятся весьма согласованно за счет подвижности клеток и тех специфических факторов, которые они синтезируют. На иммунитет работает целая «команда» клеток и белков, действующая красиво, слаженно и надежно. Эта «служба спасения» связана практически со всеми тканями и жидкостями организма. Как только в ее «центр управления» поступает сигнал о появлении агрессора, начинается операция по его обезвреживанию. Это в чем-то подобно современному МЧС, в которое достаточно позвонить по телефону «01», и можно быть уверенным, что возникшая проблема будет быстро и квалифицированно ликвидирована.
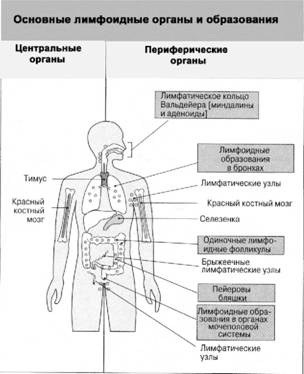 Рис. 3. В центральных лимфоидных органах человека – тимусе и костном мозге – созревают Т– и В-клетки соответственно. В гуморальный и клеточный иммунные ответы вовлечены периферические лимфоидные органы
Рис. 3. В центральных лимфоидных органах человека – тимусе и костном мозге – созревают Т– и В-клетки соответственно. В гуморальный и клеточный иммунные ответы вовлечены периферические лимфоидные органы
Органы иммунной системы разбросаны по всему телу и связаны друг с другом и другими органами сетью лимфатических сосудов подобно кровеносным сосудам. В создании иммунной системы человека принимают участие как центральные органы, в которых иммунные клетки вырабатываются и созревают – костный мозг и вилочковая железа (тимус), так и периферические, где клетки дозревают и «обучаются» – селезенка, лимфатические узлы, лимфоидная ткань и др. (рис. 3). В лимфатических сосудах и лимфоузлах содержится лимфа, которая в отличие от крови представляет собой прозрачную слегка желтоватую жидкость. Греки называли словом лимфа чистую и прозрачную воду подземных ключей и источников.
В сумме в организме взрослого человека содержится примерно 1012 лимфоидных клеток, а лимфоидная ткань составляет приблизительно 2 % общей массы тела. В организме функционирует несколько типов иммунных клеток, которые и осуществляют надзор за порядком в нем. Эти клетки располагаются как непосредственно в лимфоидной системе, так и в отдельных тканях и в крови. Все они имеют общее происхождение, у них один и тот же прародитель. При общности происхождения устройство и функции лимфоидных клеток сильно отличаются. В крови наиболее известные клетки – красные кровяные шарики, или эритроциты, которые заняты переносом кислорода в организме и к иммунной системе не имеют никакого отношения. Кроме того, там «плавает» свыше десятка других видов клеток, некоторые из них упоминаются врачами, когда они нам делают анализ крови. Среди них белые кровяные шарики – лейкоциты. В одном микролитре крови содержится 4–5 миллионов эритроцитов и от 5 до 9 тыс. лейкоцитов. Если все эритроциты довольно похожи друг на друга, то лейкоциты представляют собой весьма неоднородную популяцию клеток. К ним относятся и главные клетки иммунной системы – фагоциты и лимфоциты (их называют еще общим словом иммуноциты).
Фагоциты («пожирающие» клетки) способны связывать на своей поверхности, а затем поглощать и уничтожать самые разнообразные микробы и их токсические продукты. Для этого первоначально, узнав чужеродную клетку или вирус, в наружной мембране фагоцита образуется углубление, которое обволакивает «чужестранца». В конечном итоге «чужак» оказывается в цитоплазме фагоцита, где подвергается массированной атаке разнообразных ферментов, которые его полностью уничтожают. К фагоцитам относятся несколько типов клеток, из которых наиболее важными являются макрофаги. Фагоциты – основа врожденного иммунитета, первая линия защиты против инфекций, проникших в организм.
Около 73 лейкоцитов представляют собой лимфоциты, общее число которых в организме человека составляет около 2х1011. Этим клеткам принадлежит ведущая роль во всех реакциях приобретенного иммунитета, поскольку они специфически распознают конкретный чужеродный агент, пробравшийся в организм. Каждый из лимфоцитов, циркулирующих в крови и лимфе человека, 10–20 раз в сутки проходит через все кровеносные и лимфатические сосуды тела. Популяция лимфоцитов в организме человека также весьма неоднородна. Она состоит из клеток, сильно отличающихся по размерам (от 6 до 10 мкм), структуре и, главное, по функциям. Уже в костном мозге, который является их колыбелью, предшественники лимфоцитов разделяются на две крупные ветви. Одна из них завершает свое развитие в костном мозге и получила название B-лимфоцитов (от первой буквы английского слова bone – кость). Они – основа гуморального иммунитета. B-лимфоциты циркулируют в лимфатической системе и крови и вырабатывают специфические белки-иммуноглобулины (антитела). Именно B-лимфоциты и обеспечивают организм антителами.
Каким же образом антиген, попадая в организм, вызывает усиленный синтез именно тех антител, которые специфично реагируют только с ними? Ответ на этот вопрос дала теория селекции клонов австралийского исследователя Ф. М. Бернета. Согласно этой теории, каждая B-клетка синтезирует лишь один тип антител, которые локализуются на ее поверхности. Репертуар антител формируется в организме задолго до и независимо от встречи с антигеном. У человека разнообразие антител, присутствующих в норме на поверхности многочисленных В-лимфо-цитов, столь велико, что на практике против любого антигена найдется лимфоцит, который способен его «узнать». Роль антигена заключатся лишь в том, чтобы найти ту единственную клетку, которая содержит на своей мембране антитело, реагирующее именно с ним. После такого взаимодействия «узнающие» B-лимфоциты активизируются, начинают быстро размножаться, производить и выпускать в кровь в достаточном количестве нужные для уничтожения антигена антитела (до двух тысяч антител в секунду). Активированный лимфоцит вступает в деление и дифференцировку. И вскоре из одной клетки возникает 500—1000 генетически идентичных клеток (клон). Клон синтезирует один и тот же тип антител, способных специфически распознавать антиген и соединяться с ним.
Антитела атакуют вторгшиеся в нас микробы и другие патогены, расположенные в крови вне клеток, и нейтрализуют их. Здесь реализуется некий принцип избыточности. Многие антитела, содержащиеся на поверхности лимфоцитов, могут быть вообще в течение жизни не востребованы для защиты конкретного индивидуума. Но зато другие всегда начеку. И случись любая инфекция, они сразу готовы к бою. Bажно, что эта система антител не только участвует в уничтожении вторгшегося противника, но и запоминает всех своих врагов, с которыми прежде встречалась. После выздоровления организм может приобретать устойчивость к определенному возбудителю болезни, или, как говорят, приобрести иммунитет.
Что и как защищает нас от внешних врагов?
(иммунная система – основной щит)
Ни один орган, ни одна ткань, ни одна молекула не функционируют независимо от других, и жизнь частей превращается в жизнь целого.
С. Ганеман
Прежде чем продолжить наш рассказ о СПИДе и причинах, его вызывающих, нельзя не сказать несколько слов об основных механизмах устройства защитной системы человека, которая спасает нас на протяжении всей жизни от всевозможных вредных микроорганизмов (в том числе и вирусов) и которая-то в первую очередь «ломается» при СПИДе. Без общего представления о работе этой системы будет трудно понять, что же происходит в организме у больных СПИДом, как осуществляются другие «поломки» и почему все это столь критично для жизни человека, почему при СПИДе неизбежно наступает exitus letalis (смертельный исход).
Наш организм нередко сравнивают с хорошо укрепленной крепостью, все подступы к которой находятся под неусыпным надзором многочисленных защитников. Вообще-то эти защитники весьма сильны, и микробу обычно очень трудно проникнуть внутрь организма.
Первый эшелон обороны представлен кожей и слизистыми оболочками, преодолеть которые, если они не повреждены, многие микроорганизмы не в состоянии (рис. 1). Начнем с кожи, которая покрывает нас с головы до ног. Она не только механически защищает нас, но и обладает специальной системой для самоочищения от микроорганизмов, которые попадают на ее поверхность. Осуществляют это самоочищение сальные и потовые железы, которые выделяют молочные и жирные кислоты.
Чистая кожа лучше самостерилизуется, поскольку в ней лучше работают кожные железы. Например, возбудитель дизентерии, попав на чистую кожу, погибает через 15 минут, а на грязной коже большая часть бактерий и через 30 минут продолжает себя нормально чувствовать.

Общая площадь слизистых оболочек значительно превышает площадь поверхности кожи. Тибетская медицина утверждает, что «рот является воротами всех болезней». И вот микроб с грязных рук попал в рот или в глаз. Здесь он сразу встречается с секретом слюнных или слезных желез. И в слюне, и в слезах содержатся специальные вещества-ферменты, которые губительны для многих микробов (не зря животные вылизывают раны). Если случится, что микроорганизм сумел проскочить ротовую полость, то далее он встречается с еще одним защитником – слизистой оболочкой желудочно-кишечного тракта. В ней также содержатся вещества, губительные для микробов-«пришельцев». В желудке (если микроб туда добрался), он подвергается действию желудочного сока, содержащего соляную кислоту.
Но это еще не все. На нас и внутри нас проживают разнообразные и многочисленные микроорганизмы – «постоянные обитатели», комменсалы, – совокупность которых называют микрофлорой (может быть, лучше было бы их назвать микрофауной). Так, в нашем кишечнике содержится огромное количество микроорганизмов, которые приобрели способность жить там постоянно, не причиняя нам никакого вреда, а, наоборот, чаще всего помогая нашему организму нормально функционировать. «Постоянные обитатели» весьма ревностно относятся к «пришельцам» и, как правило, побеждают их, отвоевывая для себя «место под солнцем» (для «постоянных обитателей» наш кишечник равносилен солнцу, без которого они жить не могут). Здесь действует принцип «микробы против микробов». На нашей коже также существуют «постоянные обитатели», они, например, способны успешно бороться с таким грозным микробом, как возбудитель сибирской язвы. Прижившиеся у нас в верхних дыхательных путях пневмококки успешно справляются с вирусами гриппа. Еще одни ворота для инфекции – влагалище у женщин. Нормальная флора влагалища содержит около шести разных видов бактерий, поддерживающих среду, неблагоприятную для проживания других бактерий. В частности, там «прописан» постоянный обитатель по имени палочка Додерлейна, который занимается глубоким самоочищением влагалища от микробов-«пришельцев».
Из сказанного ясно, что микрофлора человека – еще один важный защитник организма от внешних врагов. Об этом следует помнить, когда бесконтрольно применяются для лечения антибактериальные препараты, такие, например, как антибиотики. При этом развивается так называемый дисбактериоз – разрушение и обеднение нормальной микрофлоры. Недаром еще в позапрошлом веке известный микробиолог И. И. Мечников настоятельно советовал внимательно относиться к микробному «населению» нашего кишечника, вовремя обогащать его полезными микроорганизмами, такими как молочно-кислые бактерии. Сейчас это доступно всем – в любом молочном магазине можно купить кефир с бифидобактериями.
Все выше перечисленные барьеры обусловливают так называемую естественную неспецифическую устойчивость организма, направленную сразу на многие (если не на все) инфекционные агенты.
Но вот, несмотря на многочисленные заслоны, вредный микроорганизм все-таки все преодолел, сумел выжить и стал изнутри разрушать наш организм. Тут и вступает в действие основной щит – наша собственная иммунная система, основная функция которой – распознавание и удаление из организма всего чужеродного – микробов, вирусов, грибков и даже собственных клеток и тканей, если они под действием факторов окружающей среды изменяются и становятся чужеродными. Иммунная система обеспечивает как дополнительный неспецифический, так и строго специфический иммунный ответ. Последний проявляется при попадании микроба во внутреннюю среду организма и мешает развитию только этого конкретного вида микроорганизма.
Немного истории
Сам термин «иммунитет» возник от латинского слова immuni-tas – освобождение, избавление от чего-либо. В медицинскую практику он вошел в XIX в., когда им стали обозначать «освобождение от болезни» (французский словарь Литте, 1869). Но еще задолго до появления самого термина у медиков уже существовало понятие об иммунитете в значении невосприимчивости человека к болезни, которое обозначалось как «самоисцеляющая сила организма» (vis medicatrix naturae) (Гиппократ), «жизненная сила» (Гален) или «залечивающая сила» (Парацельс). Врачам давно была известна присущая людям от рождения невосприимчивость (или, как говорят специалисты, резистентность) к болезням животных (например, куриной холере, чуме собак). Сейчас это называют врожденным (естественным) иммунитетом. С древних времен медики знали, что человек не болеет некоторыми болезнями дважды. Так, еще в IV в. до н. э. Фукидид, описывая чуму в Афинах, отмечал факты, когда те люди, которые чудом выживали, могли ухаживать за больными без риска заболеть вновь. Жизненный опыт показывал, что у людей может возникать стойкая невосприимчивость к повторному заражению после перенесенных тяжелых инфекций, таких, например, как тиф, оспа, скарлатина. Такое явление сегодня называют приобретенным иммунитетом. Это более совершенный механизм защиты организма от биологической агрессии. Он возник в эволюции позже и означает распознавание самых тонких различий между чужеродными агентами.
Лишь в конце XVIII в. произошел первый важный прорыв в практическом использовании накопленных ранее абстрактных представлений об иммунитете. Им стала знаменитая работа англичанина Эдварда Дженнера. Много лет он тщательно изучал разные случаи заболевания человека «коровьей» оспой. В конечном итоге все это навело Дженнера на мысль о возможности практического использования коровьей оспы для защиты человека от такого страшного заболевания, как натуральная оспа. Будучи убежденным, что такая форма искусственного заражения человека – безвредный способ предотвращения тяжелой болезни, которой является оспа, он в 1796 г. провел первый успешный эксперимент на человеке. Результат превзошел все ожидания! Подробнее мы еще поговорим об этом, когда речь пойдет о вакцинах. Но для справедливости заметим, что в Китае и Индии прививку оспы практиковали еще за несколько столетий до ее введения в Европе. Болячками переболевшего оспой человека расцарапывали кожу здорового человека, который обычно после этого переносил инфекцию в слабой, не смертельной форме, после чего выздоравливал и оставался устойчивым к последующим заражениям оспой.
Однако существовавшие эмпирические знания и даже успех Дженнера, за который он получил довольно большую денежную премию от Британского парламента, долгое время не находили своего полного объяснения, и природа иммунитета оставалась загадкой за семью печатями.
Спустя почти 100 лет открытый Э. Дженнером факт лег в основу дальнейших экспериментов Л. Пастера на куриной холере, завершившихся формулировкой принципа профилактики от инфекционных заболеваний – принцип иммунизации ослабленными или убитыми возбудителями (1881 г.). Чуть позднее (в 1890 г.) Эмиль фон Беринг сообщил, что после введения в организм животного не целых дифтерийных бактерий, а всего лишь некоего токсина, выделенного из них, в крови появляется нечто, способное нейтрализовать или разрушать токсин и тем самым предотвращать само заболевание, вызываемое целой бактерией. Более того, оказалось, что приготовленные из крови таких животных препараты (их назвали сыворотками) исцеляли детей, уже больных дифтерией. Вещество, которое нейтрализовало токсин и появлялось в крови только в его присутствии, получило название антитоксина. В дальнейшем это и подобные ему вещества стали называть общим термином – антитела. А тот агент, который вызывает образование этих антител, стали называть антигеном. За эти работы Эмиль фон Беринг был удостоен в 1901 г. Нобелевской премии по физиологии и медицине. (Хотелось бы отметить, что термин «антиген» сегодня кажется крайне неудачным, поскольку по смыслу он может быть применен к некоему агенту, направленному против гена. Но термин «прижился», и, по всей видимости, никуда теперь от него не уйти. Еще наши предки подметили: Multa sunt in moribus dissentanea, multa sine ratione – в обычаях много несообразного, много неразумного.) В дальнейшем П. Эрлих разработал на этой базе теорию гуморального иммунитета (т. е. иммунитета, обеспечиваемого антителами, которые, продвигаясь по жидким внутренним средам организма, такими как кровь и лимфа (от лат. humor – жидкость), поражают чужеродные тела на любом расстоянии от лимфоцита, который их производит.
Если с антигеном все было более или менее ясно почти с самого начала, то, чтобы понять природу антител, потребовалось еще более полувека, пока Арне Тизелиус (Нобелевская премия по химии за 1948 г.) не показал, что это всего лишь обычные белки, но с очень большим молекулярным весом. Химическую структуру антител расшифровали Джералд Морис Эдельман (США) и Родни Роберт Портер (Великобритания), за что они оба получили Нобелевскую премию в 1972 г. В конечном итоге было установлено, что каждое антитело (они еще называются иммуноглобулинами) состоит из четырех белков – двух легких цепей и двух тяжелых цепей. Такая структура в электронном микроскопе по своему виду напоминает «рогатку» (рис. 2). Часть молекулы антитела, которая связывается с антигеном, очень изменчива, поэтому ее называют вариабельной. Эта область содержится на самом кончике антитела, поэтому защитную молекулу иногда сравнивают с пинцетом, ухватывающим с помощью острых концов мельчайшие детали самого замысловатого часового механизма. Активный центр распознает в молекуле антигена небольшие участки, состоящие обычно из 4–8 аминокислот. Эти участки антигена подходят к структуре антитела, «как ключ к замку». «Родственные объятия» антител с антигеном (микробом) редко кончаются для последнего благополучно. Если даже антитела не могут с ним справиться самостоятельно, на помощь им придут другие компоненты, и в первую очередь специальные «клетки-пожиратели».
Значительно позднее, японец Сусумо Тонегава, основываясь на достижении Эдельмана и Портера, показал то, что никто в принципе не мог даже ожидать: те гены в геноме, которые отвечают за синтез антител, в отличие от всех других генов человека, обладают потрясающей способностью – многократно изменять свою структуру в отдельных клетках человека в течение его жизни. При этом они, варьируя в своей структуре, перераспределяются так, что потенциально готовы обеспечить производство нескольких сотен миллионов различных белков-антител, т. е. намного больше теоретического количества, потенциально действующих на человеческий организм извне чужеродных веществ – антигенов. В 1987 г. С. Тонегаве была присуждена Нобелевская премия по физиологии и медицине «за открытие генетических принципов генерации антител».
Параллельно с создателем теории гуморального иммунитета Эрлихом в те же годы наш соотечественник И. И. Мечников («поэт микробиологии», по образному определению Эмиля Ру) создавал учение о невосприимчивости (иммунитете), разработав теорию фагоцитоза и обосновав фагоцитарную теорию иммунитета. Он доказал, что у животных и человека существуют специальные клетки, —

фагоциты (или «пожирающие» клетки), – способные поглощать и разрушать патогенные микроорганизмы и другой генетически чужеродный материал, волею судьбы оказавшийся в нашем организме. Осуществляемый фагоцитами процесс – фагоцитоз – был известен ученым с 1862 г. по работам Э. Геккеля, но только Мечников первым связал фагоцитоз с защитной функцией иммунной системы. В последующей многолетней и плодотворной дискуссии между сторонниками фагоцитарной и гуморальной теорий были раскрыты многие механизмы иммунитета. Спор между Мечниковым и Эрлихом привлек интерес не только ученых, но и широкой публики. Бернард Шоу даже написал на эту тему пьесу под названием «Врач на распутье». Фагоцитоз, открытый Мечниковым, получил в дальнейшем название клеточного иммунитета, а антителообразование, обнаруженное Эрлихом, – гуморального иммунитета. Все завершилось тем, что оба ученых были признаны мировой научной общественностью и разделили между собой Нобелевскую премию по физиологии и медицине за 1908 г.
Это были первые Нобелевские премии по зарождавшейся в те годы новой науке иммунологии, а всего за XX в. около 30 ученых стали Нобелевскими лауреатами по иммунологии и близким к иммунологии областям. В результате работ всех этих исследователей наши знания о защитной системе постоянно расширялись, дополнялись и уточнялись. Так постепенно складывалось современное представление об иммунной системе животного организма и тончайших механизмах ее функционирования. Нынешним людям трудно осознать, насколько каждый из нас, ныне живущих, обязан французу Пастеру, русскому Мечникову, немцу Берингу и другим ученым, раскрывшим тайны инфекционных болезней и иммунитета. До XIX в. средняя продолжительность жизни в Европе составляла немногим более 30 лет. Если принять во внимание, что теперь она в большинстве развитых стран более 60 лет, то выходит, что перечисленные выше труженики науки подарили всем нам по меньшей мере вторую жизнь!
Благодаря наличию иммунной системы организм защищен от большинства болезнетворных микроорганизмов (вирусов, бактерий, грибков, простейших, гельминтов) и токсических продуктов их жизнедеятельности. Иммунитет также защищает организм от воздействия различных веществ, обладающих чужеродными свойствами (например, растительных и животных ядов), от развития опухолевых клеток. Кроме того, иммунитет определяет исход трансплантации органов и тканей, в том числе переливания крови, контролирует внутриутробное развитие плода и процессы старения. Таким образом, иммунитет направлен на защиту организма, поддержание его целостности и индивидуальности.
Сегодня мы знаем, что иммунная система нашего организма, наш главный щит, многослойна. Она, как и другие системы организма, состоит из органов и клеток. Иммунитет обеспечивается совокупностью лимфоидных органов и клеток, которые порой не имеют строго фиксированных анатомических связей, но трудятся весьма согласованно за счет подвижности клеток и тех специфических факторов, которые они синтезируют. На иммунитет работает целая «команда» клеток и белков, действующая красиво, слаженно и надежно. Эта «служба спасения» связана практически со всеми тканями и жидкостями организма. Как только в ее «центр управления» поступает сигнал о появлении агрессора, начинается операция по его обезвреживанию. Это в чем-то подобно современному МЧС, в которое достаточно позвонить по телефону «01», и можно быть уверенным, что возникшая проблема будет быстро и квалифицированно ликвидирована.

Органы иммунной системы разбросаны по всему телу и связаны друг с другом и другими органами сетью лимфатических сосудов подобно кровеносным сосудам. В создании иммунной системы человека принимают участие как центральные органы, в которых иммунные клетки вырабатываются и созревают – костный мозг и вилочковая железа (тимус), так и периферические, где клетки дозревают и «обучаются» – селезенка, лимфатические узлы, лимфоидная ткань и др. (рис. 3). В лимфатических сосудах и лимфоузлах содержится лимфа, которая в отличие от крови представляет собой прозрачную слегка желтоватую жидкость. Греки называли словом лимфа чистую и прозрачную воду подземных ключей и источников.
В сумме в организме взрослого человека содержится примерно 1012 лимфоидных клеток, а лимфоидная ткань составляет приблизительно 2 % общей массы тела. В организме функционирует несколько типов иммунных клеток, которые и осуществляют надзор за порядком в нем. Эти клетки располагаются как непосредственно в лимфоидной системе, так и в отдельных тканях и в крови. Все они имеют общее происхождение, у них один и тот же прародитель. При общности происхождения устройство и функции лимфоидных клеток сильно отличаются. В крови наиболее известные клетки – красные кровяные шарики, или эритроциты, которые заняты переносом кислорода в организме и к иммунной системе не имеют никакого отношения. Кроме того, там «плавает» свыше десятка других видов клеток, некоторые из них упоминаются врачами, когда они нам делают анализ крови. Среди них белые кровяные шарики – лейкоциты. В одном микролитре крови содержится 4–5 миллионов эритроцитов и от 5 до 9 тыс. лейкоцитов. Если все эритроциты довольно похожи друг на друга, то лейкоциты представляют собой весьма неоднородную популяцию клеток. К ним относятся и главные клетки иммунной системы – фагоциты и лимфоциты (их называют еще общим словом иммуноциты).
Фагоциты («пожирающие» клетки) способны связывать на своей поверхности, а затем поглощать и уничтожать самые разнообразные микробы и их токсические продукты. Для этого первоначально, узнав чужеродную клетку или вирус, в наружной мембране фагоцита образуется углубление, которое обволакивает «чужестранца». В конечном итоге «чужак» оказывается в цитоплазме фагоцита, где подвергается массированной атаке разнообразных ферментов, которые его полностью уничтожают. К фагоцитам относятся несколько типов клеток, из которых наиболее важными являются макрофаги. Фагоциты – основа врожденного иммунитета, первая линия защиты против инфекций, проникших в организм.
Около 73 лейкоцитов представляют собой лимфоциты, общее число которых в организме человека составляет около 2х1011. Этим клеткам принадлежит ведущая роль во всех реакциях приобретенного иммунитета, поскольку они специфически распознают конкретный чужеродный агент, пробравшийся в организм. Каждый из лимфоцитов, циркулирующих в крови и лимфе человека, 10–20 раз в сутки проходит через все кровеносные и лимфатические сосуды тела. Популяция лимфоцитов в организме человека также весьма неоднородна. Она состоит из клеток, сильно отличающихся по размерам (от 6 до 10 мкм), структуре и, главное, по функциям. Уже в костном мозге, который является их колыбелью, предшественники лимфоцитов разделяются на две крупные ветви. Одна из них завершает свое развитие в костном мозге и получила название B-лимфоцитов (от первой буквы английского слова bone – кость). Они – основа гуморального иммунитета. B-лимфоциты циркулируют в лимфатической системе и крови и вырабатывают специфические белки-иммуноглобулины (антитела). Именно B-лимфоциты и обеспечивают организм антителами.
Каким же образом антиген, попадая в организм, вызывает усиленный синтез именно тех антител, которые специфично реагируют только с ними? Ответ на этот вопрос дала теория селекции клонов австралийского исследователя Ф. М. Бернета. Согласно этой теории, каждая B-клетка синтезирует лишь один тип антител, которые локализуются на ее поверхности. Репертуар антител формируется в организме задолго до и независимо от встречи с антигеном. У человека разнообразие антител, присутствующих в норме на поверхности многочисленных В-лимфо-цитов, столь велико, что на практике против любого антигена найдется лимфоцит, который способен его «узнать». Роль антигена заключатся лишь в том, чтобы найти ту единственную клетку, которая содержит на своей мембране антитело, реагирующее именно с ним. После такого взаимодействия «узнающие» B-лимфоциты активизируются, начинают быстро размножаться, производить и выпускать в кровь в достаточном количестве нужные для уничтожения антигена антитела (до двух тысяч антител в секунду). Активированный лимфоцит вступает в деление и дифференцировку. И вскоре из одной клетки возникает 500—1000 генетически идентичных клеток (клон). Клон синтезирует один и тот же тип антител, способных специфически распознавать антиген и соединяться с ним.
Антитела атакуют вторгшиеся в нас микробы и другие патогены, расположенные в крови вне клеток, и нейтрализуют их. Здесь реализуется некий принцип избыточности. Многие антитела, содержащиеся на поверхности лимфоцитов, могут быть вообще в течение жизни не востребованы для защиты конкретного индивидуума. Но зато другие всегда начеку. И случись любая инфекция, они сразу готовы к бою. Bажно, что эта система антител не только участвует в уничтожении вторгшегося противника, но и запоминает всех своих врагов, с которыми прежде встречалась. После выздоровления организм может приобретать устойчивость к определенному возбудителю болезни, или, как говорят, приобрести иммунитет.
