Страница:
У больных, перенесших резекцию значительной части подвздошной кишки, происходит нарушение всасывания желчных кислот и поступление их в большом количестве в толстую кишку, что способствует увеличению проницаемости слизистой оболочки и усиленному поступлению в просвет кишки воды и электролитов, возникновению диареи. При нарушении всасывания жиров в тонкой кишке жирные кислоты, так же как и желчные, стимулируют секреторную функцию толстой кишки, что может вызвать диарею у больных с указанным синдромом. Представление, что усиление моторики толстой кишки вызывает только диарею, ошибочно. Может наблюдаться противоположная ситуация: интенсификация непропульсивных сокращений приводит к запорам. В качестве примера можно привести спастические запоры, часто сопровождающие так называемый «синдром раздраженной кишки». И наоборот, ослабление сократительной деятельности толстой кишки может вызывать диарею в связи с отсутствием резистентности, обусловленной сегментарными сокращениями. В то же время известны заболевания толстой кишки, при которых диарея связана с более частыми пропульсивными сокращениями (например, язвенный колит, хроническое воспаление толстой кишки).
С нарушением моторно-эвакуаторной функции толстой кишки связан еще один клинический синдром – запор. В клинической гастроэнтерологии запор представляет собой одну из трудных медицинских проблем, особенно, когда это хронический запор. Запором называют медленное, затрудненное, редкое или систематически неполное опорожнение кишечника. Если у большинства здоровых людей (примерно у 70–75 %) наблюдается, как правило, ежедневный оформленный стул, то при хроническом запоре стул бывает реже, чем один раз в двое суток, а более 25 % времени акта дефекации больной вынужден напрягаться; при этом кал приобретает твердую консистенцию, становится сухим и фрагментарным. Вместе с тем иногда при хроническом запоре возможно и несколько дефекаций в течение дня, но при этом каждый раз с большим трудом выделяется лишь небольшое количество твердых каловых масс, что сопровождается ощущением неполного опорожнения прямой кишки.
В числе наиболее частых причин хронического запора должны быть названы:
1) расстройства моторики (дискинезии) толстой кишки;
2) ослабление естественных позывов на дефекацию (расстройство условно-рефлекторных процессов регуляции);
3) изменение анатомической структуры толстой кишки или окружающих ее органов, препятствующие нормальному продвижению каловых масс;
4) несоответствие между емкостью толстой кишки и объемом кишечного содержимого, в частности, длительная задержка кала в удлиненных или расширенных отрезках толстой кишки (при долихосигме, долихоколон, мегаколон).
Исследования показали, что двигательные нарушения толстой кишки, приводящие к хроническим запорам, многообразны. При этом в начальный период доминируют расстройства гипермоторного типа, а затем происходит постепенное снижение перистальтической активности и тонуса толстой кишки.
Другой причиной хронического запора является нарушение функций аноректального отдела толстой кишки с ослаблением позывов на дефекацию. Существуют два анальных сфинктера: внутренний, состоящий из гладкомышечных элементов, и наружный, состоящий из поперечно-полосатых мышечных волокон. Вне акта дефекации они тонически сокращены.
Механизм акта дефекации складывается из:
1) непроизвольных сокращений гладких мышечных волокон сигмовидной и прямой кишок с одновременным расслаблением анальных сфинктеров (аносигмоидный рефлекс);
2) произвольного спирального продвижения каловых масс из сигмы в ампулу прямой кишки, а также полупроизвольно-полунепроизвольного сокращения мышцы, поднимающей задний проход синхронно с расслаблением анальных сфинктеров.
Вспомогательную роль в акте дефекации играют опущение диафрагмы при глубоком вдохе и сокращение мышц брюшного пресса при натуживании.
За счет перистальтики сигмовидной кишки каловые массы перемещаются в ампулу прямой кишки, повышая давление в ней до 20–30 мм вод. ст., что вызывает ощущение ее наполненности. При давлении 40–50 мм вод. ст. происходит акт дефекации, при котором опорожняются не только прямая кишка, но и сигмовидная, а иногда и нисходящая ободочная кишка, вплоть до селезеночного угла.
Нарушение координации всех составляющих акта дефекации вызывает его расстройство и приводит к копростазу. Чаще всего изгнание (эвакуация) каловых масс, скопившихся в прямой кишке, нарушается за счет снижения способности внутреннего и наружного анальных сфинктеров к расслаблению, а также из-за понижения чувствительности рецепторного аппарата прямой кишки к давлению калового «столба».
Позывы на дефекацию контролируются корой головного мозга при участии соответствующих «центров дефекации» в продолговатом мозге. Этим в значительной степени определяется возможная роль психических воздействий в развитии психогенных форм функционального запора. При хроническом запоре у 50–60 % больных отсутствуют нормальные позывы к дефекации (позывы «на низ»). Среди внешних (экзогенных) причин угнетения нормальных позывов «на низ» следует назвать:
1) сознательное подавление естественного рефлекса к опорожнению кишечника из-за непривычной обстановки или неблагоприятных условий для дефекации;
2) нарушение привычного суточного ритма дефекации (сменная работа, служебные командировки, иные особенности жизни и труда);
3) ряд субъективных факторов и особенностей личности (повышенная брезгливость из-за антисанитарных условий в общественных туалетах; чувство стыдливости или неловкости при появлении необходимости пользоваться туалетом в присутствии других людей).
При этом каловые массы задерживаются уже в ампуле прямой кишки, что получило название дисхезии. При частом повторении подобных ситуаций со временем может развиться привычный хронический запор, который относится к категории неврогенных или психогенных хронических запоров.
Рефлекторные формы хронического запора нередко сопровождают заболевания органов пищеварения (хронический холецистит, язвенная болезнь двенадцатиперстной кишки), развиваясь под воздействием висцеро-висцерального рефлекторного механизма, особенно часто у женщин и пожилых людей. Рефлекторный запор наблюдается также при почечнокаменной болезни, протекающей с приступами почечной колики, при рецидивирующем течении хронического аднексита, при ряде других заболеваний.
Хронический запор неврогенного происхождения может осложнить течение распространенного церебрального атеросклероза, паркинсонизма, хронической вертебробазилярной недостаточности, ишемического гемодинамического расстройства. Запоры развиваются при хронической правожелудочковой сердечной недостаточности, циррозе печени с портальной гипертензией в отечно-асцитической стадии, как следствие венозного застоя, гипоксии тканевых структур толстой кишки, водно-электролитных расстройств. В ряде случаев причиной хронических запоров становятся различные эндогенные и экзогенные хронические интоксикации. Из эндогенных интоксикаций имеют значение почечная и печеночная недостаточности, перемежающаяся порфирия, длительная гипербилирубинемия и ряд других, вызывающих токсический хронический запор. Из экзогенных интоксикаций следует упомянуть хронические профессиональные отравления свинцом, ртутью, таллием, висмутом, а также морфинизм и никотинизм.
В развитии функциональных форм хронических запоров важная роль отводится алиментарным факторам – недостаточному содержанию в рационе пищевых волокон, выполняющих специфические функции в обмене веществ и стимуляции пассажа кишечного содержимого.
Поджелудочная железа
Патофизиология
Билиарный тракт
С нарушением моторно-эвакуаторной функции толстой кишки связан еще один клинический синдром – запор. В клинической гастроэнтерологии запор представляет собой одну из трудных медицинских проблем, особенно, когда это хронический запор. Запором называют медленное, затрудненное, редкое или систематически неполное опорожнение кишечника. Если у большинства здоровых людей (примерно у 70–75 %) наблюдается, как правило, ежедневный оформленный стул, то при хроническом запоре стул бывает реже, чем один раз в двое суток, а более 25 % времени акта дефекации больной вынужден напрягаться; при этом кал приобретает твердую консистенцию, становится сухим и фрагментарным. Вместе с тем иногда при хроническом запоре возможно и несколько дефекаций в течение дня, но при этом каждый раз с большим трудом выделяется лишь небольшое количество твердых каловых масс, что сопровождается ощущением неполного опорожнения прямой кишки.
В числе наиболее частых причин хронического запора должны быть названы:
1) расстройства моторики (дискинезии) толстой кишки;
2) ослабление естественных позывов на дефекацию (расстройство условно-рефлекторных процессов регуляции);
3) изменение анатомической структуры толстой кишки или окружающих ее органов, препятствующие нормальному продвижению каловых масс;
4) несоответствие между емкостью толстой кишки и объемом кишечного содержимого, в частности, длительная задержка кала в удлиненных или расширенных отрезках толстой кишки (при долихосигме, долихоколон, мегаколон).
Исследования показали, что двигательные нарушения толстой кишки, приводящие к хроническим запорам, многообразны. При этом в начальный период доминируют расстройства гипермоторного типа, а затем происходит постепенное снижение перистальтической активности и тонуса толстой кишки.
Другой причиной хронического запора является нарушение функций аноректального отдела толстой кишки с ослаблением позывов на дефекацию. Существуют два анальных сфинктера: внутренний, состоящий из гладкомышечных элементов, и наружный, состоящий из поперечно-полосатых мышечных волокон. Вне акта дефекации они тонически сокращены.
Механизм акта дефекации складывается из:
1) непроизвольных сокращений гладких мышечных волокон сигмовидной и прямой кишок с одновременным расслаблением анальных сфинктеров (аносигмоидный рефлекс);
2) произвольного спирального продвижения каловых масс из сигмы в ампулу прямой кишки, а также полупроизвольно-полунепроизвольного сокращения мышцы, поднимающей задний проход синхронно с расслаблением анальных сфинктеров.
Вспомогательную роль в акте дефекации играют опущение диафрагмы при глубоком вдохе и сокращение мышц брюшного пресса при натуживании.
За счет перистальтики сигмовидной кишки каловые массы перемещаются в ампулу прямой кишки, повышая давление в ней до 20–30 мм вод. ст., что вызывает ощущение ее наполненности. При давлении 40–50 мм вод. ст. происходит акт дефекации, при котором опорожняются не только прямая кишка, но и сигмовидная, а иногда и нисходящая ободочная кишка, вплоть до селезеночного угла.
Нарушение координации всех составляющих акта дефекации вызывает его расстройство и приводит к копростазу. Чаще всего изгнание (эвакуация) каловых масс, скопившихся в прямой кишке, нарушается за счет снижения способности внутреннего и наружного анальных сфинктеров к расслаблению, а также из-за понижения чувствительности рецепторного аппарата прямой кишки к давлению калового «столба».
Позывы на дефекацию контролируются корой головного мозга при участии соответствующих «центров дефекации» в продолговатом мозге. Этим в значительной степени определяется возможная роль психических воздействий в развитии психогенных форм функционального запора. При хроническом запоре у 50–60 % больных отсутствуют нормальные позывы к дефекации (позывы «на низ»). Среди внешних (экзогенных) причин угнетения нормальных позывов «на низ» следует назвать:
1) сознательное подавление естественного рефлекса к опорожнению кишечника из-за непривычной обстановки или неблагоприятных условий для дефекации;
2) нарушение привычного суточного ритма дефекации (сменная работа, служебные командировки, иные особенности жизни и труда);
3) ряд субъективных факторов и особенностей личности (повышенная брезгливость из-за антисанитарных условий в общественных туалетах; чувство стыдливости или неловкости при появлении необходимости пользоваться туалетом в присутствии других людей).
При этом каловые массы задерживаются уже в ампуле прямой кишки, что получило название дисхезии. При частом повторении подобных ситуаций со временем может развиться привычный хронический запор, который относится к категории неврогенных или психогенных хронических запоров.
Рефлекторные формы хронического запора нередко сопровождают заболевания органов пищеварения (хронический холецистит, язвенная болезнь двенадцатиперстной кишки), развиваясь под воздействием висцеро-висцерального рефлекторного механизма, особенно часто у женщин и пожилых людей. Рефлекторный запор наблюдается также при почечнокаменной болезни, протекающей с приступами почечной колики, при рецидивирующем течении хронического аднексита, при ряде других заболеваний.
Хронический запор неврогенного происхождения может осложнить течение распространенного церебрального атеросклероза, паркинсонизма, хронической вертебробазилярной недостаточности, ишемического гемодинамического расстройства. Запоры развиваются при хронической правожелудочковой сердечной недостаточности, циррозе печени с портальной гипертензией в отечно-асцитической стадии, как следствие венозного застоя, гипоксии тканевых структур толстой кишки, водно-электролитных расстройств. В ряде случаев причиной хронических запоров становятся различные эндогенные и экзогенные хронические интоксикации. Из эндогенных интоксикаций имеют значение почечная и печеночная недостаточности, перемежающаяся порфирия, длительная гипербилирубинемия и ряд других, вызывающих токсический хронический запор. Из экзогенных интоксикаций следует упомянуть хронические профессиональные отравления свинцом, ртутью, таллием, висмутом, а также морфинизм и никотинизм.
В развитии функциональных форм хронических запоров важная роль отводится алиментарным факторам – недостаточному содержанию в рационе пищевых волокон, выполняющих специфические функции в обмене веществ и стимуляции пассажа кишечного содержимого.
Поджелудочная железа
После эвакуации из желудка в тонкую кишку пища подвергается наиболее интенсивному перевариванию. Чрезвычайно важную роль в этом процессе играет поджелудочная железа, точнее – ее секреты. Главные компоненты панкреатического сока – это бикарбонат, создающий щелочную среду и нейтрализующий кислый желудочный химус в двенадцатиперстной кишке до pH 6–8 (такой диапазон pH необходим для панкреатических ферментов), и пищеварительные ферменты, расщепляющие основные компоненты пищи.
Поджелудочная железа является экзокринным (секретирующим) и одновременно эндокринным (инкретирующим) органом, участвующим в пищеварении, в регуляции обмена, а также других органов и систем.
Поджелудочная железа, масса которой составляет примерно 110 г, выделяет в сутки от 1,5 до 2,5 л сока. Сок изотоничен плазме крови (независимо от стимуляции), содержит ряд электролитов и солей, а также пищеварительные ферменты. Основные анионы сока – С1- и НСО-, катионы – Na+ и К+ Кроме того, в соке присутствуют катионы Са2+, Mg2+ и анионы НРО При стимуляции концентрация катионов остается без изменений, а анионов меняется в противоположных направлениях. При максимальной секреции концентрация НСОз составляет 130–140 ммоль/л, а pH – 8,2.
Экзокринная функция поджелудочной железы имеет исключительно важное значение для пищеварения. Под влиянием психических, алиментарных, гуморальных и других раздражителей клетки ацинусов поджелудочной железы синтезируют и выделяют в двенадцатиперстную кишку более 20 проферментов и ферментов (главным образом гидролаз), которые участвуют в расщеплении в кишечнике различных составных частей пищи. Пищеварительные ферменты составляют около 90 % белков панкреатического сока. Эту функцию поджелудочной железы называют экболической в отличие от второй экзокринной функции – гидрокинетической, заключающейся в секреции воды, бикарбонатов (до 150 ммоль/л) и других электролитов. Гидрокинетическая функция поджелудочной железы обеспечивает нейтрализацию кислого желудочного содержимого и создает в кишечнике щелочную среду, оптимальную для действия панкреатических и кишечных ферментов.
Панкреатические ферменты подразделяются на амилолитические (гидролиз крахмала), протеолитические (гидролиз белков), липолитические (гидролиз жиров) и нуклеолитические (гидролиз нуклеиновых кислот).
Амилолитические ферменты — амилазы. Расщепление крахмала начинает α-амилаза, состоящая из нескольких изоферментов, и составляющая примерно 20 % белков в панкреатическом секрете. Основное количество этого фермента выделяется поджелудочной железой в активном виде. Сходный изофермент синтезируется слюнными железами, α-Амилаза расщепляет полисахариды (крахмал, гликоген) до декстринов, мальтоолигосахаридов, мальтозы и незначительного количества глюкозы. Указанные полимеры далее превращаются в глюкозу кишечными ферментами – мальтазой, γ-амилазой, изомальтазой.
Липолитические ферменты – липазы. Липолиз осуществляется панкреатическими ферментами, однако диагностическое значение в настоящее время имеет лишь липаза (гидролизует триглицериды). Из панкреатического сока выделена еще фосфолипаза (гидролиз фосфолипидов, лецитина) и карбоксил-эстераза (гидролиз эфиров жирных кислот). Поджелудочная железа выделяет основное количество липазы (немного липазы содержится также в слюне и кишечном соке), расщепляющей триглицериды до моноглицеридов и жирных кислот, которые проходят через мембрану энтероцита. Липаза гидролизует водонерастворимый субстрат, что возможно лишь на поверхности мелких эмульгированных частиц жира. Одинаковые количества фермента проявляют различную активность в зависимости от качества эмульсии: чем она тоньше, тем выше активность фермента. Липаза активна в тонкой кишке в присутствии желчных кислот, которые способствуют эмульгированию жиров.
Протеолитические ферменты — протеазы. В панкреатическом соке их много (эндопептидазы – трипсин, химотрипсин, эластаза, экзопептидазы – карбоксипептидазы А и Б). Они относятся к группе сериновых протеаз и составляют 44 % от общего белка панкреатического сока. Существуют множественные формы трипсина и химотрипсина, как и желудочных пепсинов. Ацинарные клетки не синтезируют активные протеолитические ферменты (это грозило бы самоперевариванием органа). Они выделяются в виде неактивных проферментов, которые активируются в кишке. Первым активируется трипсиноген. Под действием кишечного фермента энтерокиназы он превращается в трипсин, а затем активные молекулы трипсина обеспечивают активацию других протеолитических ферментов, включая трипсиноген (процесс активации продолжается уже аутокаталитически).
С панкреатическим соком выделяются фактически два трипсиногена, составляющие около 19 % всех его белков, два химотрипсиногена и две проэластазы. Все они называются эндопептидазами, так как при гидролизе белков «разрывают» внутренние связи между аминокислотами в середине их цепей, продуцируя пептиды. Эндопептидазы специфичны. Например, трипсин гидролизует лишь связи справа от лизина или аргинина, химотрипсин – в основном те, которые рядом с фенилаланином, тирозином и триптофаном. Эластаза способна гидролизовать эластин, белок соединительной ткани, а также другие белки. В отличие от эндопептидаз экзопептидазы разрывают в пептидных цепях С-терминальную, т. е. конечную, связь (карбоксипептидазы) или первую, N-терминаль-ную (аминопептидазы), «освобождая», таким образом, аминокислоты одну за другой.
В панкреатическом соке присутствует ингибитор трипсина – неферментный белок, тесно связанный с протеолизом. Его физиологическое значение заключается в предотвращении преждевременной активации трипсина в протоках поджелудочной железы. Определение его активности в сыворотке крови в динамике имеет значение, свидетельствующее о воспалительно-деструктивных процессах органа при гиперферментемии (синдром «уклонения ферментов»).
Калликреин является протеолитическим ферментом поджелудочной железы. Активированный трипсином, он отвечает за образование в крови каллидина, гипотензивного полипептида, идентичного брадикинину, одному из нейровазоактивных пептидов.
Нуклеолитические ферменты — нуклеазы. Принадлежат к фосфодиэстеразам. В панкреатическом соке они представлены рибонуклеазой, гидролизующей рибонуклеиновую кислоту, и дезоксирибонуклеазой, расщепляющей дезоксирибонуклеиновую кислоту.
Количество и ферментативная активность панкреатического сока зависят от количества и состава принятой пищи. Вне пищеварения, натощак, поджелудочный сок выделяется в небольших количествах. Секрецию панкреатического сока вызывает объемная и стимулирующая желудочное кислотообразование пища. Твердая, густая и жирная пища долго задерживается в желудке (медленнее эвакуируется), поэтому секреция поджелудочной железы дольше, чем после приема жидкой пищи. Основная секреция, однако, начинается в кишечной фазе, т. е. после попадания пищи и продуктов ее переваривания в двенадцатиперстную кишку.
Секреция поджелудочного сока усиливается через 2–3 мин после приема пищи и продолжается 6-14 ч (с максимальным выделением сока на 90-й минуте) в зависимости от ее состава. Смешанная пища вызывает больший секреторный ответ, чем отдельные продукты. Нейтральные жиры и продукты их переваривания больше всего стимулируют продуцирующие ферменты клетки поджелудочной железы. Белки также довольно сильный стимулятор секреции ферментов, в меньшей мере – бикарбонатов и жидкой части панкреатического сока. Поступление аминокислот в кишку вызывает значительное повышение в крови уровня гормона – холецистокинина (прежние названия – панкреозимин, холецистокинин-панкреозимин), местного стимулятора ферментсинтезирующей деятельности ацинарных клеток поджелудочной железы. Особенно сильно влияют фенилаланин, холин, метионин и другие незаменимые аминокислоты.
Преобладание углеводов в питании «щадит» поджелудочную железу, что необходимо учитывать при обострении хронического панкреатита. Малоконцентрированные растворы глюкозы и сахарозы, введенные в двенадцатиперстную кишку, вызывают кратковременную и небольшую стимуляцию секреции α-амилазы, а концентрированные растворы – резкое угнетение экзокринной секреции.
Соляная кислота является сильным естественным стимулятором внешней секреции поджелудочной железы. Все напитки и продукты, которые возбуждают аппетит, наряду с секрецией желудка усиливают секрецию поджелудочной железы. Так, выраженным сокогонным действием обладают некоторые фруктовые и органические кислоты (яблочная, лимонная, винная, молочная), а также алкоголь.
Зависимость ферментного состава сока поджелудочной железы от качества пищи хорошо известна. Находящиеся в ацинарных клетках гранулы содержат все ферменты, присутствующие в секрете, в постоянном соотношении, так что в панкреатическом соке оно также постоянно. Однако увеличение в пище доли какого-либо компонента рациона (например, белков) постепенно увеличивает синтез соответствующих гидролизующих ферментов. Эта адаптация к диете дала возможность обсуждать вопрос о возможности диетического излечения некоторых дисфункций поджелудочной железы.
Секреция поджелудочной железы регулируется нервными и гуморальными механизмами. В стимуляции панкреатической секреции прямые нервные влияния имеют меньшее значение, чем гуморальные. Ведущее значение в гуморальной регуляции секреции поджелудочной железы принадлежит гастроинтестинальным гормонам. Они относятся к числу пептидов и синтезируются специальными клетками желудка и двенадцатиперстной кишки под влиянием соответствующих химических, механических, нервных или иных стимулирующих факторов.
Секрецию поджелудочной железы усиливают секретин, холецистокинин, а также гастрин, серотонин, инсулин, бомбезин, субстанция П и соли желчных кислот. Тормозят выделение поджелудочного сока глюкагон, кальцитонин, ЖИП, ПП, соматостатин. ВИП может возбуждать и тормозить панкреатическую секрецию. Эффекты гормонов частично опосредуются через их влияние на желудочную секрецию: с усилением ее более кислое содержимое поступает в двенадцатиперстную кишку и посредством ее гормонов повышает панкреатическую секрецию.
Поджелудочная железа является экзокринным (секретирующим) и одновременно эндокринным (инкретирующим) органом, участвующим в пищеварении, в регуляции обмена, а также других органов и систем.
Поджелудочная железа, масса которой составляет примерно 110 г, выделяет в сутки от 1,5 до 2,5 л сока. Сок изотоничен плазме крови (независимо от стимуляции), содержит ряд электролитов и солей, а также пищеварительные ферменты. Основные анионы сока – С1- и НСО-, катионы – Na+ и К+ Кроме того, в соке присутствуют катионы Са2+, Mg2+ и анионы НРО При стимуляции концентрация катионов остается без изменений, а анионов меняется в противоположных направлениях. При максимальной секреции концентрация НСОз составляет 130–140 ммоль/л, а pH – 8,2.
Экзокринная функция поджелудочной железы имеет исключительно важное значение для пищеварения. Под влиянием психических, алиментарных, гуморальных и других раздражителей клетки ацинусов поджелудочной железы синтезируют и выделяют в двенадцатиперстную кишку более 20 проферментов и ферментов (главным образом гидролаз), которые участвуют в расщеплении в кишечнике различных составных частей пищи. Пищеварительные ферменты составляют около 90 % белков панкреатического сока. Эту функцию поджелудочной железы называют экболической в отличие от второй экзокринной функции – гидрокинетической, заключающейся в секреции воды, бикарбонатов (до 150 ммоль/л) и других электролитов. Гидрокинетическая функция поджелудочной железы обеспечивает нейтрализацию кислого желудочного содержимого и создает в кишечнике щелочную среду, оптимальную для действия панкреатических и кишечных ферментов.
Панкреатические ферменты подразделяются на амилолитические (гидролиз крахмала), протеолитические (гидролиз белков), липолитические (гидролиз жиров) и нуклеолитические (гидролиз нуклеиновых кислот).
Амилолитические ферменты — амилазы. Расщепление крахмала начинает α-амилаза, состоящая из нескольких изоферментов, и составляющая примерно 20 % белков в панкреатическом секрете. Основное количество этого фермента выделяется поджелудочной железой в активном виде. Сходный изофермент синтезируется слюнными железами, α-Амилаза расщепляет полисахариды (крахмал, гликоген) до декстринов, мальтоолигосахаридов, мальтозы и незначительного количества глюкозы. Указанные полимеры далее превращаются в глюкозу кишечными ферментами – мальтазой, γ-амилазой, изомальтазой.
Липолитические ферменты – липазы. Липолиз осуществляется панкреатическими ферментами, однако диагностическое значение в настоящее время имеет лишь липаза (гидролизует триглицериды). Из панкреатического сока выделена еще фосфолипаза (гидролиз фосфолипидов, лецитина) и карбоксил-эстераза (гидролиз эфиров жирных кислот). Поджелудочная железа выделяет основное количество липазы (немного липазы содержится также в слюне и кишечном соке), расщепляющей триглицериды до моноглицеридов и жирных кислот, которые проходят через мембрану энтероцита. Липаза гидролизует водонерастворимый субстрат, что возможно лишь на поверхности мелких эмульгированных частиц жира. Одинаковые количества фермента проявляют различную активность в зависимости от качества эмульсии: чем она тоньше, тем выше активность фермента. Липаза активна в тонкой кишке в присутствии желчных кислот, которые способствуют эмульгированию жиров.
Протеолитические ферменты — протеазы. В панкреатическом соке их много (эндопептидазы – трипсин, химотрипсин, эластаза, экзопептидазы – карбоксипептидазы А и Б). Они относятся к группе сериновых протеаз и составляют 44 % от общего белка панкреатического сока. Существуют множественные формы трипсина и химотрипсина, как и желудочных пепсинов. Ацинарные клетки не синтезируют активные протеолитические ферменты (это грозило бы самоперевариванием органа). Они выделяются в виде неактивных проферментов, которые активируются в кишке. Первым активируется трипсиноген. Под действием кишечного фермента энтерокиназы он превращается в трипсин, а затем активные молекулы трипсина обеспечивают активацию других протеолитических ферментов, включая трипсиноген (процесс активации продолжается уже аутокаталитически).
С панкреатическим соком выделяются фактически два трипсиногена, составляющие около 19 % всех его белков, два химотрипсиногена и две проэластазы. Все они называются эндопептидазами, так как при гидролизе белков «разрывают» внутренние связи между аминокислотами в середине их цепей, продуцируя пептиды. Эндопептидазы специфичны. Например, трипсин гидролизует лишь связи справа от лизина или аргинина, химотрипсин – в основном те, которые рядом с фенилаланином, тирозином и триптофаном. Эластаза способна гидролизовать эластин, белок соединительной ткани, а также другие белки. В отличие от эндопептидаз экзопептидазы разрывают в пептидных цепях С-терминальную, т. е. конечную, связь (карбоксипептидазы) или первую, N-терминаль-ную (аминопептидазы), «освобождая», таким образом, аминокислоты одну за другой.
В панкреатическом соке присутствует ингибитор трипсина – неферментный белок, тесно связанный с протеолизом. Его физиологическое значение заключается в предотвращении преждевременной активации трипсина в протоках поджелудочной железы. Определение его активности в сыворотке крови в динамике имеет значение, свидетельствующее о воспалительно-деструктивных процессах органа при гиперферментемии (синдром «уклонения ферментов»).
Калликреин является протеолитическим ферментом поджелудочной железы. Активированный трипсином, он отвечает за образование в крови каллидина, гипотензивного полипептида, идентичного брадикинину, одному из нейровазоактивных пептидов.
Нуклеолитические ферменты — нуклеазы. Принадлежат к фосфодиэстеразам. В панкреатическом соке они представлены рибонуклеазой, гидролизующей рибонуклеиновую кислоту, и дезоксирибонуклеазой, расщепляющей дезоксирибонуклеиновую кислоту.
Количество и ферментативная активность панкреатического сока зависят от количества и состава принятой пищи. Вне пищеварения, натощак, поджелудочный сок выделяется в небольших количествах. Секрецию панкреатического сока вызывает объемная и стимулирующая желудочное кислотообразование пища. Твердая, густая и жирная пища долго задерживается в желудке (медленнее эвакуируется), поэтому секреция поджелудочной железы дольше, чем после приема жидкой пищи. Основная секреция, однако, начинается в кишечной фазе, т. е. после попадания пищи и продуктов ее переваривания в двенадцатиперстную кишку.
Секреция поджелудочного сока усиливается через 2–3 мин после приема пищи и продолжается 6-14 ч (с максимальным выделением сока на 90-й минуте) в зависимости от ее состава. Смешанная пища вызывает больший секреторный ответ, чем отдельные продукты. Нейтральные жиры и продукты их переваривания больше всего стимулируют продуцирующие ферменты клетки поджелудочной железы. Белки также довольно сильный стимулятор секреции ферментов, в меньшей мере – бикарбонатов и жидкой части панкреатического сока. Поступление аминокислот в кишку вызывает значительное повышение в крови уровня гормона – холецистокинина (прежние названия – панкреозимин, холецистокинин-панкреозимин), местного стимулятора ферментсинтезирующей деятельности ацинарных клеток поджелудочной железы. Особенно сильно влияют фенилаланин, холин, метионин и другие незаменимые аминокислоты.
Преобладание углеводов в питании «щадит» поджелудочную железу, что необходимо учитывать при обострении хронического панкреатита. Малоконцентрированные растворы глюкозы и сахарозы, введенные в двенадцатиперстную кишку, вызывают кратковременную и небольшую стимуляцию секреции α-амилазы, а концентрированные растворы – резкое угнетение экзокринной секреции.
Соляная кислота является сильным естественным стимулятором внешней секреции поджелудочной железы. Все напитки и продукты, которые возбуждают аппетит, наряду с секрецией желудка усиливают секрецию поджелудочной железы. Так, выраженным сокогонным действием обладают некоторые фруктовые и органические кислоты (яблочная, лимонная, винная, молочная), а также алкоголь.
Зависимость ферментного состава сока поджелудочной железы от качества пищи хорошо известна. Находящиеся в ацинарных клетках гранулы содержат все ферменты, присутствующие в секрете, в постоянном соотношении, так что в панкреатическом соке оно также постоянно. Однако увеличение в пище доли какого-либо компонента рациона (например, белков) постепенно увеличивает синтез соответствующих гидролизующих ферментов. Эта адаптация к диете дала возможность обсуждать вопрос о возможности диетического излечения некоторых дисфункций поджелудочной железы.
Секреция поджелудочной железы регулируется нервными и гуморальными механизмами. В стимуляции панкреатической секреции прямые нервные влияния имеют меньшее значение, чем гуморальные. Ведущее значение в гуморальной регуляции секреции поджелудочной железы принадлежит гастроинтестинальным гормонам. Они относятся к числу пептидов и синтезируются специальными клетками желудка и двенадцатиперстной кишки под влиянием соответствующих химических, механических, нервных или иных стимулирующих факторов.
Секрецию поджелудочной железы усиливают секретин, холецистокинин, а также гастрин, серотонин, инсулин, бомбезин, субстанция П и соли желчных кислот. Тормозят выделение поджелудочного сока глюкагон, кальцитонин, ЖИП, ПП, соматостатин. ВИП может возбуждать и тормозить панкреатическую секрецию. Эффекты гормонов частично опосредуются через их влияние на желудочную секрецию: с усилением ее более кислое содержимое поступает в двенадцатиперстную кишку и посредством ее гормонов повышает панкреатическую секрецию.
Патофизиология
При структурно-функциональных нарушениях поджелудочной железы может нарушаться синтез ферментов, в связи с чем возникают дефекты пищеварения в тонкой кишке. Особенно страдает переваривание жира, так как панкреатический сок содержит наиболее активный фермент липазу. При патологии может не усваиваться до 60–80 % жира, который выводится с калом. В меньшей степени нарушается переваривание белков, может не усваиваться до 30–40 % их количества. О недостаточном переваривании белков свидетельствует появление большого количества мышечных волокон в каловых массах (креаторея) после приема мясной пищи. Переваривание углеводов также нарушено. Развивается недостаточность пищеварения.
Нарушения внешней секреции поджелудочной железы могут быть обусловлены рядом причин. Основные из них следующие:
1) развитие в поджелудочной железе воспалительных процессов (острые и хронические панкреатиты);
2) обтурация протока поджелудочной железы конкрементами (желчнокаменная болезнь, калькулез протоков), паразитами кишечника, белковослизистыми «пробками»;
3) воспалительные процессы в двенадцатиперстной кишке (дуодениты, язвенная болезнь), сопровождающиеся уменьшением образования секретина; вследствие этого понижается секреция панкреатического сока;
4) сдавление протока поджелудочной железы (опухоли, дуодениты, фатериты);
5) развитие тяжелых нарушений обменных процессов организма (ожирение, белково-энергетическая недостаточность, гормональные расстройства и др.) с формированием дистрофических поражений поджелудочной железы (липоматоз, белковая дистрофия, гемохроматоз);
6) аллергическая перестройка организма;
7) неврогенное торможение функций поджелудочной железы (вагальная дистрофия, длительная атропинизация);
8) разрушение опухолью.
В случаях развития обтурационных процессов, затрудняющих или даже прекращающих отток панкреатического секрета в двенадцатиперстную кишку, возникает гипертензия в системе протоков поджелудочной железы, вызывающая не только выраженный болевой синдром, но и внутренние разрывы, разрушения паренхимы органа. Энтерокиназа лизированных клеток поджелудочной железы в этом случае может катализировать активацию ферментов панкреатического сока непосредственно в протоковой системе (особенно трипсиногена). Более того, сам трипсин способен активизировать трипсиноген, как бы запуская «цепную» реакцию ферментативной активизации (аутокаталитическая реакция). В результате описываемых явлений ферменты поджелудочной железы могут осуществлять самопереваривание ткани поджелудочной железы с развитием некрозов.
При разрушении поджелудочной железы активные панкреатические ферменты, продукты тканевой деструкции, нарушенного метаболизма могут всасываться в кровь, в окружающие ткани. В тканях в результате действия на них ферментов развиваются некрозы; особенно характерно появление некрозов жировой клетчатки (сальника), возникающих под влиянием липазы панкреатического сока. Формируется синдром интоксикации организма.
Нарушения внешней секреции поджелудочной железы могут быть обусловлены рядом причин. Основные из них следующие:
1) развитие в поджелудочной железе воспалительных процессов (острые и хронические панкреатиты);
2) обтурация протока поджелудочной железы конкрементами (желчнокаменная болезнь, калькулез протоков), паразитами кишечника, белковослизистыми «пробками»;
3) воспалительные процессы в двенадцатиперстной кишке (дуодениты, язвенная болезнь), сопровождающиеся уменьшением образования секретина; вследствие этого понижается секреция панкреатического сока;
4) сдавление протока поджелудочной железы (опухоли, дуодениты, фатериты);
5) развитие тяжелых нарушений обменных процессов организма (ожирение, белково-энергетическая недостаточность, гормональные расстройства и др.) с формированием дистрофических поражений поджелудочной железы (липоматоз, белковая дистрофия, гемохроматоз);
6) аллергическая перестройка организма;
7) неврогенное торможение функций поджелудочной железы (вагальная дистрофия, длительная атропинизация);
8) разрушение опухолью.
В случаях развития обтурационных процессов, затрудняющих или даже прекращающих отток панкреатического секрета в двенадцатиперстную кишку, возникает гипертензия в системе протоков поджелудочной железы, вызывающая не только выраженный болевой синдром, но и внутренние разрывы, разрушения паренхимы органа. Энтерокиназа лизированных клеток поджелудочной железы в этом случае может катализировать активацию ферментов панкреатического сока непосредственно в протоковой системе (особенно трипсиногена). Более того, сам трипсин способен активизировать трипсиноген, как бы запуская «цепную» реакцию ферментативной активизации (аутокаталитическая реакция). В результате описываемых явлений ферменты поджелудочной железы могут осуществлять самопереваривание ткани поджелудочной железы с развитием некрозов.
При разрушении поджелудочной железы активные панкреатические ферменты, продукты тканевой деструкции, нарушенного метаболизма могут всасываться в кровь, в окружающие ткани. В тканях в результате действия на них ферментов развиваются некрозы; особенно характерно появление некрозов жировой клетчатки (сальника), возникающих под влиянием липазы панкреатического сока. Формируется синдром интоксикации организма.
Билиарный тракт
Важнейшим секретом, участвующим в пищеварении, является желчь. Она представляет собой продукт деятельности клеток печени – гепатоцитов, имеет сложный состав и способствует нейтрализации кислого желудочного содержимого, поступающего в двенадцатиперстную кишку, эмульгирует жиры, растворяет продукты их гидролиза, активирует панкреатическую липазу. Желчь стимулирует желчеобразование, желчевыделение, моторную и секреторную деятельность тонкой кишки, обладает бактериостатическими свойствами, способствует всасыванию из кишечника жирорастворимых витаминов, холестерина, аминокислот и других веществ.
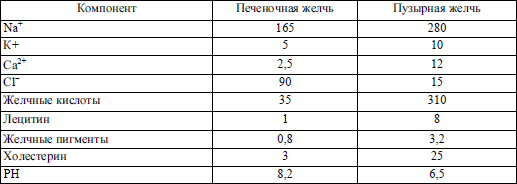
У человека за сутки образуется до 2 л желчи. Образование желчи происходит путем активной секреции ее компонентов (желчные кислоты) гепатоцитами, активного и пассивного транспорта некоторых веществ из крови (вода, глюкоза, креатинин, электролиты, витамины, гормоны и др.) и обратного всасывания воды и ряда веществ из желчных капилляров, протоков и желчного пузыря. Процесс образования желчи – желчеотделение (холерез) – идет непрерывно, а поступление желчи в двенадцатиперстную кишку – желчевыделение (холекинез) – периодически, в основном в связи с приемом пищи. Натощак желчь в кишечник почти не поступает, она направляется в желчный пузырь, емкость которого составляет всего 50–60 мл, где концентрируется и несколько изменяет свой состав. Поэтому принято говорить о двух видах желчи – печеночной и пузырной.
Желчь является не только секретом, но и экскретом, так как в ее составе выводятся различные эндогенные и экзогенные вещества. Это в большей мере определяет сложность и различия состава печеночной и пузырной желчи (табл. 2.5.).
Качественное своеобразие желчи определяют находящиеся в ней желчные кислоты, пигменты и холестерин. В печени человека образуются холевая и хенодезоксихолевая кислоты (первичные), которые в кишечнике под влиянием ферментов преобразуются в несколько вторичных желчных кислот. Основное количество желчных кислот и их солей содержится в желчи в виде соединений с гликоколом и таурином. У человека гликохолевых кислот около 80 % и таурохолевых примерно 20 %. Это соотношение изменяется под влиянием ряда факторов. Так, при приеме пищи, богатой углеводами, увеличивается содержание гликохолевых кислот, при высокобелковой диете – таурохолевых.
Из тонкой кишки всасывается в кровь около 85–90 % желчных кислот (гликохолевых и таурохолевых), выделившихся в кишку в составе желчи. Затем они приносятся в печень и включаются в состав желчи. Остальные 10–15 % желчных кислот выводятся из организма в основном в составе кала (значительное их количество связано с непереваренными волокнами пищи). Эта потеря желчных кислот восполняется их синтезом в печени.
Таблица 2.5
Состав печеночной и пузырной желчи человека (ммоль/л)
 Хотя желчеобразование идет непрерывно, интенсивность его изменяется в некоторых процессах вследствие регуляторных влияний. Так, усиливают желчеобразование акт еды, различные виды принятой пищи, т. е. желчеобразование несколько изменяется при раздражении интерорецепторов ЖКТ, других внутренних органов и при условно-рефлекторных воздействиях.
Хотя желчеобразование идет непрерывно, интенсивность его изменяется в некоторых процессах вследствие регуляторных влияний. Так, усиливают желчеобразование акт еды, различные виды принятой пищи, т. е. желчеобразование несколько изменяется при раздражении интерорецепторов ЖКТ, других внутренних органов и при условно-рефлекторных воздействиях.
К числу гуморальных стимуляторов желчеобразования относится сама желчь. Чем больше желчных кислот поступает из тонкой кишки в кровь воротной вены, тем больше их выводится в составе желчи и тем меньше синтезируется гепатоцитами. Если в кровь поступает меньше желчных кислот, то дефицит восполняется усилением синтеза желчных кислот в клетках печени. Секретин увеличивает секрецию желчи (то есть выделение в ее составе воды и электролитов). Слабее стимулируют желчеобразование глюкагон, гастрин и холецистокинин-панкреозимин.
Движение желчи в желчевыделительном аппарате обусловлено разностью давления в его частях и в двенадцатиперстной кишке, а также состоянием сфинктеров внепеченочных желчных путей. Выделяют три сфинктера (рис. 2.6): в месте слияния пузырного и общего желчного протоков (сфинктер Мирицци), в шейке желчного пузыря (сфинктер Люткенса) и в концевом отделе общего желчного протока (сфинктер Одди). Тонус мышц этих сфинктеров важен для направления движения желчи.
У человека за сутки образуется до 2 л желчи. Образование желчи происходит путем активной секреции ее компонентов (желчные кислоты) гепатоцитами, активного и пассивного транспорта некоторых веществ из крови (вода, глюкоза, креатинин, электролиты, витамины, гормоны и др.) и обратного всасывания воды и ряда веществ из желчных капилляров, протоков и желчного пузыря. Процесс образования желчи – желчеотделение (холерез) – идет непрерывно, а поступление желчи в двенадцатиперстную кишку – желчевыделение (холекинез) – периодически, в основном в связи с приемом пищи. Натощак желчь в кишечник почти не поступает, она направляется в желчный пузырь, емкость которого составляет всего 50–60 мл, где концентрируется и несколько изменяет свой состав. Поэтому принято говорить о двух видах желчи – печеночной и пузырной.
Желчь является не только секретом, но и экскретом, так как в ее составе выводятся различные эндогенные и экзогенные вещества. Это в большей мере определяет сложность и различия состава печеночной и пузырной желчи (табл. 2.5.).
Качественное своеобразие желчи определяют находящиеся в ней желчные кислоты, пигменты и холестерин. В печени человека образуются холевая и хенодезоксихолевая кислоты (первичные), которые в кишечнике под влиянием ферментов преобразуются в несколько вторичных желчных кислот. Основное количество желчных кислот и их солей содержится в желчи в виде соединений с гликоколом и таурином. У человека гликохолевых кислот около 80 % и таурохолевых примерно 20 %. Это соотношение изменяется под влиянием ряда факторов. Так, при приеме пищи, богатой углеводами, увеличивается содержание гликохолевых кислот, при высокобелковой диете – таурохолевых.
Из тонкой кишки всасывается в кровь около 85–90 % желчных кислот (гликохолевых и таурохолевых), выделившихся в кишку в составе желчи. Затем они приносятся в печень и включаются в состав желчи. Остальные 10–15 % желчных кислот выводятся из организма в основном в составе кала (значительное их количество связано с непереваренными волокнами пищи). Эта потеря желчных кислот восполняется их синтезом в печени.
Таблица 2.5
Состав печеночной и пузырной желчи человека (ммоль/л)

К числу гуморальных стимуляторов желчеобразования относится сама желчь. Чем больше желчных кислот поступает из тонкой кишки в кровь воротной вены, тем больше их выводится в составе желчи и тем меньше синтезируется гепатоцитами. Если в кровь поступает меньше желчных кислот, то дефицит восполняется усилением синтеза желчных кислот в клетках печени. Секретин увеличивает секрецию желчи (то есть выделение в ее составе воды и электролитов). Слабее стимулируют желчеобразование глюкагон, гастрин и холецистокинин-панкреозимин.
Движение желчи в желчевыделительном аппарате обусловлено разностью давления в его частях и в двенадцатиперстной кишке, а также состоянием сфинктеров внепеченочных желчных путей. Выделяют три сфинктера (рис. 2.6): в месте слияния пузырного и общего желчного протоков (сфинктер Мирицци), в шейке желчного пузыря (сфинктер Люткенса) и в концевом отделе общего желчного протока (сфинктер Одди). Тонус мышц этих сфинктеров важен для направления движения желчи.
