Интенсивность цианоза зависит от количества восстановленного гемоглобина в крови и от объема сосудистого ложа (в самой емкой, венозной его части). Поэтому при выраженной анемии или вазоконстрикции оценка цианоза затруднена. Большую роль играет и качество освещения: в мерцании некоторых люминесцентных ламп порой отчетливо видится то, чего на самом деле нет.
Существуют две главные причины цианоза: (1) артериальная гипоксемия и (2) ухудшение периферического кровотока. Они могут сочетаться.
Цианоз при нарушениях оксигенации крови в легких. В условиях артериальной гипоксемии к тканям от легких притекает кровь с исходно сниженным содержанием оксигемоглобина, в связи с чем сатурация гемоглобина венозной крови также уменьшается и венозная кровь становится более темной, что воспринимается как цианоз. Такой цианоз называется центральным и часто является диффузным. Кожные покровы в этом случае обычно хорошо снабжаются кровью, поэтому остаются теплыми, что подтверждается нормальной амплитудой фотоплетизмо-граммы. Поскольку первичная причина такого цианоза состоит в нарушении сатурации артериальной крови, пульсоксиметр позволяет не только обнаружить, но и дать точную количественную оценку глубины гипоксемии даже на той стадии, когда зрение еще не улавливает изменения окраски кожи.
Считается, что когда SpO2 опускается до 90 %, увидеть цианоз удается лишь в половине случаев. Напомним, что при нормальном положении кривой диссоциации оксигемоглобина этому уровню сатурации соответствует РаО2 = 57 мм рт. ст., что значительно ниже нормы. Даже десатурация артериальной крови до 85 % (РаО2 = 50 мм рт. ст.), что расценивается как серьезная гипоксемия, требующая коррекции, не всегда сопровождается развитием цианоза. В этом можно убедиться, сопоставляя Sp02 и внешний вид больных. Широкое применение пульсоксимет-рии рассеяло иллюзии анестезиологов относительно нормальной оксигенации пациентов во время наркоза.
Мониторинг показал, что эпизоды гипоксемии в операционной возникают в 20 (!) раз чаще, чем обнаруживаются при обычном наблюдении за больным.
Описано немало случаев, когда опытные врачи не могли распознать цианоз у пациентов с глубочайшей артериальной десатурацией, замаскированной анемией или вазоконстрикцией. Не случайно с внедрением пульсоксиметров в операционных и палатах интенсивной терапии резко сократилась частота эпи-' зодов недиагностированной или несвоевременно обнаруженной гипоксемии.
Кстати, недорогой портативный пульсоксиметр, помещающийся в кармане халата, постепенно становится таким же традиционным инструментом терапевта, как фонендоскоп, тонометр и авторучка, и обычно используется не в мониторном режиме, а для разовых измерений при обходе больных. SpO2 служит объективным показателем состояния легочного газообмена - в отличие от весьма субъективной оценки цианоза "на глаз". Миниатюрный пульсоксиметр, в котором корпус прибора и датчик смонтированы в единое целое, имеет размер спичечного коробка;
выпускается фирмой NONIN.
Цианоз при нарушениях кровообращения. Ухудшение перфузии периферии сопровождается возникновением акроцианоза. При отсутствии легочной патологии пульсоксиметр в такой ситуации показывает нормальный уровень SpO2 но из уменьшенного объема хорошо оксигенированной артериальной крови, притекающей к тканям кожи, последние извлекают прежнее количество кислорода. В результате усиленной десатурации оксигемоглобина в кожных капиллярах венозная кровь приобретает более темный цвет, что визуально воспринимается как цианоз, но не сказывается - и не может сказаться - на величине Sp02. Основные причины акроцианоза: (1) снижение сердечного выброса и (2) периферическая вазоконстрикция. В обоих случаях акроцианоз - это свидетельство нарушения кровоснабжения тканей. Акроцианоз наблюдается даже при нормальной сатурации гемоглобина артериальной крови.
К пульсоксиметрическим признакам нарушения перфузии тканей относится уменьшение амплитуды фотоплетизмограм-мы. Разумеется, этот симптом становится доступным, если монитор способен отражать на дисплее реальную амплитуду ФПГ. В крайне тяжелых случаях кожа приобретает бледно-цианотичный вид, а пульсоксиметр не хочет работать и дает сообщение типа "low perfusion" (нарушенная перфузия) или "low quality signal" (сигнал низкого качества). Подобные сообщения следует расценивать не как досадную помеху для мониторинга, а как признак серьезного неблагополучия.
Нарушения перфузии, определяемые монитором, могут иметь самые разные причины: от безобидной холодовой вазокон-стрикции до опасного генерализованного артериолоспазма или уменьшения сердечного выброса. Какую полезную информацию дает пульсоксиметр у таких больных?
Во- первых, данные пульсоксиметрии -хорошее подспорье в дифференциальной диагностике цианозов, поскольку помогают исключить или подтвердить участие дыхательной системы (по SpOa) и системы кровообращения (по амплитуде ФПГ) в нарушении транспорта кислорода.
Во- вторых, благодаря пульсоксиметрии становится обоснованным отказ от оксигенотерапии -универсального стереотипа в лечении цианотичных больных, при условии что SpOz находится в пределах нормы. Тем самым у врача появляется возможность сосредоточить усилия на решении действительных проблем: "раскрытии" периферии, ликвидации гиповолемии, повышении сократимости миокарда и пр.
В- третьих, пульсоксиметр, отражающий амплитуду фотопле-тизмограммы, позволяет судить о состоянии периферического кровотока, что ранее было недоступно. Восстановление нормальных пульсаций на ФПГ свидетельствует об улучшении кровоснабжения тканей и, как правило, совпадает с уменьшением степени акроцианоза.
Таким образом, пульсоксиметрия при гипоксемии облегчает дифференциальную диагностику, выбор лечения и контроль его эффективности, помогая адаптировать терапию к особенностям конкретного случая.
Причины артериальной гипоксемии
Существуют две главные причины цианоза: (1) артериальная гипоксемия и (2) ухудшение периферического кровотока. Они могут сочетаться.
Цианоз при нарушениях оксигенации крови в легких. В условиях артериальной гипоксемии к тканям от легких притекает кровь с исходно сниженным содержанием оксигемоглобина, в связи с чем сатурация гемоглобина венозной крови также уменьшается и венозная кровь становится более темной, что воспринимается как цианоз. Такой цианоз называется центральным и часто является диффузным. Кожные покровы в этом случае обычно хорошо снабжаются кровью, поэтому остаются теплыми, что подтверждается нормальной амплитудой фотоплетизмо-граммы. Поскольку первичная причина такого цианоза состоит в нарушении сатурации артериальной крови, пульсоксиметр позволяет не только обнаружить, но и дать точную количественную оценку глубины гипоксемии даже на той стадии, когда зрение еще не улавливает изменения окраски кожи.
Считается, что когда SpO2 опускается до 90 %, увидеть цианоз удается лишь в половине случаев. Напомним, что при нормальном положении кривой диссоциации оксигемоглобина этому уровню сатурации соответствует РаО2 = 57 мм рт. ст., что значительно ниже нормы. Даже десатурация артериальной крови до 85 % (РаО2 = 50 мм рт. ст.), что расценивается как серьезная гипоксемия, требующая коррекции, не всегда сопровождается развитием цианоза. В этом можно убедиться, сопоставляя Sp02 и внешний вид больных. Широкое применение пульсоксимет-рии рассеяло иллюзии анестезиологов относительно нормальной оксигенации пациентов во время наркоза.
Мониторинг показал, что эпизоды гипоксемии в операционной возникают в 20 (!) раз чаще, чем обнаруживаются при обычном наблюдении за больным.
Описано немало случаев, когда опытные врачи не могли распознать цианоз у пациентов с глубочайшей артериальной десатурацией, замаскированной анемией или вазоконстрикцией. Не случайно с внедрением пульсоксиметров в операционных и палатах интенсивной терапии резко сократилась частота эпи-' зодов недиагностированной или несвоевременно обнаруженной гипоксемии.
Кстати, недорогой портативный пульсоксиметр, помещающийся в кармане халата, постепенно становится таким же традиционным инструментом терапевта, как фонендоскоп, тонометр и авторучка, и обычно используется не в мониторном режиме, а для разовых измерений при обходе больных. SpO2 служит объективным показателем состояния легочного газообмена - в отличие от весьма субъективной оценки цианоза "на глаз". Миниатюрный пульсоксиметр, в котором корпус прибора и датчик смонтированы в единое целое, имеет размер спичечного коробка;
выпускается фирмой NONIN.
Цианоз при нарушениях кровообращения. Ухудшение перфузии периферии сопровождается возникновением акроцианоза. При отсутствии легочной патологии пульсоксиметр в такой ситуации показывает нормальный уровень SpO2 но из уменьшенного объема хорошо оксигенированной артериальной крови, притекающей к тканям кожи, последние извлекают прежнее количество кислорода. В результате усиленной десатурации оксигемоглобина в кожных капиллярах венозная кровь приобретает более темный цвет, что визуально воспринимается как цианоз, но не сказывается - и не может сказаться - на величине Sp02. Основные причины акроцианоза: (1) снижение сердечного выброса и (2) периферическая вазоконстрикция. В обоих случаях акроцианоз - это свидетельство нарушения кровоснабжения тканей. Акроцианоз наблюдается даже при нормальной сатурации гемоглобина артериальной крови.
К пульсоксиметрическим признакам нарушения перфузии тканей относится уменьшение амплитуды фотоплетизмограм-мы. Разумеется, этот симптом становится доступным, если монитор способен отражать на дисплее реальную амплитуду ФПГ. В крайне тяжелых случаях кожа приобретает бледно-цианотичный вид, а пульсоксиметр не хочет работать и дает сообщение типа "low perfusion" (нарушенная перфузия) или "low quality signal" (сигнал низкого качества). Подобные сообщения следует расценивать не как досадную помеху для мониторинга, а как признак серьезного неблагополучия.
Нарушения перфузии, определяемые монитором, могут иметь самые разные причины: от безобидной холодовой вазокон-стрикции до опасного генерализованного артериолоспазма или уменьшения сердечного выброса. Какую полезную информацию дает пульсоксиметр у таких больных?
Во- первых, данные пульсоксиметрии -хорошее подспорье в дифференциальной диагностике цианозов, поскольку помогают исключить или подтвердить участие дыхательной системы (по SpOa) и системы кровообращения (по амплитуде ФПГ) в нарушении транспорта кислорода.
Во- вторых, благодаря пульсоксиметрии становится обоснованным отказ от оксигенотерапии -универсального стереотипа в лечении цианотичных больных, при условии что SpOz находится в пределах нормы. Тем самым у врача появляется возможность сосредоточить усилия на решении действительных проблем: "раскрытии" периферии, ликвидации гиповолемии, повышении сократимости миокарда и пр.
В- третьих, пульсоксиметр, отражающий амплитуду фотопле-тизмограммы, позволяет судить о состоянии периферического кровотока, что ранее было недоступно. Восстановление нормальных пульсаций на ФПГ свидетельствует об улучшении кровоснабжения тканей и, как правило, совпадает с уменьшением степени акроцианоза.
Таким образом, пульсоксиметрия при гипоксемии облегчает дифференциальную диагностику, выбор лечения и контроль его эффективности, помогая адаптировать терапию к особенностям конкретного случая.
Причины артериальной гипоксемии
Артериальная гипоксемия - это следствие и признак нарушения способности дыхательной системы оксигенировать притекающую к легким венозную кровь.
Исключение составляют лишь дисгемоглобинемии, при которых, кстати, пульсоксиметрический контроль Sp02 неэффективен из-за грубых артефактов.
Значение пульсоксиметрии не сводится только к распознаванию артериальной гипоксемии и наблюдению за ее динамикой. Иногда удается определить причину нарушения оксигенации крови в легких и, следовательно, выбрать оптимальный способ коррекции.
Нужно отметить, что возможности пульсоксиметрии в дифференциальной диагностике гипоксемии скромнее, чем у лабораторного или мониторного газового анализа, ибо существующая система описания расстройств газообмена традиционно ориентирована на такие параметры, как напряжение, концентрация и парциальное давление дыхательных газов. Недостаточная точность измерения Sp02 и всегда присутствующая вероятность сдвига кривой диссоциации оксигемоглобина не позволяют использовать этот параметр для расчета РаО2. Но все же пульсоксиметрия, в сравнении с газовым анализом, обладает неоспоримым достоинством: в настоящее время это единственный широкодоступный способ обеспечить сколь угодно длительное непрерывное наблюдение за степенью насыщения артериальной крови кислородом.
Непрерывный мониторинг сатурации гемоглобина артериальной крови в сочетании с пониманием типичных механизмов нарушений легочного газообмена позволяет сделать ряд ценных выводов.
Существует несколько приемов, с помощью которых можно уточнить причину гипоксемии, выявленной пульсоксиметром.
1. Необходимо учитывать, в какой клинической ситуации возникает артериальная гипоксемия, и сопоставлять SpO2 с данными лабораторного и инструментального исследования. Например, если гипоксемия диагностируется у больного со свежей невосполненной кровопотерей, то наиболее вероятная причина снижения SpO2 - нарушение регионарных вентиляционно-перфузионных отношений в легких. Такая гипоксемия легко устраняется простой ингаляцией кислорода и инфузией.
2. Амплитуда фотоплетизмограммы в некоторых случаях позволяет подтвердить предположения, основанные на наблюдениях за SрО2. В приведенном выше примере (пациент с невосполненной кровопотерей) на дисплее пульсоксиметра отмечаются снижение пиков ФПГ, а также "дыхательные волны" - колебания кривой, синхронные с дыханием,- которые характерны именно для гиповолемии.
3. Высокоинформативна реакция SpO2 на различные лечебные воздействия (оксигенотерапию, инфузию, режим ПДКВ, изменение положения тела и пр.). Так, стойко сниженная сатурация даже на фоне применения кислорода в высокой концентрации характерна для массивного шунтирования крови в легких.
4. Изучение динамики сатурации, о которой лучше всего судить по тренду SpO2, также позволяет сделать определенные заключения. Неожиданное резкое снижение SpO2 характерно для внезапных событий, таких как смещение интубационной трубки в бронх или развитие напряженного пневмоторакса. Постепенное снижение сатурации, которую не удается нормализовать оксигенотерапией и подбором режима ИВЛ, типично для комплексных расстройств газообмена, возникающих, например, при РДС или тотальной пневмонии. Лабильная гипоксемия наблюдается при накоплении в бронхах мокроты, периодически нарушающей вентиляцию некоторых регионов легких.
5. Желательно сочетать пульсоксиметрию с другими методами мониторинга дыхания (капнографией, оксиметрией, спирометрией). Данные разных мониторов взаимно дополняют друг друга и даже в сложных случаях помогают восстановить картину нарушения легочного газообмена.
Причины артериальной гипоксемии. Таковых пять (они могут встречаться по отдельности, однако часто имеет место их сочетание):
• гиповентиляция;
• уменьшение содержания кислорода во вдыхаемом газе;
• шунтирование крови в легких;
• гиповентиляция отдельных легочных зон;
• нарушение диффузии кислорода из альвеол в кровь легочных капилляров.
В каждом из вышеперечисленных случаев гипоксемия углубляется при увеличении потребности организма в кислороде.
Пульсоксиметрия при гиповентиляции и апноэ. Снижение минутного объема вентиляции легких приводит к уменьшению доставки кислорода в альвеолы и нарушению эвакуации углекислого газа из альвеолярного пространства. При этом доставка в альвеолы углекислого газа с периферии и извлечение из них кислорода кровью, протекающей по легким, не прекращаются. В результате содержание кислорода в альвеолярном газе уменьшается, а концентрация CU2 возрастает. Соответственно изменяется и газовый состав крови, оттекающей от легких.
При гиповентиляции развиваются артериальная гипоксемия, выявляемая пульсоксиметром по снижению SpO2, и гиперкапния, сопровождающаяся расширением артери-ол, увеличением амплитуды ФПГ и тахикардией (рис. 1.11).
Степень гипо- или гипервентиляции традиционно оценивают по напряжению СОа в артериальной крови, потому что величина данного показателя зависит только от соответствия минутного объема альвеолярной вентиляции скорости продукции углекислоты. Внутрилегочный обмен кислорода подчиняется значительно более сложным законам. Поэтому снижение Sp02 можно определенно связать с гиповентиляцией лишь тогда, когда для этого есть реальные клинические предпосылки и нет оснований подозревать участие других механизмов, вызывающих гипоксемию.
Диагностика гиповентиляции по снижению SpO2 в каждом случае требует обязательного соотнесения величины этого показателя с конкретной клинической ситуацией.
Несомненным преимуществом пульсоксиметрии при гиповентиляции служит своевременность распознавания этого расстройства по самому опасному последствию - гипоксемии, способной быстро привести к тяжелым осложнениям.
Пульсоксиметр реагирует на внезапное снижение объема вентиляции значительно раньше, чем капнограф.
Как быстро развивается артериальная гипоксемия при остановке дыхания? Для анестезиолога и интенсивиста ответ на этот вопрос имеет исключительное практическое значение. Ведь речь идет о времени, которым располагает специалист, чтобы успеть интубировать больного после введения миорелаксанта, или о допустимой продолжительности аспирации мокроты у пациента, которому выполняется ИВЛ, или о любой другой ситуации, когда возникает или искусственно вызывается апноэ.
В целом скорость появления и развития гипоксемии после остановки вентиляции определяется двумя факторами: (1) потребностью организма в кислороде и (2) запасами кислорода в организме, доступными для использования в физиологическом диапазоне РаО2.
Потребность взрослого человека в кислороде в покое в среднем равна 250 мл/мин. При адекватной анестезии она снижается до 200 мл/мин, а при недостаточном обезболивании может увеличиться. Повышенная потребность в кислороде отмечается при гиперметаболических состояниях, например при стрессе.
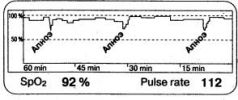 Рис. 1.11. Эпизоды апноэ на тренде SpO2 при дыхании воздухом
Рис. 1.11. Эпизоды апноэ на тренде SpO2 при дыхании воздухом
Условность приведенных здесь величин очевидна. Минутное потребление кислорода зависит от массы тела и состояния метаболизма, которое, в свою очередь, определяется множеством факторов.мышечной дрожи, гипертермии или септическом шоке. Лидером среди гиперметаболических состояний является синдром злокачественной гипертермии - редчайшее осложнение общей анестезии, при котором потребность в кислороде возрастает в десятки раз.
Запасы кислорода в организме невелики и у взрослого человека, дышащего воздухом, составляют в среднем 1,5 л, а при дыхании чистым кислородом возрастают до 4- 4,5 л. Поэтому предварительная вентиляция пациента кислородом (преоксиге-нация) существенно увеличивает допустимую продолжительность последующего апноэ. В этом можно убедиться, просматривая тренды SpO2, записанные, например, во время интубаций при вводных наркозах*.
Объем кислорода в легких при дыхании атмосферным воздухом - около 450 мл, а при дыхании чистым кислородом он повышается до 3 л (размер функциональной остаточной емкости, ФОЕ - объема газа, содержащегося в легких к концу спокойного выдоха).
Любая патология, приводящая к уменьшению ФОЕ или нарушающая использование этого резерва кислорода, укорачивает срок между моментом остановки дыхания и появлением артериальной гипоксемии.
Ниже перечислены основные причины уменьшения ФОЕ, знание которых позволяет выделить из общей массы больных группу особого риска в отношении форсированного развития гипоксемии при апноэ:
• ожирение;
• высокое внутрибрюшное давление (парез кишечника, асцит, беременность и пр.), особенно в положении лежа или в положении Тренделенбурга;
• релаксация диафрагмы;
• уменьшение количества работающей легочной ткани (обширные резекции легких, пневмония, ателектазы, РДС, пробки мокроты, пневмо- или гемоторакс и пр.);
• общая анестезия;
• период новорожденности.
Ряд проблем, связанных с преоксигенацией, подробнее рассмотрен в гл. "Оксиметрия".
Основные причины нарушения утилизации внутрилегочного газа:
• альвеолярное мертвое пространство (тромбозы и эмболии легочных сосудов) - кислород таких участков недоступен для ^использования;
• наличие в легких обширных зон с выраженным преобладанием вентиляции над кровотоком (низкое давление в легочной артерии, например при гиповолемии).
В крови человека содержится около 850 мл кислорода, связанного преимущественно с гемоглобином. При дыхании чистым кислородом его запас увеличивается приблизительно до 950 мл. При апноэ или гиповентиляции этот резерв начинает расходоваться с того момента, когда уровень кислорода в альвеолярном газе опускается ниже нормы. От количества газа, содержащегося в крови, во многом зависит скорость углубления гипоксемии.
При невосполненной кровопотере или анемии безопасная длительность апноэ укорачивается.
У детей, особенно у новорожденных, гипоксемия, обусловленная апноэ, развивается гораздо быстрее, чем у взрослых.
Как скоро обнаруживает пульсоксиметр гиповентиляцию или апноэ?
При дыхании атмосферным воздухом в легких практически нет избытка кислорода, который мог бы некоторое время поддерживать нормальный уровень РаО2 в условиях апноэ. Поэтому любое промедление в доставке новых порций кислорода в альвеолы быстро приводит к снижению парциального давления этого газа в легких и возникновению артериальной гипоксемии. Заметное уменьшение сатурации происходит уже через 30 с после внезапного сокращения объема вентиляции, но порции артериальной крови, несущей эту информацию, требуется 5-10, а при нарушениях кровообращения - до 40 с и более, чтобы достичь пульсоксиметрического датчика. К этому времени следует добавить от 2 до 15 с для обновления цифр на мониторе дисплея. Таким образом, пульсоксиметру необходимо в среднем от 40 до 60 с (а при низком минутном объеме кровообращения - до 2 мин) для того, чтобы обнаружить гиповентиляцию или апноэ, вызванные внезапным событием, например западением языка, перегибом интубационной трубки, рекураризацией или разгерметизацией контура респиратора.
По скорости реакции на внезапную гиповентиляцию пульсоксиметр уступает только быстродействующему оксиметру - монитору, предназначенному для измерения концентрации кислорода в выдыхаемом газе, а при апноэ - также и капнографу, который в этом случае регистрирует прекращение колебаний концентрации углекислого газа.
До внедрения пульсоксиметрии врачи, ведущие таких больных, были вынуждены руководствоваться лишь вышеперечисленными факторами и действовать сообразно предполагаемому сценарию развития событий. Пульсоксиметрия позволила измерить то, о чем раньше приходилось судить по весьма ненадежному внешнему признаку - скорости появления и нарастания цианоза. В результате допустимый срок интубации трахеи у больного с ожирением или эффективность преоксигенации перед аспирацией мокроты у больного с РДС перестали быть убедительными физиологическимиабстракциями, а превратились в конкретные цифровые показатели, которые легко контролировать у любого пациента.
Так, благодаря повседневной практике работы под мониторным контролем, удалось пересмотреть клиническую значимость диффузионной гипоксии, возникающей при выходе из наркоза закисью азота, определить режим преоксигенации перед интубацией трахеи и разобраться с некоторыми другими предположениями, рекомендациями и ритуалами.
Важнейшая роль мониторинга заключается в предоставлении возможности понимающему специалисту увидеть и оценить работу патофизиологических механизмов у больного. Вот почему в анестезиологии и интенсивной терапии мониторинг служит мостиком между физиологическими концепциями и реальностью клинической практики. Привычка анализировать данные мониторинга, "вписывать" их в конкретную клиническую ситуацию весьма полезна, поскольку именно так формируется умение уяснить суть происходящего и накапливается осмысленный клинический опыт. В конце концов, монитор - это своего рода дополнительный орган чувств врача, и обидно использовать его возможности на уровне простейших условных рефлексов.
В тех случаях. Когда гиповентиляция развивается постепенно, в течение нескольких часов или суток (как, например, при полирадикулоневрите или миастеническом кризе), капнограф и пульсоксиметр реагируют на нее синхронно. В такой ситуации
несомненное достоинство пульсоксиметрии - реальность выполнения длительного мониторинга у неинтубированного больного. Динамику нарастания расстройств дыхания можно контролировать по тренду SpO2 (рис. 1.12).
– К сожалению, описанные выше возможности пульсоксиметрии применимы лишь тогда, когда больной дышит атмосферным воздухом. При увеличении концентрации кислорода во вдыхаемом или вдуваемом газе даже небольшого дыхательного объема хватает, чтобы обеспечить поступление в альвеолы необходимого количества кислорода.
На фоне оксигенотерапии даже глубокая гиповентиляция может не сопровождаться снижением SpO2 и, соответственно, не выявляться пульсоксиметром.
Гипоксемия, обусловленная гиповентиляцией, быстро и полностью устраняется двумя способами (их можно сочетать):
увеличением объема вентиляции и повышением концентрации кислорода в дыхательной смеси. Оксигенотерапия позволяет в наикратчайшие сроки преодолеть наиболее опасное проявление гиповентиляции (не устраняя саму гиповентиляцию), а пульс-оксиметрия - контролировать результат; Очень часто этого бывает достаточно, чтобы выиграть время для принятия более радикальных мер.
Какой должна быть концентрация кислорода в дыхательной смеси, чтобы ликвидировать гипоксемию, вызванную гиповентиляцией? Известно, что данный показатель зависит от степени снижения минутного объема вентиляции и от потребности организма в кислороде. Однако в практической работе эти знания бесполезны, потому что никто и никогда не рассчитывает FiQ2
 Рис. 1.12. Тренд SpO2 при постепенно прогрессирующей гиповентиляции
Рис. 1.12. Тренд SpO2 при постепенно прогрессирующей гиповентиляции
заранее. Параметр всегда выбирается интуитивно и часто оказывается выше или ниже необходимого. Во многих случаях изменения в состоянии больного требуют в дальнейшем соответствующего изменения концентрации кислорода во вдыхаемом газе.
Пульсоксиметрия позволяет правильно выбирать концентрацию кислорода как при гиповентиляции, так и при других нарушениях оксигенации крови в легких, и непрерывно контролировать адекватность оксигенотерапии. (Подробнее эта тема обсуждается ниже.)
Нужно помнить, что избавиться от задержки углекислоты в организме таким способом нельзя. Поэтому капнограф дает информацию о гиповентиляции и тогда, когда она замаскирована оксигенотерапией и не распознается пульсоксиметром.
Сниженное содержание кислорода во вдыхаемом газе. При уменьшении содержания кислорода во вдыхаемом газе снижается парциальное давление кислорода в альвеолах. В результате напряжение кислорода и, соответственно, сатурация гемоглобина в крови, оттекающей от легких, падают и через некоторое время устанавливаются на новом, более низком уровне. При этом пульсоксиметр обнаруживает артериальную гипоксемию, выраженность которой зависит от степени уменьшения Fi02.
Снижение содержания кислорода во вдыхаемом газе может быть вызвано двумя причинами:
• избыточной концентрацией других компонентов газовой смеси (как правило, закиси азота);
• существенным падением атмосферного давления (дыханием разреженным воздухом высокогорья или транспортировкой пациента в самолете с негерметичным салоном).
Содержание кислорода в газовой смеси измеряется оксиметром - монитором, специально предназначенным для этой цели. Однако оксиметры до сих пор имеются далеко не во всех отделениях анестезии и интенсивной терапии, а сам метод, которому в этой книге посвящена отдельная глава, применяется значительно реже, чем пульсоксиметрия. Поэтому вероятнее всего сигнал о неблагополучии поступит от пульсоксиметра, а выяснять причину гипоксемии придется по ситуации.
Сниженное содержание кислорода в атмосферном воздухе - явление достаточно нетипичное, за исключением тех случаев, когда больница находится в горной местности. Однако риск формирования гипоксической дыхательной смеси во время наркоза вполне реален.
При любой десатурации, возникающей во время анестезии с применением закиси азота, необходимо в первую очередь проверить правильность дозирования кислорода и анестетика.
Гипоксемия, вызванная шунтом. Шунтирование крови в легких - одна из наиболее частых причин артериальной гипоксемии у пациентов в отделении интенсивной терапии и операционной..
Шунт - это часть легочного кровотока, проходящая но невентилируемым участкам легких. Венозная кровь, притекающая к легким и попадающая в шунты, не изменяет свой состав и на выходе из легких встречается с кровью, оттекающей от нормально работающих альвеол. В результате смешивания этих двух потоков образуется артериальная кровь, напряжение кислорода в которой снижено из-за примеси венозной крови (рис. 1.13). Поэтому шунтирование крови относят к группе расстройств легочного газообмена, объединенных названием "венозная примесь".
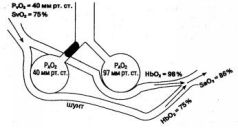 Рис. 1.13. Шунтирование крови в легких
Рис. 1.13. Шунтирование крови в легких
Прекращению вентиляции отдельных кровоснабжаемых участков легких способствуют самые разные причины:
* полная обструкция части дыхательных путей Пробками вязкой мокроты, аспирированными рвотными массами, сгустками крови, опухолью и пр.; при герметичной эндобронхиальной интубации в шунт может мгновенно превратиться целое легкое;
• пневмония - в пневмонических очагах альвеолы безвоздушны, так как заполнены экссудатом, а кровоток усилен из-за воспалительной гиперемии;
• микро- и макроателектазы - пожалуй, особенно частая причина шунтирования;
• при альвеолярном отеке легких зоны, заполненные транссудатом, превращаются в шунт;
• массивное, шунтирование крови происходит при респираторном дистресс-синдроме (РДС) через зоны интерстициального отека и консолидации альвеолярной ткани, множественные микроателектазы и участки с локальной обструкцией бронхов.
Исключение составляют лишь дисгемоглобинемии, при которых, кстати, пульсоксиметрический контроль Sp02 неэффективен из-за грубых артефактов.
Значение пульсоксиметрии не сводится только к распознаванию артериальной гипоксемии и наблюдению за ее динамикой. Иногда удается определить причину нарушения оксигенации крови в легких и, следовательно, выбрать оптимальный способ коррекции.
Нужно отметить, что возможности пульсоксиметрии в дифференциальной диагностике гипоксемии скромнее, чем у лабораторного или мониторного газового анализа, ибо существующая система описания расстройств газообмена традиционно ориентирована на такие параметры, как напряжение, концентрация и парциальное давление дыхательных газов. Недостаточная точность измерения Sp02 и всегда присутствующая вероятность сдвига кривой диссоциации оксигемоглобина не позволяют использовать этот параметр для расчета РаО2. Но все же пульсоксиметрия, в сравнении с газовым анализом, обладает неоспоримым достоинством: в настоящее время это единственный широкодоступный способ обеспечить сколь угодно длительное непрерывное наблюдение за степенью насыщения артериальной крови кислородом.
Непрерывный мониторинг сатурации гемоглобина артериальной крови в сочетании с пониманием типичных механизмов нарушений легочного газообмена позволяет сделать ряд ценных выводов.
Существует несколько приемов, с помощью которых можно уточнить причину гипоксемии, выявленной пульсоксиметром.
1. Необходимо учитывать, в какой клинической ситуации возникает артериальная гипоксемия, и сопоставлять SpO2 с данными лабораторного и инструментального исследования. Например, если гипоксемия диагностируется у больного со свежей невосполненной кровопотерей, то наиболее вероятная причина снижения SpO2 - нарушение регионарных вентиляционно-перфузионных отношений в легких. Такая гипоксемия легко устраняется простой ингаляцией кислорода и инфузией.
2. Амплитуда фотоплетизмограммы в некоторых случаях позволяет подтвердить предположения, основанные на наблюдениях за SрО2. В приведенном выше примере (пациент с невосполненной кровопотерей) на дисплее пульсоксиметра отмечаются снижение пиков ФПГ, а также "дыхательные волны" - колебания кривой, синхронные с дыханием,- которые характерны именно для гиповолемии.
3. Высокоинформативна реакция SpO2 на различные лечебные воздействия (оксигенотерапию, инфузию, режим ПДКВ, изменение положения тела и пр.). Так, стойко сниженная сатурация даже на фоне применения кислорода в высокой концентрации характерна для массивного шунтирования крови в легких.
4. Изучение динамики сатурации, о которой лучше всего судить по тренду SpO2, также позволяет сделать определенные заключения. Неожиданное резкое снижение SpO2 характерно для внезапных событий, таких как смещение интубационной трубки в бронх или развитие напряженного пневмоторакса. Постепенное снижение сатурации, которую не удается нормализовать оксигенотерапией и подбором режима ИВЛ, типично для комплексных расстройств газообмена, возникающих, например, при РДС или тотальной пневмонии. Лабильная гипоксемия наблюдается при накоплении в бронхах мокроты, периодически нарушающей вентиляцию некоторых регионов легких.
5. Желательно сочетать пульсоксиметрию с другими методами мониторинга дыхания (капнографией, оксиметрией, спирометрией). Данные разных мониторов взаимно дополняют друг друга и даже в сложных случаях помогают восстановить картину нарушения легочного газообмена.
Причины артериальной гипоксемии. Таковых пять (они могут встречаться по отдельности, однако часто имеет место их сочетание):
• гиповентиляция;
• уменьшение содержания кислорода во вдыхаемом газе;
• шунтирование крови в легких;
• гиповентиляция отдельных легочных зон;
• нарушение диффузии кислорода из альвеол в кровь легочных капилляров.
В каждом из вышеперечисленных случаев гипоксемия углубляется при увеличении потребности организма в кислороде.
Пульсоксиметрия при гиповентиляции и апноэ. Снижение минутного объема вентиляции легких приводит к уменьшению доставки кислорода в альвеолы и нарушению эвакуации углекислого газа из альвеолярного пространства. При этом доставка в альвеолы углекислого газа с периферии и извлечение из них кислорода кровью, протекающей по легким, не прекращаются. В результате содержание кислорода в альвеолярном газе уменьшается, а концентрация CU2 возрастает. Соответственно изменяется и газовый состав крови, оттекающей от легких.
При гиповентиляции развиваются артериальная гипоксемия, выявляемая пульсоксиметром по снижению SpO2, и гиперкапния, сопровождающаяся расширением артери-ол, увеличением амплитуды ФПГ и тахикардией (рис. 1.11).
Степень гипо- или гипервентиляции традиционно оценивают по напряжению СОа в артериальной крови, потому что величина данного показателя зависит только от соответствия минутного объема альвеолярной вентиляции скорости продукции углекислоты. Внутрилегочный обмен кислорода подчиняется значительно более сложным законам. Поэтому снижение Sp02 можно определенно связать с гиповентиляцией лишь тогда, когда для этого есть реальные клинические предпосылки и нет оснований подозревать участие других механизмов, вызывающих гипоксемию.
Диагностика гиповентиляции по снижению SpO2 в каждом случае требует обязательного соотнесения величины этого показателя с конкретной клинической ситуацией.
Несомненным преимуществом пульсоксиметрии при гиповентиляции служит своевременность распознавания этого расстройства по самому опасному последствию - гипоксемии, способной быстро привести к тяжелым осложнениям.
Пульсоксиметр реагирует на внезапное снижение объема вентиляции значительно раньше, чем капнограф.
Как быстро развивается артериальная гипоксемия при остановке дыхания? Для анестезиолога и интенсивиста ответ на этот вопрос имеет исключительное практическое значение. Ведь речь идет о времени, которым располагает специалист, чтобы успеть интубировать больного после введения миорелаксанта, или о допустимой продолжительности аспирации мокроты у пациента, которому выполняется ИВЛ, или о любой другой ситуации, когда возникает или искусственно вызывается апноэ.
В целом скорость появления и развития гипоксемии после остановки вентиляции определяется двумя факторами: (1) потребностью организма в кислороде и (2) запасами кислорода в организме, доступными для использования в физиологическом диапазоне РаО2.
Потребность взрослого человека в кислороде в покое в среднем равна 250 мл/мин. При адекватной анестезии она снижается до 200 мл/мин, а при недостаточном обезболивании может увеличиться. Повышенная потребность в кислороде отмечается при гиперметаболических состояниях, например при стрессе.

Условность приведенных здесь величин очевидна. Минутное потребление кислорода зависит от массы тела и состояния метаболизма, которое, в свою очередь, определяется множеством факторов.мышечной дрожи, гипертермии или септическом шоке. Лидером среди гиперметаболических состояний является синдром злокачественной гипертермии - редчайшее осложнение общей анестезии, при котором потребность в кислороде возрастает в десятки раз.
Запасы кислорода в организме невелики и у взрослого человека, дышащего воздухом, составляют в среднем 1,5 л, а при дыхании чистым кислородом возрастают до 4- 4,5 л. Поэтому предварительная вентиляция пациента кислородом (преоксиге-нация) существенно увеличивает допустимую продолжительность последующего апноэ. В этом можно убедиться, просматривая тренды SpO2, записанные, например, во время интубаций при вводных наркозах*.
Объем кислорода в легких при дыхании атмосферным воздухом - около 450 мл, а при дыхании чистым кислородом он повышается до 3 л (размер функциональной остаточной емкости, ФОЕ - объема газа, содержащегося в легких к концу спокойного выдоха).
Любая патология, приводящая к уменьшению ФОЕ или нарушающая использование этого резерва кислорода, укорачивает срок между моментом остановки дыхания и появлением артериальной гипоксемии.
Ниже перечислены основные причины уменьшения ФОЕ, знание которых позволяет выделить из общей массы больных группу особого риска в отношении форсированного развития гипоксемии при апноэ:
• ожирение;
• высокое внутрибрюшное давление (парез кишечника, асцит, беременность и пр.), особенно в положении лежа или в положении Тренделенбурга;
• релаксация диафрагмы;
• уменьшение количества работающей легочной ткани (обширные резекции легких, пневмония, ателектазы, РДС, пробки мокроты, пневмо- или гемоторакс и пр.);
• общая анестезия;
• период новорожденности.
Ряд проблем, связанных с преоксигенацией, подробнее рассмотрен в гл. "Оксиметрия".
Основные причины нарушения утилизации внутрилегочного газа:
• альвеолярное мертвое пространство (тромбозы и эмболии легочных сосудов) - кислород таких участков недоступен для ^использования;
• наличие в легких обширных зон с выраженным преобладанием вентиляции над кровотоком (низкое давление в легочной артерии, например при гиповолемии).
В крови человека содержится около 850 мл кислорода, связанного преимущественно с гемоглобином. При дыхании чистым кислородом его запас увеличивается приблизительно до 950 мл. При апноэ или гиповентиляции этот резерв начинает расходоваться с того момента, когда уровень кислорода в альвеолярном газе опускается ниже нормы. От количества газа, содержащегося в крови, во многом зависит скорость углубления гипоксемии.
При невосполненной кровопотере или анемии безопасная длительность апноэ укорачивается.
У детей, особенно у новорожденных, гипоксемия, обусловленная апноэ, развивается гораздо быстрее, чем у взрослых.
Как скоро обнаруживает пульсоксиметр гиповентиляцию или апноэ?
При дыхании атмосферным воздухом в легких практически нет избытка кислорода, который мог бы некоторое время поддерживать нормальный уровень РаО2 в условиях апноэ. Поэтому любое промедление в доставке новых порций кислорода в альвеолы быстро приводит к снижению парциального давления этого газа в легких и возникновению артериальной гипоксемии. Заметное уменьшение сатурации происходит уже через 30 с после внезапного сокращения объема вентиляции, но порции артериальной крови, несущей эту информацию, требуется 5-10, а при нарушениях кровообращения - до 40 с и более, чтобы достичь пульсоксиметрического датчика. К этому времени следует добавить от 2 до 15 с для обновления цифр на мониторе дисплея. Таким образом, пульсоксиметру необходимо в среднем от 40 до 60 с (а при низком минутном объеме кровообращения - до 2 мин) для того, чтобы обнаружить гиповентиляцию или апноэ, вызванные внезапным событием, например западением языка, перегибом интубационной трубки, рекураризацией или разгерметизацией контура респиратора.
По скорости реакции на внезапную гиповентиляцию пульсоксиметр уступает только быстродействующему оксиметру - монитору, предназначенному для измерения концентрации кислорода в выдыхаемом газе, а при апноэ - также и капнографу, который в этом случае регистрирует прекращение колебаний концентрации углекислого газа.
До внедрения пульсоксиметрии врачи, ведущие таких больных, были вынуждены руководствоваться лишь вышеперечисленными факторами и действовать сообразно предполагаемому сценарию развития событий. Пульсоксиметрия позволила измерить то, о чем раньше приходилось судить по весьма ненадежному внешнему признаку - скорости появления и нарастания цианоза. В результате допустимый срок интубации трахеи у больного с ожирением или эффективность преоксигенации перед аспирацией мокроты у больного с РДС перестали быть убедительными физиологическимиабстракциями, а превратились в конкретные цифровые показатели, которые легко контролировать у любого пациента.
Так, благодаря повседневной практике работы под мониторным контролем, удалось пересмотреть клиническую значимость диффузионной гипоксии, возникающей при выходе из наркоза закисью азота, определить режим преоксигенации перед интубацией трахеи и разобраться с некоторыми другими предположениями, рекомендациями и ритуалами.
Важнейшая роль мониторинга заключается в предоставлении возможности понимающему специалисту увидеть и оценить работу патофизиологических механизмов у больного. Вот почему в анестезиологии и интенсивной терапии мониторинг служит мостиком между физиологическими концепциями и реальностью клинической практики. Привычка анализировать данные мониторинга, "вписывать" их в конкретную клиническую ситуацию весьма полезна, поскольку именно так формируется умение уяснить суть происходящего и накапливается осмысленный клинический опыт. В конце концов, монитор - это своего рода дополнительный орган чувств врача, и обидно использовать его возможности на уровне простейших условных рефлексов.
В тех случаях. Когда гиповентиляция развивается постепенно, в течение нескольких часов или суток (как, например, при полирадикулоневрите или миастеническом кризе), капнограф и пульсоксиметр реагируют на нее синхронно. В такой ситуации
несомненное достоинство пульсоксиметрии - реальность выполнения длительного мониторинга у неинтубированного больного. Динамику нарастания расстройств дыхания можно контролировать по тренду SpO2 (рис. 1.12).
– К сожалению, описанные выше возможности пульсоксиметрии применимы лишь тогда, когда больной дышит атмосферным воздухом. При увеличении концентрации кислорода во вдыхаемом или вдуваемом газе даже небольшого дыхательного объема хватает, чтобы обеспечить поступление в альвеолы необходимого количества кислорода.
На фоне оксигенотерапии даже глубокая гиповентиляция может не сопровождаться снижением SpO2 и, соответственно, не выявляться пульсоксиметром.
Гипоксемия, обусловленная гиповентиляцией, быстро и полностью устраняется двумя способами (их можно сочетать):
увеличением объема вентиляции и повышением концентрации кислорода в дыхательной смеси. Оксигенотерапия позволяет в наикратчайшие сроки преодолеть наиболее опасное проявление гиповентиляции (не устраняя саму гиповентиляцию), а пульс-оксиметрия - контролировать результат; Очень часто этого бывает достаточно, чтобы выиграть время для принятия более радикальных мер.
Какой должна быть концентрация кислорода в дыхательной смеси, чтобы ликвидировать гипоксемию, вызванную гиповентиляцией? Известно, что данный показатель зависит от степени снижения минутного объема вентиляции и от потребности организма в кислороде. Однако в практической работе эти знания бесполезны, потому что никто и никогда не рассчитывает FiQ2

заранее. Параметр всегда выбирается интуитивно и часто оказывается выше или ниже необходимого. Во многих случаях изменения в состоянии больного требуют в дальнейшем соответствующего изменения концентрации кислорода во вдыхаемом газе.
Пульсоксиметрия позволяет правильно выбирать концентрацию кислорода как при гиповентиляции, так и при других нарушениях оксигенации крови в легких, и непрерывно контролировать адекватность оксигенотерапии. (Подробнее эта тема обсуждается ниже.)
Нужно помнить, что избавиться от задержки углекислоты в организме таким способом нельзя. Поэтому капнограф дает информацию о гиповентиляции и тогда, когда она замаскирована оксигенотерапией и не распознается пульсоксиметром.
Сниженное содержание кислорода во вдыхаемом газе. При уменьшении содержания кислорода во вдыхаемом газе снижается парциальное давление кислорода в альвеолах. В результате напряжение кислорода и, соответственно, сатурация гемоглобина в крови, оттекающей от легких, падают и через некоторое время устанавливаются на новом, более низком уровне. При этом пульсоксиметр обнаруживает артериальную гипоксемию, выраженность которой зависит от степени уменьшения Fi02.
Снижение содержания кислорода во вдыхаемом газе может быть вызвано двумя причинами:
• избыточной концентрацией других компонентов газовой смеси (как правило, закиси азота);
• существенным падением атмосферного давления (дыханием разреженным воздухом высокогорья или транспортировкой пациента в самолете с негерметичным салоном).
Содержание кислорода в газовой смеси измеряется оксиметром - монитором, специально предназначенным для этой цели. Однако оксиметры до сих пор имеются далеко не во всех отделениях анестезии и интенсивной терапии, а сам метод, которому в этой книге посвящена отдельная глава, применяется значительно реже, чем пульсоксиметрия. Поэтому вероятнее всего сигнал о неблагополучии поступит от пульсоксиметра, а выяснять причину гипоксемии придется по ситуации.
Сниженное содержание кислорода в атмосферном воздухе - явление достаточно нетипичное, за исключением тех случаев, когда больница находится в горной местности. Однако риск формирования гипоксической дыхательной смеси во время наркоза вполне реален.
При любой десатурации, возникающей во время анестезии с применением закиси азота, необходимо в первую очередь проверить правильность дозирования кислорода и анестетика.
Гипоксемия, вызванная шунтом. Шунтирование крови в легких - одна из наиболее частых причин артериальной гипоксемии у пациентов в отделении интенсивной терапии и операционной..
Шунт - это часть легочного кровотока, проходящая но невентилируемым участкам легких. Венозная кровь, притекающая к легким и попадающая в шунты, не изменяет свой состав и на выходе из легких встречается с кровью, оттекающей от нормально работающих альвеол. В результате смешивания этих двух потоков образуется артериальная кровь, напряжение кислорода в которой снижено из-за примеси венозной крови (рис. 1.13). Поэтому шунтирование крови относят к группе расстройств легочного газообмена, объединенных названием "венозная примесь".

Прекращению вентиляции отдельных кровоснабжаемых участков легких способствуют самые разные причины:
* полная обструкция части дыхательных путей Пробками вязкой мокроты, аспирированными рвотными массами, сгустками крови, опухолью и пр.; при герметичной эндобронхиальной интубации в шунт может мгновенно превратиться целое легкое;
• пневмония - в пневмонических очагах альвеолы безвоздушны, так как заполнены экссудатом, а кровоток усилен из-за воспалительной гиперемии;
• микро- и макроателектазы - пожалуй, особенно частая причина шунтирования;
• при альвеолярном отеке легких зоны, заполненные транссудатом, превращаются в шунт;
• массивное, шунтирование крови происходит при респираторном дистресс-синдроме (РДС) через зоны интерстициального отека и консолидации альвеолярной ткани, множественные микроателектазы и участки с локальной обструкцией бронхов.
