Еще один вероятный механизм шунтирования - раскрытие артериовенозных анастомозов, имеющихся в легких, но не функционирующих в нормальных условиях. Факт существования таких анастомозов доказан экспериментально, но в целом проблема изучена недостаточно. Предполагается, что эти анастомозы предназначены для сброса части венозной крови при резком повышении давления в легочной артерии.
Уменьшить, или ликвидировать шунтирование можно, лишь устранив его, причину. Возрастание SpО2 после удаления мокроты, "раскашливания" больного, применения режимов ПДКВ (PEEP - англ.) или НПД (СРАР - англ.), увеличения среднего давления в дыхательных путях при ИВЛ, подтягивания слишком глубоко введенной интубационной трубки свидетельствует о том, что причиной артериальной гипоксемии был шунт.
Степень артериальной гипоксемии напрямую зависит от объема шунтирования. Вместе с тем при одинаковом объеме шунтирования SpO2 оказывается меньше у больных с анемией, сниженным минутным объемом кровообращения или повышенной потребностью в кислороде. У таких пациентов ткани усиленно извлекают кислород из артериальной крови. В результате от органов оттекает венозная кровь с резко сниженным содержанием кислорода. Шунтирование в легких венозной крови с аномально низким содержанием кислорода способствует дополнительному уменьшению Sp02. Поэтому коррекция гипоксемии, обусловленной шунтированием, включает также меры по нормализации системной
гемодинамики и ликвидированию анемии. Пульсоксиметрия позволяет контролировать эффективность этих-мер»;
К сожалению, во многих случаях рассчитывать на быстрое устранение шунта не приходится; наоборот, прогрессирование пневмонии, РДС или аспирационного пневмонита сопровождается вовлечением в патологический процесс все новых и новых участков легочной ткани,увеличением шунта и углублением гипоксемии.
Чтобы выиграть время, необходимое для лечения критической легочной патологии, применяют оксигенотерапию, которая уменьшает гипоксемию при работающих шунтах.
Механизм действия оксигенотерапии при гипоксемии, порожденной шунтом, довольно прост. При дыхании воздухом от нормально функционирующих легочных зон оттекает кровь, гемоглобин которой насыщен кислородом на 94-98 %. У больных с утолщенными альвеолокапиллярными мембранами этот показатель может быть и ниже из-за диффузионных расстройств. Использование газовой смеси с повышенной концентрацией кислорода позволяет насытить оставшиеся 2-6 % гемоглобина крови, протекающей по функционирующим альвеолам, а также увеличить, хоть и незначительно, количество кислорода, растворенного в плазме. При небольшом объеме шунтирования этого дополнительного количества кислорода, попавшего в кровь, оттекающую от здоровых легочных зон, достаточно, чтобы поднять сатурацию крови, поступившей из шунтов, до нормального уровня. Понятно, что при массивном шунтировании этот механизм малоэффективен и гипоксемия остается резистентной к оксигенотерапии.
Считается, что в случаях, когда в легких шунтируется до 10 % минутного объема кровообращения, гипоксемию можно полностью устранить ингаляцией 30 % кислорода. При 30 % шунте нормализовать SpO2 удается, только применяя чистый кислород. При объеме шунтирования свыше 50 % общего кровотока гипоксемия резистентна к оксигенотерапии, и даже с помощью 100 % кислорода удается увеличить SpO2 лишь на несколько процентов. Зная механизм действия оксигенотерапии при шунтировании, нетрудно понять, почему это так. Разумеется, приведенные здесь цифры' имеют ориёнтировочный характер, но весьма Типичны для подавляющего числа случаев. Реакция SpO2 на увеличение концентрации кислорода во вдыхаемом газе - важный критерий в диагностике шунтирования крови в легких.
Гипоксемия при регионарной гиповентиляции. Шунтирование крови в легких происходит при полном прекращении вентиляции кровоснабжаемого участка легких. Однако часто вентиляция отдельных легочных зон сохраняется, но становится недостаточной для обеспечения в них нормального газообмена. Возникает регионарная гиповентиляция.
В идеальном случае объем вентиляции легких в целом и каждого легочного региона в частности; должен соответствовать объему общего и регионарного кровотока. Но даже у здорового человека в легких, наряду с такими "идеальными" регионами, есть области, где вентиляция избыточна по отношению к крово-току (зоны с высокими вентиляционно-перфузионными отношениями). Сатурация гемоглобина крови, оттекающей от этих зон, на несколько процентов выше, чем в идеальных регионах.
Существуют также регионы, вентиляция которых недостаточна для полноценной обработки потока венозной крови (зоны с низкими вентиляционно-перфузионными отношениями) От таких областей поступает кровь с уменьшенной сатурацией. В норме избыточная сатурация крови в одних регионах эффективно компенсирует нехватку сатурации в других. Таким образом формируется нормальный газовый состав артериальной крови (рис. 1.14).
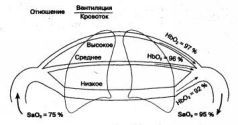 Рис. 1.14. Влияние различий регионарных вентиляционно-перфузионных отношений на SpO2 при дыхании атмосферным воздухом
Рис. 1.14. Влияние различий регионарных вентиляционно-перфузионных отношений на SpO2 при дыхании атмосферным воздухом
.Возможности этого естественного компенсирующего механизма ограничены кислородной емкостью основного переносчика кислорода - гемоглобина и достаточны лишь для нормально работающих легких.
В условиях патологии объем регионов с низкими вентиляционно-перфузионными отношениями порой увеличивается настолько, что полная компенсация становится невозможной. Когда поток недонасышенной кислородом крови от гиповенти-лируемых регионов резко возрастает, несколько дополнительных процентов сатурации, заработанные небольшим потоком крови в гипервентилируемых зонах, неспособны исправить ситуацию. Возникает артериальная гипоксемия, которую помогает выявить пульсоксиметр.
Развитие гипоксемии по вышеописанному механизму происходит лишь в том случае, когда больной дышит воздухом.
Увеличение концентрации кислорода во вдыхаемом или вдуваемом газе (FiO2) до 25-50 % позволяет существенно увеличить, а во многих случаях и полностью нормализовать SpO2.
Гипервентиляция (спонтанная или аппаратная) при венти-ляционио-перфузионном дисбалансе также способствует повышению Sp02 но ее эффективность меньше, чем у ок-сигенотерапии.
Появление в легких областей с низкими вентиляционно-перфузионными отношениями обусловлено двумя причинами: (1) локальным уменьшением вентиляции или (2) локальным увеличением кровотока.
Вентиляция региона может уменьшиться из-за сужения бронха, снижения растяжимости отдельных участков легочной ткани, пареза или болевого ограничения подвижности одного из куполов диафрагмы, одностороннего пневмо-, гемо- или гидроторакса. Основные конкретные причины нарушения вентиляции отдельных легочных регионов:
• уменьшение просвета бронхов вследствие скоплений мокроты;
• регионарный бронхиолоспазм;
• отек слизистой оболочки бронхиол, преобладающий в нижних отделах легких;
• сдавление мелких бронхов инфильтратами при РДС или очаговой пневмонии;
• частичное перекрытие крупных бронхов глубоко введенной интубационной трубкой;
• опухоль, наличие инородного тела в бронхах;
• увеличение жесткости отдельных участков легочной ткани, например при интерстициальном отеке, преобладающем в нижних зонах;
• недавно расправленный ателектаз;
• экспираторное закрытие дыхательных путей.
Локальное увеличение легочного кровотока происходит в результате его патологического перераспределения. Когда давление в легочной артерии снижается и становится недостаточным для подъема крови в верхние зоны легких, кровоток осуществляется главным образом через нижележащие отделы, вентиляция которых перестает соответствовать возросшему потоку крови. Сходная картина наблюдается при росте внутрилегочного давления (например при ИВЛ), которое пережимает альвеолярные капилляры в верхних зонах легких и тем самым направляет кровоток в нижние регионы, где капиллярное давление выше. Особенно выраженное снижение Sp02 наблюдается при сочетании этих двух факторов, например при ИВЛ на фоне гиповолемии.
Причины перераспределения легочного кровотока, которые могут вызвать артериальную гипоксемию:
• снижение давления в легочной артерии:
– гиповолемия, в том числе скрытая; "
– общая анестезия;
– применение некоторых вазодилататоров, действующих на артериолы малого круга;
– снижение минутного объема кровообращения;
• высокое внутрилегочное давление:
– ИВЛ;
– ПДКВ.НПД;
– ауто-ПДКВ.
Даже беглое знакомство с этим коротким списком позволяет сделать вывод, что на перераспределение кровотока в легких влияют причины функционального характера:) нарушения, кровообращения, воздействие медикаментов, режимы вентиляция. В этих
случаях гипоксемия возникает не в связи с поражением бронхо-легочного аппарата, а в результате нарушения условий его работы. Своевременная коррекция функциональных расстройств приводит к быстрой нормализации Sp02.
Итак, артериальная гипоксемия, обусловленная снижением регионарных вентиляционно-перфузионных отношений, порождается самыми разнообразными причинами (не исключено их сочетание). Пульсоксиметр может обнаружить снижение Sp02 у больного с кровотечением, высоким спинальным или эпидуральным блоком, задержкой мокроты, пневмотораксом или при "жестком" режиме ИВЛ; и во всех этих случаях работает один и тот же механизм развития гипоксемии - недостаточная по отношению к кровотоку вентиляция отдельных легочных регионов. Этим обстоятельством объясняется общее для всех перечисленных ситуаций явление: быстрое и полное устранение артериальной гипоксемии ингаляцией кислорода в относительно невысокой концентрации. Именно поэтому гипоксемия, вызванная регионарной гиповентиляцией, чаще наблюдается у пациентов, дышащих атмосферным воздухом. Оксигенотерапия во многих случаях; способна замаскировать данный тип расстройств легочного газообмена. Механизм действия оксигеноте-рапии на газообмен в гиповентилируемых регионах аналогичен таковому на легкие в целом при общей гиповентиляции: достаточно увеличить концентрацию кислорода в гиповентилируемых альвеолах, чтобы нормализовать сатурацию протекающей по ним крови.
Гипоксемия при диффузионных расстройствах. Теоретические аспекты нарушения диффузии Кислорода через барьер, отделяющий гемоглобин эритроцитов от альвеолярного газа, разработаны достаточно подробно. Этого, к сожалению, нельзя сказать о клинической оценке диффузионных расстройств при анестезии и интенсивной терапии. Несмотря на ясные представления о механизмах нарушения диффузии кислорода в легких, практическая медицина критических состояний в настоящее время не располагает общедоступными методами выявления (не говоря уже о точной количественной оценке) диффузионных расстройств у конкретного больного.
Уменьшение диффузионной способности легких сказывается прежде всего на переносе кислорода из альвеол в кровь. Внутрилегочный обмен углекислого газа не страдает даже при выраженных диффузионных расстройствах, так как СО2, в силу своей высокой растворимости в водных средах, обладает очень большой проникающей способностью.
Причины нарушения диффузии кислорода из альвеол в кровь легочных капилляров достаточно разнообразны:
• уменьшение общей площади функционирующих альвеол (сокращение эффективной дыхательной поверхности):
– обширные резекции легочной ткани, пульмонэктомия;
– множественные ателектазы, коллапс легкого;
– обширная пневмония;
– РДС;
– массивная тромбоэмболия легочных сосудов;
• утолщение альвеолокапиллярной мембраны из-за ее отека или фиброза;
• в обоих случаях гипоксемия усиливается при увеличении линейной скорости движения крови по легочным сосудам, когда времени нахождения эритроцита в капилляре не хватает для завершения сатурации гемоглобина:
– гипердинамические состояния кровообращения (сепсис, инфузия адреномиметиков, физическая нагрузка и пр.):
– уменьшение количества функционирующих легочных сосудов: резекции легких, тромбозы и эмболии в системе малого) круга.
Три вышеперечисленных фактора, ограничивающие диффузию и вызывающие артериальную гипоксемию, встречаются при различной патологии.
Гипоксемия, обусловленная диффузионными расстройствами, обычно легко устраняется ингаляцией кислорода.
При повышении концентрации кислорода в альвеолах возрастает движущая сила диффузии - разность напряжений газа по обе стороны альвеоло-капиллярной мембраны. В результате гипоксемия уменьшается или исчезает, хотя Причина, по которой она возникла, остается. Лишь при крайне выраженных диффузионных расстройствах эффект оксигенотерапии может быть неполным.
В клинической практике гипоксемия, развивающаяся вследствие нарушений диффузии, наблюдается очень часто, но, к сожалению, в каждом случае мы можем лишь предполагать наличие нарушений, опираясь на здравый смысл и знание прикладной физиологии.
Гипоксемия смешанного происхождения
Нередко артериальная гипоксемия порождается несколькими механизмами, действующими одновременно. Рассмотрим на двух примерах, как у таких больных использовать данные пуль-соксиметрии для диагностики этих механизмов и определения патогенетически обоснованных мер коррекции гипоксемии.
Пример 1
Ситуация: у больного через несколько минут после введения раствора местного анестетика в эпидуральный катетер развилась клиническая картина тотального спинального блока с резким уменьшением SpO2. На дисплее пульсоксиметра отмечается появление дыхательных волн.
Причины гипоксемии: (1) общая гиповентиляция, вызванная релаксацией межреберных мышц и диафрагмы, и (2) регионарная гиповентиляция вследствие перераспределения легочного кровотока, вызванного относительной гиповолемией.
Проблемы: ИВЛ, которая может потребоваться для решения первой проблемы, приводит к критическому снижению венозного возврата и усиливает неравномерность распределения легочного кровотока.
Коррекция гипоксемии: (1) ингаляция 100 % кислорода через маску или интубационную трубку, (2) при выраженной гиповентиляции - вспомогательная ИВЛ, лучше в высокочастотном режиме с минимальным положительным давлением, а при апноэ - ИВЛ (лучше - ВЧ ИВЛ или ИВЛ с активным выдохом), (3) форсированная инфузионная терапия, применение эфедрина или других вазопрессоров.
Комментарий: оксигенотерапия - универсальное средство, которое эффективно как при общей, так и при регионарной гиповентиляции. При недостаточности этой меры (низкий уровень Sp02 и/или признаки нарастающей гиперкапнии) приходится устранять гиповентиляцию с помощью ИВЛ. Искусственная вентиляция легких воздухом (например, мешком AMBU) ликвидирует компонент гипоксемии, связанный с общей гиповентиляцией, но усиливает неравномерность распределения легочного кровотока(гиповолемия!) и поэтому неспособна нормализовать Sp02. Необходимо поднять Fi Оад принять активные меры для увеличения венозного возврата. Режим ИВЛ следует подбирать так, чтобы среднее давление в дыхательных путях было минимальным.
Пример 2
Ситуация: больному с субтотальной пневмонией осуществляется ИВЛ с повышенным давлением вдоха и отношением вдох:
выдох 1: 2. Несмотря на высокое содержание кислорода во вдуваемом газе, SpO; остается резко сниженным. На фоне инфузии добутамина, начатой в связи с синдромом малого сердечного выброса, отмечено увеличение SpO2.
Причины гипоксемии: (1) шунтировавйе крови через пневмонические очаги, (2) диффузионные расстройства, вызванные резчайшим сокращением дыхательной поверхности, (3) выраженное уменьшение функциональной остаточной емкости, запаса кислорода в которой недостаточно для оксигенации капиллярной крови в фазе выдоха, то есть на протяжении 1/3 каждого дыхательного цикла.
Проблемы: высокое давление во время искусственного вдоха пережимает капилляры в работающих зонах легких, в результате чего кровоток направляется в шунты.
Коррекция гипоксемии: увеличение сократимости правого желудочка под действием добутамина приводит К дополнительному повышению давления в легочной артерии, которое противодействует компрессии легочных капилляров во время вдоха в работающих участках легких. За счет этого увеличивается кровоток по вентилируемым зонам и возрастает Sp02. Кроме того, увеличение минутного объема кровообращения обычно сопровождается некоторым повышением содержания кислорода в венозной крови, попадающей затем в легочные шунты. Это также способствует росту SpO2.
Комментарий: можно несколько уменьшить шунтирование и увеличить дыхательную поверхность, расправив микроателектазы, которые всегда имеются в подобных ситуациях. Это достигается специальным подбором метода искусственной вентиляции и параметров режима. Повысить ФОБ удается с помощью ПДКВ или, лучше, применением ИВЛ с инверсией фаз дыхательного цикла. Мониторинг Sp02 позволяет непрерывно контролировать результат!
Применение пульсоксиметрии в типичных клинических ситуациях
Уменьшить, или ликвидировать шунтирование можно, лишь устранив его, причину. Возрастание SpО2 после удаления мокроты, "раскашливания" больного, применения режимов ПДКВ (PEEP - англ.) или НПД (СРАР - англ.), увеличения среднего давления в дыхательных путях при ИВЛ, подтягивания слишком глубоко введенной интубационной трубки свидетельствует о том, что причиной артериальной гипоксемии был шунт.
Степень артериальной гипоксемии напрямую зависит от объема шунтирования. Вместе с тем при одинаковом объеме шунтирования SpO2 оказывается меньше у больных с анемией, сниженным минутным объемом кровообращения или повышенной потребностью в кислороде. У таких пациентов ткани усиленно извлекают кислород из артериальной крови. В результате от органов оттекает венозная кровь с резко сниженным содержанием кислорода. Шунтирование в легких венозной крови с аномально низким содержанием кислорода способствует дополнительному уменьшению Sp02. Поэтому коррекция гипоксемии, обусловленной шунтированием, включает также меры по нормализации системной
гемодинамики и ликвидированию анемии. Пульсоксиметрия позволяет контролировать эффективность этих-мер»;
К сожалению, во многих случаях рассчитывать на быстрое устранение шунта не приходится; наоборот, прогрессирование пневмонии, РДС или аспирационного пневмонита сопровождается вовлечением в патологический процесс все новых и новых участков легочной ткани,увеличением шунта и углублением гипоксемии.
Чтобы выиграть время, необходимое для лечения критической легочной патологии, применяют оксигенотерапию, которая уменьшает гипоксемию при работающих шунтах.
Механизм действия оксигенотерапии при гипоксемии, порожденной шунтом, довольно прост. При дыхании воздухом от нормально функционирующих легочных зон оттекает кровь, гемоглобин которой насыщен кислородом на 94-98 %. У больных с утолщенными альвеолокапиллярными мембранами этот показатель может быть и ниже из-за диффузионных расстройств. Использование газовой смеси с повышенной концентрацией кислорода позволяет насытить оставшиеся 2-6 % гемоглобина крови, протекающей по функционирующим альвеолам, а также увеличить, хоть и незначительно, количество кислорода, растворенного в плазме. При небольшом объеме шунтирования этого дополнительного количества кислорода, попавшего в кровь, оттекающую от здоровых легочных зон, достаточно, чтобы поднять сатурацию крови, поступившей из шунтов, до нормального уровня. Понятно, что при массивном шунтировании этот механизм малоэффективен и гипоксемия остается резистентной к оксигенотерапии.
Считается, что в случаях, когда в легких шунтируется до 10 % минутного объема кровообращения, гипоксемию можно полностью устранить ингаляцией 30 % кислорода. При 30 % шунте нормализовать SpO2 удается, только применяя чистый кислород. При объеме шунтирования свыше 50 % общего кровотока гипоксемия резистентна к оксигенотерапии, и даже с помощью 100 % кислорода удается увеличить SpO2 лишь на несколько процентов. Зная механизм действия оксигенотерапии при шунтировании, нетрудно понять, почему это так. Разумеется, приведенные здесь цифры' имеют ориёнтировочный характер, но весьма Типичны для подавляющего числа случаев. Реакция SpO2 на увеличение концентрации кислорода во вдыхаемом газе - важный критерий в диагностике шунтирования крови в легких.
Гипоксемия при регионарной гиповентиляции. Шунтирование крови в легких происходит при полном прекращении вентиляции кровоснабжаемого участка легких. Однако часто вентиляция отдельных легочных зон сохраняется, но становится недостаточной для обеспечения в них нормального газообмена. Возникает регионарная гиповентиляция.
В идеальном случае объем вентиляции легких в целом и каждого легочного региона в частности; должен соответствовать объему общего и регионарного кровотока. Но даже у здорового человека в легких, наряду с такими "идеальными" регионами, есть области, где вентиляция избыточна по отношению к крово-току (зоны с высокими вентиляционно-перфузионными отношениями). Сатурация гемоглобина крови, оттекающей от этих зон, на несколько процентов выше, чем в идеальных регионах.
Существуют также регионы, вентиляция которых недостаточна для полноценной обработки потока венозной крови (зоны с низкими вентиляционно-перфузионными отношениями) От таких областей поступает кровь с уменьшенной сатурацией. В норме избыточная сатурация крови в одних регионах эффективно компенсирует нехватку сатурации в других. Таким образом формируется нормальный газовый состав артериальной крови (рис. 1.14).

.Возможности этого естественного компенсирующего механизма ограничены кислородной емкостью основного переносчика кислорода - гемоглобина и достаточны лишь для нормально работающих легких.
В условиях патологии объем регионов с низкими вентиляционно-перфузионными отношениями порой увеличивается настолько, что полная компенсация становится невозможной. Когда поток недонасышенной кислородом крови от гиповенти-лируемых регионов резко возрастает, несколько дополнительных процентов сатурации, заработанные небольшим потоком крови в гипервентилируемых зонах, неспособны исправить ситуацию. Возникает артериальная гипоксемия, которую помогает выявить пульсоксиметр.
Развитие гипоксемии по вышеописанному механизму происходит лишь в том случае, когда больной дышит воздухом.
Увеличение концентрации кислорода во вдыхаемом или вдуваемом газе (FiO2) до 25-50 % позволяет существенно увеличить, а во многих случаях и полностью нормализовать SpO2.
Гипервентиляция (спонтанная или аппаратная) при венти-ляционио-перфузионном дисбалансе также способствует повышению Sp02 но ее эффективность меньше, чем у ок-сигенотерапии.
Появление в легких областей с низкими вентиляционно-перфузионными отношениями обусловлено двумя причинами: (1) локальным уменьшением вентиляции или (2) локальным увеличением кровотока.
Вентиляция региона может уменьшиться из-за сужения бронха, снижения растяжимости отдельных участков легочной ткани, пареза или болевого ограничения подвижности одного из куполов диафрагмы, одностороннего пневмо-, гемо- или гидроторакса. Основные конкретные причины нарушения вентиляции отдельных легочных регионов:
• уменьшение просвета бронхов вследствие скоплений мокроты;
• регионарный бронхиолоспазм;
• отек слизистой оболочки бронхиол, преобладающий в нижних отделах легких;
• сдавление мелких бронхов инфильтратами при РДС или очаговой пневмонии;
• частичное перекрытие крупных бронхов глубоко введенной интубационной трубкой;
• опухоль, наличие инородного тела в бронхах;
• увеличение жесткости отдельных участков легочной ткани, например при интерстициальном отеке, преобладающем в нижних зонах;
• недавно расправленный ателектаз;
• экспираторное закрытие дыхательных путей.
Локальное увеличение легочного кровотока происходит в результате его патологического перераспределения. Когда давление в легочной артерии снижается и становится недостаточным для подъема крови в верхние зоны легких, кровоток осуществляется главным образом через нижележащие отделы, вентиляция которых перестает соответствовать возросшему потоку крови. Сходная картина наблюдается при росте внутрилегочного давления (например при ИВЛ), которое пережимает альвеолярные капилляры в верхних зонах легких и тем самым направляет кровоток в нижние регионы, где капиллярное давление выше. Особенно выраженное снижение Sp02 наблюдается при сочетании этих двух факторов, например при ИВЛ на фоне гиповолемии.
Причины перераспределения легочного кровотока, которые могут вызвать артериальную гипоксемию:
• снижение давления в легочной артерии:
– гиповолемия, в том числе скрытая; "
– общая анестезия;
– применение некоторых вазодилататоров, действующих на артериолы малого круга;
– снижение минутного объема кровообращения;
• высокое внутрилегочное давление:
– ИВЛ;
– ПДКВ.НПД;
– ауто-ПДКВ.
Даже беглое знакомство с этим коротким списком позволяет сделать вывод, что на перераспределение кровотока в легких влияют причины функционального характера:) нарушения, кровообращения, воздействие медикаментов, режимы вентиляция. В этих
случаях гипоксемия возникает не в связи с поражением бронхо-легочного аппарата, а в результате нарушения условий его работы. Своевременная коррекция функциональных расстройств приводит к быстрой нормализации Sp02.
Итак, артериальная гипоксемия, обусловленная снижением регионарных вентиляционно-перфузионных отношений, порождается самыми разнообразными причинами (не исключено их сочетание). Пульсоксиметр может обнаружить снижение Sp02 у больного с кровотечением, высоким спинальным или эпидуральным блоком, задержкой мокроты, пневмотораксом или при "жестком" режиме ИВЛ; и во всех этих случаях работает один и тот же механизм развития гипоксемии - недостаточная по отношению к кровотоку вентиляция отдельных легочных регионов. Этим обстоятельством объясняется общее для всех перечисленных ситуаций явление: быстрое и полное устранение артериальной гипоксемии ингаляцией кислорода в относительно невысокой концентрации. Именно поэтому гипоксемия, вызванная регионарной гиповентиляцией, чаще наблюдается у пациентов, дышащих атмосферным воздухом. Оксигенотерапия во многих случаях; способна замаскировать данный тип расстройств легочного газообмена. Механизм действия оксигеноте-рапии на газообмен в гиповентилируемых регионах аналогичен таковому на легкие в целом при общей гиповентиляции: достаточно увеличить концентрацию кислорода в гиповентилируемых альвеолах, чтобы нормализовать сатурацию протекающей по ним крови.
Гипоксемия при диффузионных расстройствах. Теоретические аспекты нарушения диффузии Кислорода через барьер, отделяющий гемоглобин эритроцитов от альвеолярного газа, разработаны достаточно подробно. Этого, к сожалению, нельзя сказать о клинической оценке диффузионных расстройств при анестезии и интенсивной терапии. Несмотря на ясные представления о механизмах нарушения диффузии кислорода в легких, практическая медицина критических состояний в настоящее время не располагает общедоступными методами выявления (не говоря уже о точной количественной оценке) диффузионных расстройств у конкретного больного.
Уменьшение диффузионной способности легких сказывается прежде всего на переносе кислорода из альвеол в кровь. Внутрилегочный обмен углекислого газа не страдает даже при выраженных диффузионных расстройствах, так как СО2, в силу своей высокой растворимости в водных средах, обладает очень большой проникающей способностью.
Причины нарушения диффузии кислорода из альвеол в кровь легочных капилляров достаточно разнообразны:
• уменьшение общей площади функционирующих альвеол (сокращение эффективной дыхательной поверхности):
– обширные резекции легочной ткани, пульмонэктомия;
– множественные ателектазы, коллапс легкого;
– обширная пневмония;
– РДС;
– массивная тромбоэмболия легочных сосудов;
• утолщение альвеолокапиллярной мембраны из-за ее отека или фиброза;
• в обоих случаях гипоксемия усиливается при увеличении линейной скорости движения крови по легочным сосудам, когда времени нахождения эритроцита в капилляре не хватает для завершения сатурации гемоглобина:
– гипердинамические состояния кровообращения (сепсис, инфузия адреномиметиков, физическая нагрузка и пр.):
– уменьшение количества функционирующих легочных сосудов: резекции легких, тромбозы и эмболии в системе малого) круга.
Три вышеперечисленных фактора, ограничивающие диффузию и вызывающие артериальную гипоксемию, встречаются при различной патологии.
Гипоксемия, обусловленная диффузионными расстройствами, обычно легко устраняется ингаляцией кислорода.
При повышении концентрации кислорода в альвеолах возрастает движущая сила диффузии - разность напряжений газа по обе стороны альвеоло-капиллярной мембраны. В результате гипоксемия уменьшается или исчезает, хотя Причина, по которой она возникла, остается. Лишь при крайне выраженных диффузионных расстройствах эффект оксигенотерапии может быть неполным.
В клинической практике гипоксемия, развивающаяся вследствие нарушений диффузии, наблюдается очень часто, но, к сожалению, в каждом случае мы можем лишь предполагать наличие нарушений, опираясь на здравый смысл и знание прикладной физиологии.
Гипоксемия смешанного происхождения
Нередко артериальная гипоксемия порождается несколькими механизмами, действующими одновременно. Рассмотрим на двух примерах, как у таких больных использовать данные пуль-соксиметрии для диагностики этих механизмов и определения патогенетически обоснованных мер коррекции гипоксемии.
Пример 1
Ситуация: у больного через несколько минут после введения раствора местного анестетика в эпидуральный катетер развилась клиническая картина тотального спинального блока с резким уменьшением SpO2. На дисплее пульсоксиметра отмечается появление дыхательных волн.
Причины гипоксемии: (1) общая гиповентиляция, вызванная релаксацией межреберных мышц и диафрагмы, и (2) регионарная гиповентиляция вследствие перераспределения легочного кровотока, вызванного относительной гиповолемией.
Проблемы: ИВЛ, которая может потребоваться для решения первой проблемы, приводит к критическому снижению венозного возврата и усиливает неравномерность распределения легочного кровотока.
Коррекция гипоксемии: (1) ингаляция 100 % кислорода через маску или интубационную трубку, (2) при выраженной гиповентиляции - вспомогательная ИВЛ, лучше в высокочастотном режиме с минимальным положительным давлением, а при апноэ - ИВЛ (лучше - ВЧ ИВЛ или ИВЛ с активным выдохом), (3) форсированная инфузионная терапия, применение эфедрина или других вазопрессоров.
Комментарий: оксигенотерапия - универсальное средство, которое эффективно как при общей, так и при регионарной гиповентиляции. При недостаточности этой меры (низкий уровень Sp02 и/или признаки нарастающей гиперкапнии) приходится устранять гиповентиляцию с помощью ИВЛ. Искусственная вентиляция легких воздухом (например, мешком AMBU) ликвидирует компонент гипоксемии, связанный с общей гиповентиляцией, но усиливает неравномерность распределения легочного кровотока(гиповолемия!) и поэтому неспособна нормализовать Sp02. Необходимо поднять Fi Оад принять активные меры для увеличения венозного возврата. Режим ИВЛ следует подбирать так, чтобы среднее давление в дыхательных путях было минимальным.
Пример 2
Ситуация: больному с субтотальной пневмонией осуществляется ИВЛ с повышенным давлением вдоха и отношением вдох:
выдох 1: 2. Несмотря на высокое содержание кислорода во вдуваемом газе, SpO; остается резко сниженным. На фоне инфузии добутамина, начатой в связи с синдромом малого сердечного выброса, отмечено увеличение SpO2.
Причины гипоксемии: (1) шунтировавйе крови через пневмонические очаги, (2) диффузионные расстройства, вызванные резчайшим сокращением дыхательной поверхности, (3) выраженное уменьшение функциональной остаточной емкости, запаса кислорода в которой недостаточно для оксигенации капиллярной крови в фазе выдоха, то есть на протяжении 1/3 каждого дыхательного цикла.
Проблемы: высокое давление во время искусственного вдоха пережимает капилляры в работающих зонах легких, в результате чего кровоток направляется в шунты.
Коррекция гипоксемии: увеличение сократимости правого желудочка под действием добутамина приводит К дополнительному повышению давления в легочной артерии, которое противодействует компрессии легочных капилляров во время вдоха в работающих участках легких. За счет этого увеличивается кровоток по вентилируемым зонам и возрастает Sp02. Кроме того, увеличение минутного объема кровообращения обычно сопровождается некоторым повышением содержания кислорода в венозной крови, попадающей затем в легочные шунты. Это также способствует росту SpO2.
Комментарий: можно несколько уменьшить шунтирование и увеличить дыхательную поверхность, расправив микроателектазы, которые всегда имеются в подобных ситуациях. Это достигается специальным подбором метода искусственной вентиляции и параметров режима. Повысить ФОБ удается с помощью ПДКВ или, лучше, применением ИВЛ с инверсией фаз дыхательного цикла. Мониторинг Sp02 позволяет непрерывно контролировать результат!
Применение пульсоксиметрии в типичных клинических ситуациях
Пульсоксиметрия при гиповолемии. Острая гиповолемия - самый частый компонент расстройств кровообращения при критических состояниях. Но, несмотря на это обстоятельство, диагностика несоответствия объема циркулирующей крови емкости сосудистого русла во многих случаяхсвязана со значительными трудностями. Поэтому выбор объема и состава инфузионной и медикаментозной терапии гиповолемии в основном зависит от опыта врача, а контроль эффективности лечения нередко сводится к оценке внешнего вида больного, измерению центрального венозного и артериального давления и контролю диуреза.
Пульсоксиметрия не принадлежит к точным методам мониторинга гемодииамики, однако нарушения системного и легочного кровообращения, вызванные гиповолемией, приводят к типичным изменениям пульсоксиметрических показателей, которые дополняют общую картину.
Комплекс изменений на дисплее пульсоксиметра, возникающий при гиповолемии, складывается из следующих симптомов.
• Снижение 5р0г, обусловленное выраженной неравномерностью легочного кровотока. Этот признак очень типичен для гиповолемии, но может быть выявлен только у больных, дышащих воздухом или смесью N2O: 02 с высоким содержанием закиси азота. Для коррекции гипоксемии, вызванной гиповолемией, обычно достаточно умеренного (до 30-50 %) увеличения содержания кислорода во вдыхаемом газе.
• Тахикардия - компенсаторная реакция, направленная на поддержание сердечного выброса.
• Снижение амплитуды фотоплетизмограммы в результате периферического артериолоспазма и уменьшения ударного объема. При выраженных расстройствах кровообращения пульсирующий сигнал настолько затухает, что пульсоксиметр иногда вообще отказывается работать. Увеличение амплитуды ФПГ на фоне интенсивной терапии свидетельствует о восстановлении периферического кровотока. Нужно иметь в виду, что артериолоспазм, возникший из-за гиповолемии, способен сохраняться некоторое время после нормализации ОЦК. Дыхательные волны на фотоплетизмограмме (рис. 1.15) - колебания высоты волн, синхронные с дыханием*. На этот признак редко обращают внимание, хотя при гиповолемии он порой появляется раньше остальных. Дыхательные волны отражают возросшую чувствительность венозного возврата к колебаниям внутригрудного давления, что в большей степени характерно для гиповолемии ив несколько меньшей - для ИВЛ.
* В некоторых моделях пульсоксиметров имеется функция автоматического приведения ФПГ к изолинии -чтобы придать картинке на дисплее "красивый" вид. Эта любезность разработчиков лишает нас одного из самых чувствительных и демонстративных симптомов гиноволемии. Автоматическое масштабирование ФПГ (autoscaling) обычно не сглаживает дыхательные волны, так как ЭТА функция включается при более или менее стойком изменении амплитуды.
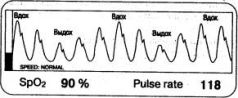 Рис. 1.15. Типичная пульсоксиметрическая картина при гиповолемии:
Рис. 1.15. Типичная пульсоксиметрическая картина при гиповолемии:
гипоксемия, тахикардия, низкая амплитуда ФПГ и дыхательные волны
Последний из перечисленных симптомов нуждается в пояснениях. При самостоятельном дыхании каждому вдоху соответствуют снижение внутригрудного давления и временное увеличение венозного возврата. Поэтому несколько сердечных циклов, приходящихся на фазу вдоха, характеризуются возросшим ударным объемом. На ФПГ им соответствуют высокие пульсовые волны. Клиническим эквивалентом дыхательных волн является парадоксальный пульс, но чувствительность пульсоксиметра в данном случае выше, чем у пальцев врача (если этот врач не китаец).
При ИВЛ наблюдается обратная картина. Вдувание газа в легкие приводит к росту внутригрудного давления. При гиповолемии это сопровождается временным ограничением венозного возврата и снижением волн ФПГ. В фазе выдоха амплитуда ФПГ увеличивается, возвращаясь к исходному уровню.
Поэтому при проведении ИВЛ больным с гиповолемией рекомендуется уменьшать дыхательный объем компенсаторно увеличивать частоту вентиляции, снижать отношение вдох:
выдох до 1:3 и избегать применения ПДКВ. Подбор режима, основанный на этих принципах, позволяет существенно снизить пиковое и среднее внутригрудное давление и тем самым уменьшить отрицательное влияние ИВЛ на венозный возврат. Перевыполнение этих рекомендаций логически приводит нас к оптимальному способу вентиляции при гиповолемии - высокочастотной ИВЛ, которая должна осуществляться с относительно невысокой частотой (80-120 в 1 мин) и отношением вдох: выдох, равному 1:3.
Обнаружение вышеперечисленных пульсоксиметрических признаков гиповолемии доступно только при использовании монитора соответствующего класса.
Такой монитор должен обладать свойством отражения реальной амплитуды ФПГ столбчатым индикатором (самый частый вариант) или в цифровом виде ("амплитудный фактор" DATEX). Желательно, чтобы пульсоксиметр запоминал и воспроизводил в виде трендов изменения не только SpO2, но и амплитуды ФПГ*.
* Тренд амплитуды ФПГ выводится на дисплей лишь у единичных моделей пульсоксиметров. К ним относятся, например, мониторы серии AURA фирмы CURATIVUS.
Такие явления, как дыхательные волны на ФПГ, лучше определяются при малой скорости записи, когда на экране помещается большое количество циклов, но для этого должна иметься возможность регулировать временной масштаб дисплея. И наконец, надо помнить, что при гиповолемии ушной датчик обычно дает более качественный сигнал, чем пальцевой.
Кстати, пульсоксиметрия предоставляет возможность оценить эффективность специального приема, с помощью которого удается в большинстве случаев существенно уменьшить отрицательное влияние ИВЛ на гемодинамику при гиповолемии. Речь идет о режиме ИВЛ с активным выдохом (отрицательном давлении в фазе выдоха, NEEP). Снижение давления в дыхательных путях в фазе выдоха до (-3)-(-8) см вод. ст. увеличивает венозный возврат и ударный объем, что проявляется возрастанием амплитуды волн ФПГ. Увеличение дыхательных волн на ФПГ при вентиляции в этом режиме обусловлено циклическим возрастанием венозною возбрзла. в фазе активного выдоха 1.
Адекватная терапия острой гиповолемии приводит к нормализации пульсоксиметрических показателей. При отсутствии специфических травм или других сопутствующих обстоятельств стойкое снижение SpO2 после коррекции волемических расстройств обусловлено двумя причинами:
1. Гипергидратацией легочной ткани при избыточном объеме инфузий. SpО2 удается постепенно нормализовать, проводя терапию диуретиками и применяя сеансы дыхания в режиме ПДКВ или НПД.
2. Неуклонно прогрессирующее снижение SpО2 должно настораживать, поскольку может оказаться первым признаком повреждения легких по типу респираторяого дистресс-синдро-ма. В этом случае положительное действие дегидратационной терапии на SpO2 оказывается неотчетливым и нестойким, а, поначалу эффективная, оксигенотерапия вскоре неспособна устранить артериальную гипоксемию.
Пульсоксиметрия ори оксигенотерапии. Увеличение концентрации кислорода во вдыхаемой или вдуваемой газовой смеси - универсальный способ коррекции артериальной гипоксемии. У большинства пациентов одной только оксигенотерапии, как правило, достаточно для того, чтобы нормализовать или хотя бы повысить Sр02. Однако, руководствуясь принципом: "Если больной дышит плохо, пусть он плохо дышит кислородом' 1, - полезно иметь в виду следующее:
• беспричинной гипоксемии не бывает;
• кислород ликвидирует гипоксемию, но не причину, ее породившую;
• к кислороду необходимо относиться так же, как к любому другому медицинскому препарату; его нужно применять по определенным показаниям, в определенных дозах.и помнить, что он обладает весьма опасными побочными эффектами;
В настоящее время наблюдается крайне сдержанное, а нередко и откровенно негативное отношение к атому режиму, в основном из-за его способности провоцировать раннее экспираторное закрытие дыхательных путей (ЭЗДП). Об этой опасности действительно необходимо помнить, как, впрочем, и о том, что в неумелых руках любой метод лечения обычно' реализуется побочными действиями, а не лечебным эффектом..
Пульсоксиметрия не принадлежит к точным методам мониторинга гемодииамики, однако нарушения системного и легочного кровообращения, вызванные гиповолемией, приводят к типичным изменениям пульсоксиметрических показателей, которые дополняют общую картину.
Комплекс изменений на дисплее пульсоксиметра, возникающий при гиповолемии, складывается из следующих симптомов.
• Снижение 5р0г, обусловленное выраженной неравномерностью легочного кровотока. Этот признак очень типичен для гиповолемии, но может быть выявлен только у больных, дышащих воздухом или смесью N2O: 02 с высоким содержанием закиси азота. Для коррекции гипоксемии, вызванной гиповолемией, обычно достаточно умеренного (до 30-50 %) увеличения содержания кислорода во вдыхаемом газе.
• Тахикардия - компенсаторная реакция, направленная на поддержание сердечного выброса.
• Снижение амплитуды фотоплетизмограммы в результате периферического артериолоспазма и уменьшения ударного объема. При выраженных расстройствах кровообращения пульсирующий сигнал настолько затухает, что пульсоксиметр иногда вообще отказывается работать. Увеличение амплитуды ФПГ на фоне интенсивной терапии свидетельствует о восстановлении периферического кровотока. Нужно иметь в виду, что артериолоспазм, возникший из-за гиповолемии, способен сохраняться некоторое время после нормализации ОЦК. Дыхательные волны на фотоплетизмограмме (рис. 1.15) - колебания высоты волн, синхронные с дыханием*. На этот признак редко обращают внимание, хотя при гиповолемии он порой появляется раньше остальных. Дыхательные волны отражают возросшую чувствительность венозного возврата к колебаниям внутригрудного давления, что в большей степени характерно для гиповолемии ив несколько меньшей - для ИВЛ.
* В некоторых моделях пульсоксиметров имеется функция автоматического приведения ФПГ к изолинии -чтобы придать картинке на дисплее "красивый" вид. Эта любезность разработчиков лишает нас одного из самых чувствительных и демонстративных симптомов гиноволемии. Автоматическое масштабирование ФПГ (autoscaling) обычно не сглаживает дыхательные волны, так как ЭТА функция включается при более или менее стойком изменении амплитуды.

гипоксемия, тахикардия, низкая амплитуда ФПГ и дыхательные волны
Последний из перечисленных симптомов нуждается в пояснениях. При самостоятельном дыхании каждому вдоху соответствуют снижение внутригрудного давления и временное увеличение венозного возврата. Поэтому несколько сердечных циклов, приходящихся на фазу вдоха, характеризуются возросшим ударным объемом. На ФПГ им соответствуют высокие пульсовые волны. Клиническим эквивалентом дыхательных волн является парадоксальный пульс, но чувствительность пульсоксиметра в данном случае выше, чем у пальцев врача (если этот врач не китаец).
При ИВЛ наблюдается обратная картина. Вдувание газа в легкие приводит к росту внутригрудного давления. При гиповолемии это сопровождается временным ограничением венозного возврата и снижением волн ФПГ. В фазе выдоха амплитуда ФПГ увеличивается, возвращаясь к исходному уровню.
Поэтому при проведении ИВЛ больным с гиповолемией рекомендуется уменьшать дыхательный объем компенсаторно увеличивать частоту вентиляции, снижать отношение вдох:
выдох до 1:3 и избегать применения ПДКВ. Подбор режима, основанный на этих принципах, позволяет существенно снизить пиковое и среднее внутригрудное давление и тем самым уменьшить отрицательное влияние ИВЛ на венозный возврат. Перевыполнение этих рекомендаций логически приводит нас к оптимальному способу вентиляции при гиповолемии - высокочастотной ИВЛ, которая должна осуществляться с относительно невысокой частотой (80-120 в 1 мин) и отношением вдох: выдох, равному 1:3.
Обнаружение вышеперечисленных пульсоксиметрических признаков гиповолемии доступно только при использовании монитора соответствующего класса.
Такой монитор должен обладать свойством отражения реальной амплитуды ФПГ столбчатым индикатором (самый частый вариант) или в цифровом виде ("амплитудный фактор" DATEX). Желательно, чтобы пульсоксиметр запоминал и воспроизводил в виде трендов изменения не только SpO2, но и амплитуды ФПГ*.
* Тренд амплитуды ФПГ выводится на дисплей лишь у единичных моделей пульсоксиметров. К ним относятся, например, мониторы серии AURA фирмы CURATIVUS.
Такие явления, как дыхательные волны на ФПГ, лучше определяются при малой скорости записи, когда на экране помещается большое количество циклов, но для этого должна иметься возможность регулировать временной масштаб дисплея. И наконец, надо помнить, что при гиповолемии ушной датчик обычно дает более качественный сигнал, чем пальцевой.
Кстати, пульсоксиметрия предоставляет возможность оценить эффективность специального приема, с помощью которого удается в большинстве случаев существенно уменьшить отрицательное влияние ИВЛ на гемодинамику при гиповолемии. Речь идет о режиме ИВЛ с активным выдохом (отрицательном давлении в фазе выдоха, NEEP). Снижение давления в дыхательных путях в фазе выдоха до (-3)-(-8) см вод. ст. увеличивает венозный возврат и ударный объем, что проявляется возрастанием амплитуды волн ФПГ. Увеличение дыхательных волн на ФПГ при вентиляции в этом режиме обусловлено циклическим возрастанием венозною возбрзла. в фазе активного выдоха 1.
Адекватная терапия острой гиповолемии приводит к нормализации пульсоксиметрических показателей. При отсутствии специфических травм или других сопутствующих обстоятельств стойкое снижение SpO2 после коррекции волемических расстройств обусловлено двумя причинами:
1. Гипергидратацией легочной ткани при избыточном объеме инфузий. SpО2 удается постепенно нормализовать, проводя терапию диуретиками и применяя сеансы дыхания в режиме ПДКВ или НПД.
2. Неуклонно прогрессирующее снижение SpО2 должно настораживать, поскольку может оказаться первым признаком повреждения легких по типу респираторяого дистресс-синдро-ма. В этом случае положительное действие дегидратационной терапии на SpO2 оказывается неотчетливым и нестойким, а, поначалу эффективная, оксигенотерапия вскоре неспособна устранить артериальную гипоксемию.
Пульсоксиметрия ори оксигенотерапии. Увеличение концентрации кислорода во вдыхаемой или вдуваемой газовой смеси - универсальный способ коррекции артериальной гипоксемии. У большинства пациентов одной только оксигенотерапии, как правило, достаточно для того, чтобы нормализовать или хотя бы повысить Sр02. Однако, руководствуясь принципом: "Если больной дышит плохо, пусть он плохо дышит кислородом' 1, - полезно иметь в виду следующее:
• беспричинной гипоксемии не бывает;
• кислород ликвидирует гипоксемию, но не причину, ее породившую;
• к кислороду необходимо относиться так же, как к любому другому медицинскому препарату; его нужно применять по определенным показаниям, в определенных дозах.и помнить, что он обладает весьма опасными побочными эффектами;
В настоящее время наблюдается крайне сдержанное, а нередко и откровенно негативное отношение к атому режиму, в основном из-за его способности провоцировать раннее экспираторное закрытие дыхательных путей (ЭЗДП). Об этой опасности действительно необходимо помнить, как, впрочем, и о том, что в неумелых руках любой метод лечения обычно' реализуется побочными действиями, а не лечебным эффектом..
