Страница:
s-электронынаружного слоя в нем распариваются, один из них занимает вакантное место третьего
р-электронаи образует при своем движении облако в виде
объемной восьмерки, перпендикулярное по отношению к облакам двух других р-электронов.
Атом при этом переходит в возбужденное состояние.Все четыре валентных электрона становятся неспаренными,они могут образовывать четыре химические связи.
Противоречия:1) три р-электрона должны образовывать три химические связи с атомами водорода во взаимно перпендикулярных направлениях (под углом 90°); 2) четвертый атом водорода мог бы присоединяться в произвольном направлении.
Разрешение противоречий:1) в процессе образования химических связей облака всех валентных электронов атома углерода (одного s– и трех р-электронов) выравниваются, становятся одинаковыми; 2) облака принимают форму несимметричных, вытянутых в направлении к вершинам тэтраэдра объемных восьмерок. Несимметричное распределение электронной плотности означает, что вероятность нахождения электрона по одну сторону от ядра больше, чем по другую; 3) угол между осями гибридных электронных облаков равен 109°, что позволяет им максимально удаляться друг от друга; 4) такие облака могут значительно перекрываться электронными облаками водородных атомов, что ведет к большому выделению энергии и образованию прочных, одинаковых по свойствам химических связей.
Гибридизация может распространяться на разное число электронных облаков.
Шаростержневая модель молекулы:
1) детали, изображающие атомы, соединяются на некотором расстоянии друг от друга посредством стерженьков, символизирующих валентные связи; 2) модель дает наглядное представление о том, какие атомы с какими соединены, но она не передает относительных размеров и внешней формы молекулы.
11. Строение и номенклатура углеводородов ряда метана
12. Химические свойства предельных углеводородов
13. Применение и получение предельных углеводородов
14. Алкины (ацетиленовые углеводороды)
15. Непредельные (ненасыщенные) углеводороды
16. Этилен и его гомологи
17. Строение и номенклатура углеводородов ряда этилена
18. Химические свойства углеводородов ряда этилена. Правило Марковникова
19. Применение и получение этиленовых углеводородов
Атом при этом переходит в возбужденное состояние.Все четыре валентных электрона становятся неспаренными,они могут образовывать четыре химические связи.
Противоречия:1) три р-электрона должны образовывать три химические связи с атомами водорода во взаимно перпендикулярных направлениях (под углом 90°); 2) четвертый атом водорода мог бы присоединяться в произвольном направлении.
Разрешение противоречий:1) в процессе образования химических связей облака всех валентных электронов атома углерода (одного s– и трех р-электронов) выравниваются, становятся одинаковыми; 2) облака принимают форму несимметричных, вытянутых в направлении к вершинам тэтраэдра объемных восьмерок. Несимметричное распределение электронной плотности означает, что вероятность нахождения электрона по одну сторону от ядра больше, чем по другую; 3) угол между осями гибридных электронных облаков равен 109°, что позволяет им максимально удаляться друг от друга; 4) такие облака могут значительно перекрываться электронными облаками водородных атомов, что ведет к большому выделению энергии и образованию прочных, одинаковых по свойствам химических связей.
Гибридизация может распространяться на разное число электронных облаков.
Шаростержневая модель молекулы:
1) детали, изображающие атомы, соединяются на некотором расстоянии друг от друга посредством стерженьков, символизирующих валентные связи; 2) модель дает наглядное представление о том, какие атомы с какими соединены, но она не передает относительных размеров и внешней формы молекулы.
11. Строение и номенклатура углеводородов ряда метана
Строение углеводородов.
В природном газе и особенно в нефти содержится много углеводородов, сходных с метаном по строению и свойствам.
Предельные углеводороды (неразветвленного строения):1) метан; 2) этан; 3) пропан; 4) бутан; 5) пентан; 6) гексан; 7) гептан; 8) октан; 9) нонан; 10) декан.
Для наименования всех предельных углеводородов принят суффикс – ан.
С увеличением молекулярной массы последовательно возрастают температуры плавления и кипения углеводородов.
Первые четыре вещества (С1 – С4) при обычных условиях – газы.
Все предельные углеводороды нерастворимы в воде, но могут растворяться в органических растворителях.
Общая формула углеводородов:СnH2n+2, где n – число атомов углерода в молекуле.
Пространственное и электронное строение молекул пропана и бутана.
Атомы углерода в них расположены не по прямой линии, а зигзагообразно.
Причина – в тетраэдрическом направлении валентных связей атомов углерода.
Если к одному атому углерода присоединился другой атом углерода, то у этого последнего остались три свободные валентности, все они направлены к вершинам тетраэдра. Следующий атом углерода может присоединиться только в одном из этих направлений.
Углеродная цепь неизменно принимает зигзагообразную форму.
Угол между ковалентными связями, соединяющими атомы углерода в такой цепи, как и в молекуле метана, 109° 28?.
Зигзагообразная цепь атомов углерода может принимать различные пространственные формы.
Это связано с тем, что атомы в молекуле могут относительно свободно вращаться вокруг простых сигма-связей.
Углеродная цепь получается сильно изогнутой. Если повернуть атом углерода, то молекула примет почти кольцеобразную форму.
Такое вращение существует в молекулах как проявление теплового движения (если нет препятствующих этому факторов).
Наиболее энергетически выгодной является форма с наибольшим удалением атомов друг от друга.
Все эти разновидности легко переходят одна в другую, при этом их химическое строение (последовательность связи атомов в молекулах) остается неизменным.
Свойство атомов углеродасоединяться друг с другом в длинные цепи связано с положением элемента в Периодической системе Д.И. Менделеева и строением его атомов.
При химической реакции у атома углерода трудно полностью оторвать четыре валентных электрона, а также присоединить к нему столько же элетронов от других атомов до образования полного октета.
В природном газе и особенно в нефти содержится много углеводородов, сходных с метаном по строению и свойствам.
Предельные углеводороды (неразветвленного строения):1) метан; 2) этан; 3) пропан; 4) бутан; 5) пентан; 6) гексан; 7) гептан; 8) октан; 9) нонан; 10) декан.
Для наименования всех предельных углеводородов принят суффикс – ан.
С увеличением молекулярной массы последовательно возрастают температуры плавления и кипения углеводородов.
Первые четыре вещества (С1 – С4) при обычных условиях – газы.
Все предельные углеводороды нерастворимы в воде, но могут растворяться в органических растворителях.
Общая формула углеводородов:СnH2n+2, где n – число атомов углерода в молекуле.
Пространственное и электронное строение молекул пропана и бутана.
Атомы углерода в них расположены не по прямой линии, а зигзагообразно.
Причина – в тетраэдрическом направлении валентных связей атомов углерода.
Если к одному атому углерода присоединился другой атом углерода, то у этого последнего остались три свободные валентности, все они направлены к вершинам тетраэдра. Следующий атом углерода может присоединиться только в одном из этих направлений.
Углеродная цепь неизменно принимает зигзагообразную форму.
Угол между ковалентными связями, соединяющими атомы углерода в такой цепи, как и в молекуле метана, 109° 28?.
Зигзагообразная цепь атомов углерода может принимать различные пространственные формы.
Это связано с тем, что атомы в молекуле могут относительно свободно вращаться вокруг простых сигма-связей.
Углеродная цепь получается сильно изогнутой. Если повернуть атом углерода, то молекула примет почти кольцеобразную форму.
Такое вращение существует в молекулах как проявление теплового движения (если нет препятствующих этому факторов).
Наиболее энергетически выгодной является форма с наибольшим удалением атомов друг от друга.
Все эти разновидности легко переходят одна в другую, при этом их химическое строение (последовательность связи атомов в молекулах) остается неизменным.
Свойство атомов углеродасоединяться друг с другом в длинные цепи связано с положением элемента в Периодической системе Д.И. Менделеева и строением его атомов.
При химической реакции у атома углерода трудно полностью оторвать четыре валентных электрона, а также присоединить к нему столько же элетронов от других атомов до образования полного октета.
12. Химические свойства предельных углеводородов
1.
Горение углеводородов на воздухе и выделение большого количества теплоты.
Продукты горения подтверждают наличие углерода и водорода в метане. Если поджечь газ, собранный в стеклянном цилиндре, то после прекращения горения стенки внутри цилиндра становятся влажными.
При добавлении в цилиндр известковой воды она становится мутной.
При горении метана образуются вода и оксид углерода (IV).
2. Смесь метана с кислородом или воздухом при поджигании может взрываться.
Наиболее сильный взрыв получается, если смешать метан с кислородом в объемном отношении 1:2. Оптимальное отношение объемов при взрыве метана с воздухом 1:10.
Взрыв меньшей силы может происходить и при некоторых других объемных отношениях газов.
Наиболее опасными являются смеси метана с воздухом в каменноугольных шахтах, заводских котельных, квартирах.
Для обеспечения безопасности работы в шахтах устанавливают автоматические приборы – анализаторы, сигнализирующие о появлении газа.
Горение углеводородов, которые имеют значительную молекулярную массу.
Парафин – это смесь твердых углеводородов.
Если поместить в фарфоровую чашечку кусочек парафина, расплавить и поджечь его, то при горении образуется много копоти.
Когда горят газообразные вещества, они хорошо смешиваются с воздухом и поэтому сгорают полностью.
При горении расплавленного парафина кислорода не хватает для сгорания всего углерода и углерод выделяется в свободном виде.
3. При сильном нагревании углеводороды разлагаются на простые вещества – углерод и водород.
Эти реакции могут служить подтверждением молекулярной формулы вещества: при разложении метана образуется двойной, а при разложении этана – тройной объем водорода по сравнению с объемом исходного газа (объем углерода как твердого вещества в расчет не принимается).
4. Реакция с галогенами (хлором).
Если смесь метана с хлором в закрытом стеклянном цилиндре выставить на рассеянный солнечный свет (при прямом солнечном освещении может произойти взрыв), то произойдет постепенное ослабление желто-зеленой окраски хлора при взаимодействии его с метаном.
Химическая реакция заключается в разрыве одних связей и образовании новых.
Атомы хлора имеют в наружном слое по одному неспаренному электрону, становятся свободными радикалами.
Когда атом-радикал, который обладает высокой химической активностью, сталкивается с молекулой метана, его электрон начинает взаимодействовать с электронным облаком атома водорода. Между этими атомами устанавливается ковалентная связьи образуется молекула хлороводорода.
Продукты горения подтверждают наличие углерода и водорода в метане. Если поджечь газ, собранный в стеклянном цилиндре, то после прекращения горения стенки внутри цилиндра становятся влажными.
При добавлении в цилиндр известковой воды она становится мутной.
При горении метана образуются вода и оксид углерода (IV).
2. Смесь метана с кислородом или воздухом при поджигании может взрываться.
Наиболее сильный взрыв получается, если смешать метан с кислородом в объемном отношении 1:2. Оптимальное отношение объемов при взрыве метана с воздухом 1:10.
Взрыв меньшей силы может происходить и при некоторых других объемных отношениях газов.
Наиболее опасными являются смеси метана с воздухом в каменноугольных шахтах, заводских котельных, квартирах.
Для обеспечения безопасности работы в шахтах устанавливают автоматические приборы – анализаторы, сигнализирующие о появлении газа.
Горение углеводородов, которые имеют значительную молекулярную массу.
Парафин – это смесь твердых углеводородов.
Если поместить в фарфоровую чашечку кусочек парафина, расплавить и поджечь его, то при горении образуется много копоти.
Когда горят газообразные вещества, они хорошо смешиваются с воздухом и поэтому сгорают полностью.
При горении расплавленного парафина кислорода не хватает для сгорания всего углерода и углерод выделяется в свободном виде.
3. При сильном нагревании углеводороды разлагаются на простые вещества – углерод и водород.
Эти реакции могут служить подтверждением молекулярной формулы вещества: при разложении метана образуется двойной, а при разложении этана – тройной объем водорода по сравнению с объемом исходного газа (объем углерода как твердого вещества в расчет не принимается).
4. Реакция с галогенами (хлором).
Если смесь метана с хлором в закрытом стеклянном цилиндре выставить на рассеянный солнечный свет (при прямом солнечном освещении может произойти взрыв), то произойдет постепенное ослабление желто-зеленой окраски хлора при взаимодействии его с метаном.
Химическая реакция заключается в разрыве одних связей и образовании новых.
Атомы хлора имеют в наружном слое по одному неспаренному электрону, становятся свободными радикалами.
Когда атом-радикал, который обладает высокой химической активностью, сталкивается с молекулой метана, его электрон начинает взаимодействовать с электронным облаком атома водорода. Между этими атомами устанавливается ковалентная связьи образуется молекула хлороводорода.
13. Применение и получение предельных углеводородов
Сферы применения предельных углеводородов:
1) метанв составе природного газа находит все более широкое применение в быту и на производстве;
2) пропан и бутанприменяются в виде «сжиженного газа», особенно в тех местностях, где нет подвода природного газа;
3) жидкие углеводородыиспользуются как горючее для двигателей внутреннего сгорания в автомашинах, самолетах;
4) метанкак доступный углеводород в большей степени используется в качестве химического сырья;
5) реакция горения и разложения метанаиспользуется в производстве сажи, идущей на получение типографской краски и резиновых изделий из каучука;
6) высокая теплота сгорания углеводородов обусловливает использование их в качестве топлива;
7) метан– основной источник получения водорода в промышленности для синтеза аммиака и ряда органических соединений.
Наиболее распространенный способ получения водорода из метана – взаимодействие его с водяным паром.
Реакция хлорирования служит для получения хлорпроизводного метана.
Особенности хлорметана:1) это газ; 2) это вещество, которое легко переходит в жидкое состояние; 3) это вещество, которое поглощает большое количество теплоты при последующем испарении.
Особенности дихлорметана, трихлорметана и тетрахлорметана:1) это жидкости; 2) используются как растворители; 3) применяются для тушения огня (особенно когда нельзя использовать воду); 4) тяжелые негорючие газы этих веществ, которые образуются при испарении жидкости, быстро изолируют горящий предмет от кислорода воздуха.
Из гомологов метана при реакции изомеризации получаются углероводороды разветвленного строения.
Они используются в производстве каучуков и высококачественных сортов бензина.
Получение углеводородов:1) предельные углеводороды в больших количествах содержатся в природном газе и нефти; 2) из природных источников их извлекают для использования в качестве топлива и химического сырья.
Особенности синтеза метана:1) синтез метана показывает возможность перехода от простых веществ к органическим соединениям. Реакция идет при нагревании углерода с водородом в присутствии порошкообразного никеля в качестве катализатора; 2) синтез метана – реакция экзотермическая. Сильное нагревание не будет повышать выход продукта, равновесие сместится в сторону образования исходных веществ; 3) при слабом нагревании будет недостаточна скорость образования метана; 4) оптимальная температура синтеза метана примерно 500 °C; 5) для разложения метана необходима температура 1000 °C.
1) метанв составе природного газа находит все более широкое применение в быту и на производстве;
2) пропан и бутанприменяются в виде «сжиженного газа», особенно в тех местностях, где нет подвода природного газа;
3) жидкие углеводородыиспользуются как горючее для двигателей внутреннего сгорания в автомашинах, самолетах;
4) метанкак доступный углеводород в большей степени используется в качестве химического сырья;
5) реакция горения и разложения метанаиспользуется в производстве сажи, идущей на получение типографской краски и резиновых изделий из каучука;
6) высокая теплота сгорания углеводородов обусловливает использование их в качестве топлива;
7) метан– основной источник получения водорода в промышленности для синтеза аммиака и ряда органических соединений.
Наиболее распространенный способ получения водорода из метана – взаимодействие его с водяным паром.
Реакция хлорирования служит для получения хлорпроизводного метана.
Особенности хлорметана:1) это газ; 2) это вещество, которое легко переходит в жидкое состояние; 3) это вещество, которое поглощает большое количество теплоты при последующем испарении.
Особенности дихлорметана, трихлорметана и тетрахлорметана:1) это жидкости; 2) используются как растворители; 3) применяются для тушения огня (особенно когда нельзя использовать воду); 4) тяжелые негорючие газы этих веществ, которые образуются при испарении жидкости, быстро изолируют горящий предмет от кислорода воздуха.
Из гомологов метана при реакции изомеризации получаются углероводороды разветвленного строения.
Они используются в производстве каучуков и высококачественных сортов бензина.
Получение углеводородов:1) предельные углеводороды в больших количествах содержатся в природном газе и нефти; 2) из природных источников их извлекают для использования в качестве топлива и химического сырья.
Особенности синтеза метана:1) синтез метана показывает возможность перехода от простых веществ к органическим соединениям. Реакция идет при нагревании углерода с водородом в присутствии порошкообразного никеля в качестве катализатора; 2) синтез метана – реакция экзотермическая. Сильное нагревание не будет повышать выход продукта, равновесие сместится в сторону образования исходных веществ; 3) при слабом нагревании будет недостаточна скорость образования метана; 4) оптимальная температура синтеза метана примерно 500 °C; 5) для разложения метана необходима температура 1000 °C.
14. Алкины (ацетиленовые углеводороды)
Алкины– это углеводороды, в молекулах которых два атома углерода находятся в состоянии sp-гибридизации и связаны друг с другом тройной связью.
Общая формула: CnH2n–2, где n > 2.
Особенности алкинов: 1) длина связи в алкинах равна 0,120 нм; 2) каждый атом углерода в состоянии sp-гибридизации связан с двумя другими атомами; 3) может присоединять еще два атома.
Существует два типа изомерии алкинов: 1) изомерия положения тройной связи; 2) изомерия цепи.
Первые два члена гомологического ряда – этин и пропин –изомеров не имеют.
Для бутиноввозможен только один вид изомерии – изомерия положения тройной связи.
Существует два типа номенклатуры: 1) международная номенклатура: этин; пропин; 2) рациональная номенклатура: ацетилен; метиацетилен.
Физические свойства алкинов: 1) С2Н2...С4Н6 – газы; 2) С5Н8...С15Н28 – жидкости; 3) С16Н30... – твердые вещества; 4) плохо растворимы в воде.
Химические свойства алкинов: обладают большой реакционной способностью, характеризуются реакцией присоединения, тройная связь содержит две ?-связи.
Реакции присоединения:
1) присоединение водорода (гидрирование). На I ступени образуются алкены, на II ступени – алканы.
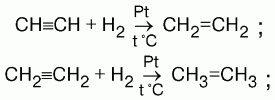 2) присоединение галогенов (галогенирование). HC?CH + HCl ? CH2=CHCl ? CH3-CHCl2;
2) присоединение галогенов (галогенирование). HC?CH + HCl ? CH2=CHCl ? CH3-CHCl2;
На I ступени образуются дигалогеналкены, на II – тетрагалогеналканы.
Реакция алкинов с бромной водой – качественная реакция на алкины. Бромная вода обесцвечивается;
3) присоединение галогеноводородов (гидрогалогенирование).
На I ступени образуются моногалогеналкены, на II – дигалогеналканы;
4) присоединение воды (гидратация).
Ацетилен образует альдегид,его гомологи – кетоны (реакция М.Г. Кучерова):
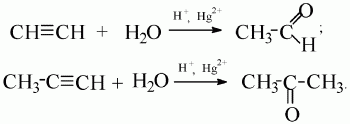 Реакция окисления:1) горение (полное окисление): 2С2Н2 + 5O2 ? 4СO2 + 2Н2О; 2) неполное окисление (под действием окислителя типа КМnO4, К2Сr2О7).
Реакция окисления:1) горение (полное окисление): 2С2Н2 + 5O2 ? 4СO2 + 2Н2О; 2) неполное окисление (под действием окислителя типа КМnO4, К2Сr2О7).
При действии сильных окислителей (КМnO4 в нейтральной среде, К2Сr2О7 в кислотной среде) алкины окисляются с разрывом молекулы по тройной связи (кроме ацетилена).
Конечным продуктом реакции являются карбоновые кислоты: СН3-С?С-СН3 + 3[О] + Н2О ? 2СН3-СООН – этановая (уксусная) кислота.
При неполном окислении ацетилена образуется двухосновная щавелевая кислота: СН?Н + 4[О] ? НООС-СООН.
Общая формула: CnH2n–2, где n > 2.
Особенности алкинов: 1) длина связи в алкинах равна 0,120 нм; 2) каждый атом углерода в состоянии sp-гибридизации связан с двумя другими атомами; 3) может присоединять еще два атома.
Существует два типа изомерии алкинов: 1) изомерия положения тройной связи; 2) изомерия цепи.
Первые два члена гомологического ряда – этин и пропин –изомеров не имеют.
Для бутиноввозможен только один вид изомерии – изомерия положения тройной связи.
Существует два типа номенклатуры: 1) международная номенклатура: этин; пропин; 2) рациональная номенклатура: ацетилен; метиацетилен.
Физические свойства алкинов: 1) С2Н2...С4Н6 – газы; 2) С5Н8...С15Н28 – жидкости; 3) С16Н30... – твердые вещества; 4) плохо растворимы в воде.
Химические свойства алкинов: обладают большой реакционной способностью, характеризуются реакцией присоединения, тройная связь содержит две ?-связи.
Реакции присоединения:
1) присоединение водорода (гидрирование). На I ступени образуются алкены, на II ступени – алканы.
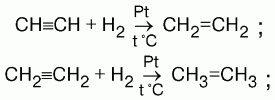
На I ступени образуются дигалогеналкены, на II – тетрагалогеналканы.
Реакция алкинов с бромной водой – качественная реакция на алкины. Бромная вода обесцвечивается;
3) присоединение галогеноводородов (гидрогалогенирование).
На I ступени образуются моногалогеналкены, на II – дигалогеналканы;
4) присоединение воды (гидратация).
Ацетилен образует альдегид,его гомологи – кетоны (реакция М.Г. Кучерова):

При действии сильных окислителей (КМnO4 в нейтральной среде, К2Сr2О7 в кислотной среде) алкины окисляются с разрывом молекулы по тройной связи (кроме ацетилена).
Конечным продуктом реакции являются карбоновые кислоты: СН3-С?С-СН3 + 3[О] + Н2О ? 2СН3-СООН – этановая (уксусная) кислота.
При неполном окислении ацетилена образуется двухосновная щавелевая кислота: СН?Н + 4[О] ? НООС-СООН.
15. Непредельные (ненасыщенные) углеводороды
Непредельные углеводороды– это углеводороды, в молекулах которых имеются атомы углерода, которые связаны между собой двойными или тройными связями.
Ненасыщенные углеводороды– это углеводороды, молекулы которых имеют меньшее число атомов водорода, чем насыщенные.
Особенности непредельных углеводородов:
1) первыми представителями гомологических рядов непредельных углеводородов являются этилен (с двойной связью) и ацетилен (с тройной связью);
2) двойная связь состоит из одной ?-связи и одной ?-связи;
3) по своей природе ?-связь резко отличается от ?-связи. Основные отличия ?-связи от ?-связи:
а) ?-связь менее прочная при перекрывании электронных облаков вне плоскости молекулы;
б) двойная связь изображается двумя одинаковыми черточками, но при этом учитывается их неравноценность;
4) тройная связь состоит из одной ?-связи и двух ?-связей.
Особенность тройной связи ацетилена и его гомологов: из электронного строения видно, что кратные связи (двойные и тройные) сравнительно легко (легче, чем одинарные) разрываются при химическом взаимодействии.
Гомологические ряды непредельных углеводородов и их особенности:
1) соединения гомологического ряда этилена выражаются общей формулой СnН2n;
2) названия гомологов по рациональной номенклатуре производятся от названий соответствующих предельных углеводородов путем замены окончаний (-ан на – илен);
3) по заместительной номенклатуре названия этиленовых углеводородов производятся от названий предельных углеводородов при замене окончаний – ан на – ен (-ен – двойная связь).
Общее международное название этиленовых углеводородов – алкены.
Олефины– это непредельные углеводороды ряда этилена, которые содержат одну двойную связь;
4) гомологический ряд ацетилена выражается формулой СnН2n-2;
5) название ацетиленовых углеводородов по заместительной номенклатуре производятся от названий предельных углеводородов при замене окончаний – анна – ин.
Алкины– это общее название ацетиленовых углеводородов по заместительной номенклатуре.
Важным источником получения этилена и его гомологов служат газообразные и жидкие продукты крекинга углеводородов нефти.
Крекинг– это процесс расщепления углеводородов с длинными цепями на молекулы меньшей длины.
При крекинге наряду с предельными углеводородами всегда получаются и непредельные, которые образуются при крекинге, а также получаются дегидрированием предельных углеводородов, содержащихся в попутных газах нефтедобычи.
Ненасыщенные углеводороды– это углеводороды, молекулы которых имеют меньшее число атомов водорода, чем насыщенные.
Особенности непредельных углеводородов:
1) первыми представителями гомологических рядов непредельных углеводородов являются этилен (с двойной связью) и ацетилен (с тройной связью);
2) двойная связь состоит из одной ?-связи и одной ?-связи;
3) по своей природе ?-связь резко отличается от ?-связи. Основные отличия ?-связи от ?-связи:
а) ?-связь менее прочная при перекрывании электронных облаков вне плоскости молекулы;
б) двойная связь изображается двумя одинаковыми черточками, но при этом учитывается их неравноценность;
4) тройная связь состоит из одной ?-связи и двух ?-связей.
Особенность тройной связи ацетилена и его гомологов: из электронного строения видно, что кратные связи (двойные и тройные) сравнительно легко (легче, чем одинарные) разрываются при химическом взаимодействии.
Гомологические ряды непредельных углеводородов и их особенности:
1) соединения гомологического ряда этилена выражаются общей формулой СnН2n;
2) названия гомологов по рациональной номенклатуре производятся от названий соответствующих предельных углеводородов путем замены окончаний (-ан на – илен);
3) по заместительной номенклатуре названия этиленовых углеводородов производятся от названий предельных углеводородов при замене окончаний – ан на – ен (-ен – двойная связь).
Общее международное название этиленовых углеводородов – алкены.
Олефины– это непредельные углеводороды ряда этилена, которые содержат одну двойную связь;
4) гомологический ряд ацетилена выражается формулой СnН2n-2;
5) название ацетиленовых углеводородов по заместительной номенклатуре производятся от названий предельных углеводородов при замене окончаний – анна – ин.
Алкины– это общее название ацетиленовых углеводородов по заместительной номенклатуре.
Важным источником получения этилена и его гомологов служат газообразные и жидкие продукты крекинга углеводородов нефти.
Крекинг– это процесс расщепления углеводородов с длинными цепями на молекулы меньшей длины.
При крекинге наряду с предельными углеводородами всегда получаются и непредельные, которые образуются при крекинге, а также получаются дегидрированием предельных углеводородов, содержащихся в попутных газах нефтедобычи.
16. Этилен и его гомологи
Особенности строения этилена:1) это бесцветный газ; 2) немного легче воздуха; 3) почти не имеет запаха; 4) плотность этилена при нормальных условиях – 1,25 г/л; 5) молярная масса газа – 1,25 г/л х 22,4 л/моль = 28 г/моль; 6) относительная молекулярная масса этилена – 28 г/моль; 7) не может иметь более двух атомов водорода; 8) молекулярная формула этилена – С2Н4; 9) в его молекуле атомы углерода соединены с меньшим числом атомов водорода, чем в молекуле этана; 10) атомы соединяются в соответствии с валентностью; 11) молекула этилена симметрична, т. е. каждый атом углерода в ней связан с двумя атомами водорода. Четвертые единицы валентности атомов углерода не могут оставаться свободными, они соединяются друг с другом, образуя вторую связь между атомами углерода; 12) в молекуле этилена устанавливается двойная связь. Каждая валентность атома углерода обусловливается наличием неспаренного электрона в его наружном электронном слое; 13) в молекуле этилена сохраняется четырехвалентность углерода и правило электронного октета для его атомов.
Особенности sр2-гибридизации:
1) гибридные облака принимают одинаковую форму несимметричных, вытянутых в одну сторону объемных восьмерок;
2) при образовании химических связей они расходятся на наибольшее удаление друг от друга – это достигается тогда, когда угол между их осями будет составлять 120°;
3) у атомов углерода остается еще по одному р-электрону.
Облако этого электрона не затронуто гибридизацией, оно не изменило своей формы и также имеет вид объемной восьмерки с равномерным распределением электронной плотности по обе стороны ядра;
4) оси электронных облаков перпендикулярны плоскости атомных ядер и оказываются наиболее удаленными от электронных облаков, которые участвуют в образовании химических связей.
Сигма-связь– это первая, более прочная связь, которая образуется при перекрывании электронных облаков в направлении прямой, соединяющей центры атомов.
Сигма-связь – это обычные ковалентные связи атомов углерода с атомами водорода.
Молекулы предельных углеводородов содержат только сигма-связи.
Пи-связь– это менее прочная связь, которая образуется при перекрывании электронных облаков вне плоскости атомных ядер.
Электроны ?-связи и ?-связи теряют свою принадлежность к определенному атому.
Особенности ?-связи и ?-связи:
1) вращение атомов углерода в молекуле возможно в случае, если они соединены ?-связью;
2) появление ?-связи лишает атомы углерода в молекуле свободного вращения.
Особенности sр2-гибридизации:
1) гибридные облака принимают одинаковую форму несимметричных, вытянутых в одну сторону объемных восьмерок;
2) при образовании химических связей они расходятся на наибольшее удаление друг от друга – это достигается тогда, когда угол между их осями будет составлять 120°;
3) у атомов углерода остается еще по одному р-электрону.
Облако этого электрона не затронуто гибридизацией, оно не изменило своей формы и также имеет вид объемной восьмерки с равномерным распределением электронной плотности по обе стороны ядра;
4) оси электронных облаков перпендикулярны плоскости атомных ядер и оказываются наиболее удаленными от электронных облаков, которые участвуют в образовании химических связей.
Сигма-связь– это первая, более прочная связь, которая образуется при перекрывании электронных облаков в направлении прямой, соединяющей центры атомов.
Сигма-связь – это обычные ковалентные связи атомов углерода с атомами водорода.
Молекулы предельных углеводородов содержат только сигма-связи.
Пи-связь– это менее прочная связь, которая образуется при перекрывании электронных облаков вне плоскости атомных ядер.
Электроны ?-связи и ?-связи теряют свою принадлежность к определенному атому.
Особенности ?-связи и ?-связи:
1) вращение атомов углерода в молекуле возможно в случае, если они соединены ?-связью;
2) появление ?-связи лишает атомы углерода в молекуле свободного вращения.
17. Строение и номенклатура углеводородов ряда этилена
Строение углеводородов:1)
этилен– первый представитель гомологического ряда веществ, в молекулах которых имеется двойная связь между атомами углерода; 2) ближайшие гомологи этилена –
пропилен и бутилен;3) названия углеводородов ряда этилена образуются путем изменения суффикса
– ансоответствующего предельного углеводорода на –
илен (этилен, пропилен и т. д.).
Особенности систематической (международной) номенклатуры:а) названия этих углеводородов принимают суффикс – ен(этен, пропен, бутен и т. д.); б) гомологи этилена должны отличаться друг от друга по составу молекул на группу атомов СН2; в) в молекуле каждого непредельного углеводорода при образовании двойной связи на два атома водорода меньше, чем в молекуле соответствующего предельного углеводорода; г) состав углеводородов ряда этилена (этена) выражается формулой СnН2n; д) непредельные углеводороды могут образовывать радикалы.
Реакция присоединения, характерная для всех алкенов:
1. Присоединение водорода.
Эта реакция протекает в присутствии катализатора – мелко раздробленного никеля, платины или палладия – при комнатной температуре.
Реакция гидрирования, или гидрогенизация,– это присоединение водорода к веществу.
При гидрогенизации олефины превращаются в предельные углеводороды.
2. Присоединение галогенов.
Реакция протекает при обычных условиях.
Дихлорэтан– это жидкость, которая хорошо растворяет органические вещества.
Реакция присоединения брома служит качественной реакцией на непредельные углеводороды.
3. Присоединение галогеноводородов.
Галогенопроизводные углеводороды можно получить двумя путями:
1) присоединение к этилену хлороводорода;
2) замещение водорода в этане на хлор.
4. Присоединение воды.
Реакция протекает в присутствии катализатора – серной кислоты.
Сначала происходит присоединение серной кислоты к этилену по месту разрыва двойной связи с образованием этилсерной кислоты.
Затем этилсерная кислота при взаимодействии с водой образует спирт и кислоту.
Реакция присоединения воды к этилену в присутствии твердых катализаторов используется для промышленного получения этилового спирта из непредельных углеводородов, которые содержатся в газах крекинга нефти (попутных газах), а также в коксовых газах.
Важным химическим свойством этилена и его гомологов является способность легко окисляться при обычной температуре.
При этом окислению подвергаются оба атома углерода, соединенные двойной связью.
Этилен горит светящимся пламенем с образованием оксида углерода и воды: С2Н4 + 3O2 ? 2СO2 + 2Н2О.
Особенности систематической (международной) номенклатуры:а) названия этих углеводородов принимают суффикс – ен(этен, пропен, бутен и т. д.); б) гомологи этилена должны отличаться друг от друга по составу молекул на группу атомов СН2; в) в молекуле каждого непредельного углеводорода при образовании двойной связи на два атома водорода меньше, чем в молекуле соответствующего предельного углеводорода; г) состав углеводородов ряда этилена (этена) выражается формулой СnН2n; д) непредельные углеводороды могут образовывать радикалы.
Реакция присоединения, характерная для всех алкенов:
1. Присоединение водорода.
Эта реакция протекает в присутствии катализатора – мелко раздробленного никеля, платины или палладия – при комнатной температуре.
Реакция гидрирования, или гидрогенизация,– это присоединение водорода к веществу.
При гидрогенизации олефины превращаются в предельные углеводороды.
2. Присоединение галогенов.
Реакция протекает при обычных условиях.
Дихлорэтан– это жидкость, которая хорошо растворяет органические вещества.
Реакция присоединения брома служит качественной реакцией на непредельные углеводороды.
3. Присоединение галогеноводородов.
Галогенопроизводные углеводороды можно получить двумя путями:
1) присоединение к этилену хлороводорода;
2) замещение водорода в этане на хлор.
4. Присоединение воды.
Реакция протекает в присутствии катализатора – серной кислоты.
Сначала происходит присоединение серной кислоты к этилену по месту разрыва двойной связи с образованием этилсерной кислоты.
Затем этилсерная кислота при взаимодействии с водой образует спирт и кислоту.
Реакция присоединения воды к этилену в присутствии твердых катализаторов используется для промышленного получения этилового спирта из непредельных углеводородов, которые содержатся в газах крекинга нефти (попутных газах), а также в коксовых газах.
Важным химическим свойством этилена и его гомологов является способность легко окисляться при обычной температуре.
При этом окислению подвергаются оба атома углерода, соединенные двойной связью.
Этилен горит светящимся пламенем с образованием оксида углерода и воды: С2Н4 + 3O2 ? 2СO2 + 2Н2О.
18. Химические свойства углеводородов ряда этилена. Правило Марковникова
Химические свойства:1) для этилена характерна
горючесть;2) в отличие от метана, этилен горит светящимся пламенем, что обусловливается повышенным содержанием в нем углерода; 3) углерод, который образуется при распаде молекул этилена от нагревания, сгорает не сразу; 4) если пропускать этилен в раствор перманганата калия, то фиолетовый раствор быстро обесцвечивается; 5) если пропускать этилен и метан в сосуды с бромной водой (водный раствор брома), то от этилена красно-бурый бром быстро обесцвечивается; 6) метан на бромную воду не действует; 7) этилен оказывается более реакционным веществом, чем предельные углеводороды; 8) при реакции этилена с бромом образуется бесцветная жидкость дибромэтан, происходит присоединение молекул брома к молекулам этилена; 9) присоединение атомов брома идет за счет двойной связи, которая при этом превращается в простую связь. Легко присоединяют бром и другие непредельные углеводороды. Раствор перманганата калия и бромная вода являются реактивами на непредельные углеводороды; 10) по двойной связи к непредельным углеводородам в присутствии катализатора (платины, никеля) может присоединяться водород.
В результате этой реакции происходит насыщение атомов углерода водородными атомами до предела.
Реакции гидрирования– это реакции, в которых происходит присоединение водорода к веществу.
Характерные черты реакции гидрирования:1) в процессе гидрирования атомы углерода при двойной связи из состояния sр2-гибридизации переходят в состояние sр3-гибридизации; 2) изменяется пространственное строение молекулы; 3) из плоской молекулы этилена при гидрировании образуется объемная молекула этана.
Правило Марковникова.
При ионном присоединении галогеноводорода к двойной углерод-углеродной связи несимметричного алкена водород присоединяется к тому атому углерода при двойной связи, с которым соединено больше водородных атомов, а атом галогена – к тому атому углерода, где их меньше.
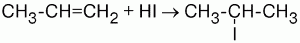 Влиянием метильного радикала на двойную связь и обусловливается тот факт, что присоединение идет не произвольно, а в определенном направлении.
Влиянием метильного радикала на двойную связь и обусловливается тот факт, что присоединение идет не произвольно, а в определенном направлении.
Атом углерода смещает в свою сторону электронную плотность связей с атомами водорода и приобретает частичный отрицательный заряд. Электронная плотность связи радикала с соседним атомом углерода смещается в сторону последнего, а это образует смещение весьма подвижного облака ?-связи к крайнему атому углерода.
В результате этой реакции происходит насыщение атомов углерода водородными атомами до предела.
Реакции гидрирования– это реакции, в которых происходит присоединение водорода к веществу.
Характерные черты реакции гидрирования:1) в процессе гидрирования атомы углерода при двойной связи из состояния sр2-гибридизации переходят в состояние sр3-гибридизации; 2) изменяется пространственное строение молекулы; 3) из плоской молекулы этилена при гидрировании образуется объемная молекула этана.
Правило Марковникова.
При ионном присоединении галогеноводорода к двойной углерод-углеродной связи несимметричного алкена водород присоединяется к тому атому углерода при двойной связи, с которым соединено больше водородных атомов, а атом галогена – к тому атому углерода, где их меньше.
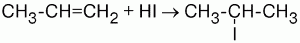
Атом углерода смещает в свою сторону электронную плотность связей с атомами водорода и приобретает частичный отрицательный заряд. Электронная плотность связи радикала с соседним атомом углерода смещается в сторону последнего, а это образует смещение весьма подвижного облака ?-связи к крайнему атому углерода.
19. Применение и получение этиленовых углеводородов
Применение углеводородов:
1) благодаря высокой химической активности углеводороды ряда этилена являются ценным сырьем для синтеза многих органических веществ;
2) этиленовые углеводороды не используются в качестве горючего;
3) особенно широко этилен используется для получения органических веществ;
4) этилен применяется для получения этилового спирта, полиэтилена. Он ускоряет созревание плодов (помидоров, цитрусовых и др.) при введении небольших количеств его в воздух теплиц. Этилен и его гомологи используются как химическое сырье для синтеза многих органических веществ;
5) при взаимодействии этилена с хлором получается 1,2-дихлорэтан.
Особенности дихлорэтана:а) это летучая, трудновоспламеняющаяся жидкость; б) используется для растворения смол; в) используется для очистки текстильных материалов; г) применяется в сельском хозяйстве для обеззараживания зернохранилищ; д) используется в борьбе с филлоксерой винограда;
6) при присоединении хлороводорода к этилену получается хлорэтан.
Особенности хлорэтана:а) это газ, который легко превращается в жидкость; б) если налить небольшое количество хлорэтана на руку, произойдет быстрое испарение жидкости и сильное местное охлаждение; в) используется в медицине для замораживания; г) используется в медицине для местной анестезии – при легких операциях;
7) присоединение воды к этилену лежит в основе производства этанола (этилового спирта);
8) при полимеризации этилена и пропилена получаются широко применяемые в технике и быту полиэтилен и полипропилен;
9) в практическом применении этилен ускоряет созревание плодов (помидоров, груш, дынь, лимонов и др.);
10) для лучшего хранения плоды транспортируются неспелыми и доводятся до созревания на месте, путем ввода небольшого количества этилена в воздух закрытых хранилищ.
Получение углеводородов:
1) углеводороды ряда этилена химически активны;
2) в промышленности эти углеводороды получаются: а) при переработке нефтепродуктов путем высокотемпературного разложения; б) путем дегидрирования предельных углеводородов.
1) благодаря высокой химической активности углеводороды ряда этилена являются ценным сырьем для синтеза многих органических веществ;
2) этиленовые углеводороды не используются в качестве горючего;
3) особенно широко этилен используется для получения органических веществ;
4) этилен применяется для получения этилового спирта, полиэтилена. Он ускоряет созревание плодов (помидоров, цитрусовых и др.) при введении небольших количеств его в воздух теплиц. Этилен и его гомологи используются как химическое сырье для синтеза многих органических веществ;
5) при взаимодействии этилена с хлором получается 1,2-дихлорэтан.
Особенности дихлорэтана:а) это летучая, трудновоспламеняющаяся жидкость; б) используется для растворения смол; в) используется для очистки текстильных материалов; г) применяется в сельском хозяйстве для обеззараживания зернохранилищ; д) используется в борьбе с филлоксерой винограда;
6) при присоединении хлороводорода к этилену получается хлорэтан.
Особенности хлорэтана:а) это газ, который легко превращается в жидкость; б) если налить небольшое количество хлорэтана на руку, произойдет быстрое испарение жидкости и сильное местное охлаждение; в) используется в медицине для замораживания; г) используется в медицине для местной анестезии – при легких операциях;
7) присоединение воды к этилену лежит в основе производства этанола (этилового спирта);
8) при полимеризации этилена и пропилена получаются широко применяемые в технике и быту полиэтилен и полипропилен;
9) в практическом применении этилен ускоряет созревание плодов (помидоров, груш, дынь, лимонов и др.);
10) для лучшего хранения плоды транспортируются неспелыми и доводятся до созревания на месте, путем ввода небольшого количества этилена в воздух закрытых хранилищ.
Получение углеводородов:
1) углеводороды ряда этилена химически активны;
2) в промышленности эти углеводороды получаются: а) при переработке нефтепродуктов путем высокотемпературного разложения; б) путем дегидрирования предельных углеводородов.
