Страница:
9) в результате поликонденсации фенола с формальдегидом в присутствии катализаторов образуются фенолоформальдегидные смолы.
Особенности фенопластов– это важнейшие заменители цветных и черных металлов во многих отраслях промышленности, из них изготавливается большое количество изделий широкого потребления, электроизоляционные материалы и строительные детали.
Особенности углеводов:
1) углеводы – это органические соединения, состав которых обычно выражается общей формулой Сn (Н2О)m, (n и m > 4);
2) существуют также соединения, которые относятся к углеводам, состав которых не соответствует общей формуле, например сахар рамноза С6Н12O5;
3) углеводы являются очень распространенными природными соединениями;
4) углеводы входят в состав растений и живых организмов.
В растениях они образуются в результате фотосинтеза: nСO2 + mН2О ? Сn (Н2О) m + n O2;
5) содержание углеводов в растениях составляет до 80 % массы сухого вещества, в организмах человека и животных – до 20 %;
6) они играют важную роль в физиологических процессах.
Олигосахариды– это продукты конденсации двух или нескольких молекул моносахаридов.
Дисахариды (диозы)– это продукты конденсации двух молекул моносахаридов.
50. Кетоны
51. Одноосновные карбоновые кислоты
52. Химические свойства и получение карбоновых кислот
53. Муравьиная и уксусная кислоты
54. Пальмитиновая и стеариновая кислоты
55. Сложные эфиры
56. Жиры и углеводы
57. Гидролиз жиров в технике. Гидрирование жиров
58. Мыла и другие моющие средства
59. Глюкоза. Физические свойства
Особенности фенопластов– это важнейшие заменители цветных и черных металлов во многих отраслях промышленности, из них изготавливается большое количество изделий широкого потребления, электроизоляционные материалы и строительные детали.
Особенности углеводов:
1) углеводы – это органические соединения, состав которых обычно выражается общей формулой Сn (Н2О)m, (n и m > 4);
2) существуют также соединения, которые относятся к углеводам, состав которых не соответствует общей формуле, например сахар рамноза С6Н12O5;
3) углеводы являются очень распространенными природными соединениями;
4) углеводы входят в состав растений и живых организмов.
В растениях они образуются в результате фотосинтеза: nСO2 + mН2О ? Сn (Н2О) m + n O2;
5) содержание углеводов в растениях составляет до 80 % массы сухого вещества, в организмах человека и животных – до 20 %;
6) они играют важную роль в физиологических процессах.
Олигосахариды– это продукты конденсации двух или нескольких молекул моносахаридов.
Дисахариды (диозы)– это продукты конденсации двух молекул моносахаридов.
50. Кетоны
Кетонаминазываются карбонилсодержащие соединения, в которых углерод карбонильной группы связан с двумя углеродными радикалами.
Общая формула кетонов —
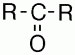 В соответствии с международной номенклатурой названия кетонов строятся из названия соответствующего углеводорода с добавлением окончания
– он.В конце названия ставится цифра, указывающая положение в цепи атома углерода, с которым связан карбонильный кислород. Если разветвленность одинакова, то нумеруют с того конца цепи, к которому ближе расположена карбонильная группа.
В соответствии с международной номенклатурой названия кетонов строятся из названия соответствующего углеводорода с добавлением окончания
– он.В конце названия ставится цифра, указывающая положение в цепи атома углерода, с которым связан карбонильный кислород. Если разветвленность одинакова, то нумеруют с того конца цепи, к которому ближе расположена карбонильная группа.
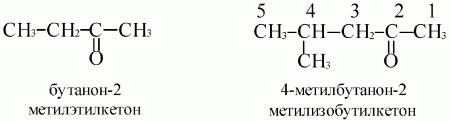 Для некоторых кетонов распространены тривиальные названия, например ацетон.
Для некоторых кетонов распространены тривиальные названия, например ацетон.
Физические свойства.Простейшие кетоны являются бесцветными жидкостями, которые растворяются в воде. Кетоны обладают приятным запахом. Высшие кетоны – твердые вещества. Газообразных кетонов не бывает, так как уже простейший из них (ацетон) – жидкость. Многие химические свойства, характерные для альдегидов, проявляюся и у кетонов.
Химические свойства:
1) для кетонов характерны те же реакции замещения по ?-С атому:
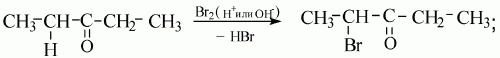 2) гидрирование кетонов в присутствии катализаторов приводит к образованию вторичных спиртов.
2) гидрирование кетонов в присутствии катализаторов приводит к образованию вторичных спиртов.
Кетоныокисляются значительно труднее альдегидов и только сильными окислителями. При окислении кетонов происходит разрыв (деструкция) углеродной цепи, и образуется смесь продуктов. Кетоны не вступают в реакцию «серебряного зеркала».
Получение:
1) кетоны образуются при окислении или каталитическом дегидрировании вторичных спиртов в присутствии медных катализаторов, например:
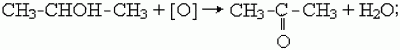 2) как и альдегиды, кетоны можно получить гидролизом дигалогенпроизводных алканов. Чтобы получился кетон, оба атома галогена в исходном соединении должны находиться при одном (не крайнем) атоме углерода:
2) как и альдегиды, кетоны можно получить гидролизом дигалогенпроизводных алканов. Чтобы получился кетон, оба атома галогена в исходном соединении должны находиться при одном (не крайнем) атоме углерода:
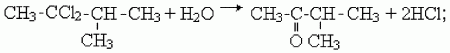 3) кетоны образуются в результате присоединения воды к гомологам ацетилена в присутствии катализаторов – солей ртути (II), например:
3) кетоны образуются в результате присоединения воды к гомологам ацетилена в присутствии катализаторов – солей ртути (II), например:
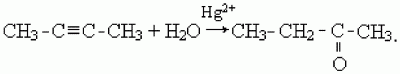
Общая формула кетонов —
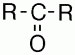
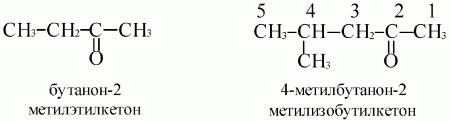
Физические свойства.Простейшие кетоны являются бесцветными жидкостями, которые растворяются в воде. Кетоны обладают приятным запахом. Высшие кетоны – твердые вещества. Газообразных кетонов не бывает, так как уже простейший из них (ацетон) – жидкость. Многие химические свойства, характерные для альдегидов, проявляюся и у кетонов.
Химические свойства:
1) для кетонов характерны те же реакции замещения по ?-С атому:
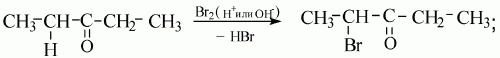
Кетоныокисляются значительно труднее альдегидов и только сильными окислителями. При окислении кетонов происходит разрыв (деструкция) углеродной цепи, и образуется смесь продуктов. Кетоны не вступают в реакцию «серебряного зеркала».
Получение:
1) кетоны образуются при окислении или каталитическом дегидрировании вторичных спиртов в присутствии медных катализаторов, например:
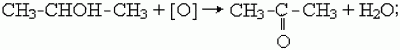
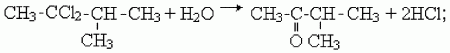
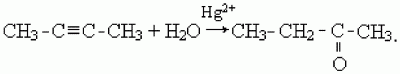
51. Одноосновные карбоновые кислоты
Строение и физические свойства кислот.
Карбоновые кислоты– это органические вещества, молекулы которых содержат одну или несколько карбоксильных групп, которые соединены с углеводородным радикалом. В зависимости от числа карбоксильных групп в молекуле различают кислоты одноосновные и двуосновные.
Гомологический ряд одноосновных карбоновых кислот:
1) муравьиная кислота Н-СООН;
2) уксусная кислота СН3-СООН;
3) пропионовая кислота СН3-СН2-СООН;
4) масляная кислота СН3-СН2-СН2-СООН;
5) валериановая кислота СН3-(СН2)3-СООН;
6) капроновая кислота СН3-(СН2)4-СООН.
Твердые вещества:
1) пальмитиновая кислота СН3-(СН2)14-СООН;
2) маргариновая кислота СН3-(СН2)15-СООН;
3) стеариновая кислота СН3-(СН2)16-СООН.
Существуют также бензойная, щавелевая, терефталевая, молочная кислоты.
По систематической номенклатуре названия кислот образуются от названий соответствующих углеводородов с прибавлением слова кислота,например: метановая кислота HCOOH, пропановая кислота СН3-СН2-СOOH.
Характерные особенности карбоновых кислот:
1) среди кислот, в отличие от альдегидов, нет газообразных веществ, так как молекулы ассоциированы;
2) низшие представители ряда – это жидкости с острым запахом, хорошо растворимые в воде;
3) с повышением молекулярной массы растворимость в воде понижается;
4) высшие кислоты – твердые вещества без запаха, в воде не растворимы;
5) определение молекулярной массы жидких кислот показывает, что они состоят из удвоенных молекул – димеров;
6) между двумя молекулами могут устанавливаться две водородные связи, это и обусловливает сравнительно большую прочность димерных молекул.
7) ароматическими карбоновыми кислотами называют производные бензола и его гомологов, содержащие карбоксильные группы, непосредственно связанные с углеродными атомами ароматического ядра, например C6H5-COOH – бензойная, если же карбоксильная группа находится в боковой цепи, то такие кислоты называют жирноароматическими, они напоминают в своем химическом поведении карбоновые кислоты алифатического ряда. Например: C6H5-CH2-COOH – фенилуксусная;
8) по количеству карбоксильных групп ароматические кислоты могут быть одно-, двух– и более основные;
9) под влиянием карбонильного атома кислорода изменяются свойства водородного атома в гидроксильной группе;
10) электронная плотность связи С=О (особенно ?-связи) смещена в сторону кислорода, как элемента более электроотрицательного.
Карбоновые кислоты– это органические вещества, молекулы которых содержат одну или несколько карбоксильных групп, которые соединены с углеводородным радикалом. В зависимости от числа карбоксильных групп в молекуле различают кислоты одноосновные и двуосновные.
Гомологический ряд одноосновных карбоновых кислот:
1) муравьиная кислота Н-СООН;
2) уксусная кислота СН3-СООН;
3) пропионовая кислота СН3-СН2-СООН;
4) масляная кислота СН3-СН2-СН2-СООН;
5) валериановая кислота СН3-(СН2)3-СООН;
6) капроновая кислота СН3-(СН2)4-СООН.
Твердые вещества:
1) пальмитиновая кислота СН3-(СН2)14-СООН;
2) маргариновая кислота СН3-(СН2)15-СООН;
3) стеариновая кислота СН3-(СН2)16-СООН.
Существуют также бензойная, щавелевая, терефталевая, молочная кислоты.
По систематической номенклатуре названия кислот образуются от названий соответствующих углеводородов с прибавлением слова кислота,например: метановая кислота HCOOH, пропановая кислота СН3-СН2-СOOH.
Характерные особенности карбоновых кислот:
1) среди кислот, в отличие от альдегидов, нет газообразных веществ, так как молекулы ассоциированы;
2) низшие представители ряда – это жидкости с острым запахом, хорошо растворимые в воде;
3) с повышением молекулярной массы растворимость в воде понижается;
4) высшие кислоты – твердые вещества без запаха, в воде не растворимы;
5) определение молекулярной массы жидких кислот показывает, что они состоят из удвоенных молекул – димеров;
6) между двумя молекулами могут устанавливаться две водородные связи, это и обусловливает сравнительно большую прочность димерных молекул.
7) ароматическими карбоновыми кислотами называют производные бензола и его гомологов, содержащие карбоксильные группы, непосредственно связанные с углеродными атомами ароматического ядра, например C6H5-COOH – бензойная, если же карбоксильная группа находится в боковой цепи, то такие кислоты называют жирноароматическими, они напоминают в своем химическом поведении карбоновые кислоты алифатического ряда. Например: C6H5-CH2-COOH – фенилуксусная;
8) по количеству карбоксильных групп ароматические кислоты могут быть одно-, двух– и более основные;
9) под влиянием карбонильного атома кислорода изменяются свойства водородного атома в гидроксильной группе;
10) электронная плотность связи С=О (особенно ?-связи) смещена в сторону кислорода, как элемента более электроотрицательного.
52. Химические свойства и получение карбоновых кислот
Химические свойства:
1) растворимые в воде кислоты, в отличие от спиртов, имеют характерный кислый вкус;
2) кислоты окрашивают лакмус в красный цвет;
3) карбоновые кислоты проводят электрический ток;
4) их диссоциацию в водном растворе можно выразить уравнением: R-COOH – >H++ R-СОО-;
5) по степени диссоциации только муравьиная кислота является электролитом средней силы;
6) остальные карбоновые кислоты относятся к слабым электролитам;
7) по мере повышения молекулярной массы степень диссоциации карбоновых кислот понижается;
8) при действии на растворы кислот некоторых металлов происходит выделение водорода и образование соли (ацетат магния), например:
2СН3-COOH + Mg ? Н2 + (CH3COO)2Mg.
Ионное уравнение этой реакции:
2СН3СООН + Mg ? Н2 + Mg2++ 2СН3СОО-;
9) выделение водорода идет медленнее, чем при реакции металла с сильными кислотами – серной и соляной;
10) при взаимодействии кислот с основными оксидами и основаниями образуются соли (пропионат натрия):
СН3-СН2-COOH + NaOH ? СН3-СН2-COONa + Н2О.
Особенности такой реакции:а) в пробирку с уксусной кислотой необходимо добавить этилового спирта; б) если добавить в эту пробирку серной кислоты и подогреть смесь, появляется приятный запах этилового эфира уксусной кислоты.
Особенности этилового эфира уксусной кислоты:
1) этиловый эфир уксусной кислоты относится к классу сложных эфиров;
2) температура кипения ниже, чем у уксусной кислоты, так как отсутствуют водородные связи.
Отличие реакции присоединения в альдегидах от реакции присоединения карбоновых кислот.
1. В альдегидах легко идут реакции присоединения по двойной связи С=О.
2. У карбонильной группы кислот реакции присоединения затруднены, двойная связь в ней устойчивее, например присоединение водорода может происходить лишь в более жестких условиях, чем в альдегидах.
Такое изменение свойств связи С=О объясняется:
1) наличием в молекуле гидроксильной группы: сдвиг электронов от нее к атому углерода частично гасит его положительный заряд и это сказывается на реакционной способности карбонильной группы;
2) в молекулах существует не одностороннее, а взаимное влияние атомов.
Особенности реакции карбоновых кислот с углеводородным радикалом:
1) в нем возможны реакции замещения водорода галогенами;
2) особенно легко замещение происходит в углеводородном звене, ближайшем к карбоксилу.
1) растворимые в воде кислоты, в отличие от спиртов, имеют характерный кислый вкус;
2) кислоты окрашивают лакмус в красный цвет;
3) карбоновые кислоты проводят электрический ток;
4) их диссоциацию в водном растворе можно выразить уравнением: R-COOH – >H++ R-СОО-;
5) по степени диссоциации только муравьиная кислота является электролитом средней силы;
6) остальные карбоновые кислоты относятся к слабым электролитам;
7) по мере повышения молекулярной массы степень диссоциации карбоновых кислот понижается;
8) при действии на растворы кислот некоторых металлов происходит выделение водорода и образование соли (ацетат магния), например:
2СН3-COOH + Mg ? Н2 + (CH3COO)2Mg.
Ионное уравнение этой реакции:
2СН3СООН + Mg ? Н2 + Mg2++ 2СН3СОО-;
9) выделение водорода идет медленнее, чем при реакции металла с сильными кислотами – серной и соляной;
10) при взаимодействии кислот с основными оксидами и основаниями образуются соли (пропионат натрия):
СН3-СН2-COOH + NaOH ? СН3-СН2-COONa + Н2О.
Особенности такой реакции:а) в пробирку с уксусной кислотой необходимо добавить этилового спирта; б) если добавить в эту пробирку серной кислоты и подогреть смесь, появляется приятный запах этилового эфира уксусной кислоты.
Особенности этилового эфира уксусной кислоты:
1) этиловый эфир уксусной кислоты относится к классу сложных эфиров;
2) температура кипения ниже, чем у уксусной кислоты, так как отсутствуют водородные связи.
Отличие реакции присоединения в альдегидах от реакции присоединения карбоновых кислот.
1. В альдегидах легко идут реакции присоединения по двойной связи С=О.
2. У карбонильной группы кислот реакции присоединения затруднены, двойная связь в ней устойчивее, например присоединение водорода может происходить лишь в более жестких условиях, чем в альдегидах.
Такое изменение свойств связи С=О объясняется:
1) наличием в молекуле гидроксильной группы: сдвиг электронов от нее к атому углерода частично гасит его положительный заряд и это сказывается на реакционной способности карбонильной группы;
2) в молекулах существует не одностороннее, а взаимное влияние атомов.
Особенности реакции карбоновых кислот с углеводородным радикалом:
1) в нем возможны реакции замещения водорода галогенами;
2) особенно легко замещение происходит в углеводородном звене, ближайшем к карбоксилу.
53. Муравьиная и уксусная кислоты
Особенности муравьиной кислоты:1) первый представитель гомологического ряда предельных кислот; 2) содержится в едких выделениях муравьев, в крапиве, хвое ели; 3) это самая сильная кислота в ряду одноосновных карбоновых кислот.
Муравьиная кислота имеет и другие особенности:1) в молекуле кислоты легко можно заметить не только карбоксильную группу, но и альдегидную; 2) муравьиная кислота наряду с типичными свойствами кислот проявляет свойства альдегидов. Например, она легко окисляется аммиачным раствором оксида серебра (I).
Применение и получение муравьиной кислоты:а) муравьиная кислота применяется в технике в качестве восстановителя; б) реакцией кислоты со спиртами получают сложные эфиры, которые находят применение в качестве растворителей и душистых веществ.
Особенности уксусной кислоты:часто встречается в растениях, выделениях животных, образуется при окислении органических веществ.
Применение и получение уксусной кислоты.Из всех карбоновых кислот уксусная кислота имеет наиболее широкое применение. Используется водный раствор уксусной кислоты – уксус – в качестве вкусового и консервирующего средства (приправа к пище, маринование грибов, овощей).
Получение уксусной кислоты.
1. Путем различных реакций солеобразования получаются соли уксусной кислоты – ацетаты.
2. Взаимодействием кислоты со спиртами получаются разнообразные сложные эфиры.
3. Как и эфиры муравьиной кислоты, сложные эфиры используются в качестве растворителей и душистых веществ.
4. Уксусная кислота используется в производстве ацетатного волокна.
5. Уксусная кислота используется при синтезе красителей (например, индиго), лекарственных веществ (например, аспирина) и т. д.
6. Уксусную кислоту получают гидролизом ацетонитрила или других производных: сложных эфиров, хлорангидридов и амидов, кроме этого возможно окисление соответствующих спиртов, альдегидов и алкенов.
Плотность уксусной кислоты больше единицы, остальных карбоновых кислот – меньше единицы. Уксусная кислота имеет более высокую температуру кипения, чем этанол, это обусловлено тем, что молекулы уксусной кислоты попарно связываются не одной, а двумя водородными связями, и в жидком состоянии существуют в сновном в виде димера:
 Но могут иметь и линейный характер:
Но могут иметь и линейный характер:
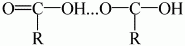
Муравьиная кислота имеет и другие особенности:1) в молекуле кислоты легко можно заметить не только карбоксильную группу, но и альдегидную; 2) муравьиная кислота наряду с типичными свойствами кислот проявляет свойства альдегидов. Например, она легко окисляется аммиачным раствором оксида серебра (I).
Применение и получение муравьиной кислоты:а) муравьиная кислота применяется в технике в качестве восстановителя; б) реакцией кислоты со спиртами получают сложные эфиры, которые находят применение в качестве растворителей и душистых веществ.
Особенности уксусной кислоты:часто встречается в растениях, выделениях животных, образуется при окислении органических веществ.
Применение и получение уксусной кислоты.Из всех карбоновых кислот уксусная кислота имеет наиболее широкое применение. Используется водный раствор уксусной кислоты – уксус – в качестве вкусового и консервирующего средства (приправа к пище, маринование грибов, овощей).
Получение уксусной кислоты.
1. Путем различных реакций солеобразования получаются соли уксусной кислоты – ацетаты.
2. Взаимодействием кислоты со спиртами получаются разнообразные сложные эфиры.
3. Как и эфиры муравьиной кислоты, сложные эфиры используются в качестве растворителей и душистых веществ.
4. Уксусная кислота используется в производстве ацетатного волокна.
5. Уксусная кислота используется при синтезе красителей (например, индиго), лекарственных веществ (например, аспирина) и т. д.
6. Уксусную кислоту получают гидролизом ацетонитрила или других производных: сложных эфиров, хлорангидридов и амидов, кроме этого возможно окисление соответствующих спиртов, альдегидов и алкенов.
Плотность уксусной кислоты больше единицы, остальных карбоновых кислот – меньше единицы. Уксусная кислота имеет более высокую температуру кипения, чем этанол, это обусловлено тем, что молекулы уксусной кислоты попарно связываются не одной, а двумя водородными связями, и в жидком состоянии существуют в сновном в виде димера:

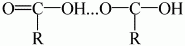
54. Пальмитиновая и стеариновая кислоты
Из высших предельных одноосновных карбоновых кислот наиболее важными являются следующие кислоты: СН3(СН2)14СООН – пальмитиновая и СН3(СН2)16СООН – стеариновая. В виде сложных эфиров глицерина они входят в состав растительных и животных жиров.
Характерные особенности пальмитиновой и стеариновой кислот:
1) это твердые вещества белого цвета;
2) эти кислоты не растворимы в воде;
3) углеводородные радикалы в молекулах этих кислот содержат неразветвленную цепь из пятнадцати и семнадцати атомов углерода, которые соединены ?-связими;
4) им свойственны те же реакции, что и другим карбоновым кислотам. Например, при взаимодействии с раствором щелочи они образуют соли: C15H31COOH + NaOH ? C15H31COONa + Н2О;
5) натриевые соли пальмитиновых и стеариновых кислот (пальмиаты и стеараты) растворимы в воде;
6) они обладают моющими свойствами и составляют основную часть обычного твердого мыла;
7) из карбоновых солей, которые содержатся в мыле, получаются кислоты, действуя на их водный раствор сильной кислотой, например:
С17Н35СОО-+ Na++ H++ HSO4-? С17Н35СООН + NaHSO4;
8) кальциевые и магниевые соли высших карбоновых кислот в воде не растворяются;
Олеиновая кислота является представителем непредельных одноосновных карбоновых кислот.
Существуют кислоты, в углеводородном радикале которых имеются одна или несколько двойных связей между атомами углерода.
Особенности олеиновой кислоты:
1) олеиновая кислота – это одна из высших непредельных кислот;
2) олеиновая кислота имеет формулу: С17Н33СООН, или СН3-(СН2)7-СН = СН-(СН2)7-СООН;
3) наряду с пальмитиновой и стеариновой кислотами она в виде сложного эфира глицерина входит в состав жиров;
4) в молекуле олеиновой кислоты в середине цепи имеется двойная связь.
Свойства олеиновой кислоты: а) в отличие от стеариновой кислоты, олеиновая кислота – жидкость; б) из-за наличия двойной связи в углеводородном радикале молекулы возможна цистрансизомерия:
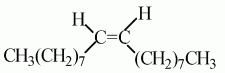 в) олеиновая кислота – цисизомер; г) силы взаимодействия между молекулами сравнительно невелики и вещество оказывается жидким; д) молекулы трансизомера более вытянутые; е) молекулы трансизомера могут плотнее примыкать друг к другу; ж) силы взаимодействия между ними больше, и вещество оказывается твердым – это элаидиновая кислота; з) наряду с карбоксильной группой олеиновая кислота имеет двойную связь.
в) олеиновая кислота – цисизомер; г) силы взаимодействия между молекулами сравнительно невелики и вещество оказывается жидким; д) молекулы трансизомера более вытянутые; е) молекулы трансизомера могут плотнее примыкать друг к другу; ж) силы взаимодействия между ними больше, и вещество оказывается твердым – это элаидиновая кислота; з) наряду с карбоксильной группой олеиновая кислота имеет двойную связь.
Характерные особенности пальмитиновой и стеариновой кислот:
1) это твердые вещества белого цвета;
2) эти кислоты не растворимы в воде;
3) углеводородные радикалы в молекулах этих кислот содержат неразветвленную цепь из пятнадцати и семнадцати атомов углерода, которые соединены ?-связими;
4) им свойственны те же реакции, что и другим карбоновым кислотам. Например, при взаимодействии с раствором щелочи они образуют соли: C15H31COOH + NaOH ? C15H31COONa + Н2О;
5) натриевые соли пальмитиновых и стеариновых кислот (пальмиаты и стеараты) растворимы в воде;
6) они обладают моющими свойствами и составляют основную часть обычного твердого мыла;
7) из карбоновых солей, которые содержатся в мыле, получаются кислоты, действуя на их водный раствор сильной кислотой, например:
С17Н35СОО-+ Na++ H++ HSO4-? С17Н35СООН + NaHSO4;
8) кальциевые и магниевые соли высших карбоновых кислот в воде не растворяются;
Олеиновая кислота является представителем непредельных одноосновных карбоновых кислот.
Существуют кислоты, в углеводородном радикале которых имеются одна или несколько двойных связей между атомами углерода.
Особенности олеиновой кислоты:
1) олеиновая кислота – это одна из высших непредельных кислот;
2) олеиновая кислота имеет формулу: С17Н33СООН, или СН3-(СН2)7-СН = СН-(СН2)7-СООН;
3) наряду с пальмитиновой и стеариновой кислотами она в виде сложного эфира глицерина входит в состав жиров;
4) в молекуле олеиновой кислоты в середине цепи имеется двойная связь.
Свойства олеиновой кислоты: а) в отличие от стеариновой кислоты, олеиновая кислота – жидкость; б) из-за наличия двойной связи в углеводородном радикале молекулы возможна цистрансизомерия:

55. Сложные эфиры
Получение и строение сложных эфиров:
1) сложные эфиры образуются при взаимодействии кислот со спиртами. В общем виде получение их может быть выражено уравнением:
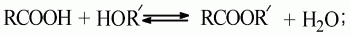 2) реакции кислот со спиртами, ведущие к образованию сложных эфиров, называются реакциями этерификации (лат. aether – эфир);
2) реакции кислот со спиртами, ведущие к образованию сложных эфиров, называются реакциями этерификации (лат. aether – эфир);
3) они проводятся в присутствии сильных минеральных кислот, при этом ионы водорода оказывают каталитическое действие;
4) названия сложных эфиров образуются из названий соответствующих кислот и спиртов, например: а) метиловый эфир уксусной кислоты СН3СООСН3; б) этиловый эфир муравьиной кислоты НСООС2Н5;
5) атом водорода функциональной группы в кислотах является подвижным, поэтому в спиртах при реакции этерификации водород должен отщепляться от молекулы кислоты, гидроксильная группа при этом отщепляется от молекулы спирта.
Как идет реакция, устанавливается при помощи меченых атомов:
а) если на карбоновую кислоту действовать спиртом, который вместо обычного атома кислорода содержит тяжелый изотоп массой 18:
RCOOH + HO18R ? RCOO18R + Н2O;
б) после проведения реакции тяжелый изотоп кислорода находится в сложном эфире;
в) при реакции этерификации от молекулы спирта отделяется не гидроксильная группа, а только атом водорода, гидроксильная же группа отделяется от молекулы кислоты.
Физические свойства сложных эфиров:сложные эфиры одноосновных карбоновых кислот – это обычно жидкости с приятным запахом (этиловый эфир муравьиной кислоты – запах рома, бутиловый эфир масляной кислоты – запах ананаса и т. д.).
Нахождение сложных эфиров в природе.
1. Синтетические сложные эфиры в виде фруктовых эссенций используются наряду с другими душистыми веществами в производстве фруктовых вод, кондитерских изделий.
2. Также сложные эфиры используются при изготовлении духов и одеколонов.
3. Некоторые из сложных эфиров (например, этиловый эфир уксусной кислоты) служат растворителями.
Химические свойства сложных эфиров:
1) взаимодействие их с водой. Например, при нагревании этилового эфира уксусной кислоты с водой в присутствии неорганической кислоты образуются уксусная кислота и этиловый спирт;
2) такая реакция называется гидролизом.
Особенности реакции гидролиза:
а) эта реакция противоположна реакции образования сложного эфира;
б) реакция гидролиза сложного эфира обратима, так же как и реакция этерификации.
1) сложные эфиры образуются при взаимодействии кислот со спиртами. В общем виде получение их может быть выражено уравнением:
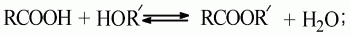
3) они проводятся в присутствии сильных минеральных кислот, при этом ионы водорода оказывают каталитическое действие;
4) названия сложных эфиров образуются из названий соответствующих кислот и спиртов, например: а) метиловый эфир уксусной кислоты СН3СООСН3; б) этиловый эфир муравьиной кислоты НСООС2Н5;
5) атом водорода функциональной группы в кислотах является подвижным, поэтому в спиртах при реакции этерификации водород должен отщепляться от молекулы кислоты, гидроксильная группа при этом отщепляется от молекулы спирта.
Как идет реакция, устанавливается при помощи меченых атомов:
а) если на карбоновую кислоту действовать спиртом, который вместо обычного атома кислорода содержит тяжелый изотоп массой 18:
RCOOH + HO18R ? RCOO18R + Н2O;
б) после проведения реакции тяжелый изотоп кислорода находится в сложном эфире;
в) при реакции этерификации от молекулы спирта отделяется не гидроксильная группа, а только атом водорода, гидроксильная же группа отделяется от молекулы кислоты.
Физические свойства сложных эфиров:сложные эфиры одноосновных карбоновых кислот – это обычно жидкости с приятным запахом (этиловый эфир муравьиной кислоты – запах рома, бутиловый эфир масляной кислоты – запах ананаса и т. д.).
Нахождение сложных эфиров в природе.
1. Синтетические сложные эфиры в виде фруктовых эссенций используются наряду с другими душистыми веществами в производстве фруктовых вод, кондитерских изделий.
2. Также сложные эфиры используются при изготовлении духов и одеколонов.
3. Некоторые из сложных эфиров (например, этиловый эфир уксусной кислоты) служат растворителями.
Химические свойства сложных эфиров:
1) взаимодействие их с водой. Например, при нагревании этилового эфира уксусной кислоты с водой в присутствии неорганической кислоты образуются уксусная кислота и этиловый спирт;
2) такая реакция называется гидролизом.
Особенности реакции гидролиза:
а) эта реакция противоположна реакции образования сложного эфира;
б) реакция гидролиза сложного эфира обратима, так же как и реакция этерификации.
56. Жиры и углеводы
Жиры в природе, их физические свойства.
1. Наряду с углеводами и белками жиры входят в состав всех растительных и животных организмов и составляют одну из основных частей пищи.
2. Животные жиры, как правило, твердые вещества.
3. Растительные жиры чаще бывают жидкими и называются еще маслами.
4. Известны также жидкие жиры животного происхождения (например, рыбий жир) и твердые растительные масла (например, кокосовое масло).
5. Все жиры легче воды.
6. В воде они не растворимы, но хорошо растворяются во многих органических растворителях (дихлорэтане, бензине).
Особенности строения жиров.
Строение жиров было установлено М. Шеврелеми М. Бертло. Нагревая жиры с водой (в присутствии щелочи), М. Шеврель еще в начале XIX в. установил, что, присоединяя воду, они разлагаются на глицерин и карбоновые кислоты – стеариновую, олеиновую и др. М. Бертло (1854 г.) осуществил обратную реакцию. Он нагревал смесь глицерина с кислотами и получил при этом вещества, аналогичные жирам; М. Шеврель провел реакцию гидролиза сложного эфира, а М. Бертло осуществил реакцию этерификации, т. е. синтез сложного эфира. На основании этих данных легко прийти к выводу о строении жиров.
Характерные особенности жиров.
1. Жиры – это сложные эфиры трехатомного спирта глицерина и карбоновых кислот.
2. В большинстве случаев жиры образованы высшими предельными и непредельными карбоновыми кислотами, главным образом:
а) пальмитиновой C15H31-СООН;
б) стеариновой С17Н35-СООН;
в) олеиновой С17Н33-СООН;
г) линолевой С17Н31-СООН и некоторыми другими.
3. В меньшей степени в образовании жиров участвуют низшие кислоты, например, масляная кислота С3Н7-СООН (в сливочном масле), капроновая кислота С5Н11-СООН и др.
4. Жиры, которые образуются преимущественно предельными кислотами, твердые (говяжий жир, бараний жир).
5. С повышением содержания непредельных кислот температура плавления жиров понижается, они становятся более легкоплавкими (свиное сало, сливочное масло).
Химические свойства жировопределяются принадлежностью их к классу сложных эфиров. Поэтому наиболее характерная для них реакция – гидролиз.
Жиры как питательные вещества.
1. Жиры являются важной составной частью нашей пищи.
При их окислении в организме выделяется в два раза больше теплоты, чем при окислении таких же количеств белков и углеводов.
2. Как вещества, не растворимые в воде, жиры не могут непосредственно всасываться в организм из органов пищеварения.
1. Наряду с углеводами и белками жиры входят в состав всех растительных и животных организмов и составляют одну из основных частей пищи.
2. Животные жиры, как правило, твердые вещества.
3. Растительные жиры чаще бывают жидкими и называются еще маслами.
4. Известны также жидкие жиры животного происхождения (например, рыбий жир) и твердые растительные масла (например, кокосовое масло).
5. Все жиры легче воды.
6. В воде они не растворимы, но хорошо растворяются во многих органических растворителях (дихлорэтане, бензине).
Особенности строения жиров.
Строение жиров было установлено М. Шеврелеми М. Бертло. Нагревая жиры с водой (в присутствии щелочи), М. Шеврель еще в начале XIX в. установил, что, присоединяя воду, они разлагаются на глицерин и карбоновые кислоты – стеариновую, олеиновую и др. М. Бертло (1854 г.) осуществил обратную реакцию. Он нагревал смесь глицерина с кислотами и получил при этом вещества, аналогичные жирам; М. Шеврель провел реакцию гидролиза сложного эфира, а М. Бертло осуществил реакцию этерификации, т. е. синтез сложного эфира. На основании этих данных легко прийти к выводу о строении жиров.
Характерные особенности жиров.
1. Жиры – это сложные эфиры трехатомного спирта глицерина и карбоновых кислот.
2. В большинстве случаев жиры образованы высшими предельными и непредельными карбоновыми кислотами, главным образом:
а) пальмитиновой C15H31-СООН;
б) стеариновой С17Н35-СООН;
в) олеиновой С17Н33-СООН;
г) линолевой С17Н31-СООН и некоторыми другими.
3. В меньшей степени в образовании жиров участвуют низшие кислоты, например, масляная кислота С3Н7-СООН (в сливочном масле), капроновая кислота С5Н11-СООН и др.
4. Жиры, которые образуются преимущественно предельными кислотами, твердые (говяжий жир, бараний жир).
5. С повышением содержания непредельных кислот температура плавления жиров понижается, они становятся более легкоплавкими (свиное сало, сливочное масло).
Химические свойства жировопределяются принадлежностью их к классу сложных эфиров. Поэтому наиболее характерная для них реакция – гидролиз.
Жиры как питательные вещества.
1. Жиры являются важной составной частью нашей пищи.
При их окислении в организме выделяется в два раза больше теплоты, чем при окислении таких же количеств белков и углеводов.
2. Как вещества, не растворимые в воде, жиры не могут непосредственно всасываться в организм из органов пищеварения.
57. Гидролиз жиров в технике. Гидрирование жиров
Гидролиз жиров в технике, его особенности:
1) реакция гидролиза используется в технике для получения из жиров глицерина, карбоновых кислот, мыла;
2) глицерин и кислоты образуются при нагревании жира с водой в автоклавах;
3) для получения мыла кислоты нагревают с раствором карбоната натрия;
4) чтобы выделить мыло, в раствор необходимо добавить хлорид натрия, при этом мыло всплывает наверх в виде плотного слоя – ядра. Из этой массы готовится ядровое мыло – обычные сорта хозяйственного мыла.
Для получения туалетного мыла ядровое мыло высушивают, смешивают с красящими и душистыми веществами, подвергают пластической обработке и штампуют в куски нужной формы.
Гидрирование жиров.
1. Для получения мыла и других веществ требуются преимущественно твердые жиры. В практике возможно превращение более дешевых растительных масел в твердые жиры, которые можно подвергать той или иной технической переработке.
2. Жидкие жиры отличаются от твердых непредельностью своего состава – наличием двойных связей в углеводородных радикалах.
3. Жидкие непредельные кислоты могут быть превращены в твердые путем присоединения к ним водорода, таким же путем можно превратить жидкие жиры в твердые.
Сущность способа гидрирования:
а) сущность способа гидрирования заключается в том, что через нагретую смесь масла с тонко измельченным катализатором (никелевым или медно-никелевым) пропускают водород под давлением;
б) водород присоединяется по месту двойных связей в углеводородных радикалах, и масло превращается в твердый жир, например:
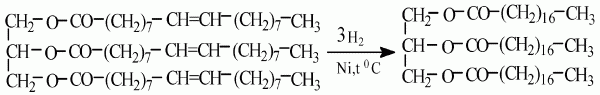 4. В промышленности процесс гидрирования осуществляется в ряде последовательно соединенных автоклавов по непрерывному методу.
4. В промышленности процесс гидрирования осуществляется в ряде последовательно соединенных автоклавов по непрерывному методу.
Проходя через систему автоклавов, жир подвергается все большему гидрированию; в результате получается масса, похожая по своей консистенции на сало.
Гидрированное масло называется еще саломасом. От катализатора саломас отделяется при помощи фильтрования.
Гидрированный жир– полноценный продукт для производства мыла, а при использовании определенных сортов масел – и для употребления в пищу, например в составе маргарина.
1) реакция гидролиза используется в технике для получения из жиров глицерина, карбоновых кислот, мыла;
2) глицерин и кислоты образуются при нагревании жира с водой в автоклавах;
3) для получения мыла кислоты нагревают с раствором карбоната натрия;
4) чтобы выделить мыло, в раствор необходимо добавить хлорид натрия, при этом мыло всплывает наверх в виде плотного слоя – ядра. Из этой массы готовится ядровое мыло – обычные сорта хозяйственного мыла.
Для получения туалетного мыла ядровое мыло высушивают, смешивают с красящими и душистыми веществами, подвергают пластической обработке и штампуют в куски нужной формы.
Гидрирование жиров.
1. Для получения мыла и других веществ требуются преимущественно твердые жиры. В практике возможно превращение более дешевых растительных масел в твердые жиры, которые можно подвергать той или иной технической переработке.
2. Жидкие жиры отличаются от твердых непредельностью своего состава – наличием двойных связей в углеводородных радикалах.
3. Жидкие непредельные кислоты могут быть превращены в твердые путем присоединения к ним водорода, таким же путем можно превратить жидкие жиры в твердые.
Сущность способа гидрирования:
а) сущность способа гидрирования заключается в том, что через нагретую смесь масла с тонко измельченным катализатором (никелевым или медно-никелевым) пропускают водород под давлением;
б) водород присоединяется по месту двойных связей в углеводородных радикалах, и масло превращается в твердый жир, например:
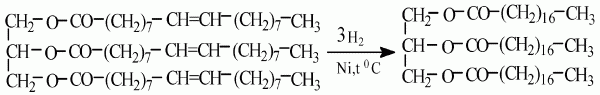
Проходя через систему автоклавов, жир подвергается все большему гидрированию; в результате получается масса, похожая по своей консистенции на сало.
Гидрированное масло называется еще саломасом. От катализатора саломас отделяется при помощи фильтрования.
Гидрированный жир– полноценный продукт для производства мыла, а при использовании определенных сортов масел – и для употребления в пищу, например в составе маргарина.
58. Мыла и другие моющие средства
Характерные особенности мыла:
1) мыла– это соли высших карбоновых кислот;
2) обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот;
3) натриевые соли образуют твердые мыла, калиевые соли – жидкие мыла;
4) мыла получаются при гидролизе жиров в присутствии щелочей:
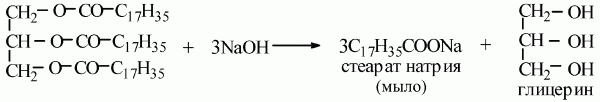 5) происходит реакция омыления;
5) происходит реакция омыления;
6) омыление жиров может протекать и в присутствии серной кислоты (кислотное омыление);
7) при кислотном омылении получаются глицерин и высшие карбоновые кислоты;
8) карбоновые кислоты действием щелочи или соды переходят в мыла;
9) исходным сырьем для получения мыла служат растительные масла (подсолнечное, хлопковое и др.), животные жиры, а также гидроксид натрия или кальцинированная сода;
10) растительные масла предварительно подвергаются гидрогенизации.
Гидрогенизация– это превращение растительного масла в твердые жиры.
Заменители жиров– это синтетические карбоновые жирные кислоты с большой молекулярной массой.
Получение мыла из непищевых продуктов:
1) необходимые для производства мыла карбоновые кислоты получаются окислением парафина;
2) нейтрализацией кислот, которые содержат от 10 до16 углеродных атомов в молекуле, получается туалетное мыло;
3) нейтрализацией кислот, которые содержат от 17 до 21 атома углерода, получается хозяйственное мыло и мыло для технических целей;
4) наряду с мылом из синтетических кислот производятся моющие средства из других видов сырья.
Алкилсульфаты– это соли сложных эфиров высших спиртов и серной кислоты.
В общем виде образование таких солей можно записать уравнениями:
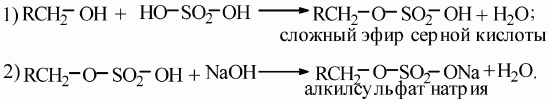 Особенности образующихся солей.
Особенности образующихся солей.
1. Эти соли содержат в молекуле от 12 до 14 углеродных атомов.
2. Они обладают очень хорошими моющими свойствами.
3. Кальциевые и магниевые соли растворимы в воде.
4. Такие мыла моют в жесткой воде.
5. Алкилсульфаты содержатся во многих стиральных порошках.
6. Синтетические моющие средства высвобождают сотни тысяч тонн пищевого сырья – растительных масел и жиров.
1) мыла– это соли высших карбоновых кислот;
2) обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот;
3) натриевые соли образуют твердые мыла, калиевые соли – жидкие мыла;
4) мыла получаются при гидролизе жиров в присутствии щелочей:
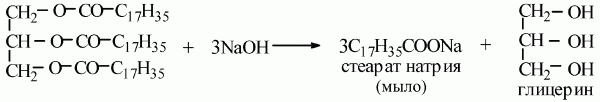
6) омыление жиров может протекать и в присутствии серной кислоты (кислотное омыление);
7) при кислотном омылении получаются глицерин и высшие карбоновые кислоты;
8) карбоновые кислоты действием щелочи или соды переходят в мыла;
9) исходным сырьем для получения мыла служат растительные масла (подсолнечное, хлопковое и др.), животные жиры, а также гидроксид натрия или кальцинированная сода;
10) растительные масла предварительно подвергаются гидрогенизации.
Гидрогенизация– это превращение растительного масла в твердые жиры.
Заменители жиров– это синтетические карбоновые жирные кислоты с большой молекулярной массой.
Получение мыла из непищевых продуктов:
1) необходимые для производства мыла карбоновые кислоты получаются окислением парафина;
2) нейтрализацией кислот, которые содержат от 10 до16 углеродных атомов в молекуле, получается туалетное мыло;
3) нейтрализацией кислот, которые содержат от 17 до 21 атома углерода, получается хозяйственное мыло и мыло для технических целей;
4) наряду с мылом из синтетических кислот производятся моющие средства из других видов сырья.
Алкилсульфаты– это соли сложных эфиров высших спиртов и серной кислоты.
В общем виде образование таких солей можно записать уравнениями:

1. Эти соли содержат в молекуле от 12 до 14 углеродных атомов.
2. Они обладают очень хорошими моющими свойствами.
3. Кальциевые и магниевые соли растворимы в воде.
4. Такие мыла моют в жесткой воде.
5. Алкилсульфаты содержатся во многих стиральных порошках.
6. Синтетические моющие средства высвобождают сотни тысяч тонн пищевого сырья – растительных масел и жиров.
59. Глюкоза. Физические свойства
Глюкоза – бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус (лат. «глюкос» – сладкий):
1) она встречается почти во всех органах растения: в плодах, корнях, листьях, цветах;
2) особенно много глюкозы в соке винограда и спелых фруктах, ягодах;
3) глюкоза есть в животных организмах;
4) в крови человека ее содержится примерно 0,1 %.
Особенности строения глюкозы
1. Состав глюкозы выражается формулой: С6Н12O6, она принадлежит к многоатомным спиртам.
2. Если раствор этого вещества прилить к свежеосажденному гидроксиду меди (II), образуется ярко-синий раствор, как в случае глицерина.
Опыт подтверждает принадлежность глюкозы к многоатомным спиртам.
3. Существует сложный эфир глюкозы, в молекуле которого пять остатков уксусной кислоты. Из этого следует, что в молекуле углевода пять гидроксильных групп. Этот факт объясняет, почему глюкоза хорошо растворяется в воде и имеет сладкий вкус.
Если раствор глюкозы нагреть с аммиачным раствором оксида серебра (I), то получится характерное «серебряное зеркало».
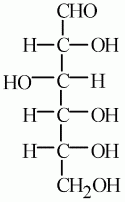
Шестой атом кислорода в молекуле вещества входит в состав альдегидной группы.
4. Чтобы составить полное представление о строении глюкозы, надо знать, как построен скелет молекулы. Поскольку все шесть атомов кислорода входят в состав функциональных групп, следовательно, атомы углерода, образующие скелет, соединены друг с другом непосредственно.
5. Цепь атомов углерода прямая, а не разветвленная.
6. Альдегидная группа может находиться только в конце неразветвленной углеродной цепи, и гидроксильные группы могут быть устойчивы, находясь лишь у разных атомов углерода.
7. Глюкоза одновременно и альдегид, и многоатомный спирт: она альдегидоспирт.
 8. В растворе глюкозы содержатся молекулы не только с открытой цепью атомов, но и циклические, в которых нет альдегидной группы.
8. В растворе глюкозы содержатся молекулы не только с открытой цепью атомов, но и циклические, в которых нет альдегидной группы.
1) она встречается почти во всех органах растения: в плодах, корнях, листьях, цветах;
2) особенно много глюкозы в соке винограда и спелых фруктах, ягодах;
3) глюкоза есть в животных организмах;
4) в крови человека ее содержится примерно 0,1 %.
Особенности строения глюкозы
1. Состав глюкозы выражается формулой: С6Н12O6, она принадлежит к многоатомным спиртам.
2. Если раствор этого вещества прилить к свежеосажденному гидроксиду меди (II), образуется ярко-синий раствор, как в случае глицерина.
Опыт подтверждает принадлежность глюкозы к многоатомным спиртам.
3. Существует сложный эфир глюкозы, в молекуле которого пять остатков уксусной кислоты. Из этого следует, что в молекуле углевода пять гидроксильных групп. Этот факт объясняет, почему глюкоза хорошо растворяется в воде и имеет сладкий вкус.
Если раствор глюкозы нагреть с аммиачным раствором оксида серебра (I), то получится характерное «серебряное зеркало».
Шестой атом кислорода в молекуле вещества входит в состав альдегидной группы.
4. Чтобы составить полное представление о строении глюкозы, надо знать, как построен скелет молекулы. Поскольку все шесть атомов кислорода входят в состав функциональных групп, следовательно, атомы углерода, образующие скелет, соединены друг с другом непосредственно.
5. Цепь атомов углерода прямая, а не разветвленная.
6. Альдегидная группа может находиться только в конце неразветвленной углеродной цепи, и гидроксильные группы могут быть устойчивы, находясь лишь у разных атомов углерода.
7. Глюкоза одновременно и альдегид, и многоатомный спирт: она альдегидоспирт.

