Способы применения пиридина:1) ароматические и основные свойства пиридина используются при синтезе разного рода лекарственных препаратов, красителей, гербицидов; 2) также пиридин используется как растворитель для денатурирования этанола.
80. Пиррол
81. Пиримидиновые и пуриновые основания
82. Нуклеиновые кислоты
83. Строение полинуклеотидов. Двойная спираль ДНК
84. Строение полимеров, свойства и синтез полимеров
85. Пластмассы
86. Полиэтилен и полипропилен
87. Поливинилхлорид и полистирол
88. Синтетические волокна
80. Пиррол
Особенности строения пиррола:
1) это пятичленное гетероциклическое соединение, которое содержит в цикле один атом азота:
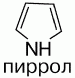 2) бесцветная жидкость с температурой кипения 130 °C. При хранении окрашивается и окисляется. Название пиррола (красное масло) было дано Рунге (1834 г.), обнаружившим его в костяном масле (продукт сухой перегонки костей) и в небольшом количестве в каменноугольной смоле. Название связано с покраснением сосновой лучинки, смоченной соляной кислотой. Строение было установлено А. Байером в 1870 г. Пиррол в промышленности получают из фурана и аммиака (реакция Юрьева).
2) бесцветная жидкость с температурой кипения 130 °C. При хранении окрашивается и окисляется. Название пиррола (красное масло) было дано Рунге (1834 г.), обнаружившим его в костяном масле (продукт сухой перегонки костей) и в небольшом количестве в каменноугольной смоле. Название связано с покраснением сосновой лучинки, смоченной соляной кислотой. Строение было установлено А. Байером в 1870 г. Пиррол в промышленности получают из фурана и аммиака (реакция Юрьева).
Атомы углерода, затратив по три электрона на установление ?-связей, могут предоставить для образования общего электронного облака лишь четыре р-электрона, а их должно быть шесть. В атоме азота имеется пять валентных электронов, три из них идут на установление связей с атомом водорода и углеродными атомами, а два электрона включаются в образование шестиэлектронного р-облака. Эти электроны в структурной формуле, в отличие от пиридина, обозначаются внутри кольца. В этом случае электроны азота уже не могут быть обозначены двумя точками внутри цикла.
Причиной утраты пирролом свойств оснований является электронная пара азота, которая «занята» в ароматическом секстете молекулы.
Кислотно-основные свойства пиррола.
Пиррол является очень слабой кислотой, он реагирует с металлами, образуя соли.
 Основные свойства, которые можно было бы предположить у пиррола как вторичного амина, очень ослаблены за счет сопряжения электронной пары с кольцом и маскируются быстрой полимеризацией под влиянием кислот.
Основные свойства, которые можно было бы предположить у пиррола как вторичного амина, очень ослаблены за счет сопряжения электронной пары с кольцом и маскируются быстрой полимеризацией под влиянием кислот.
Применение пиррола.
Пиррол применяется для синтеза различных органических соединений, в том числе лекарственных средств. Полиэтилентерефталат это полимер, в молекулах которого многократно повторяется группировка сложного эфира.
При изучении номенклатуры пиррола следует помнить, что углеродные атомы ядра обозначаются либо буквами греческого алфавита (соседние с гетероатомом – буквой ?, следующие буквой ? и т. д.), либо по цифровой системе (начиная с самого гетероатома).
1) это пятичленное гетероциклическое соединение, которое содержит в цикле один атом азота:

Атомы углерода, затратив по три электрона на установление ?-связей, могут предоставить для образования общего электронного облака лишь четыре р-электрона, а их должно быть шесть. В атоме азота имеется пять валентных электронов, три из них идут на установление связей с атомом водорода и углеродными атомами, а два электрона включаются в образование шестиэлектронного р-облака. Эти электроны в структурной формуле, в отличие от пиридина, обозначаются внутри кольца. В этом случае электроны азота уже не могут быть обозначены двумя точками внутри цикла.
Причиной утраты пирролом свойств оснований является электронная пара азота, которая «занята» в ароматическом секстете молекулы.
Кислотно-основные свойства пиррола.
Пиррол является очень слабой кислотой, он реагирует с металлами, образуя соли.

Применение пиррола.
Пиррол применяется для синтеза различных органических соединений, в том числе лекарственных средств. Полиэтилентерефталат это полимер, в молекулах которого многократно повторяется группировка сложного эфира.
При изучении номенклатуры пиррола следует помнить, что углеродные атомы ядра обозначаются либо буквами греческого алфавита (соседние с гетероатомом – буквой ?, следующие буквой ? и т. д.), либо по цифровой системе (начиная с самого гетероатома).
81. Пиримидиновые и пуриновые основания
На основе типичных представителей азотистых гетероциклов – пиридина и пиррола – можно рассмотреть соединения, которые содержат более одного гетероатома в молекуле.
Особенности строения оснований пиримидина и пурина:
 1) это бесцветные кристаллические вещества;
1) это бесцветные кристаллические вещества;
2) пиримидин – шестичленный цикл, подобный пиридину, который отличается от него наличием в молекуле еще одного гетероатома (азота) вместо группы СН; 3) пурин является бициклическим.
Особый интерес представляют не столько пиримидин и пурин, сколько вещества с их характерной структурой – пиримидиновые и пуриновые основания,которые входят в состав природных высокомолекулярных веществ – нуклеиновых кислот, которые осуществляют синтез белков в организмах.
Структурные формулы пиримидиновых оснований:
 Цитозин– (2-гидрокси-4-аминопиримидин) – бесцветное малорастворимое вещество с Тпл 320–325 °C. Цитозин является слабым основанием, сравнимым с анилином и очень слабой NH-кислотой. Цитозин входит в состав нуклеиновых кислот. Урацил (2,4-дигидроксипиримидин) – бесцветное малорастворимое в воде вещество с Тпл 335 °C. Входит в состав нуклеиновых кислот, нуклеотидов. Получают из гидролизатов нуклеиновых кислот. Урацил вступает в реакции электрофильного замещения: алкилирования, галогенирования, азосочетания. Тимин (2,4-дигидрокси-5-метилпиримидин) – бесцветное малорастворимое кристаллическое вещество с Тпл 318 °C. Являясь производным урацила, обнаруживает сходные свойства, за исключением реакций SE, поскольку 5-е положение занято метильным радикалом. Входит в состав нуклеиновых кислот, нуклеотидов, является основой лекарственных препаратов. Например, азидотимидин – лекарство против СПИДа.
Цитозин– (2-гидрокси-4-аминопиримидин) – бесцветное малорастворимое вещество с Тпл 320–325 °C. Цитозин является слабым основанием, сравнимым с анилином и очень слабой NH-кислотой. Цитозин входит в состав нуклеиновых кислот. Урацил (2,4-дигидроксипиримидин) – бесцветное малорастворимое в воде вещество с Тпл 335 °C. Входит в состав нуклеиновых кислот, нуклеотидов. Получают из гидролизатов нуклеиновых кислот. Урацил вступает в реакции электрофильного замещения: алкилирования, галогенирования, азосочетания. Тимин (2,4-дигидрокси-5-метилпиримидин) – бесцветное малорастворимое кристаллическое вещество с Тпл 318 °C. Являясь производным урацила, обнаруживает сходные свойства, за исключением реакций SE, поскольку 5-е положение занято метильным радикалом. Входит в состав нуклеиновых кислот, нуклеотидов, является основой лекарственных препаратов. Например, азидотимидин – лекарство против СПИДа.
Структурные формулы пуриновых оснований:
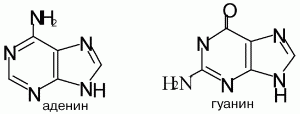 Аденин (6-аминопурин) – бесцветное кристаллическое вещество с Тпл 360–365 °C, мало растворяется в воде. Входит в состав нуклеотидов, нуклеозидов и нуклеиновых кислот. Его используют в качестве исходного соединения для органического и микробиологического синтеза и в медицине, например в качестве консерванта донорской крови. Гуанин (2-амино-6-гидроксипурин) – бесцветное кристаллическое вещество с Тпл 365 °C, мало растворяется в воде, входит в состав нуклеотидов, нуклеозидов и нуклеиновых кислот.
Аденин (6-аминопурин) – бесцветное кристаллическое вещество с Тпл 360–365 °C, мало растворяется в воде. Входит в состав нуклеотидов, нуклеозидов и нуклеиновых кислот. Его используют в качестве исходного соединения для органического и микробиологического синтеза и в медицине, например в качестве консерванта донорской крови. Гуанин (2-амино-6-гидроксипурин) – бесцветное кристаллическое вещество с Тпл 365 °C, мало растворяется в воде, входит в состав нуклеотидов, нуклеозидов и нуклеиновых кислот.
Особенности строения оснований пиримидина и пурина:

2) пиримидин – шестичленный цикл, подобный пиридину, который отличается от него наличием в молекуле еще одного гетероатома (азота) вместо группы СН; 3) пурин является бициклическим.
Особый интерес представляют не столько пиримидин и пурин, сколько вещества с их характерной структурой – пиримидиновые и пуриновые основания,которые входят в состав природных высокомолекулярных веществ – нуклеиновых кислот, которые осуществляют синтез белков в организмах.
Структурные формулы пиримидиновых оснований:

Структурные формулы пуриновых оснований:

82. Нуклеиновые кислоты
Характерные особенности нуклеиновых кислот и теории их происхождения:
1) нуклеиновые кислоты – природные полимеры, они были обнаружены в ядрах клеток (лат. nucleus– ядро) еще в прошлом столетии, но долгое время их роль в жизни организмов была неизвестна ученым;
2) несколько десятилетий назад было расшифровано строение нуклеиновых кислот и установлено, что они играют главную роль в хранении и передаче наследственной информации и обеспечивают синтез белков в клетке.
Состав нуклеиновых кислот.
Нуклеиновые кислоты подвергаются гидролизу, при этом получается не один продукт (как у крахмала или целлюлозы), а несколько (как у белков): а) углевод (пентоза); б) азотсодержащие гетероциклические соединения (пиримидиновые и пуриновые основания); в) ортофосфорная кислота.
В организмах существуют два вида нуклеиновых кислот:
1) рибонуклеиновые (РНК);
2) дезоксирибонуклеиновые (ДНК).
Основные отличия этих нуклеиновых кислот.
1. Они различаются характером углеводного компонента – пентозы.
2. При гидролизе одних кислот образуется рибоза, в таком случае это рибонуклеиновые кислоты (РНК).
3. При гидролизе других – дезоксирибоза, это дезоксирибонуклеиновые кислоты (ДНК).
4. Различаются нуклеиновые кислоты и входящими в них азотистыми основаниями.
5. В РНК и ДНК входят по четыре основания из пяти, в их числе обязательно оба пуриновых основания – аденин и гуанин – и одно из пиримидиновых оснований – цитозин. Четвертое же основание (второе пиримидиновое) в нуклеиновых кислотах разное: в РНК это урацил, а в ДНК – тимин.
6. Неодинакова у нуклеиновых кислот и молекулярная масса: у РНК – от нескольких десятков тысяч до нескольких миллионов, ДНК – достигает даже нескольких десятков миллионов.
7. Структурными звеньями нуклеиновых кислот являются так называемые нуклеотиды.
Они выделены как промежуточные продукты гидролиза, когда процесс разложения не дошел до образования конечных продуктов.
Структурные формулы нуклеотидов.
Мононуклеотидыпредставляют собой фосфаты нуклеозидов, в которых фосфорная кислота связана сложноэфирной связью с одной из свободных гидроксильных групп пентозы.
Нуклеозиды– это N-гликозиды пиримидиновых или пуриновых оснований, в которых первый углеродный атом пентозы (атом углерода, обозначаемый 1) связан гликозидной связью с N-1-пиримидина или N-9-пурина.
1) нуклеиновые кислоты – природные полимеры, они были обнаружены в ядрах клеток (лат. nucleus– ядро) еще в прошлом столетии, но долгое время их роль в жизни организмов была неизвестна ученым;
2) несколько десятилетий назад было расшифровано строение нуклеиновых кислот и установлено, что они играют главную роль в хранении и передаче наследственной информации и обеспечивают синтез белков в клетке.
Состав нуклеиновых кислот.
Нуклеиновые кислоты подвергаются гидролизу, при этом получается не один продукт (как у крахмала или целлюлозы), а несколько (как у белков): а) углевод (пентоза); б) азотсодержащие гетероциклические соединения (пиримидиновые и пуриновые основания); в) ортофосфорная кислота.
В организмах существуют два вида нуклеиновых кислот:
1) рибонуклеиновые (РНК);
2) дезоксирибонуклеиновые (ДНК).
Основные отличия этих нуклеиновых кислот.
1. Они различаются характером углеводного компонента – пентозы.
2. При гидролизе одних кислот образуется рибоза, в таком случае это рибонуклеиновые кислоты (РНК).
3. При гидролизе других – дезоксирибоза, это дезоксирибонуклеиновые кислоты (ДНК).
4. Различаются нуклеиновые кислоты и входящими в них азотистыми основаниями.
5. В РНК и ДНК входят по четыре основания из пяти, в их числе обязательно оба пуриновых основания – аденин и гуанин – и одно из пиримидиновых оснований – цитозин. Четвертое же основание (второе пиримидиновое) в нуклеиновых кислотах разное: в РНК это урацил, а в ДНК – тимин.
6. Неодинакова у нуклеиновых кислот и молекулярная масса: у РНК – от нескольких десятков тысяч до нескольких миллионов, ДНК – достигает даже нескольких десятков миллионов.
7. Структурными звеньями нуклеиновых кислот являются так называемые нуклеотиды.
Они выделены как промежуточные продукты гидролиза, когда процесс разложения не дошел до образования конечных продуктов.
Структурные формулы нуклеотидов.
Мононуклеотидыпредставляют собой фосфаты нуклеозидов, в которых фосфорная кислота связана сложноэфирной связью с одной из свободных гидроксильных групп пентозы.
Нуклеозиды– это N-гликозиды пиримидиновых или пуриновых оснований, в которых первый углеродный атом пентозы (атом углерода, обозначаемый 1) связан гликозидной связью с N-1-пиримидина или N-9-пурина.
83. Строение полинуклеотидов. Двойная спираль ДНК
Особенности строения полинуклеотидов:
1) основную структурную линию макромолекулы ДНК образуют последовательно соединенные друг с другом только звенья пентозы и ортофосфорной кислоты;
2) азотистые основания присоединены сбоку к углеводным звеньям;
3) они образуют «бахрому» макромолекулы нуклеиновой кислоты;
4) остатки ортофосфорной кислоты соединяют между собой углеводные звенья, образуя химические связи (за счет выделения молекул воды) с гидроксилом третьего атома углерода одной молекулы пентозы и гидроксилом пятого углеродного атома другой молекулы пентозы.
При этом у остатков фосфорной кислоты сохраняется еще по одной гидроксильной группе, способной диссоциировать, что и обусловливает кислотные свойства макромолекул;
5) самое существенное в строении нуклеиновых кислот – последовательность азотистых (пиримидиновых и пуриновых) оснований, «прицепленных» к основной цепи, которая состоит из остатков пентозы и фосфорной кислоты, т. е. последовательность нуклеотидов в макромолекуле.
С определенной последовательностью нуклеотидов, т. е. первичной структурой нуклеиновых кислот, связаны их биологические функции в клетке.
Двойная спираль ДНК, ее особенности.
Дезоксирибонуклеиновые кислоты, в молекулах которых зашифрована в виде различной последовательности нуклеотидов вся наследственная информация биологического строения.
1. Макромолекулы ДНК представляют собой спираль, которая состоит из двух цепей, закрученных вокруг общей оси.
2. Это их вторичная структура.
3. В поддержании вторичной структуры, как и в белках, важная роль принадлежит водородным связям.
4. Образуются они здесь между пиримидиновыми и пуриновыми основаниями разных цепей макромолекулы, располагающимися, в отличие от радикалов белковых молекул, не снаружи, а внутри спирали.
5. Водородные связи образуются между атомами водорода, имеющими значительный (хотя и частичный) положительный заряд, и отрицательно заряженными атомами кислорода.
Происхождение положительных и отрицательных зарядов на атомах, между которыми образуются водородные связи:
1) азотистые основания соединяются по определенному принципу, дополняя друг друга, – пиримидиновое обязательно с пуриновым и наоборот, при этом между цепями молекулы всегда находятся одинаковые ступеньки из трех гетероциклов (а не из двух и не из четырех);
2) это обеспечивает равномерность в построении всей молекулы ДНК.
Химия и биохимия белков и нуклеиновых кислот в своем развитии привели к созданию новых наук: а) биоорганической химии; б) молекулярной биологии.
1) основную структурную линию макромолекулы ДНК образуют последовательно соединенные друг с другом только звенья пентозы и ортофосфорной кислоты;
2) азотистые основания присоединены сбоку к углеводным звеньям;
3) они образуют «бахрому» макромолекулы нуклеиновой кислоты;
4) остатки ортофосфорной кислоты соединяют между собой углеводные звенья, образуя химические связи (за счет выделения молекул воды) с гидроксилом третьего атома углерода одной молекулы пентозы и гидроксилом пятого углеродного атома другой молекулы пентозы.
При этом у остатков фосфорной кислоты сохраняется еще по одной гидроксильной группе, способной диссоциировать, что и обусловливает кислотные свойства макромолекул;
5) самое существенное в строении нуклеиновых кислот – последовательность азотистых (пиримидиновых и пуриновых) оснований, «прицепленных» к основной цепи, которая состоит из остатков пентозы и фосфорной кислоты, т. е. последовательность нуклеотидов в макромолекуле.
С определенной последовательностью нуклеотидов, т. е. первичной структурой нуклеиновых кислот, связаны их биологические функции в клетке.
Двойная спираль ДНК, ее особенности.
Дезоксирибонуклеиновые кислоты, в молекулах которых зашифрована в виде различной последовательности нуклеотидов вся наследственная информация биологического строения.
1. Макромолекулы ДНК представляют собой спираль, которая состоит из двух цепей, закрученных вокруг общей оси.
2. Это их вторичная структура.
3. В поддержании вторичной структуры, как и в белках, важная роль принадлежит водородным связям.
4. Образуются они здесь между пиримидиновыми и пуриновыми основаниями разных цепей макромолекулы, располагающимися, в отличие от радикалов белковых молекул, не снаружи, а внутри спирали.
5. Водородные связи образуются между атомами водорода, имеющими значительный (хотя и частичный) положительный заряд, и отрицательно заряженными атомами кислорода.
Происхождение положительных и отрицательных зарядов на атомах, между которыми образуются водородные связи:
1) азотистые основания соединяются по определенному принципу, дополняя друг друга, – пиримидиновое обязательно с пуриновым и наоборот, при этом между цепями молекулы всегда находятся одинаковые ступеньки из трех гетероциклов (а не из двух и не из четырех);
2) это обеспечивает равномерность в построении всей молекулы ДНК.
Химия и биохимия белков и нуклеиновых кислот в своем развитии привели к созданию новых наук: а) биоорганической химии; б) молекулярной биологии.
84. Строение полимеров, свойства и синтез полимеров
Низкомолекулярное вещество, из которого синтезируют полимер, называется мономером. Многократно повторяющиеся в макромолекуле группы атомов называются структурными звеньями. Молекула мономера и структурное звено макромолекулы одинаковы по составу, но
различны по строению:
1) в данном случае в молекуле пропилена имеется двойная связь между атомами;
2) в структурном звене полипропилена она отсутствует;
3) число n в формуле полимера показывает, сколько молекул мономера соединяется в макромолекулу. Она называется степенью полимеризации.
Макромолекулы полимеров могут иметь различную геометрическую форму:
а) линейную(зигзагообразную), когда структурные звенья соединены в длинные цепи последовательно одно за другим;
б) разветвленную(с ними мы встречались на примере крахмала);
в) пространственную, когда линейные молекулы соединены между собой химическими связями (например, в вулканизированном каучуке – резине).
Геометрическаяформа полимеров существенно сказывается на их свойствах.
Свойства полимеров:
1) полимеры могут иметь кристаллическое и аморфное строение;
2) молекулярная масса для полимеров имеет некоторые особенности.
Характерные особенности молекулярной массы.
1. В процессе полимеризации в макромолекулы соединяется различное число молекул мономера в зависимости от того, когда произойдет обрыв растущей полимерной цепи.
2. При этом образуются макромолекулы разной длины и разной массы.
3. Указываемая для такого вещества молекулярная масса – это лишь ее среднее значение, от которого масса отдельных молекул существенно отклоняется в ту или иную сторону.
Например, если молекулярная масса полимера 28 000, то в нем могут быть молекулы с относительной массой 26 000, 28 000, 30 000 и т. д.
Свойства, которые вытекают из особенностей строения полимеров:
1) низкомолекулярные вещества характеризуются определенными температурами плавления, кипения и другими константами;
2) если нагревать какой-нибудь полимер линейной структуры, то будет видно, что он сначала размягчится, а потом, по мере дальнейшего повышения температуры, начнет постепенно плавиться, образуя вязкотекучую жидкость;
3) многие полимеры характеризуются плохой растворимостью;
4) вещества линейной структуры все же могут, хотя и с трудом, растворяться в тех или иных растворителях, образуя весьма вязкие растворы;
5) пространственные полимеры совершенно не растворимы.
Некоторые из них, например резина, могут только набухать в растворителях.
1) в данном случае в молекуле пропилена имеется двойная связь между атомами;
2) в структурном звене полипропилена она отсутствует;
3) число n в формуле полимера показывает, сколько молекул мономера соединяется в макромолекулу. Она называется степенью полимеризации.
Макромолекулы полимеров могут иметь различную геометрическую форму:
а) линейную(зигзагообразную), когда структурные звенья соединены в длинные цепи последовательно одно за другим;
б) разветвленную(с ними мы встречались на примере крахмала);
в) пространственную, когда линейные молекулы соединены между собой химическими связями (например, в вулканизированном каучуке – резине).
Геометрическаяформа полимеров существенно сказывается на их свойствах.
Свойства полимеров:
1) полимеры могут иметь кристаллическое и аморфное строение;
2) молекулярная масса для полимеров имеет некоторые особенности.
Характерные особенности молекулярной массы.
1. В процессе полимеризации в макромолекулы соединяется различное число молекул мономера в зависимости от того, когда произойдет обрыв растущей полимерной цепи.
2. При этом образуются макромолекулы разной длины и разной массы.
3. Указываемая для такого вещества молекулярная масса – это лишь ее среднее значение, от которого масса отдельных молекул существенно отклоняется в ту или иную сторону.
Например, если молекулярная масса полимера 28 000, то в нем могут быть молекулы с относительной массой 26 000, 28 000, 30 000 и т. д.
Свойства, которые вытекают из особенностей строения полимеров:
1) низкомолекулярные вещества характеризуются определенными температурами плавления, кипения и другими константами;
2) если нагревать какой-нибудь полимер линейной структуры, то будет видно, что он сначала размягчится, а потом, по мере дальнейшего повышения температуры, начнет постепенно плавиться, образуя вязкотекучую жидкость;
3) многие полимеры характеризуются плохой растворимостью;
4) вещества линейной структуры все же могут, хотя и с трудом, растворяться в тех или иных растворителях, образуя весьма вязкие растворы;
5) пространственные полимеры совершенно не растворимы.
Некоторые из них, например резина, могут только набухать в растворителях.
85. Пластмассы
Характерные особенности пластмасс:
1) пластмассаминазывают материалы, изготовляемые на основе полимеров, способные принимать при нагревании заданную форму и сохранять ее после охлаждения;
2) по масштабу производства они занимают первое место среди полимерных материалов;
3) в пластмассах сочетаются большая механическая прочность, малая плотность, высокая химическая стойкость, хорошие теплоизоляционные и электроизоляционные свойства и т. п.;
4) пластмассы производятся из доступного сырья, они легко поддаются переработке в самые разнообразные изделия;
5) кроме полимера (называемого часто смолой), в пластмассах почти всегда содержатся другие компоненты, придающие материалу определенные качества:
а) полимерное вещество для них является связующим;
б) в пластмассы входят:
– наполнители(древесная мука, ткань, асбест, стекловолокно и др.), снижающие стоимость материала и улучшающие его механические свойства, пластификаторы (например, высококипящие сложные эфиры), повышающие эластичность, устраняющие хрупкость, стабилизаторы (антиоксиданты, светостабилизаторы), которые способствуют сохранению свойств пластмасс в процессе их переработки и использования;
– красители, сообщающие материалу требуемую окраску, и другие вещества.
Для правильного обращения с пластмассами нужно знать, термопластичными или термореактивными являются образующие их полимеры.
Термопластичные полимеры(например, полиэтилен):
1) при нагревании размягчаются и в этом состоянии легко изменяют форму;
2) при охлаждении они снова затвердевают и сохраняют приданную форму;
3) при следующем нагревании они снова размягчаются, принимают новую форму и т. д.;
4) из термопластичных полимеров посредством нагревания и давления можно формовать различные изделия и при необходимости подвергать их повторно такой же переработке.
Термореактивные полимеры:
1) при нагревании сначала становятся пластичными, но потом утрачивают пластичность, становятся неплавкими и нерастворимыми, так как в них происходит химическое взаимодействие между линейными макромолекулами, образуется пространственная структура полимера (подобно превращению каучука в резину);
2) повторно переработать такой материал в новое изделие уже невозможно: он приобрел пространственную структуру и утратил необходимое для этого свойство пластичности.
На основе приведенных общих сведений о полимерах рассмотрим некоторые наиболее распространенные пластмассы.
Пластмассы на основе полимеров являются ценными заменителями многих природных материалов (металла, дерева, кожи, клеев и т. д.).
1) пластмассаминазывают материалы, изготовляемые на основе полимеров, способные принимать при нагревании заданную форму и сохранять ее после охлаждения;
2) по масштабу производства они занимают первое место среди полимерных материалов;
3) в пластмассах сочетаются большая механическая прочность, малая плотность, высокая химическая стойкость, хорошие теплоизоляционные и электроизоляционные свойства и т. п.;
4) пластмассы производятся из доступного сырья, они легко поддаются переработке в самые разнообразные изделия;
5) кроме полимера (называемого часто смолой), в пластмассах почти всегда содержатся другие компоненты, придающие материалу определенные качества:
а) полимерное вещество для них является связующим;
б) в пластмассы входят:
– наполнители(древесная мука, ткань, асбест, стекловолокно и др.), снижающие стоимость материала и улучшающие его механические свойства, пластификаторы (например, высококипящие сложные эфиры), повышающие эластичность, устраняющие хрупкость, стабилизаторы (антиоксиданты, светостабилизаторы), которые способствуют сохранению свойств пластмасс в процессе их переработки и использования;
– красители, сообщающие материалу требуемую окраску, и другие вещества.
Для правильного обращения с пластмассами нужно знать, термопластичными или термореактивными являются образующие их полимеры.
Термопластичные полимеры(например, полиэтилен):
1) при нагревании размягчаются и в этом состоянии легко изменяют форму;
2) при охлаждении они снова затвердевают и сохраняют приданную форму;
3) при следующем нагревании они снова размягчаются, принимают новую форму и т. д.;
4) из термопластичных полимеров посредством нагревания и давления можно формовать различные изделия и при необходимости подвергать их повторно такой же переработке.
Термореактивные полимеры:
1) при нагревании сначала становятся пластичными, но потом утрачивают пластичность, становятся неплавкими и нерастворимыми, так как в них происходит химическое взаимодействие между линейными макромолекулами, образуется пространственная структура полимера (подобно превращению каучука в резину);
2) повторно переработать такой материал в новое изделие уже невозможно: он приобрел пространственную структуру и утратил необходимое для этого свойство пластичности.
На основе приведенных общих сведений о полимерах рассмотрим некоторые наиболее распространенные пластмассы.
Пластмассы на основе полимеров являются ценными заменителями многих природных материалов (металла, дерева, кожи, клеев и т. д.).
86. Полиэтилен и полипропилен
Особенности полиэтилена и его строения:
1) структурная формула полиэтилена: (-СН2-СН2-)n;
2) это твердый, белого цвета, термопластичный, немного жирный на ощупь материал, напоминает парафин.
Это сходство можно понять, если учесть, что полимер по строению – предельный углеводород (парафин) с большой молекулярной массой.
Горючесть полиэтилена и его химическая стойкость по отношению к реагентам.
1. Полиэтилен горит голубоватым, слабо светящимся пламенем.
2. Растворы кислот, щелочей, окислителей (перманганата калия) на него не действуют.
3. Концентрированная азотная кислота разрушает полиэтилен.
Способы применения полиэтилена:
1) как хороший диэлектрик он широко используется для изоляции электропроводов и кабелей, применяемых в различных средствах связи, высокочастотных установках;
2) значительная водо– и газонепроницаемость пленок полиэтилена позволяет использовать их как упаковочный материал для различных изделий и продуктов питания;
3) в сельском хозяйстве пленки нашли применение при строительстве теплиц, для устранения фильтрационных потерь воды в каналах и водохранилищах, для укрытия плодово-ягодных культур и саженцев от заморозков и т. п.;
4) химическая стойкость полиэтилена дает возможность изготовлять из него разного рода трубы, детали в химическом аппаратостроении, емкости для хранения и перевозки химически агрессивных жидкостей. В больших количествах из полиэтилена изготовляют предметы бытового назначения: фляги, кружки, упаковочные пакеты и т. д.
Способы получения полиэтилена.
1. Полиэтилен получается в промышленности при высоком давлении (150–300 МПа, 200–280 °C) и низком давлении (0,2–2,5 МПа, 80—100 °C).
2. Полимер высокого давления не имеет строго линейной структуры, в его цепных макромолекулах образуются ответвления.
3. Полимер низкого давления в результате действия особого катализатора приобретает строго линейную структуру, поэтому молекулы его могут плотнее примыкать друг к другу (возрастает степень кристалличности), что существенно сказывается на свойствах материала.
4. При обращении с изделиями из полиэтилена следует учитывать возможные различия в свойствах, например: а) изделия из полимера высокого давления могут эксплуатироваться при температурах до 60–70 °C; б) изделия из полимера низкого давления – до 100 °C.
Полипропилен и его характерные особенности:
1) структурная формула полипропилена: (-СН2-СН(CH3)-)n;
2) он имеет много общего с полиэтиленом;
3) полипропилен – это тоже твердый, жирный на ощупь, белого цвета, термопластичный материал.
1) структурная формула полиэтилена: (-СН2-СН2-)n;
2) это твердый, белого цвета, термопластичный, немного жирный на ощупь материал, напоминает парафин.
Это сходство можно понять, если учесть, что полимер по строению – предельный углеводород (парафин) с большой молекулярной массой.
Горючесть полиэтилена и его химическая стойкость по отношению к реагентам.
1. Полиэтилен горит голубоватым, слабо светящимся пламенем.
2. Растворы кислот, щелочей, окислителей (перманганата калия) на него не действуют.
3. Концентрированная азотная кислота разрушает полиэтилен.
Способы применения полиэтилена:
1) как хороший диэлектрик он широко используется для изоляции электропроводов и кабелей, применяемых в различных средствах связи, высокочастотных установках;
2) значительная водо– и газонепроницаемость пленок полиэтилена позволяет использовать их как упаковочный материал для различных изделий и продуктов питания;
3) в сельском хозяйстве пленки нашли применение при строительстве теплиц, для устранения фильтрационных потерь воды в каналах и водохранилищах, для укрытия плодово-ягодных культур и саженцев от заморозков и т. п.;
4) химическая стойкость полиэтилена дает возможность изготовлять из него разного рода трубы, детали в химическом аппаратостроении, емкости для хранения и перевозки химически агрессивных жидкостей. В больших количествах из полиэтилена изготовляют предметы бытового назначения: фляги, кружки, упаковочные пакеты и т. д.
Способы получения полиэтилена.
1. Полиэтилен получается в промышленности при высоком давлении (150–300 МПа, 200–280 °C) и низком давлении (0,2–2,5 МПа, 80—100 °C).
2. Полимер высокого давления не имеет строго линейной структуры, в его цепных макромолекулах образуются ответвления.
3. Полимер низкого давления в результате действия особого катализатора приобретает строго линейную структуру, поэтому молекулы его могут плотнее примыкать друг к другу (возрастает степень кристалличности), что существенно сказывается на свойствах материала.
4. При обращении с изделиями из полиэтилена следует учитывать возможные различия в свойствах, например: а) изделия из полимера высокого давления могут эксплуатироваться при температурах до 60–70 °C; б) изделия из полимера низкого давления – до 100 °C.
Полипропилен и его характерные особенности:
1) структурная формула полипропилена: (-СН2-СН(CH3)-)n;
2) он имеет много общего с полиэтиленом;
3) полипропилен – это тоже твердый, жирный на ощупь, белого цвета, термопластичный материал.
87. Поливинилхлорид и полистирол
Характерные особенности поливинилхлорида:
1) структурная формула поливинилхлорида: (-СН2-СН(Cl)-)n;
2) это термопластичный полимер, линейные макромолекулы которого построены по типу «голова – хвост» (М от 10 000 до 150 000);
3) получается он радикальной полимеризацией хлорвинила (винилхлорида) СН2=СНCl в присутствии инициаторов, которые дают при распаде свободные радикалы для начала роста цепи.
Особенности строения поливинилхлорида.
1. По составу и строению его можно рассматривать как хлорпроизводное полиэтилена.
2. Атомы хлора, заместившие часть атомов водорода, прочно соединены с углеродными атомами.
3. Поливинилхлорид устойчив к действию кислот и щелочей, обладает хорошими диэлектрическими свойствами, большой механической прочностью.
4. Он практически не горит, но сравнительно легко разлагается при нагревании, выделяя при этом хлороводород.
5. На основе поливинилхлорида получаются пластмассы двух типов: а) винипласт, обладающий значительной жесткостью; б) пластикат – более мягкий материал. Для предотвращения разложения полимера в пластмассу вводятся стабилизаторы, а при получении мягкого пластиката, кроме того, пластификаторы.
6. Из винипласта готовятся химически стойкие трубы, детали химической аппаратуры, аккумуляторные банки и многое другое. Пластикат идет на изготовление линолеума, искусственной кожи, клеенки, непромокаемых плащей, используется для изоляции проводов, в том числе подводных кабелей и т. д.
Полистирол, его особенности:
1) структурная формула полистирола: (-СН2-СН(C6H5)-)n;
2) мономер данного полимера – стирол: С6Н5-CH=СН2;
3) он представляет собой сочетание непредельного углеводорода с ароматическим: это как бы этилен, в молекуле которого один атом водорода заменен ароматическим радикалом фенилом – С6Н5, или же бензол, в молекуле которого атом водорода заменен радикалом винилом СН2=СН-;
4) полистирол имеет линейную структуру, молекулярная масса его от 50 000 до 300 000;
5) получается он радикальной полимеризацией мономера в присутствии инициатора.
Свойства полистирола.
1. Это термопластичный материал, обладающий высокими диэлектрическими свойствами.
2. Химически стойкий по отношению к щелочам и кислотам, кроме азотной.
3. Полистирол при нагревании довольно легко деполимеризуется, т. е. разлагается с образованием исходного мономера.
4. Будучи материалом весьма термопластичным, полистирол легко поддается формованию.
5. Из него готовят широкий ассортимент изделий.
1) структурная формула поливинилхлорида: (-СН2-СН(Cl)-)n;
2) это термопластичный полимер, линейные макромолекулы которого построены по типу «голова – хвост» (М от 10 000 до 150 000);
3) получается он радикальной полимеризацией хлорвинила (винилхлорида) СН2=СНCl в присутствии инициаторов, которые дают при распаде свободные радикалы для начала роста цепи.
Особенности строения поливинилхлорида.
1. По составу и строению его можно рассматривать как хлорпроизводное полиэтилена.
2. Атомы хлора, заместившие часть атомов водорода, прочно соединены с углеродными атомами.
3. Поливинилхлорид устойчив к действию кислот и щелочей, обладает хорошими диэлектрическими свойствами, большой механической прочностью.
4. Он практически не горит, но сравнительно легко разлагается при нагревании, выделяя при этом хлороводород.
5. На основе поливинилхлорида получаются пластмассы двух типов: а) винипласт, обладающий значительной жесткостью; б) пластикат – более мягкий материал. Для предотвращения разложения полимера в пластмассу вводятся стабилизаторы, а при получении мягкого пластиката, кроме того, пластификаторы.
6. Из винипласта готовятся химически стойкие трубы, детали химической аппаратуры, аккумуляторные банки и многое другое. Пластикат идет на изготовление линолеума, искусственной кожи, клеенки, непромокаемых плащей, используется для изоляции проводов, в том числе подводных кабелей и т. д.
Полистирол, его особенности:
1) структурная формула полистирола: (-СН2-СН(C6H5)-)n;
2) мономер данного полимера – стирол: С6Н5-CH=СН2;
3) он представляет собой сочетание непредельного углеводорода с ароматическим: это как бы этилен, в молекуле которого один атом водорода заменен ароматическим радикалом фенилом – С6Н5, или же бензол, в молекуле которого атом водорода заменен радикалом винилом СН2=СН-;
4) полистирол имеет линейную структуру, молекулярная масса его от 50 000 до 300 000;
5) получается он радикальной полимеризацией мономера в присутствии инициатора.
Свойства полистирола.
1. Это термопластичный материал, обладающий высокими диэлектрическими свойствами.
2. Химически стойкий по отношению к щелочам и кислотам, кроме азотной.
3. Полистирол при нагревании довольно легко деполимеризуется, т. е. разлагается с образованием исходного мономера.
4. Будучи материалом весьма термопластичным, полистирол легко поддается формованию.
5. Из него готовят широкий ассортимент изделий.
88. Синтетические волокна
Особенности синтетических волокон.
1. Изготовление волокон и тканей – вторая обширная область народно-хозяйственного применения синтетических высокомолекулярных веществ.
2. Кроме волокон, выпрядаемых непосредственно из природных материалов (льна, хлопка, шерсти), получаются также искусственные волокна.
3. Примером их является ацетатное волокно.
4. Производство искусственных волокон, основывающееся на переработке природных полимеров, не может покрыть все возрастающую потребность в волокнистых материалах.
Возникла необходимость получать волокна из синтетических высокомолекулярных соединений.
Искусственные и синтетические волокна составляют одну группу химических волокон, при производстве тех и других используются химические методы.
Волокно лавсан, его особенности.
1. Полимер, используемый для производства лавсана, синтезируют путем поликонденсаций двухатомного спирта этиленгликоля и двухосновной кислоты ароматического ряда терефталевой кислоты.
2. Вещества взаимодействуют между собой по типу реакции этерификации, которая, многократно повторяясь, ведет к образованию макромолекулы – полиэфира: а) волокно лавсан обладает большой прочностью, износостойкостью, свето– и термостойкостью; б) оно хороший диэлектрик, устойчиво к действию кислот и щелочей средней концентрации (концентрированные кислоты действуют на него разрушающе); в) используется лавсан в виде нитей и штапеля в смеси с другими волокнами; г) изделия из него широко известны:
– это ткани для изготовления различных видов одежды;
– трикотажные изделия, тюль;
– обивочные материалы и т. п.
Поскольку лавсан по химическому строению негигроскопичен, то при производстве тканей для одежды он используется преимущественно в смеси с другими волокнами: лавсан обеспечивает прочность, износостойкость изделия.
3. Ткани из лавсана (или с лавсаном) характеризуются несминаемостью, что повышает их потребительские качества.
4. Высокая прочность лавсана позволяет готовить из него изделия технического назначения – канаты, транспортные ленты, фильтровальные ткани.
5. Сравнительно высокая термостойкость позволяет использовать технические изделия из лавсана в довольно широких интервалах температур (от –70 до +170 °C).
Волокно капрон, его особенности.
1. Полимер, из которого получают это волокно, можно рассматривать как продукт поликонденсации аминокапроновой кислоты.
2. Как и в случае лавсана, полимер получается в виде смолы.
3. и технология формования волокон из расплава.
1. Изготовление волокон и тканей – вторая обширная область народно-хозяйственного применения синтетических высокомолекулярных веществ.
2. Кроме волокон, выпрядаемых непосредственно из природных материалов (льна, хлопка, шерсти), получаются также искусственные волокна.
3. Примером их является ацетатное волокно.
4. Производство искусственных волокон, основывающееся на переработке природных полимеров, не может покрыть все возрастающую потребность в волокнистых материалах.
Возникла необходимость получать волокна из синтетических высокомолекулярных соединений.
Искусственные и синтетические волокна составляют одну группу химических волокон, при производстве тех и других используются химические методы.
Волокно лавсан, его особенности.
1. Полимер, используемый для производства лавсана, синтезируют путем поликонденсаций двухатомного спирта этиленгликоля и двухосновной кислоты ароматического ряда терефталевой кислоты.
2. Вещества взаимодействуют между собой по типу реакции этерификации, которая, многократно повторяясь, ведет к образованию макромолекулы – полиэфира: а) волокно лавсан обладает большой прочностью, износостойкостью, свето– и термостойкостью; б) оно хороший диэлектрик, устойчиво к действию кислот и щелочей средней концентрации (концентрированные кислоты действуют на него разрушающе); в) используется лавсан в виде нитей и штапеля в смеси с другими волокнами; г) изделия из него широко известны:
– это ткани для изготовления различных видов одежды;
– трикотажные изделия, тюль;
– обивочные материалы и т. п.
Поскольку лавсан по химическому строению негигроскопичен, то при производстве тканей для одежды он используется преимущественно в смеси с другими волокнами: лавсан обеспечивает прочность, износостойкость изделия.
3. Ткани из лавсана (или с лавсаном) характеризуются несминаемостью, что повышает их потребительские качества.
4. Высокая прочность лавсана позволяет готовить из него изделия технического назначения – канаты, транспортные ленты, фильтровальные ткани.
5. Сравнительно высокая термостойкость позволяет использовать технические изделия из лавсана в довольно широких интервалах температур (от –70 до +170 °C).
Волокно капрон, его особенности.
1. Полимер, из которого получают это волокно, можно рассматривать как продукт поликонденсации аминокапроновой кислоты.
2. Как и в случае лавсана, полимер получается в виде смолы.
3. и технология формования волокон из расплава.
