Многочисленные исследования выявили фундаментальный вклад ГПГ в эволюцию конкретных функциональных систем прокариот. Возможно, наиболее впечатляющие результаты были получены для кластера генов фотосинтеза цианобактерий и других фотосинтезирующих бактерий (Raymond et al., 2002). Филогенетический анализ уверенно показывает, что эти кластеры представляют собой сложную мозаику генов, собранных посредством множественных актов ГПГ. Попросту говоря, кислородный фотосинтез, который сформировал нынешнюю атмосферу Земли, вероятно, появился благодаря ГПГ (Mulkidjanian et al., 2006). К тому же большинство цианофагов несут один или более ген фотосинтеза, предположительно используя их для усиления фотосинтетической активности инфицированных клеток. Таким образом, бактериофаги фактически являются переносчиками генов фотосинтеза при ГПГ (Lindell et al., 2005).
Особенно важным представляется открытие агентов переноса генов (АПГ) в нескольких группах бактерий и архей. АПГ являются дефектными производными от хвостатых бактериофагов, которые упаковывают и переносят случайные фрагменты хромосомы (не являющиеся генами профагов, кодирующими капсид и аппарат упаковки) между прокариотами (Paul, 2008). В прямых экспериментах с сообществами морских микроорганизмов было показано, что АПГ переносят гены необычайно эффективно и малоизбирательно по отношению к реципиенту (McDaniel et al., 2010). Таким образом, как это ни поразительно, АПГ вполне правомочно можно рассматривать как специализированные средства перемещения генов путем ГПГ, которые, вероятно, вносят важный вклад в потоки генов в мире прокариот. Мы вернемся к роли вирусов и АПГ в ГПГ и эволюции геномов в целом в главе 10.
Кроме непосредственной экспериментальной проверки и сравнения геномов, недавний ГПГ определяется посредством анализа состава нуклеотидов, частот олигонуклеотидных последовательностей, частоты использования тех или иных кодонов и других «лингвистических» признаков нуклеотидных последовательностей, которые обнаруживают приобретение генов в горизонтальном направлении в виде композиционных аномалий данного генома. Однако перенесенные горизонтально последовательности относительно быстро изменяются, так как приобретенные гены «одомашниваются» в процессе эволюции, так что перенесенные гены в геноме-реципиенте скоро становятся «лингвистически» неразличимы (Ragan, 2001). Важно отметить, что молекулярные механизмы ГПГ между близкородственными организмами хорошо понятны (если не сказать полностью понятны) и включают конъюгацию, перенос бактериофагами (трансдукцию) и трансформацию (Bushman, 2001).
В отличие от четко установленных недавних случаев ГПГ, особенно между компактными группами родственных организмов, обобщение явления ГПГ на большие эволюционные расстояния, особенно в отдаленном прошлом, их механизмы и влияние на эволюцию архей и бактерий остаются предметом жарких споров (Gogarten and Townsend, 2005; Kurland et al., 2003)[51]. Сравнительная геномика предоставила достаточно свидетельств вероятного ГПГ, включая перенос между очень отдаленными организмами, в частности археями и бактериями. Первым явным свидетельством массивного ГПГ между археями и бактериями было обнаружение того, что гипертермофильные бактерии (конкретно Aquifex aeolicus и Thermotoga maritima) содержат намного больше гомологов белков, характерных для архей, чем мезофильные бактерии, а также белки, имеющие гомологи как среди архей, так и среди бактерий, но с аминокислотными последовательностями, существенно больше похожими на архейные гомологи, чем на бактериальные (см. рис. 5–4)[52]. Сравнение с мезофильными бактериями показало, что доля «архейных» белков у бактерий-гипертермофилов была намного больше (причем с высокой статистической значимостью), чем у мезофилов (Aravind et al., 1998; Nelson et al., 1999). Впоследствии было продемонстрировано, что мезофильные археи с относительно большим геномом, Methanosarcina и галобактерии, обладают намного большим количеством «бактериальных» генов, чем термофильные археи с небольшими геномами (см. рис. 5–4; Deppenmeier et al., 2002). Это обстоятельство позволяет грубо оценить долю генов, которые могли быть приобретены археями и бактериями в местах их совместного обитания за счет ГПГ между ними, по крайней мере в 20 процентов.
Несмотря на эти замечательные открытия, ГПГ между эволюционно далекими прокариотами остается предметом дебатов, и все имеющиеся к настоящему времени свидетельства часто (иногда жестко) критикуются (Kurland, 2005; Kurland et al., 2003). Таксономический анализ результатов сравнения последовательностей большого числа геномов дает серьезные аргументы в пользу предполагаемого ГПГ, особенно если учесть, что для прокариот с различными стилями жизни получаются сильно разнящиеся результаты (см. рис. 5–4). И все же эти свидетельства не «доказывают» ГПГ, и в свое время были предложены иные объяснения (не всегда правдоподобные), такие как конвергенция белковых последовательностей удаленных организмов, которые живут в похожих условиях среды обитания (например, гипертермофильные археи и бактерии). Так или иначе, в течение первой декады третьего тысячелетия многочисленные филогеномные исследования – анализ филогенетических деревьев для всех (или почти всех) генов прокариот, которые являются в достаточной степени консервативными и, таким образом, содержат достаточно филогенетической информации для надежных выводов, выявили обширный перенос генов между хорошо известными группами архей и бактерий, включающий даже перенос генов между царствами (Beiko and Hamilton, 2006; Puigbo et al., 2009; Sicheritz-Ponten and Andersson, 2001). Кроме того, эти исследования продемонстрировали существование «скоростных магистралей» (highways), предпочтительных путей для потока генов (Beiko et al., 2005). Широкие магистрали связывают, в частности, различные термофильные организмы (см. также гл. 6).
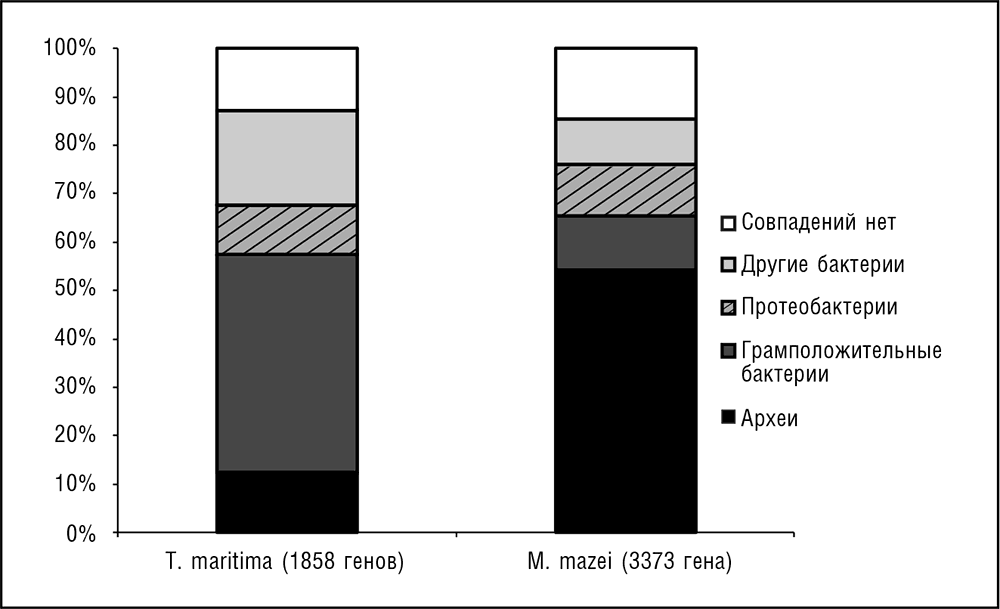 Рис 5–4. Анализ генов в геномах архей и бактерий на предмет таксономической близости наиболее близких гомологов. Показаны данные для гипертермофильной бактерии Thermotoga maritima и для мезофильной археи Methanosarcina mazei. Результаты были получены программой BLASTP путем поиска аминокислотных последовательностей всех белков в каждом геноме с использованием базы данных последовательностей белков NCBI (Altschul et al., 1997).
Рис 5–4. Анализ генов в геномах архей и бактерий на предмет таксономической близости наиболее близких гомологов. Показаны данные для гипертермофильной бактерии Thermotoga maritima и для мезофильной археи Methanosarcina mazei. Результаты были получены программой BLASTP путем поиска аминокислотных последовательностей всех белков в каждом геноме с использованием базы данных последовательностей белков NCBI (Altschul et al., 1997).
Ключевая проблема «горизонтальной геномики» – отношение между специфичной для каждого семейства потерей генов и ГПГ. Фундаментальные исследования выявили сложный и нетривиальный характер эволюции прокариот, проявляющийся в «пятнистой» филогенетической структуре, наблюдаемой для многих КОГ (см. рис. 5–5). Такую картину можно объяснить либо ГПГ, либо потерей генов, либо комбинацией этих двух явлений. Простейший (и наиболее, как принято говорить, экономный) эволюционный сценарий можно вычислить, когда известно соотношение скоростей процессов ГПГ и потери генов. Но это отношение (которое, несомненно, различно для разных групп прокариот[53], что будет обсуждаться ниже в этой главе и в гл. 6) является одним из самых больших белых пятен в прокариотической геномике. Известно несколько глобальных реконструкций эволюции прокариот, все из которых основывались на некоторой версии принципа экономии и использовании того или иного сценария с переменным соотношением скоростей приобретения/потерь или попытками оценки оптимальной величины этого соотношения (Kunin and Ouzounis, 2003; Mirkin et al., 2003). Результатом этих исследований был вывод о том, что в процессе эволюции прокариот ГПГ может быть почти так же или несколько менее (вероятно, приблизительно вдвое) распространен, как потеря генов. Соответственно, в процессе эволюции большинства КОГ, по всей видимости, произошло по меньшей мере одно событие ГПГ, даже в пределах того ограниченного множества организмов, которые были проанализированы. Конечно, эти исследования проводились на базе сильно упрощенных предположений, таких как одинаковая для всех организмов частота ГПГ и потери генов внутри групп прокариот; представления, что высокая сложность предковых форм малоправдоподобна (казалось бы, естественная, но, по-видимому, ложная идея; см. гл. 8 об эволюции сложности); и, собственно, концепции дерева видов. Хотя результаты не сильно зависят от топологии дерева видов, базовое представление о дереве с обособленными ветвями, представляющими эволюцию сравниваемых организмов, необходимо при любой реконструкции. В этом заключается фундаментальная проблема, которая достигает буквально философских высот: для того чтобы содержательно обсуждать горизонтальный перенос, сперва непременно следует определить главное, вертикальное направление эволюции. Однако, если организмы обмениваются генами с высокой скоростью, в предельном случае совершенно свободно и равномерно, концепция вертикальной эволюции не имеет никакого смысла, так же как и противоположная ей концепция ГПГ. Следовательно, представление эволюции прокариот в виде паутины (сети) кажется логической неизбежностью (см. рис. 5–6). Я должен, однако, оговориться: хотя древовидная компонента эволюции и не обязана существовать, в эволюции прокариот она на самом деле прослеживается. Она схематически изображена на рис. 5–6 и будет главной темой в главе 6.
 Рис. 5–5. Филетическая карта КОГ. Закрашенные кружки символизируют наличие члена КОГ в геноме, незакрашенные обозначают их отсутствие.
Рис. 5–5. Филетическая карта КОГ. Закрашенные кружки символизируют наличие члена КОГ в геноме, незакрашенные обозначают их отсутствие.
Здесь же мы продолжим обсуждение ГПГ с пониманием того, что древовидная структура действительно наблюдается как важная центральная тенденция эволюции прокариот (см. гл. 6). Широко распространено мнение, что «информационные» гены, кодирующие белки, вовлеченные в процессы трансляции, транскрипции и репликации, намного менее склонны к ГПГ, чем операционные гены, кодирующие ферменты, вовлеченные в метаболизм, транспортные системы и другие «операционные» белки. Обоснование этой точки зрения заключается в так называемой гипотезе сложности (Jain et al., 1999). В соответствии с этой гипотезой, причина низкого темпа ГПГ среди информационных генов заключается в том, что белки, кодируемые этими генами (в отличие от белков, кодируемых большинством операционных генов), обычно являются составными частями сложных белковых машин, которые сильно взаимно адаптированы и, таким образом, не могут быть легко заменены соответствующими ортологами из эволюционно далеких организмов (известными как ксенологи). Однако справедливость гипотезы сложности и ее применимость в общем случае остается неясной, так как и среди информационных генов обнаружено много очевидных случаев ГПГ. Весьма неожиданно, что эти случаи включают не только подавляющее большинство аминоцил-тРНК синтетаз (АРСаз), ферментов, функционирующих в относительной изоляции, но также многие рибосомные белки, являющиеся компонентами молекулярной машины трансляции, рибосомы (Makarova et al., 2001b). Явные свидетельства ГПГ были также обнаружены для таких традиционных маркеров вертикальной филогении, как субъединицы ДНК-зависимой РНК-полимеразы (Iyer et al., 2004a). Разница в режимах эволюции информационных и операционных генов, очевидно, обусловлена как значительно меньшим распространением замены генов неортологами, так и снижением частоты ГПГ как такового среди информационных генов.
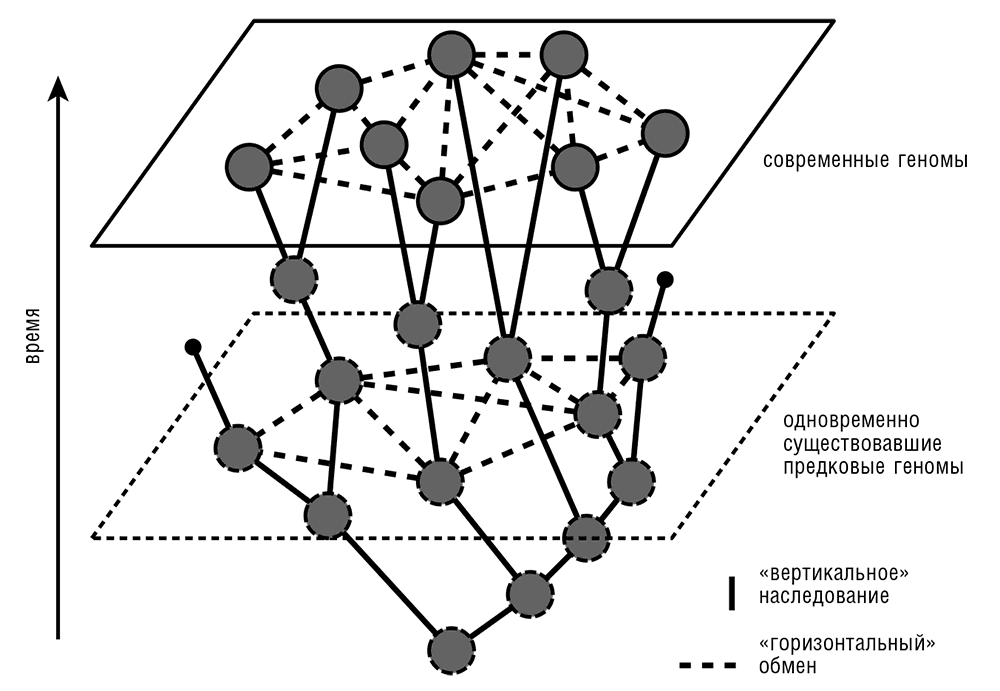 Рис. 5–6. Сетевое представление эволюции прокариот.
Рис. 5–6. Сетевое представление эволюции прокариот.
В свое время было высказано предположение, что ГПГ между близкородственными организмами (в соответствии с оценкой степени похожести их субъединиц рРНК и других консервативных генов) более широко распространен, чем ГПГ между эволюционно далекими организмами, и такой градиент ГПГ может вносить существенный вклад в наблюдаемую филогенетическую связь между различными группами прокариот (Gogarten et al., 2002). Систематическое изучение способности генов, полученных от других бактерий, комплементировать функции ортологов, показало, что с увеличением степени расхождения последовательностей ортологичных генов комплементация становится менее эффективной (Diaz et al.2011). Это наблюдение интуитивно привлекательно, так как перенесенный ген должен работать в другой клеточной среде, и, таким образом, можно ожидать, что чем меньше расхождение между набором генов донора и реципиента и структурой генов-ортологов, тем более вероятно, что перенесенный ген успешно приживется и будет зафиксирован отбором. Представляется вероятным, что различия в фиксации перенесенных генов в мире прокариот могут быть фактором, обеспечивающим целостность и стабильность геномов, вопреки интенсивному ГПГ. Мы вернемся к этому вопросу в главе 6 в контексте концепции древа жизни.
Особенно важным представляется открытие агентов переноса генов (АПГ) в нескольких группах бактерий и архей. АПГ являются дефектными производными от хвостатых бактериофагов, которые упаковывают и переносят случайные фрагменты хромосомы (не являющиеся генами профагов, кодирующими капсид и аппарат упаковки) между прокариотами (Paul, 2008). В прямых экспериментах с сообществами морских микроорганизмов было показано, что АПГ переносят гены необычайно эффективно и малоизбирательно по отношению к реципиенту (McDaniel et al., 2010). Таким образом, как это ни поразительно, АПГ вполне правомочно можно рассматривать как специализированные средства перемещения генов путем ГПГ, которые, вероятно, вносят важный вклад в потоки генов в мире прокариот. Мы вернемся к роли вирусов и АПГ в ГПГ и эволюции геномов в целом в главе 10.
Кроме непосредственной экспериментальной проверки и сравнения геномов, недавний ГПГ определяется посредством анализа состава нуклеотидов, частот олигонуклеотидных последовательностей, частоты использования тех или иных кодонов и других «лингвистических» признаков нуклеотидных последовательностей, которые обнаруживают приобретение генов в горизонтальном направлении в виде композиционных аномалий данного генома. Однако перенесенные горизонтально последовательности относительно быстро изменяются, так как приобретенные гены «одомашниваются» в процессе эволюции, так что перенесенные гены в геноме-реципиенте скоро становятся «лингвистически» неразличимы (Ragan, 2001). Важно отметить, что молекулярные механизмы ГПГ между близкородственными организмами хорошо понятны (если не сказать полностью понятны) и включают конъюгацию, перенос бактериофагами (трансдукцию) и трансформацию (Bushman, 2001).
В отличие от четко установленных недавних случаев ГПГ, особенно между компактными группами родственных организмов, обобщение явления ГПГ на большие эволюционные расстояния, особенно в отдаленном прошлом, их механизмы и влияние на эволюцию архей и бактерий остаются предметом жарких споров (Gogarten and Townsend, 2005; Kurland et al., 2003)[51]. Сравнительная геномика предоставила достаточно свидетельств вероятного ГПГ, включая перенос между очень отдаленными организмами, в частности археями и бактериями. Первым явным свидетельством массивного ГПГ между археями и бактериями было обнаружение того, что гипертермофильные бактерии (конкретно Aquifex aeolicus и Thermotoga maritima) содержат намного больше гомологов белков, характерных для архей, чем мезофильные бактерии, а также белки, имеющие гомологи как среди архей, так и среди бактерий, но с аминокислотными последовательностями, существенно больше похожими на архейные гомологи, чем на бактериальные (см. рис. 5–4)[52]. Сравнение с мезофильными бактериями показало, что доля «архейных» белков у бактерий-гипертермофилов была намного больше (причем с высокой статистической значимостью), чем у мезофилов (Aravind et al., 1998; Nelson et al., 1999). Впоследствии было продемонстрировано, что мезофильные археи с относительно большим геномом, Methanosarcina и галобактерии, обладают намного большим количеством «бактериальных» генов, чем термофильные археи с небольшими геномами (см. рис. 5–4; Deppenmeier et al., 2002). Это обстоятельство позволяет грубо оценить долю генов, которые могли быть приобретены археями и бактериями в местах их совместного обитания за счет ГПГ между ними, по крайней мере в 20 процентов.
Несмотря на эти замечательные открытия, ГПГ между эволюционно далекими прокариотами остается предметом дебатов, и все имеющиеся к настоящему времени свидетельства часто (иногда жестко) критикуются (Kurland, 2005; Kurland et al., 2003). Таксономический анализ результатов сравнения последовательностей большого числа геномов дает серьезные аргументы в пользу предполагаемого ГПГ, особенно если учесть, что для прокариот с различными стилями жизни получаются сильно разнящиеся результаты (см. рис. 5–4). И все же эти свидетельства не «доказывают» ГПГ, и в свое время были предложены иные объяснения (не всегда правдоподобные), такие как конвергенция белковых последовательностей удаленных организмов, которые живут в похожих условиях среды обитания (например, гипертермофильные археи и бактерии). Так или иначе, в течение первой декады третьего тысячелетия многочисленные филогеномные исследования – анализ филогенетических деревьев для всех (или почти всех) генов прокариот, которые являются в достаточной степени консервативными и, таким образом, содержат достаточно филогенетической информации для надежных выводов, выявили обширный перенос генов между хорошо известными группами архей и бактерий, включающий даже перенос генов между царствами (Beiko and Hamilton, 2006; Puigbo et al., 2009; Sicheritz-Ponten and Andersson, 2001). Кроме того, эти исследования продемонстрировали существование «скоростных магистралей» (highways), предпочтительных путей для потока генов (Beiko et al., 2005). Широкие магистрали связывают, в частности, различные термофильные организмы (см. также гл. 6).

Ключевая проблема «горизонтальной геномики» – отношение между специфичной для каждого семейства потерей генов и ГПГ. Фундаментальные исследования выявили сложный и нетривиальный характер эволюции прокариот, проявляющийся в «пятнистой» филогенетической структуре, наблюдаемой для многих КОГ (см. рис. 5–5). Такую картину можно объяснить либо ГПГ, либо потерей генов, либо комбинацией этих двух явлений. Простейший (и наиболее, как принято говорить, экономный) эволюционный сценарий можно вычислить, когда известно соотношение скоростей процессов ГПГ и потери генов. Но это отношение (которое, несомненно, различно для разных групп прокариот[53], что будет обсуждаться ниже в этой главе и в гл. 6) является одним из самых больших белых пятен в прокариотической геномике. Известно несколько глобальных реконструкций эволюции прокариот, все из которых основывались на некоторой версии принципа экономии и использовании того или иного сценария с переменным соотношением скоростей приобретения/потерь или попытками оценки оптимальной величины этого соотношения (Kunin and Ouzounis, 2003; Mirkin et al., 2003). Результатом этих исследований был вывод о том, что в процессе эволюции прокариот ГПГ может быть почти так же или несколько менее (вероятно, приблизительно вдвое) распространен, как потеря генов. Соответственно, в процессе эволюции большинства КОГ, по всей видимости, произошло по меньшей мере одно событие ГПГ, даже в пределах того ограниченного множества организмов, которые были проанализированы. Конечно, эти исследования проводились на базе сильно упрощенных предположений, таких как одинаковая для всех организмов частота ГПГ и потери генов внутри групп прокариот; представления, что высокая сложность предковых форм малоправдоподобна (казалось бы, естественная, но, по-видимому, ложная идея; см. гл. 8 об эволюции сложности); и, собственно, концепции дерева видов. Хотя результаты не сильно зависят от топологии дерева видов, базовое представление о дереве с обособленными ветвями, представляющими эволюцию сравниваемых организмов, необходимо при любой реконструкции. В этом заключается фундаментальная проблема, которая достигает буквально философских высот: для того чтобы содержательно обсуждать горизонтальный перенос, сперва непременно следует определить главное, вертикальное направление эволюции. Однако, если организмы обмениваются генами с высокой скоростью, в предельном случае совершенно свободно и равномерно, концепция вертикальной эволюции не имеет никакого смысла, так же как и противоположная ей концепция ГПГ. Следовательно, представление эволюции прокариот в виде паутины (сети) кажется логической неизбежностью (см. рис. 5–6). Я должен, однако, оговориться: хотя древовидная компонента эволюции и не обязана существовать, в эволюции прокариот она на самом деле прослеживается. Она схематически изображена на рис. 5–6 и будет главной темой в главе 6.

Здесь же мы продолжим обсуждение ГПГ с пониманием того, что древовидная структура действительно наблюдается как важная центральная тенденция эволюции прокариот (см. гл. 6). Широко распространено мнение, что «информационные» гены, кодирующие белки, вовлеченные в процессы трансляции, транскрипции и репликации, намного менее склонны к ГПГ, чем операционные гены, кодирующие ферменты, вовлеченные в метаболизм, транспортные системы и другие «операционные» белки. Обоснование этой точки зрения заключается в так называемой гипотезе сложности (Jain et al., 1999). В соответствии с этой гипотезой, причина низкого темпа ГПГ среди информационных генов заключается в том, что белки, кодируемые этими генами (в отличие от белков, кодируемых большинством операционных генов), обычно являются составными частями сложных белковых машин, которые сильно взаимно адаптированы и, таким образом, не могут быть легко заменены соответствующими ортологами из эволюционно далеких организмов (известными как ксенологи). Однако справедливость гипотезы сложности и ее применимость в общем случае остается неясной, так как и среди информационных генов обнаружено много очевидных случаев ГПГ. Весьма неожиданно, что эти случаи включают не только подавляющее большинство аминоцил-тРНК синтетаз (АРСаз), ферментов, функционирующих в относительной изоляции, но также многие рибосомные белки, являющиеся компонентами молекулярной машины трансляции, рибосомы (Makarova et al., 2001b). Явные свидетельства ГПГ были также обнаружены для таких традиционных маркеров вертикальной филогении, как субъединицы ДНК-зависимой РНК-полимеразы (Iyer et al., 2004a). Разница в режимах эволюции информационных и операционных генов, очевидно, обусловлена как значительно меньшим распространением замены генов неортологами, так и снижением частоты ГПГ как такового среди информационных генов.

В свое время было высказано предположение, что ГПГ между близкородственными организмами (в соответствии с оценкой степени похожести их субъединиц рРНК и других консервативных генов) более широко распространен, чем ГПГ между эволюционно далекими организмами, и такой градиент ГПГ может вносить существенный вклад в наблюдаемую филогенетическую связь между различными группами прокариот (Gogarten et al., 2002). Систематическое изучение способности генов, полученных от других бактерий, комплементировать функции ортологов, показало, что с увеличением степени расхождения последовательностей ортологичных генов комплементация становится менее эффективной (Diaz et al.2011). Это наблюдение интуитивно привлекательно, так как перенесенный ген должен работать в другой клеточной среде, и, таким образом, можно ожидать, что чем меньше расхождение между набором генов донора и реципиента и структурой генов-ортологов, тем более вероятно, что перенесенный ген успешно приживется и будет зафиксирован отбором. Представляется вероятным, что различия в фиксации перенесенных генов в мире прокариот могут быть фактором, обеспечивающим целостность и стабильность геномов, вопреки интенсивному ГПГ. Мы вернемся к этому вопросу в главе 6 в контексте концепции древа жизни.
Конец бесплатного ознакомительного фрагмента
