В работе, выполненной совместно с Александром Лобковским и Юрием Вульфом, мы задались вопросом, не удастся ли в данном случае убить двух зайцев, то есть возможно ли объяснить эволюцию белок-кодирующих генов и практически повсеместную отрицательную корреляцию между эволюционными скоростями и уровнем экспрессии в рамках одной простой модели (Lobkovsky et al., 2010). В анализе эволюции, ведомой ошибками укладки, проводимом для «безрешеточной»[38] модели укладки белка, были получены оценки эволюционных скоростей для гипотетического случая, в котором ошибки укладки белка являются единственным фактором, влияющим на приспособленность организма. Результаты анализа воспроизвели, и весьма точно, универсальное распределение эволюционных скоростей белков, а также зависимость между скоростью эволюции и экспрессией. Этот результат позволяет предположить, что универсальный закон распределения скоростей эволюции и в самом деле вытекает из фундаментальных физических принципов укладки белка.
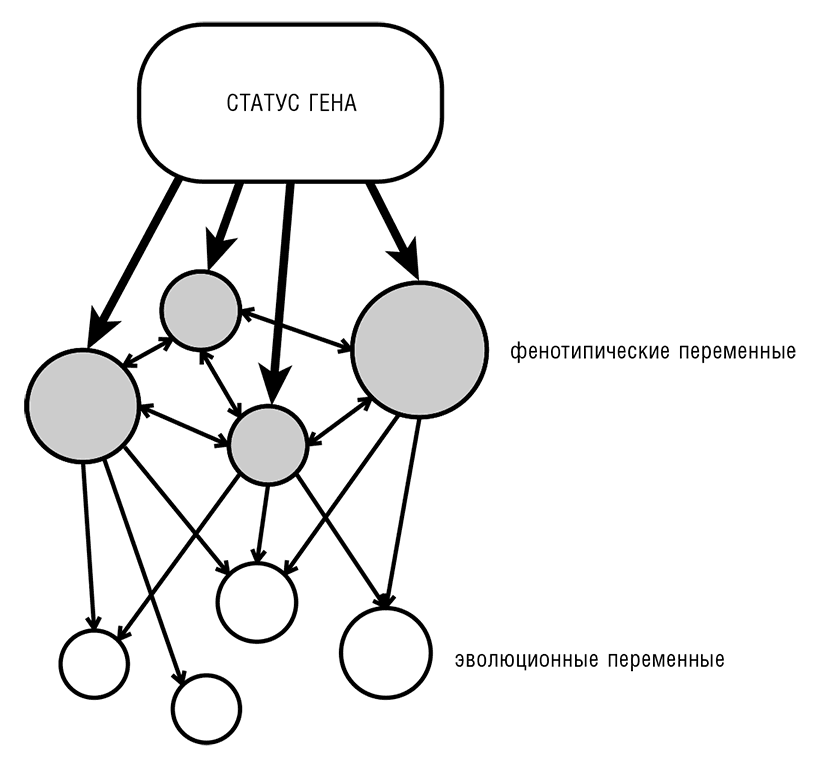
Слабость или даже отсутствие некоторых интуитивно ожидаемых корреляций между эволюционными и фенотипическими переменными кажутся не менее поразительными, чем обнаруженные корреляции. В самом деле, биологическая интуиция всей этой области знаний подсказывает, как было указано в начале этого раздела, что гены с большей «биологической значимостью» будут эволюционировать медленнее и будут теряться с меньшей вероятностью (Wilson et al., 1977). Общее понятие биологической важности можно конкретизировать измерением фенотипических эффектов от нокаута или других мутаций многих генов – желательно всех генов многих организмов. Можно предположить, что чем больше эффект от нокаута гена, тем медленнее этот ген будет эволюционировать, и гены, утрата которых вызывает летальный эффект, будут эволюционировать значительно медленнее генов, менее существенных для выживания. К настоящему времени проведено сравнение фенотипических эффектов нокаута генов и скоростей эволюционирования генов для множества модельных организмов и получен недвусмысленный и как будто парадоксальный результат: связь между экспериментально измеренной биологической важностью гена и скоростью его эволюции очень слаба, если вообще существует (Hurst and Smith, 1999; Jordan et al., 2002; Krylov et al., 2003; Wang and Zhang, 2009). Еще более удивительным кажется отсутствие сильной корреляции между скоростью утраты гена в течение эволюции, представляющей в некотором смысле временную меру биологической важности или существенности гена, и экспериментально определенным эффектом на приспособленность: только те наборы генов, которые вообще не утрачиваются на продолжительных отрезках эволюции, таких как вся эволюция эукариот, обогащены «важными» генами (Krylov et al., 2003; Wang and Zhang, 2009). Первые работы, показавшие почти полное отсутствие связи между скоростью эволюции и биологической значимостью, были основаны на простом измерении эффекта (присутствует/отсутствует) нокаута гена (соответственно, существенный/несущественный ген). Можно предполагать, что такие измерения слишком грубы и не дают осмысленной оценки биологической важности. Однако, например, в последних работах лаборатории Джорджа Занга было продемонстрировано почти полное отсутствие корреляции между скоростью эволюции и весьма точно измеренным влиянием на приспособленность пекарских дрожжей (S. cerevisiae) во множестве различных условий (Wang and Zhang, 2009), что уменьшает вероятность получения неадекватных результатов.
Чем же тогда объяснить неожиданно слабую связь между эволюцией и функцией гена? По отношению к эволюции последовательностей можно предположить, что скорость эволюции более зависит от внутренних характеристик гена (в особенности от структуры кодируемого белка), чем от его биологической значимости. Однако это объяснение неприменимо к случаям утраты гена. Наиболее осмысленным – хотя опять-таки противоречащим здравому смыслу – кажется следующее объяснение: фенотипический эффект нокаута гена (и в целом – набора необходимых генов) не проявляется как консервативное свойство в эволюционном процессе и быстро меняется (в масштабах эволюционной шкалы), вероятно благодаря высокой скорости эволюции сетей взаимодействующих генов[39]. Ясно, что это предположение можно проверить опытным путем, пусть и с помощью трудоемких экспериментов.
Почти нейтральные сети и белковая эволюция
В целом скорость эволюции гена определяется размером его почти нейтральной сети, то есть множества последовательностей, получаемых друг из друга в результате одношаговых мутаций (пусть и необязательно с помощью одной замены) и имеющих приспособленность примерно такую же, как и у наиболее приспособленной последовательности (Wagner, 2008a; Wolf et al., 2010). Чем больше нейтральная сеть, тем слабее ограничения для конкретного гена, тем быстрее он может эволюционировать (рис. 4–5).
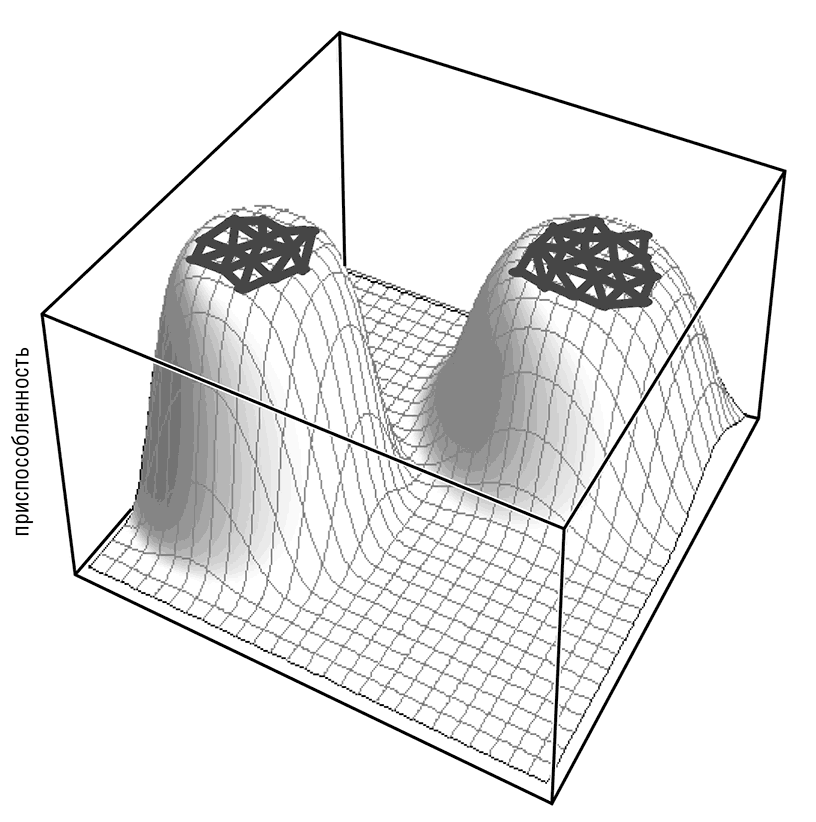 Рис. 4–5. Почти нейтральная сеть и белковая эволюция. Две почти нейтральные сети для двух вымышленных белков схематично представлены как две области, находящиеся на широких вершинах пиков приспособленности.
Рис. 4–5. Почти нейтральная сеть и белковая эволюция. Две почти нейтральные сети для двух вымышленных белков схематично представлены как две области, находящиеся на широких вершинах пиков приспособленности.
В эволюции белка приспособленность отдельной последовательности в основном зависит от ее устойчивости к ошибкам укладки и от уровня экспрессии, а размер почти нейтральной сети зависит от высоты и формы пика, занимаемого этой последовательностью и ее соседями на ландшафте устойчивости (рис. 4–6). В этой модели высокоэкспрессированные белки, чьи исходные последовательности высоко устойчивы к ошибкам укладки, занимают высокие и крутые пики с небольшой областью высокой приспособленности (малые почти нейтральные сети) и, следовательно, подвержены сильному стабилизирующему отбору и медленно эволюционируют. И наоборот, белки с более низким уровнем экспрессии и меньшей устойчивостью находятся на более низких, пологих пиках, имеют более широкую область высокой приспособленности и, соответственно, подвержены более слабому отбору и имеют высокую скорость эволюции (рис. 4–6; Wolf et al., 2010).
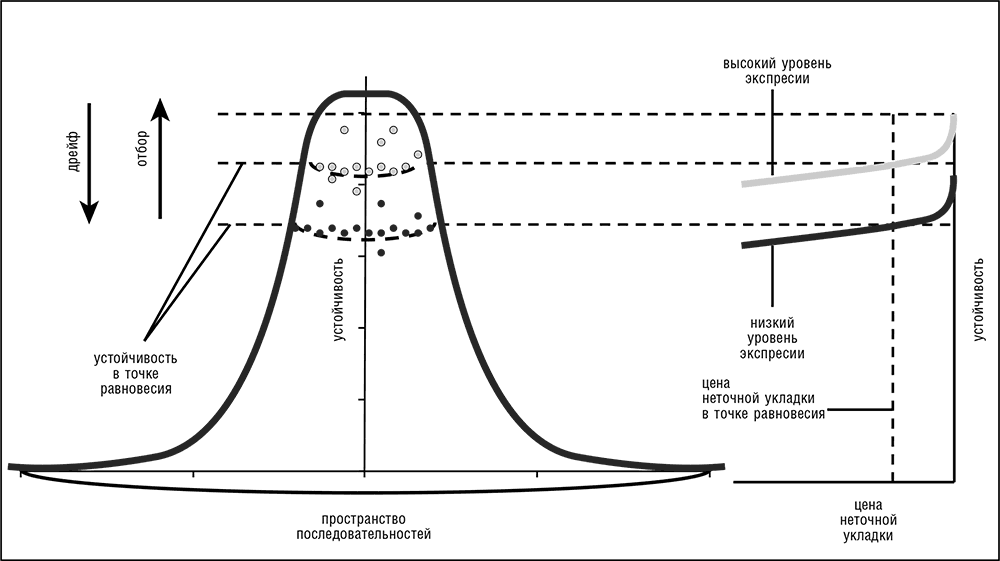 Рис. 4–6. Модель эволюции белка, управляемой издержками неточной укладки.
Рис. 4–6. Модель эволюции белка, управляемой издержками неточной укладки.

В эволюции белка приспособленность отдельной последовательности в основном зависит от ее устойчивости к ошибкам укладки и от уровня экспрессии, а размер почти нейтральной сети зависит от высоты и формы пика, занимаемого этой последовательностью и ее соседями на ландшафте устойчивости (рис. 4–6). В этой модели высокоэкспрессированные белки, чьи исходные последовательности высоко устойчивы к ошибкам укладки, занимают высокие и крутые пики с небольшой областью высокой приспособленности (малые почти нейтральные сети) и, следовательно, подвержены сильному стабилизирующему отбору и медленно эволюционируют. И наоборот, белки с более низким уровнем экспрессии и меньшей устойчивостью находятся на более низких, пологих пиках, имеют более широкую область высокой приспособленности и, соответственно, подвержены более слабому отбору и имеют высокую скорость эволюции (рис. 4–6; Wolf et al., 2010).

Геномная эволюция путем дупликации генов, модель рождения и смерти гена и универсальное распределение численности паралогичных семейств
Мы уже касались вопроса дупликации генов в предыдущей главе, в частности при построении списка важнейших механизмов геномной эволюции. Однако есть еще по крайней мере два хороших повода вернуться к этому механизму эволюции и обсудить его более детально. Во-первых, дупликация несомненно является одним из главных путей геномной эволюции для всех форм жизни и играет принципиальную роль в эволюции эукариот (см. гл. 8). Во-вторых, эволюция путем дупликации генов представляет собой формально простой процесс, для которого довольно легко построить хорошо работающие физические (или математические) модели, которые и рассматриваются в этой главе.
Представление о дупликации как об исключительно эффективном способе геномной эволюции лежит в основе современного эволюционного мышления. Упрощенно говоря, сущность этого представления состоит в том, что создание новых функциональных объектов (белков и РНК) путем модификации уже имеющихся (вспомните модель «эволюции как мастерового» Жакоба; Jacob, 1977) – это, очевидно, намного более простой путь, чем создание этих объектов с самого начала, с нуля (история этой идеи рассказывается в гл. 2). Как и другие представления геномики, эволюция путем генной дупликации имеет строгие количественные подтверждения – большинство генов в геноме принадлежат семействам паралогов (за исключением очень небольших геномов, таких как у микоплазмы и других паразитических бактерий; Jordan et al., 2001). Более детальная реконструкция эволюции показывает, что дупликация проявляется, с различной интенсивностью, на всех этапах эволюции, таким образом, любой геном – это набор дупликаций самого различного возраста. Выбирая некоторую эволюционную линию, допустим, животные – хордовые – млекопитающие – приматы – и т. д., мы можем обнаружить в геноме (например, в нашем) все соответствующие классы дупликаций: дупликации, специфичные для животных, дупликации, специфичные для хордовых, специфичные для приматов и т. д. (Lespinet et al., 2002).
Распределение численности паралогичных семейств в любом геноме – еще одна универсальная статистическая закономерность, обнаруженная сравнительной геномикой (рис. 4–7). Распределения для всех геномов приблизительно описываются степенной функцией с отрицательным показателем степени: y = ах-y (где у – положительное число, а – коэффициент; Koonin et al., 2002; Luscombe et al., 2002). Эти распределения, имеющие в двойных логарифмических координатах вид прямых линий, показывают, что большинство семейств по численности малы (включая семейства геномов с преобладанием синглетонных сайтов), и только немногие семейства включают в себя большое число паралогов.
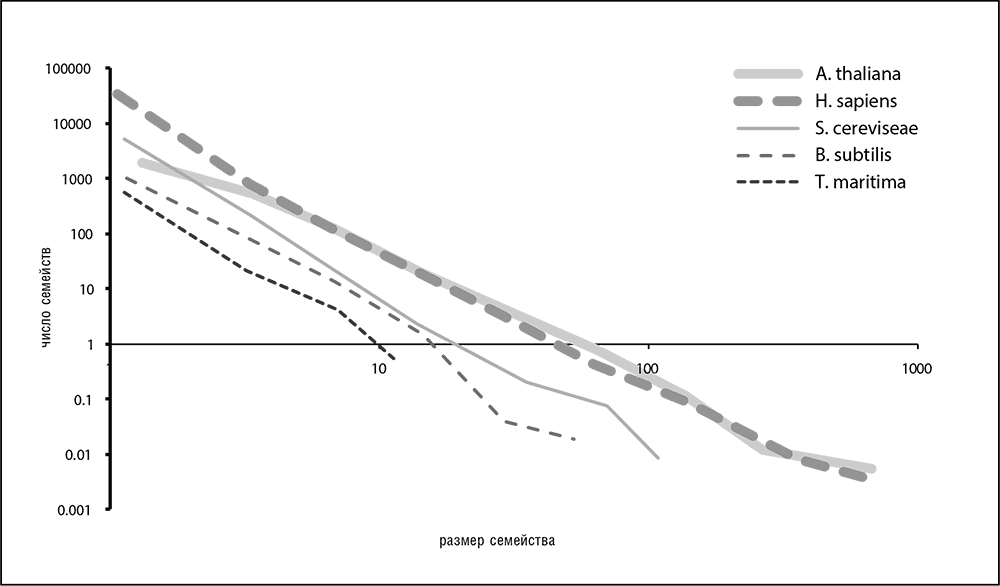 Рис. 4–7. Распределение размера семейств паралогичных генов для нескольких сильно отличающихся геномов. Показаны распределения для растения резуховидки Таля (A. thaliana), человека (H. sapiens), для пекарских дрожжей (S. cereviseae), для сенной палочки (B. subtilis) и для бактерии Thermotoga maritima. Использованы данные из базы данных EggNog (Jensen et al., 2008)
Рис. 4–7. Распределение размера семейств паралогичных генов для нескольких сильно отличающихся геномов. Показаны распределения для растения резуховидки Таля (A. thaliana), человека (H. sapiens), для пекарских дрожжей (S. cereviseae), для сенной палочки (B. subtilis) и для бактерии Thermotoga maritima. Использованы данные из базы данных EggNog (Jensen et al., 2008)
Возникновение универсальной степенной закономерности распределения численности паралогичных семейств может быть описано с высокой точностью простой математической моделью эволюционного процесса (рис. 4–8). Эта модель основана на математической теории так называемых процессов рождения и смерти (один из видов марковских процессов) и для случая эволюции путем генной дупликации чаще называется моделью рождения, смерти и инновации (Karev et al., 2002). В рамках этой модели рождение – это такая генная дупликация, при которой появляется новый член паралогичного семейства, смерть – утрата гена, а инновация – это рождение нового семейства либо путем такой дупликации, которая вызывает быструю эволюции и тем самым как бы стирает «память» старого семейства, либо путем горизонтального переноса генов[40]. Наиболее интересный результат этого моделирования состоит в том, что эта модель эволюции путем генной дупликации воспроизводит рассмотренные нами распределения численности семейств паралогичных генов только при соблюдении вполне определенных условий: частоты рождения и смерти гена должны быть примерно равными и зависеть от численности семейства таким образом, чтобы большие семейства оказывались более динамичными, чем маленькие.
Стоит подчеркнуть, что динамика эволюции генного семейства описывается именно той стохастической моделью, которая используется в статистической физике. Однако, чтобы эта модель была совместима с полученными данными, необходимо соблюдение тонкого баланса между рождением, смертью и обновлением, и похоже, что этот баланс поддерживается естественным отбором. Примечательно, что эта и подобные модели описывают с одинаковой точностью эволюцию геномов как прокариот, так и эукариот, несмотря на существенные различия между процессами, ведущими к образованию семейств паралогичных генов. Для эукариот важнейшим, если не единственным, процессом, лежащим в основе эволюции семейств, является «честная» генная дупликация, a для прокариот количественно более важным является горизонтальный перенос генов (поэтому такие генные семейства «псевдопаралогичны»; см. гл. 5 и 7). Тот факт, что рассмотренные здесь модели одинаково хорошо описывают биологически отличающиеся процессы эволюции генома, ведущие к сходным результатам, с одной стороны, подчеркивает универсальность этих моделей, а с другой – указывает на их ограниченную ценность для биолога.
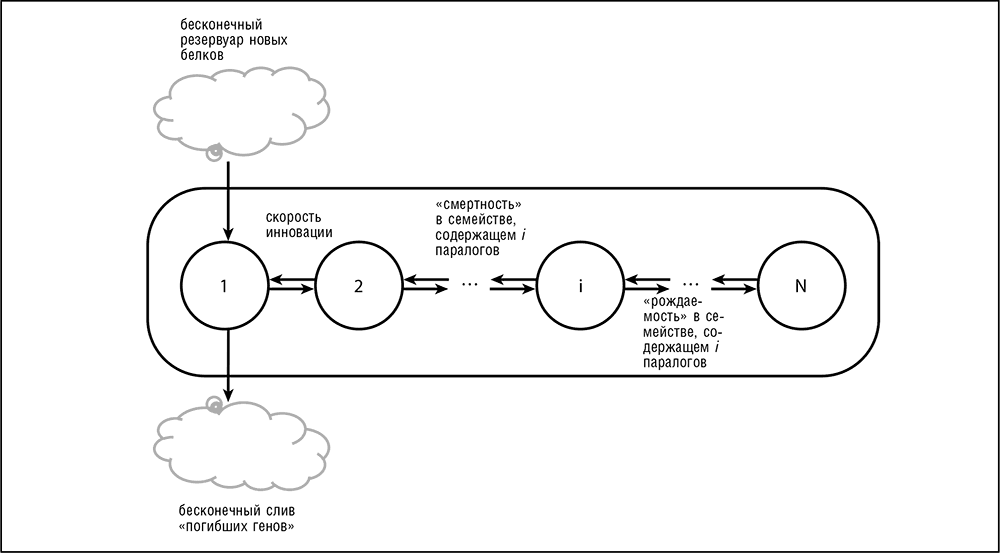 Рис. 4–8. Модель рождения, смерти и инновации в применении к эволюции генных семейств. Под рождением подразумевается генная дупликация или приобретение псевдопаралогичного гена путем горизонтального переноса с последующим расширением паралогичного семейства, смертью называется утрата гена (независимо от способа утраты), а инновацией считается приобретение нового гена, который становится родоначальником нового семейства (Karev et al., 2002)
Рис. 4–8. Модель рождения, смерти и инновации в применении к эволюции генных семейств. Под рождением подразумевается генная дупликация или приобретение псевдопаралогичного гена путем горизонтального переноса с последующим расширением паралогичного семейства, смертью называется утрата гена (независимо от способа утраты), а инновацией считается приобретение нового гена, который становится родоначальником нового семейства (Karev et al., 2002)
Представление о дупликации как об исключительно эффективном способе геномной эволюции лежит в основе современного эволюционного мышления. Упрощенно говоря, сущность этого представления состоит в том, что создание новых функциональных объектов (белков и РНК) путем модификации уже имеющихся (вспомните модель «эволюции как мастерового» Жакоба; Jacob, 1977) – это, очевидно, намного более простой путь, чем создание этих объектов с самого начала, с нуля (история этой идеи рассказывается в гл. 2). Как и другие представления геномики, эволюция путем генной дупликации имеет строгие количественные подтверждения – большинство генов в геноме принадлежат семействам паралогов (за исключением очень небольших геномов, таких как у микоплазмы и других паразитических бактерий; Jordan et al., 2001). Более детальная реконструкция эволюции показывает, что дупликация проявляется, с различной интенсивностью, на всех этапах эволюции, таким образом, любой геном – это набор дупликаций самого различного возраста. Выбирая некоторую эволюционную линию, допустим, животные – хордовые – млекопитающие – приматы – и т. д., мы можем обнаружить в геноме (например, в нашем) все соответствующие классы дупликаций: дупликации, специфичные для животных, дупликации, специфичные для хордовых, специфичные для приматов и т. д. (Lespinet et al., 2002).
Распределение численности паралогичных семейств в любом геноме – еще одна универсальная статистическая закономерность, обнаруженная сравнительной геномикой (рис. 4–7). Распределения для всех геномов приблизительно описываются степенной функцией с отрицательным показателем степени: y = ах-y (где у – положительное число, а – коэффициент; Koonin et al., 2002; Luscombe et al., 2002). Эти распределения, имеющие в двойных логарифмических координатах вид прямых линий, показывают, что большинство семейств по численности малы (включая семейства геномов с преобладанием синглетонных сайтов), и только немногие семейства включают в себя большое число паралогов.

Возникновение универсальной степенной закономерности распределения численности паралогичных семейств может быть описано с высокой точностью простой математической моделью эволюционного процесса (рис. 4–8). Эта модель основана на математической теории так называемых процессов рождения и смерти (один из видов марковских процессов) и для случая эволюции путем генной дупликации чаще называется моделью рождения, смерти и инновации (Karev et al., 2002). В рамках этой модели рождение – это такая генная дупликация, при которой появляется новый член паралогичного семейства, смерть – утрата гена, а инновация – это рождение нового семейства либо путем такой дупликации, которая вызывает быструю эволюции и тем самым как бы стирает «память» старого семейства, либо путем горизонтального переноса генов[40]. Наиболее интересный результат этого моделирования состоит в том, что эта модель эволюции путем генной дупликации воспроизводит рассмотренные нами распределения численности семейств паралогичных генов только при соблюдении вполне определенных условий: частоты рождения и смерти гена должны быть примерно равными и зависеть от численности семейства таким образом, чтобы большие семейства оказывались более динамичными, чем маленькие.
Стоит подчеркнуть, что динамика эволюции генного семейства описывается именно той стохастической моделью, которая используется в статистической физике. Однако, чтобы эта модель была совместима с полученными данными, необходимо соблюдение тонкого баланса между рождением, смертью и обновлением, и похоже, что этот баланс поддерживается естественным отбором. Примечательно, что эта и подобные модели описывают с одинаковой точностью эволюцию геномов как прокариот, так и эукариот, несмотря на существенные различия между процессами, ведущими к образованию семейств паралогичных генов. Для эукариот важнейшим, если не единственным, процессом, лежащим в основе эволюции семейств, является «честная» генная дупликация, a для прокариот количественно более важным является горизонтальный перенос генов (поэтому такие генные семейства «псевдопаралогичны»; см. гл. 5 и 7). Тот факт, что рассмотренные здесь модели одинаково хорошо описывают биологически отличающиеся процессы эволюции генома, ведущие к сходным результатам, с одной стороны, подчеркивает универсальность этих моделей, а с другой – указывает на их ограниченную ценность для биолога.

Структура и эволюция сетей: всеобщность степенного закона и стоящие за ним фундаментальные процессы
Сеть (network) – популярнейшее понятие системной биологии, повсеместно пронизывающее современную культуру, не только в рамках биологии или науки в целом[41]. В самом деле, трудно придумать более естественный способ представления связей между многочисленными объектами, чем сеть (в математике рассматриваемую как ориентированный или неориентированный граф). В биологическом контексте узлами (или иначе – вершинами) сети часто представляют гены или белки, а ребрами (связями между узлами) обозначают их взаимодействия, которые могут быть физическими, генетическими или регуляторными (Barabasi and Oltvai, 2004). К настоящему времени разработано множество методов описания и сравнения структур (топологий) сетей (табл. 4–1). Наиболее часто для анализа используется понятие функции распределения степеней вершин, где под степенью вершины понимают число ребер, связывающих эту вершину с другими. Сравнение таких функций, выполненное для сетей различного типа, показало принципиальное отличие биологических сетей (а также многих небиологических, включая Интернет) от случайных графов: случайные графы имеют колоколообразное распределение Пуассона, а для биологических сетей распределения описываются степенной функцией (табл. 4–1). Сети, имеющие степенные функции распределения степеней вершин, называют масштабно-инвариантными сетями, так как графики их функций внешне не меняются при масштабировании (обратите внимание на прямую линию в двойных логарифмических координатах на табл. 4–1). Такие сети всегда содержат небольшое число вершин с высокими степенями, так называемых хабов (hubs), и большое число слабосвязанных вершин.
Таблица 4–1. Случайные и масштабно-инвариантные сети.
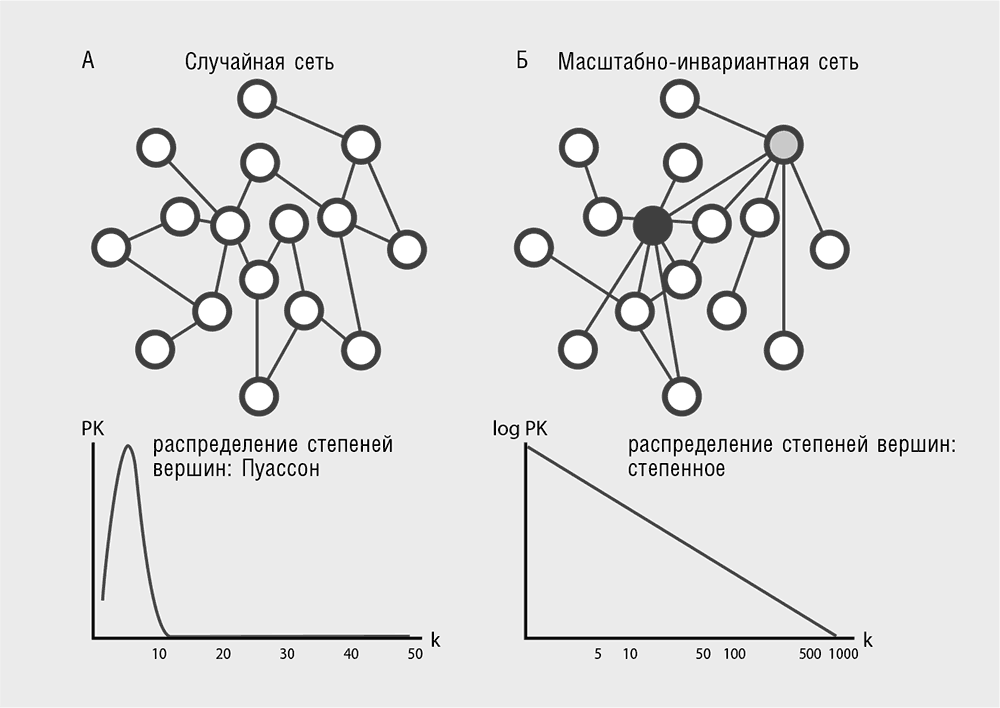
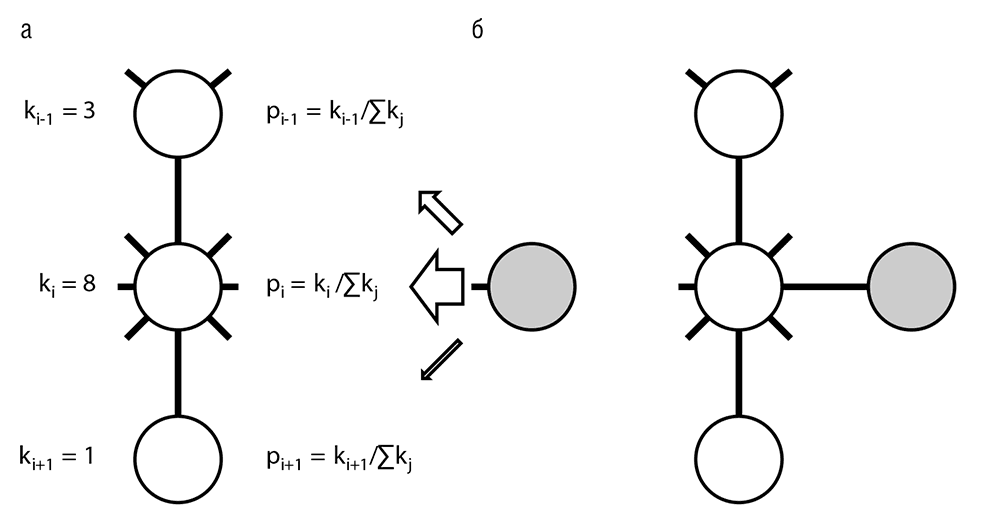 Рис. 4–9. Предпочтительное присоединение в эволюции биологических сетей: а – фрагмент сети и новый добавляемый элемент; б – результат включения новой вершины в сеть. Ki = степень i-й вершины, pi = вероятность присоединения новой вершины к вершине i (см. табл. 4–1)
Рис. 4–9. Предпочтительное присоединение в эволюции биологических сетей: а – фрагмент сети и новый добавляемый элемент; б – результат включения новой вершины в сеть. Ki = степень i-й вершины, pi = вероятность присоединения новой вершины к вершине i (см. табл. 4–1)
Примечательно, что степенная функция распределения степеней вершин, по всей видимости, является неотъемлемым свойством эволюционирующих сетей (включая Интернет) и не обязательно имеет биологическое происхождение. Все типы биологических сетей, как описывающих физические взаимодействия между белками, так и отражающих взаимную регуляцию генов, несомненно, появились в результате эволюции и обладают указанным типом распределения (другими словами, являются масштабно-инвариантными). Для объяснения универсального степенного закона распределения Барабаши с коллегами предложили принцип предпочтительного присоединения (preferential attachment) новых вершин, что на простом циничном языке означает, что в процессе эволюции сети «богатые делаются еще богаче» (Barabasi, 2002). Предпочтительное присоединение представляет собой стохастический, неадаптивный процесс. В самом деле, когда создается новый сайт в Интернете и случайно связывается с другими сайтами, с большей вероятностью он окажется связанным с хабом, чем с изолированным сайтом, просто потому что очень многие различные пути в сети ведут к хабам (табл. 4–1). Этот режим эволюции по своей природе консервативен – сеть сохраняет свою структуру в процессе роста. Является ли предпочтительное присоединение главным принципом эволюции биологических сетей? По этому вопросу еще не достигнуто согласия. В случае если этот принцип существен для биологических сетей, должны обнаружиться некоторые специфические биологические механизмы, обеспечивающие его выполнение (рис. 4–9). Высокая интерактивность хабов, представленная «липкостью» некоторых белков, склонных к взаимодействиям, не обязательно функционально значимым, со многими другими белками, могла бы быть одним из таких механизмов. Еще более важный вклад в формирование сетей осуществляется посредством важнейшего механизма эволюции – генной дупликации. Когда ген удваивается, все имеющиеся его связи с другими генами также удваиваются, а потом начинают постепенно расходиться в процессе последующей эволюции. В простейшей модели эволюции (такой как сбалансированная модель рождения, смерти и обновления), если частота генной дупликации пропорциональна размеру семейства, структура сети (то есть распределение степеней вершин) будет сохраняться даже при отсутствии давления отбора (Koonin et al., 2002; Lynch, 2007a).
Таблица 4–1. Случайные и масштабно-инвариантные сети.


Примечательно, что степенная функция распределения степеней вершин, по всей видимости, является неотъемлемым свойством эволюционирующих сетей (включая Интернет) и не обязательно имеет биологическое происхождение. Все типы биологических сетей, как описывающих физические взаимодействия между белками, так и отражающих взаимную регуляцию генов, несомненно, появились в результате эволюции и обладают указанным типом распределения (другими словами, являются масштабно-инвариантными). Для объяснения универсального степенного закона распределения Барабаши с коллегами предложили принцип предпочтительного присоединения (preferential attachment) новых вершин, что на простом циничном языке означает, что в процессе эволюции сети «богатые делаются еще богаче» (Barabasi, 2002). Предпочтительное присоединение представляет собой стохастический, неадаптивный процесс. В самом деле, когда создается новый сайт в Интернете и случайно связывается с другими сайтами, с большей вероятностью он окажется связанным с хабом, чем с изолированным сайтом, просто потому что очень многие различные пути в сети ведут к хабам (табл. 4–1). Этот режим эволюции по своей природе консервативен – сеть сохраняет свою структуру в процессе роста. Является ли предпочтительное присоединение главным принципом эволюции биологических сетей? По этому вопросу еще не достигнуто согласия. В случае если этот принцип существен для биологических сетей, должны обнаружиться некоторые специфические биологические механизмы, обеспечивающие его выполнение (рис. 4–9). Высокая интерактивность хабов, представленная «липкостью» некоторых белков, склонных к взаимодействиям, не обязательно функционально значимым, со многими другими белками, могла бы быть одним из таких механизмов. Еще более важный вклад в формирование сетей осуществляется посредством важнейшего механизма эволюции – генной дупликации. Когда ген удваивается, все имеющиеся его связи с другими генами также удваиваются, а потом начинают постепенно расходиться в процессе последующей эволюции. В простейшей модели эволюции (такой как сбалансированная модель рождения, смерти и обновления), если частота генной дупликации пропорциональна размеру семейства, структура сети (то есть распределение степеней вершин) будет сохраняться даже при отсутствии давления отбора (Koonin et al., 2002; Lynch, 2007a).
Разбиение генома по биологическим функциям: универсальный степенной закон
До сих пор в нашем обсуждении универсальных количественных закономерностей в геномной эволюции мы преднамеренно обходили стороной вопрос биологических функций. Конечно, это абстракция: геном ни в коем случае не сумма безликих «молекул», а ансамбль генов, каждый из которых кодирует определенную биологическую функцию[42]. Сначала может показаться неожиданным, что способ рассуждения, позаимствованный из статистической физики, может быть применен и к биологическим функциям. Для применения такого подхода необходимо разделить гены на большие функциональные классы, о которых можно думать как о разных типах «молекул» и которые пригодны для статистического анализа, если они включают достаточно много генов.
Как показывается в серии доскональных исследований Эрика Ван Нимвегена[43], различные функциональные классы генов по-разному соотносятся с общим числом генов в геноме (Molina and van Nimwegen, 2009; van Nimwegen, 2003). Не учитывая некоторые отклонения, для прокариот можно указать три основных показателя степени, описывающие эти соотношения: 0, 1 и 2. Генам белков, участвующих в информационных процессах (трансляции, транскрипции и репликации), соответствует показатель степени 0 – число таких генов достигает некоторого константного значения уже в минимальных геномах и в принципе не зависит от сложности генома. Число метаболических ферментов и транспортных белков примерно прямо пропорционально общему числу генов (показатель степени 1). Регуляторные гены и компоненты систем передачи сигналов показывают квадратичную зависимость (показатель степени равен 2; рис. 4-10). Показатели степени этих трех обширных классов остаются неизменными, с очень небольшими отклонениями, для всех групп прокариот, и это позволяет предположить, что разница в эволюционной динамике генов с различными функциями отражает какие-то фундаментальные законы эволюции клеточных организмов, или, другими словами, строгие и четко выраженные ограничения в функциональном устройстве геномов. Для генов эукариот обнаружены похожие, хотя и не такие явные, степенные соотношения, показатель степени для регуляторных генов эукариот значительно больше 1 (хотя и меньше 2). Имея в виду все вышесказанное, можно заключить, что эти соотношения представляют еще один набор универсалий геномной эволюции, которые становятся еще интереснее при рассмотрении их связи с функциональным устройством клетки.
Фундаментальные причины существования различных соотношений для различных функциональных классов генов еще не выяснены. Привлекательно простая модель эволюции метаболических сетей прокариот как «ящика с инструментами», предложенная Сергеем Масловым и коллегами, может быть первым шагом на пути объяснения квадратичной зависимости, характерной для регуляторных генов (Maslov et al., 2009). В этой модели ферменты, необходимые для утилизации новых метаболитов, добавляются вместе с соответствующими им регуляторами (в первую очередь посредством горизонтального переноса генов, гл. 5) во все более развитую сеть реакций. В результате усложнения сети, обеспечивающей все большее разнообразие ферментов промежуточных реакций, увеличивается отношение числа регуляторных генов к регулируемым. В какой-то момент, и его наступление можно точно предсказать, цена добавления новых регуляторов неизбежно станет слишком невыгодной («разрастающаяся бюрократия») и будет ограничивать рост сложности генома.
Как показывается в серии доскональных исследований Эрика Ван Нимвегена[43], различные функциональные классы генов по-разному соотносятся с общим числом генов в геноме (Molina and van Nimwegen, 2009; van Nimwegen, 2003). Не учитывая некоторые отклонения, для прокариот можно указать три основных показателя степени, описывающие эти соотношения: 0, 1 и 2. Генам белков, участвующих в информационных процессах (трансляции, транскрипции и репликации), соответствует показатель степени 0 – число таких генов достигает некоторого константного значения уже в минимальных геномах и в принципе не зависит от сложности генома. Число метаболических ферментов и транспортных белков примерно прямо пропорционально общему числу генов (показатель степени 1). Регуляторные гены и компоненты систем передачи сигналов показывают квадратичную зависимость (показатель степени равен 2; рис. 4-10). Показатели степени этих трех обширных классов остаются неизменными, с очень небольшими отклонениями, для всех групп прокариот, и это позволяет предположить, что разница в эволюционной динамике генов с различными функциями отражает какие-то фундаментальные законы эволюции клеточных организмов, или, другими словами, строгие и четко выраженные ограничения в функциональном устройстве геномов. Для генов эукариот обнаружены похожие, хотя и не такие явные, степенные соотношения, показатель степени для регуляторных генов эукариот значительно больше 1 (хотя и меньше 2). Имея в виду все вышесказанное, можно заключить, что эти соотношения представляют еще один набор универсалий геномной эволюции, которые становятся еще интереснее при рассмотрении их связи с функциональным устройством клетки.
Фундаментальные причины существования различных соотношений для различных функциональных классов генов еще не выяснены. Привлекательно простая модель эволюции метаболических сетей прокариот как «ящика с инструментами», предложенная Сергеем Масловым и коллегами, может быть первым шагом на пути объяснения квадратичной зависимости, характерной для регуляторных генов (Maslov et al., 2009). В этой модели ферменты, необходимые для утилизации новых метаболитов, добавляются вместе с соответствующими им регуляторами (в первую очередь посредством горизонтального переноса генов, гл. 5) во все более развитую сеть реакций. В результате усложнения сети, обеспечивающей все большее разнообразие ферментов промежуточных реакций, увеличивается отношение числа регуляторных генов к регулируемым. В какой-то момент, и его наступление можно точно предсказать, цена добавления новых регуляторов неизбежно станет слишком невыгодной («разрастающаяся бюрократия») и будет ограничивать рост сложности генома.
